布洛芬对活性污泥中功能酶活性的影响
Effect of Ibuprofen on Functional Enzymes of Activated Sludge
-
摘要: 布洛芬是常用非甾体抗炎药,使用量大、去除率低,且药品的存在会诱发水生生物发生不同应激变化。研究对比了在不同浓度梯度布洛芬暴露下活性污泥中脲酶、转化酶活性的动态变化率、总变化率的不同响应。结果表明,在布洛芬浓度为35~40 μg·L-1时,对脲酶活性的抑制程度超过了40%,布洛芬浓度达28 μg·L-1后,脲酶活性总变化率单调增加,在布洛芬浓度达到40 μg·L-1时,脲酶活性总变化率超过了70%。而转化酶活性动态变化率低于±20%,总变化率低于±30%。上述研究结果表明,脲酶活性在布洛芬较低浓度暴露下变化幅度大、响应快。因此推荐使用较为敏感的脲酶活性生物指标,评价布洛芬等新型有机污染物对复杂污泥机制中活性污泥微生物活性影响。相关实验数据可以对污水处理系统的潜在风险进行早期预警。Abstract: Ibuprofen used as a common non-steroidal anti-inflammatory pharmaceutical could induce different stress effect on aquatic organisms with a higher level of consumption and a lower degree of removal efficiency. The differences between the changes of urease activity and invertase activity under the exposure of ibuprofen were studied. The results showed that the inhibition of urease activity exceeded 40% under the exposure concentration range of ibuprofen (35-40 μg·L-1), and the overall change rate of urease activity monotonically increased beyond 28 μg·L-1. The overall change rate of urease activity exceeded 70% when the concentration of ibuprofen reached 40 μg·L-1. While the dynamic change rates of invertase activity were less than ±20%, its overall change rates were less than ±30%. Ccompared with activity of invertase, urease activity had a wide range of changes and a rapid response under the lower-concentration exposure of ibuprofen. Therefore urease activity could be recommended as a sensitive biological indicator to evaluate the impact of ibuprofen on the microbial activity of activated sludge. The related data may provide early warning of the potential risks in wastewater treatment systems.
-
Key words:
- ibuprofen /
- activated sludge /
- urease activity /
- invertase activity /
- sensitive indicator
-
2022年5月,国务院办公厅出台了《新污染物治理行动方案》,将抗生素列为新污染物之一,打响了抗生素环境污染治理攻坚战. 抗生素在人和动物的疾病防治中具有重要作用,并作为生长促进剂广泛用于农业、畜牧业和水产养殖等行业[1]. 其中,磺胺甲噁唑(Sulfamethoxazole,SMX)具有成本低、抗菌广谱等优点,是应用最广泛的抗生素之一[2]. 由于SMX的使用量大、残留性强,在废水出水、地表水甚至是饮用水中均有检出,浓度最高可达7910 ng·L−1[3 − 4],对水生生态系统和人类健康产生危害[5]. 此外,预计到2050年,由环境中抗生素长期污染导致的抗性微生物和抗性基因的传播与扩散将威胁全球1000万人的生命[6]. 因此,开发切实有效的SMX深度去除技术对降低水体中抗生素危害风险具有重要意义.
高级氧化技术(AOPs)已被证明可以产生具有高效活性的自由基,对降解抗生素具有巨大潜力[7]. 其中基于过硫酸盐的高级氧化技术可以产生氧化电位高、半衰期长、pH适用范围广的硫酸根自由基(SO4·−)而被广泛关注[8 − 10]. 过渡金属(如钴、铜、铁、锌等)常用于活化过一硫酸盐(PMS),但高价金属的持续积累将会阻碍污染物的降解[9]. 所以为了克服氧化还原循环的局限性,近年来提出了双反应中心的方案. 基于此,本文将钴与铜二者相结合,制备钴铜(Co-Cu)双金属氧化物催化剂协同活化PMS,加速水中抗生素类新污染物的去除.
综上,本文拟采用Co-Cu/PMS体系处理水中的SMX,考察PMS浓度、Co-Cu投加量、水中常见的无机阴离子(Cl−、HCO3−、SO42−)及富里酸(FA)对SMX去除率的影响,探究Co-Cu/PMS体系降解SMX的主要活性氧物种(ROS).
1. 材料与方法(Materials and methods)
1.1 实验试剂
磺胺甲噁唑(SMX,98.0%)、对苯醌(p-BQ,99.0%)、L-组氨酸(L-His,99.0%)、富里酸(FA,85.0%)、尿素(Urea,99.0%)、磷酸二氢钠(NaH2PO4·2H2O,99.0%)、磷酸氢二钠(Na2HPO4·12H2O,99.0%)均由上海麦克林生化技术有限公司提供. 叔丁醇(TBA,99.5%)购自天津大茂化学试剂有限公司. 过一硫酸盐(PMS,KHSO5·0.5KHSO4·0.5K2SO4),5,5-二甲基-1-吡咯啉-N-氧化物(DMPO>98.0%)和2,2,6,6-四甲基-4-哌啶醇(TEMP>98.0%)购自上海西格玛奥德里奇贸易有限公司. 硝酸钴(Co(NO3)2·6H2O,99.0%),硝酸铜(Cu(NO3)2·3H2O,99.0%),双氰胺(C2H4N4,99.0%)购自阿拉丁化学有限公司. 乙腈(色谱纯)与甲醇(色谱纯)购自海麦克林生化科技股份有限公司. 实验用水为超纯水(Milli-Q,美国,18.25 MΩ·cm). 所有原液避光保存在4 ℃的冰箱中,1个月内用完.
1.2 催化剂的制备
采用溶剂热法合成Co-Cu催化剂. 将10 mmol Co(NO3)2·6H2O和5 mmol Cu(NO3)2·3H2O溶于70 mL无水甲醇中,形成透明溶液. 然后,在上述混合物中加入30 mmol尿素,剧烈搅拌30 min.将溶液转移到100 mL内衬聚四氟乙烯的不锈钢高压釜中,在180 ℃的烤箱中密封12 h. 然后用去离子水和乙醇洗涤所得沉积物,直到pH达到中性. 粉末在真空烘箱中80 ℃干燥12 h,400 ℃煅烧3 h,升温速度为1 ℃·min−1. 催化剂命名为Co-Cu. 为了比较,用同样的方法制备了铜氧化物(CuO)和钴氧化物(Co3O4).
1.3 催化剂的表征
采用加速电压为200 kV的透射电镜(TEM,FEI Talos F200X G2,美国)和加速电压为5 kV的场发射扫描电镜(FESEM,ZEISS Sigma 300,德国)对制备的催化剂的形貌和结构进行分析. 采用能量色散X射线能谱仪(EDS,Oxford Xplore)作图测定催化剂的元素组成. 采用德国产Cu Kα射线辐射源(λ = 0.15406 nm)的Bruker-D8-Advance衍射仪对样品的晶体结构进行XRD分析. 采用Al Kα X射线源,用美国Thermo Scientific K-Alpha进行X射线光电子能谱(XPS)分析.
1.4 实验与分析方法
SMX降解实验在一系列带有特富龙(Teflon)盖的40 mL顶空瓶(CNW,安谱,中国上海)中进行的,将其置于温度为(25.0±0.5)℃,转速为150 r·min−1的恒温振荡培养箱中. 向顶空瓶中依次加入SMX和Co-Cu,最后加入PMS启动反应. 用10 mmol·L−1的磷酸盐缓冲液(PBS)将溶液pH维持在7.0. 在不同的时间点(0、5、10、20、30、40、60 min)取样,立即用50 mmol·L−1 Na2S2O3终止反应. 用0.22 μm PTFE膜过滤之后(预实验表明PTFE膜过滤不影响SMX浓度的分析),采用高效液相色谱法(HPLC,上海沃特世科技有限公司)检测SMX残余浓度. 考察了PMS浓度(0—0.6 mmol·L−1)和Co-Cu投加量(0—60 mg·L−1)对SMX去除的影响;研究了无机阴离子和FA对SMX降解的影响,反应开始前,将Cl−、HCO3−、SO42−和FA分别添加到反应溶液中;反应开始前,将自由基淬灭剂(TBA、MeOH、p-BQ和L-His)分别添加到反应溶液中,推测在SMX降解过程中起作用的主要活性氧物种(ROS).
SMX残余浓度Waters 2998 HPLC分析方法:C18色谱柱(Hypersil BDS,4.6 mm × 150 mm,5 μm),流动相为40%乙腈和60%水,流速1 mL·min−1,柱温35 ℃,进样量20 μL,检测波长263 nm.
Bruker EMX PLUS电子顺磁共振(EPR)分析方法:采用DMPO作为羟基自由基(·OH)和硫酸根自由基(SO4·−)的捕获剂,TEMP作为单线态氧(1O2)的捕获剂. 将适量体积的样品分别加入DMPO和TEMP的水溶液中,利用PBS条件pH至7.0. 将该溶液搅拌5 min后使用30 μL毛细管取样,插入EPR腔中检测. 检测条件:20 ℃,中心磁场磁通量密度为3498 G,扫描宽度100 G,扫描时间30 s,调制频率100 kHz,磁通量密度调制幅度为1.0 G,微波频率9.8 GHz,微波功率为6.3 mW.
2. 结果与讨论(Results and discussion)
2.1 催化剂的表征
2.1.1 电镜分析
如图1A所示,制备的Co-Cu催化剂为致密的金属纳米颗粒. 通过扫描电镜(SEM)可知Co、Cu和O在Co-Cu催化剂表面的含量分别为60.84%wt、14.26%wt和24.89% wt. 用高分辨透射电镜(HR-TEM)进一步表征了所制备催化剂的结构. 如图1B所示,Co-Cu催化剂的晶格间距为0.23 nm、0.20 nm和0.24 nm,分别对应于CuO的(111)面、Co3O4的(400)面和(311)面. 图1C是Co-Cu催化剂透射电镜能谱(TEM-EDS),图1D—F分别是催化剂中O、Co和Cu元素能谱图,表明3种元素分布均匀.
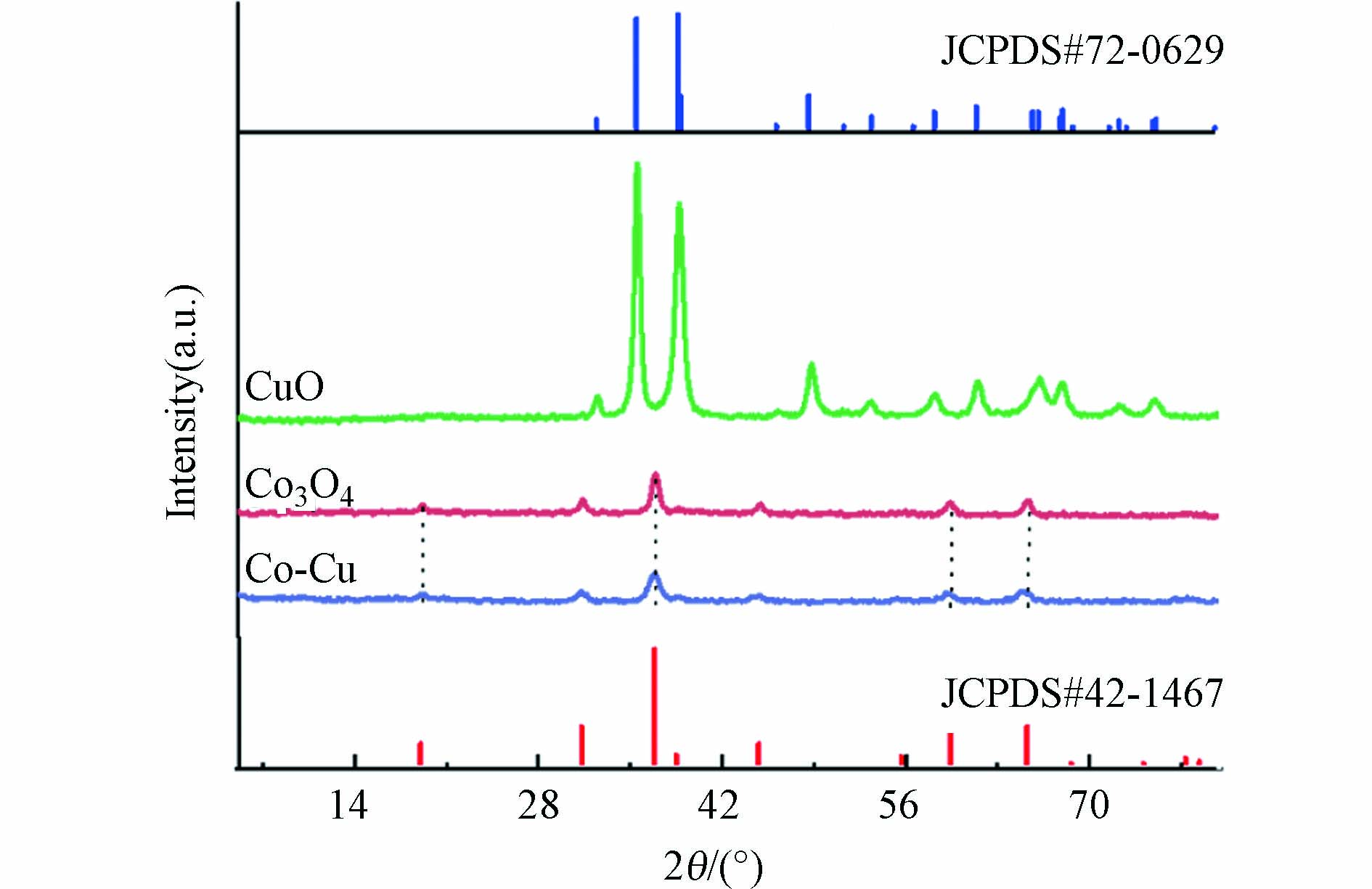
2.1.2 XRD分析
利用XRD对Co-Cu催化剂的晶体结构进行分析. 如图2所示,在32.5(110)、35.5(−111)、38.7(111)、48.7(−202)和61.5(-113)处观察到的衍射峰归属于CuO(JCPDS#72-0629);而19.0(111)、31.2(220)、36.8(311)、59.3(511)和65.2(440)的衍射峰对应于Co3O4(JCPDS# 42-1467). 由于合成的Co-Cu催化剂中钴的含量多于铜,所以Co-Cu催化剂的XRD图谱主要呈现出Co3O4的衍射峰.
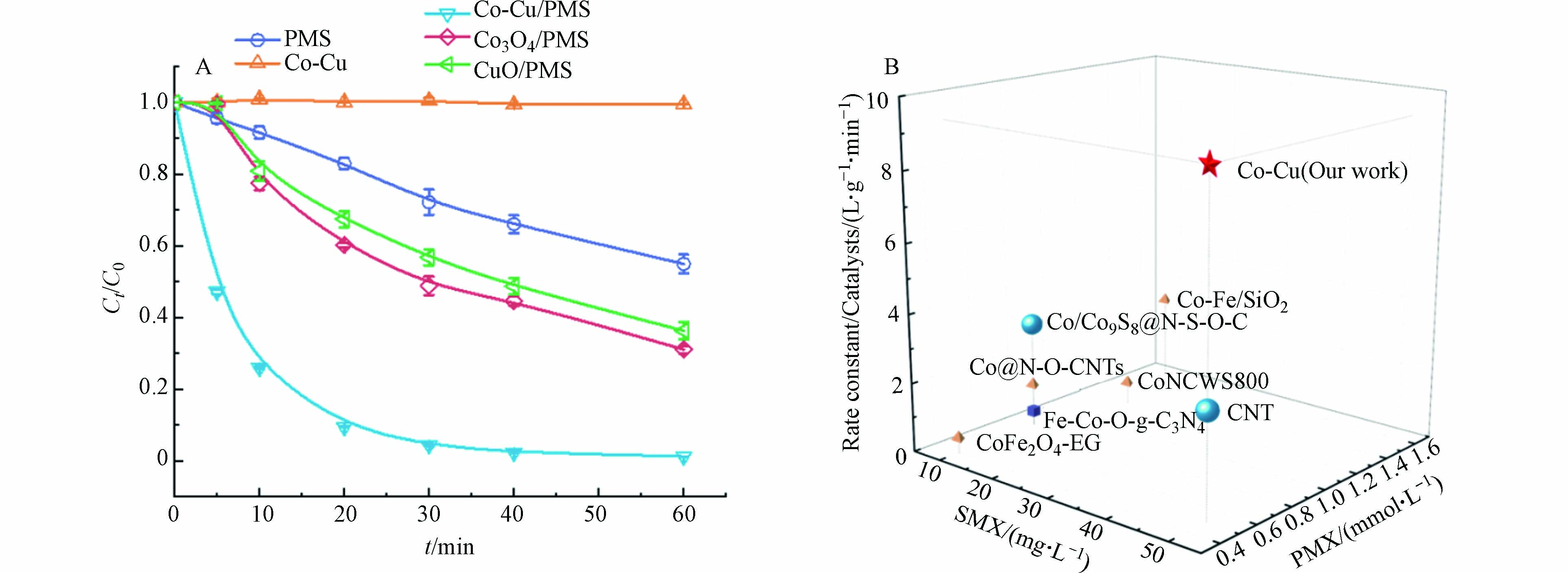
2.2 不同体系中SMX去除率
以相同的方法分别制备了Co3O4、CuO、Co-Cu催化剂,对其活性测试. 如图3A所示,在SMX浓度为50 mg·L−1,Co-Cu投加量为50 mg·L−1,PMS浓度为0.5 mmol·L−1,反应温度25 ℃条件下,单独的Co-Cu催化剂对SMX的吸附作用非常微弱;而在单独PMS体系中,60 min内大约去除40%的SMX. 加入催化剂之后,SMX降解效果增强显著,催化活化效果顺序为Co-Cu/PMS>Co3O4/PMS>CuO/PMS. 在Co-Cu/PMS体系中,30 min内SMX降解率可达95.6%,说明Co-Cu催化剂中存在双金属协同作用,可以高效活化PMS促进SMX的降解. 此外,为了更好地评估Co-Cu催化剂对PMS的催化性能,将本体系和之前文献报道中SMX降解速率常数标准化为催化剂投加量(Rate constant/Catalysts). 结果如图3B显示,本体系使用的SMX浓度较大、PMS浓度较小且归一化之后的数值高达9.2,远高于文献中的数值[2,8,11 − 15],表明Co-Cu对PMS具有卓越的催化活性.
2.3 PMS浓度与催化剂投加量的影响
PMS浓度与催化剂投加量在AOPs过程中具有重要影响[16]. 在SMX浓度为50 mg·L−1,反应温度25 ℃条件下,增加PMS浓度对SMX的降解产生显著影响. 如图4所示,在单独PMS体系中,当PMS浓度从0 mmol·L−1增加至0.6 mmol·L−1时,降解速率常数kobs提升近120倍,即从0.0115×10−2 min−1增加到0.014 min−1. 在Co-Cu/PMS体系中,PMS浓度为0.2 mmol·L−1时,30 min后反应不再进行,表明此条件下PMS的利用率达到了上限;当PMS浓度增加到0.5 mmol·L−1时,反应继续进行,说明PMS的用量直接关乎SMX的去除率,且PMS浓度再增加,SMX降解速率加快,该体系中当PMS浓度从0 mmol·L−1增加至0.6 mmol·L−1时,降解速率常数kobs提升近1000倍,即从0.0135×10−2 min−1增加到0.148 min−1. 同样地,SMX的降解速率随Co-Cu催化剂投加量的增加而加快. 上述实验结果表明,Co-Cu可有效活化PMS产生活性氧物种促进SMX的降解.
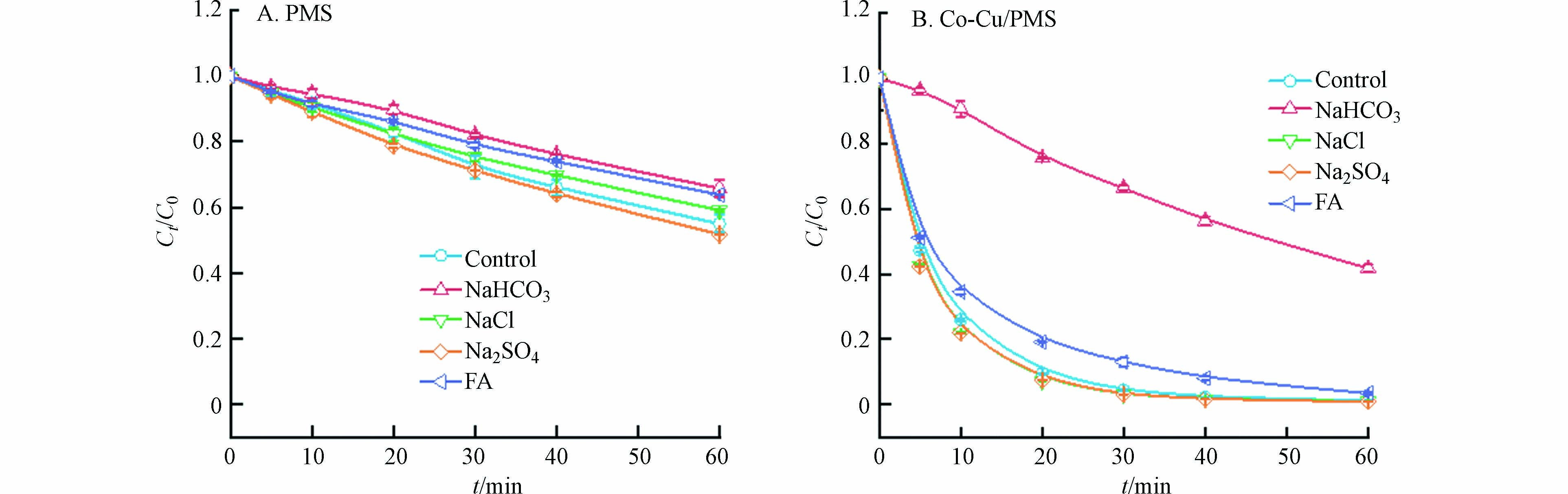
2.4 水体基质的影响
水体基质(包括无机阴离子、天然有机质等)一部分会与体系ROS反应产生次级自由基(如氯自由基等)加快反应进程,一部分也会通过改变溶液pH或消耗体系ROS降低目标污染物的去除效果[17]. 因此,在催化剂投加量为50 mg·L−1,PMS浓度为0.5 mmol·L−1,SMX浓度为50 mg·L−1的条件下,考察了碳酸氢根离子(HCO3−)、硫酸根离子(SO42−)、氯离子(Cl−)和富里酸(FA)对SMX去除率的影响. 结果表明,如图5所示,10 mmol·L−1HCO3−和10 mg·L−1 FA在单独PMS体系中存在较弱抑制作用;而在Co-Cu/PMS体系中,10 mmol·L−1 HCO3−存在较强的抑制作用,10 mg·L−1FA抑制作用较小. 这是由于HCO3−能与溶液中的SO4·−反应生成氧化能力较弱的HCO3·- [18],从而降低了PMS对SMX的降解效果. FA可能与溶液中的ROS反应,或是遮蔽了催化剂表面的活性位点,进而抑制了反应进程[19]. 此外,10 mmol·L−1 Cl−与10 mmol·L−1SO42−对两个反应体系均无显著影响.
2.5 Co-Cu活化PMS的机理分析
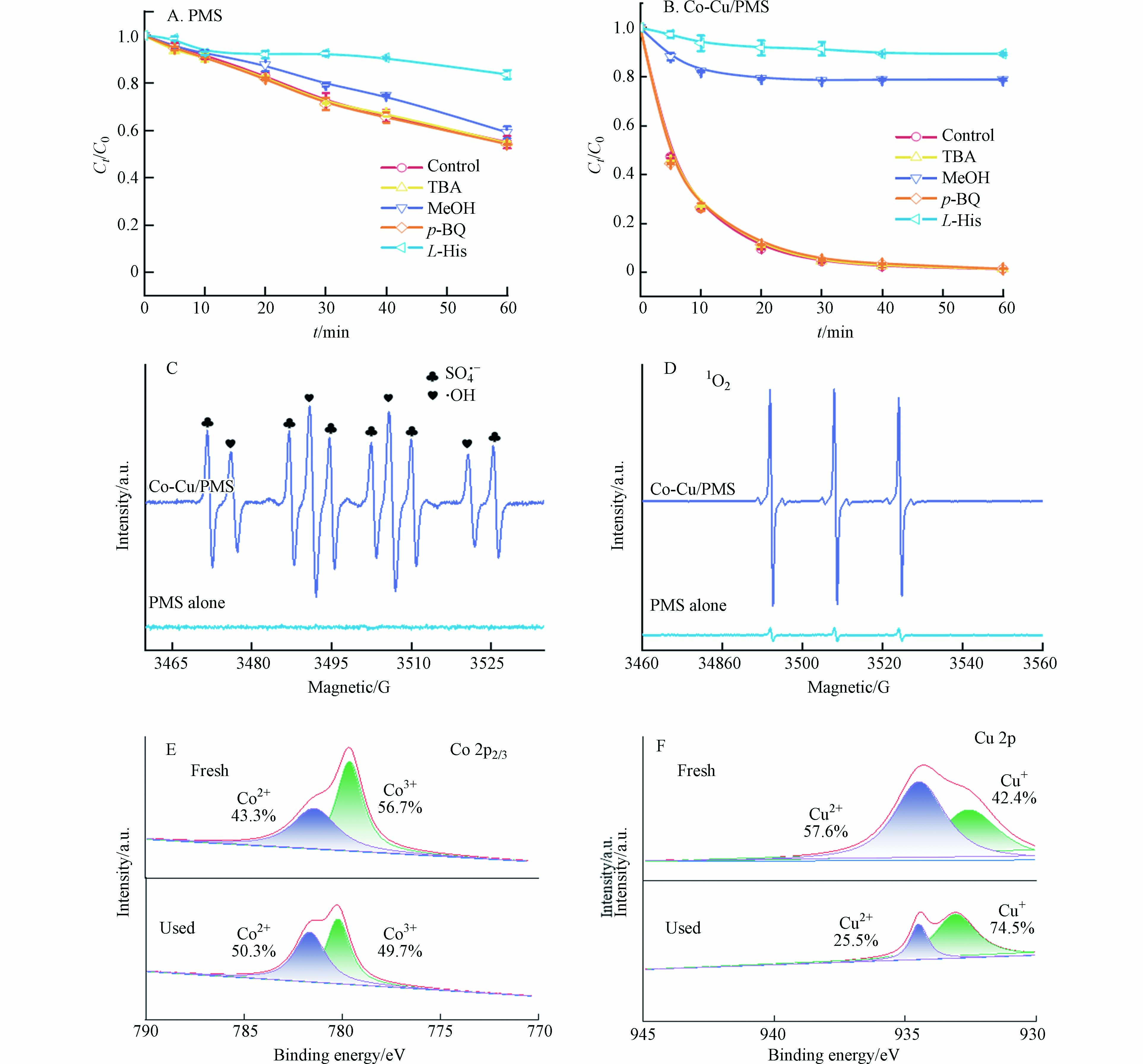
2.5.1 主要活性氧物种鉴定
通常认为在PMS高级氧化体系中,硫酸根自由基(SO4·−)和羟基自由基(·OH)的产生会诱导有机污染物的降解[20 − 21]. 因此,使用叔丁醇(TBA)和甲醇(MeOH)作为淬灭剂来鉴定体系中是否有两种自由基(·OH和SO4·−),因为MeOH可以快速消耗SO4·−和·OH,二级速率常数分别为(1.6—7.7) × 107 mol·L−1·s−1和(1.2—2.8) × 109 mol·L−1·s−1,而TBA仅能快速消耗·OH,与SO4·−反应比较慢,二级速率常数分别为(3.8—7.6) × 108 mol·L−1·s−1和(4.0—9.1) × 105 mol·L−1·s−1 [22]. 选用L-组氨酸(L-His)和对苯醌(p-BQ)来淬灭单线态氧(1O2)和超氧自由基(O2·−)[23]. 如图6AB所示,在单独PMS体系中,250 mmol·L−1 MeOH对SMX的去除率影响较小,而5 mmol·L−1 L-His则表现出较强抑制作用,使SMX的去除率从45.1%降到16.5%. 在Co-Cu/PMS体系中,MeOH和L-His对SMX的去除率均展示出很强的抑制作用. 而TBA和p-BQ对两个反应体系中SMX的去除率没有显著影响. 淬灭实验结果表明1O2是单独PMS体系降解SMX的主要活性氧物种(ROS),SO4·−和1O2是Co-Cu/PMS体系中的主要ROS.
为印证体系中的主要ROS,进行了EPR测试. 使用DMPO作为SO4·−和·OH的捕获剂,TEMP作为1O2的捕获剂[12,24]. 如图6C所示,在单独的PMS体系中,未观察到SO4·−、·OH特征峰;在Co-Cu/PMS体系中,能观察到很强的DMPO-SO4·−和DMPO-·OH加合物的特征峰. DMPO-·OH加合物特征峰的出现,说明PMS同样被活化产生了·OH,但并未在体系中起作用. 在图6D中,单独PMS体系和Co-Cu/PMS体系中均出现三重等幅信号,这是TEMP-1O2加合产物的特征峰,且该信号在催化剂存在下显著增强,说明Co-Cu活化PMS可产生更多1O2.
综上所述,淬灭试验和EPR的结果共同证实,SO4·−和1O2是Co-Cu/PMS体系中降解SMX的主要ROS.
2.5.2 Co-Cu的XPS分析
为了揭示Co-Cu催化剂对PMS的活化机理,对反应前后的Co-Cu催化剂样品进行XPS表征. 在Co 2p3/2光谱中位于779.5 eV和781.3 eV附近的两个峰,分别归属于Co2+和Co3+;在Cu 2p光谱中可以观测到933.6 eV和932.6 eV附近的两个峰,分别归属于Cu2+和Cu+ [25]. 如图6EF所示,反应后Co2+的含量从43.3%升至50.3%,Cu2+的含量从57.6%降至25.5%,说明Co-Cu催化剂存在双反应活性中心,共同活化PMS.
基于上述分析,反应机理可解释为以下步骤(式(1-8)):Co-Cu表面的Co2+/Cu+激活PMS生成SO4·−和Co3+/Cu2+(式(1-2));Co3+/Cu2+可氧化PMS生成SO5·−(式(3-4)),而且SO4·−直接与PMS反应也可生成SO5·−(式(5));以上生成的SO5·−可与H2O反应生成1O2(式(6));此外,EPR实验中测到的·OH可由SO4·−与H2O反应生成(式(7))[26].
≡Co2++HSO−5→≡Co3++SO⋅−4+OH− (1) ≡Cu++HSO−5→≡Cu2++SO⋅−4+OH− (2) ≡Co3++HSO−5→≡Co2++SO⋅−5+H+ (3) ≡Cu2++HSO−5→≡Cu++SO⋅−5+H+ (4) SO⋅−4+HSO−5→SO⋅−5+HSO−4 (5) 2SO⋅−5+H2O→1.51O2+2HSO−4 (6) SO⋅−4+H2O→SO2−4+⋅OH+H+ (7) 3. 结论(Conclusion)
(1)在pH 7.0,Co-Cu投加量50 mg·L−1,SMX浓度50 mg·L−1,PMS浓度0.5 mmol·L−1,25 ℃条件下,SMX在30 min内的去除率为95.6%. 增加PMS浓度和Co-Cu投加量,均可加快SMX的去除.
(2)在单独PMS体系与Co-Cu/PMS体系中,水体中FA与HCO3−对SMX的降解均存在抑制作用,其中HCO3−抑制作用更强;Cl−与SO42−对两个反应体系均无显著影响.
(3)在Co-Cu/PMS体系中,SO4·−和1O2对SMX的降解都发挥作用,且淬灭实验表明1O2作用更强.
(4)在钴铜双反应活性中心中,Cu+/ Cu2+循环是活化PMS的主要成分.
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 2147
- HTML全文浏览数: 2147
- PDF下载数: 33
- 施引文献: 0




 下载:
下载: