Mn对超富集植物青葙Cd毒害的缓解效应
Mitigation Effect of Mn on Cd Toxicity in a Hyperaccumulator Celosia argentea Linn.
-
摘要: 为了探究Cd胁迫下青葙中Mn的生理作用,通过水培实验,研究在Cd暴露下(0、5和25 μmol·L-1)施加Mn(5、100和1 000 μmol·L-1)对青葙的干重、叶绿素含量、Cd含量和青葙根部不同区域实时Cd2+流速的影响。结果表明,提高Mn的供应水平可缓解Cd对青葙生长的抑制效应。在Cd浓度为5 μmol·L-1,施加1 000 μmol·L-1的Mn时,青葙的根、茎、叶干重和总干重分别增加了26.8%、11.8%、22.7%和21.19%。当Cd处理浓度为25 μmol·L-1时,1 000 μmol·L-1的Mn显著增加了青葙的叶绿素a和总叶绿素的含量(P<0.05)。相反地,Mn的添加显著减少了叶片中的丙二醛含量(P<0.05)。在Cd处理为5 μmol·L-1和25 μmol·L-1时,施加Mn使丙二醛含量降低了30%。这表明,Mn浓度的增加能够减少Cd对青葙的脂质过氧化伤害,保护叶绿素。Mn对青葙Cd积累的影响并不是严格的拮抗效应。在低Cd浓度(5 μmol·L-1)处理组中,Mn的添加对青葙Cd累积无显著影响(P>0.05)。在高浓度处理时(25 μmol·L-1 Cd),1 000 μmol·L-1的Mn显著降低了青葙根、茎和叶的Cd含量(P<0.05),较施加5 μmol·L-1 Mn处理分别降低了41.4%、41.5%和23.3%。这可能与Mn2+抑制青葙根系对Cd2+的吸收有关。非损伤微测技术(NMT)分析结果显示,Mn2+的添加显著抑制了根表面Cd2+的内流速率。当加入50 μmol·L-1的Mn时,距根尖200 μm的Cd2+的内流速率下降了71.4%。上述结果表明,施加Mn有效地缓解了Cd对青葙的毒性效应。Abstract: To explore the mitigation of Cd toxicity to Celosia argentea by Mn, the effects of Mn on the dry weight, chlorophyll content, Cd content and real-time Cd2+ flux in different regions of root were studied using a hydroponic experiment with three levels of Cd (0, 5 and 25 μmol·L-1) and three levels of Mn (5, 100 and 1 000 μmol·L-1). The results showed that the inhibition of Cd on the growth of C. argentea could be alleviated by increasing the supply of Mn. When the supply concentration of Cd was 5 μmol·L-1, 1 000 μmol·L-1 Mn application increased the dry weight of root, stem, leaf, and total dry weight of C. argentea by 26.8%, 11.8%, 22.7% and 21.19%, respectively. When Cd concentration was 25 μmol·L-1, the contents of chlorophyll a and total chlorophyll in C. argentea were significantly increased by 1 000 μmol·L-1 Mn (P<0.05). On the contrary, the content of malondialdehyde (MDA) in leaves was significantly decreased by adding Mn (P<0.05). At 5 μmol·L-1 and 25 μmol·L-1 Cd treatment, Mn application reduced MDA content by 30%. This finding indicated that elevation of Mn supply can reduce the lipid peroxidation injury of Cd to C. argentea and protect chlorophyll. The effect of Mn on Cd accumulation in C. argentea was not full antagonism. At 5 μmol·L-1 Cd treatment, the addition of Mn had no significant effect on Cd accumulation (P>0.05). At high concentration Cd treatment (25 μmol·L-1), application of 1 000 μmol·L-1 Mn significantly decreased the Cd concentrations in roots, stems and leaves (P<0.05), which were 41.4%, 41.5% and 23.3% lower than those with 5 μmol·L-1 Mn treatment, respectively. This may be related to the inhibition of Cd2+ uptake by C. argentea roots by Mn2+. Non-invasive micro-test analysis (NMT) showed that the addition of Mn2+ significantly inhibited the Cd2+ influxes at the root surface. The addition of 50 μmol·L-1 Mn2+ decreased the rates of Cd2+ flux by 71.4% at 200 μm from root tip. The above results showed that the toxic effect of Cd on C. argentea was effectively alleviated by applying Mn.
-
Key words:
- Cd /
- Mn /
- Celosia argentea /
- mitigation
-
偶氮染料是纺织业中使用最多的一类染料 [1],具有难降解的特性。常见的处理方法包括物化法、化学法和生物法。物化法不能彻底降解污染物,化学法成本过高,生物法降解缓慢[2],因此限制了这些方法的应用。
次氯酸钠氧化法广泛用于降解废水中的污染物,并以污染物去除效率高、设备简单、经济性等优点而受到人们的重视。NaClO溶液的稳定性较差,大大降低了其氧化性的利用率。此外,采用NaClO直接氧化废水,会产生具有强致癌性的氯代有机物。增强NaClO的氧化性和消除氯代有机物对拓宽其在水处理中的应用极为重要。镍基催化剂能促进NaClO溶液的分解增强其氧化性,且以催化效果好、便宜等优点而备受关注[3]。NaClO在氧化镍的作用下生成具有极强活性的原子氧,迅速氧化废水中的污染物,从而达到去除COD和脱色的目的[4-5]。本课题组研发的NaClO催化氧化法能有效降解活性艳红K-2BP、酸性大红3R等偶氮染料,活性艳红K-2BP的脱色率在120 min达到94%以上[6],而酸性大红3R的脱色率在35 min达到90%以上。原子氧在脱色降解过程起了主导作用,因此未在染料降解产物中发现氯代有机物。
研究染料的分子结构与脱色性能之间的关系对废水的处理至关重要。染料种类繁多,结构各异,可以采用QSPR (quantitative molecular structure-properties relationships)法研究分子结构和脱色性能的关系。该方法简单易行,了解了分子结构信息,就可以分析和预测染料的理化性质或环境行为[7]。
本研究分别采用NaClO催化氧化法和NaClO氧化法脱色降解活性黄X-R废水,考察比较两种方法的脱色效果;比较催化氧化法对活性黄X-R和另外两种偶氮染料的脱色效果,在此基础上采用QSPR分析该方法处理不同染料效果存在差异的原因,进而指出其适用范围。本研究选择适当的染料分子结构描述符,通过线性回归法研究上述目标染料分子结构与NaClO催化氧化法对其脱色效果之间的关系。研究结果将为推广应用NaClO催化氧化法提供理论依据。
1. 材料与方法 (Materials and methods)
1.1 实验材料
催化剂载体选用水处理用耐酸碱的γ-Al2O3小球,参数如下:直径为 2−3 mm,Al2O3 > 92%,孔容为0.35 mL·g−1,比表面积大于300 m2·g−1。Na2S2O8 (99%)、NAOH (99%)、Ni(NO3)2·6H2O (99%)、H2SO4 (98%)、呋喃甲醇(99.2%)和叔丁醇(99.9%)均为分析纯,NaClO溶液有效氯含量大于10%。
仪器包括:ZYL便携式余氯分析仪、MIT-3F型COD检测仪、723N扫模型可见光分光光度计、Rigaku Smartlab9 x射线衍射仪(日本理学)、EscaLab 250Xi型X射线光电子能谱仪,Al-Kα射线单色源(美国赛默飞)、扫描电镜SEM(美国FEI Inspect F50)。
1.2 催化剂制备
催化剂制备步骤如下:先将γ-Al2O3小球浸泡在摩尔浓度为0.6 mol·L−1 Na2S2O8和0.5 mol·L−1 NaOH的混合液里,在振荡器上以100 r·min−1的频率振荡2 h,将得到的Na2S2O8-NaOH/Al2O3小球滤出后烘干。然后将Na2S2O8-NaOH/Al2O3小球浸泡在含有0.6 mol·L−1 Ni2+的溶液里发生反应,在γ-Al2O3表面形成一层镍氧化物/镍氢氧化物沉淀,将制得的小球滤出后烘干,得到镍基Al2O3小球。将得到的镍基Al2O3小球再次浸泡在Na2S2O8-NaOH混合液里,在振荡器上以100 r·min−1的频率振荡2 h后将催化剂小球滤出,用蒸馏水清洗。最后将洗净的催化剂置于马弗炉中低温焙烧2 h,制得催化氧化实验所需的催化剂样品。
Ni(OH)2为还原性氢氧化物,能和强氧化剂反应生成羟基氧化镍NiOOH。通过Ni2+在碱性溶液中被Na2S2O8氧化的反应来合成NiOOH(见式(1)和式(2)),从中可以看出,碱性条件促进Ni(OH)2和NiOOH的生成。
Ni2++2OH−⟶Ni(OH)2 (1) 2Ni(OH)2+S2O2−8+2OH−⟶2NiOOH+2SO2−4+2H2O (2) 在NiOOH存在的情况下,NaClO的分解反应2NaClO→2NaCl+O2↑可以看作是反应(3)和反应(4)的总和:
2NiOOH+NaClO⟶NaCl+2NiO2+H2O (3) 2NiO2+NaClO+H2O⟶2NiOOH+NaCl+O2 (4) 产生的氧分子能被物理吸附在镍基催化层上(式5),捕获电子后转化为化学吸附氧
O−2 O2(g)+S↔O2 (5) O2+e−↔O−2+∗ (6) O−2\xLeftrightarrowΔG1O−+O (7) O2\xLeftrightarrowΔG22O (8) 其中,O2(g)为气态氧,S为表面吸附位置,O2为表面物理吸附的氧,*和e−代表导带底部空位和导带电子,ΔG为反应能。反应产生的原子氧O非常活跃,可以快速氧化和分解有机物。羟基氧化镍可以长时间用作催化剂,因为它可以通过反应(3)和(4)进行再生利用。
1.3 活性黄X-R浓度的检测
染料废水在波长为390 nm处有最大特征吸收峰,在390 nm检测不同浓度废水的吸光度,建立质量浓度和吸光度的标准曲线方程y =96.877 x –1.1831,R2 = 0.9987。
1.4 染料脱色率分析
配制一定浓度的活性黄X-R溶液,加入一定量的NaClO溶液,充分搅拌,调节pH至所需值,得到废水/NaClO混合液。取50 mL混合液放入100 mL锥形瓶内,把一定量催化剂样品快速放入溶液中。在振荡器上以100 r·min−1的速度振荡120 min。分别在第10、30、50、70、90、120 min时取3 mL左右上清液,直接测其吸光度,利用标准曲线方程求得染料的浓度,按公式(9)计算其脱色率。测好吸光度后将染料溶液倒回锥形瓶中继续反应。
脱色率=C0−CtC0×100(%) (9) 式中,C0 和Ct 分别为初始染料浓度和t时刻染料浓度,mg·L−1。
1.5 自由基清除剂实验
配制质量浓度为200 mg·L−1的活性黄X-R溶液,加入120 mg·L−1的NaClO溶液,充分搅拌,调节到pH 9,得到废水/NaClO混合液。在两个相同组分的混合液中分别加入20 mmol·L−1的叔丁醇和呋喃甲醇,与催化剂一起放入100 mL锥形瓶内,在振荡器上以100 r·min−1的速度振荡反应,检测染料的脱色率变化,并以此来判断在反应中起主导作用的自由基。叔丁醇是一种良好的OH·和
SO−4⋅ 2. 结果与讨论 (Results and discussion)
2.1 反应条件对活性黄X-R溶液脱色率的影响
2.1.1 染料浓度对脱色率的影响
检测了当pH 为9、有效氯浓度为120 mg·L、催化剂投加量为240 g·L−1、初始染料浓度为100、200、300、400 mg·L−1时的脱色率,结果如图1所示。前期的研究结果表明[11],有催化剂时,弱碱性环境pH 9有利于反应(1)和反应(2)的发生,促进活性氧的产生,增大NaClO的转化率。当催化剂存在时,脱色率随着初始染料浓度的增加而增加:当染料浓度为100、200、300、400 mg·L−1时,脱色率在120 min时分别为41.1%、41.21%、42.47%和50.03%。没有催化剂时,当初始染料浓度为100、200、300、400 mg·L−1时,脱色率在反应120 min时分别为43.7%、42.67%、41.78%和40.17%。加入催化剂后,初始染料浓度为100、200、300 mg·L−1溶液在120 min时的脱色率基本没有发生变化,可能是因为NaClO的直接氧化起了主导作用。当初始染料浓度为400 mg·L−1时,催化剂的加入使脱色率增加到50.03%,催化剂的吸附和活性氧的氧化作用对脱色率的增量做了一定的贡献,吸附量随着染料浓度的增加而增大,进而促进了活性氧与之发生反应。
催化氧化法对活性黄X-R的脱色效果远差于其对活性艳红K-2BP和酸性大红3R的脱色效果,脱色率随浓度变化的趋势也和后面两种染料的相反,活性艳红K-2BP和酸性大红3R的脱色率随着染料初始浓度的增加而减小(图2),因为反应的速率受到活性氧产量的限制,高浓度溶液需要更多的活性氧才能保持同样的降解速率。
 图 2 初始染料浓度对脱色率的影响Figure 2. Effect of initial dye concentration on color removal ratepH为9,催化剂投加量为240 g·L−1和 (a) 活性艳红K-2BP,有效氯为120 mg·L−1 (b) 酸性大红3R,有效氯为60 mg·L−1pH 9, catalyst dosage 240 g·L−1 and (a) reactive brilliant red K-2BP, available chlorine 120 mg·L−1 (b) acid red 3R, available chlorine 60 mg·L−1
图 2 初始染料浓度对脱色率的影响Figure 2. Effect of initial dye concentration on color removal ratepH为9,催化剂投加量为240 g·L−1和 (a) 活性艳红K-2BP,有效氯为120 mg·L−1 (b) 酸性大红3R,有效氯为60 mg·L−1pH 9, catalyst dosage 240 g·L−1 and (a) reactive brilliant red K-2BP, available chlorine 120 mg·L−1 (b) acid red 3R, available chlorine 60 mg·L−1以上实验结果表明,催化氧化体系降解活性黄X-R的机理可能有别于活性艳红K-2BP和酸性大红3R的降解机理,NaClO更倾向于直接氧化活性黄X-R,因此抑制了其本身的催化分解反应,减少了活性氧的产量;活性黄X-R分子也可能不易被具有亲电子性的活性氧攻击,使NaClO的直接氧化作用在脱色反应中占据了主导地位。因此,当NaClO有效氯浓度足够高的时候,染料的分解速率随着染料浓度的增加而增大,从表观上看,脱色率增大。
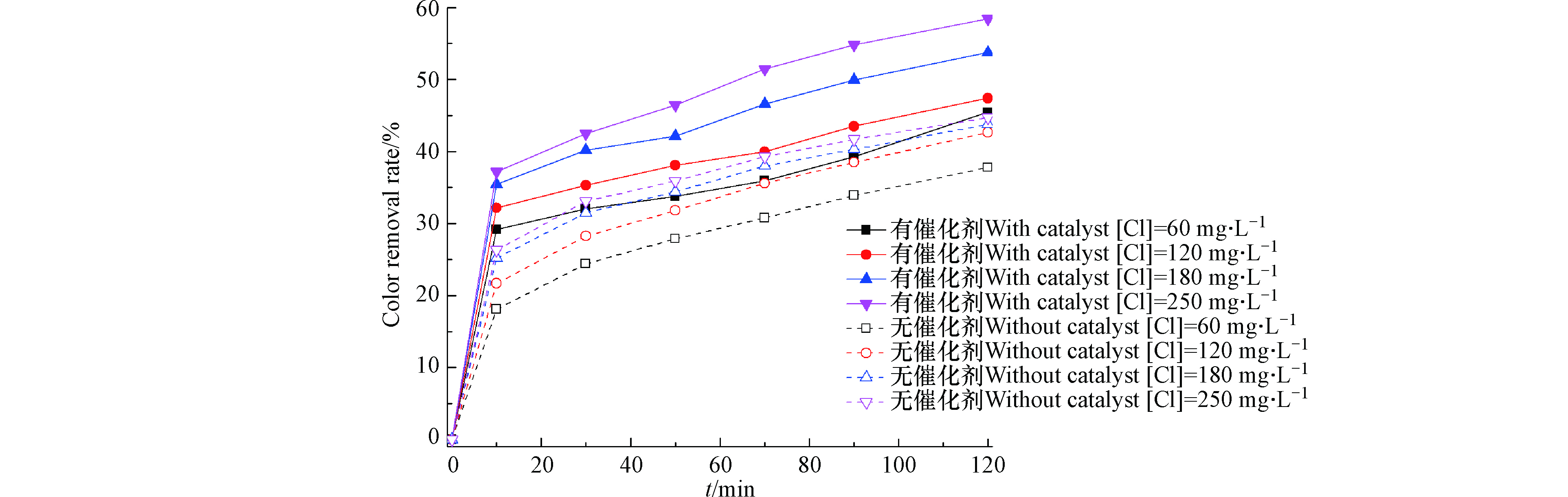
2.1.2 有效氯浓度对脱色率的影响
检测了当pH 9、染料浓度为200 mg·L−1、催化剂投加量为240 g·L−1、 有效氯为60、120、180 、250 mg·L−1时的脱色率,结果如图3所示。脱色率随着有效氯浓度的增加而增大。有催化剂存在时,当有效氯浓度从60 mg·L−1增加到250 mg·L−1,120 min时染料的脱色率从45%提升到了58%,增幅有限,主要是因为NaClO的直接氧化起了主导作用。NaClO在pH 9时的氧化性较弱,脱色效果差,单独氧化时NaClO的利用率较低[12]。有效氯浓度的增大也促进了NaClO直接氧化染料反应的进行,改善了活性黄X-R的脱色效果:当初始有效氯浓度从60 mg·L−1增加到250 mg·L−1,染料的脱色率从37.8%提升到了44.7%,比催化剂存在时的脱色率低6.3%–13.3%,增值是由催化剂的吸附和产生的活性氧作用所导致的。
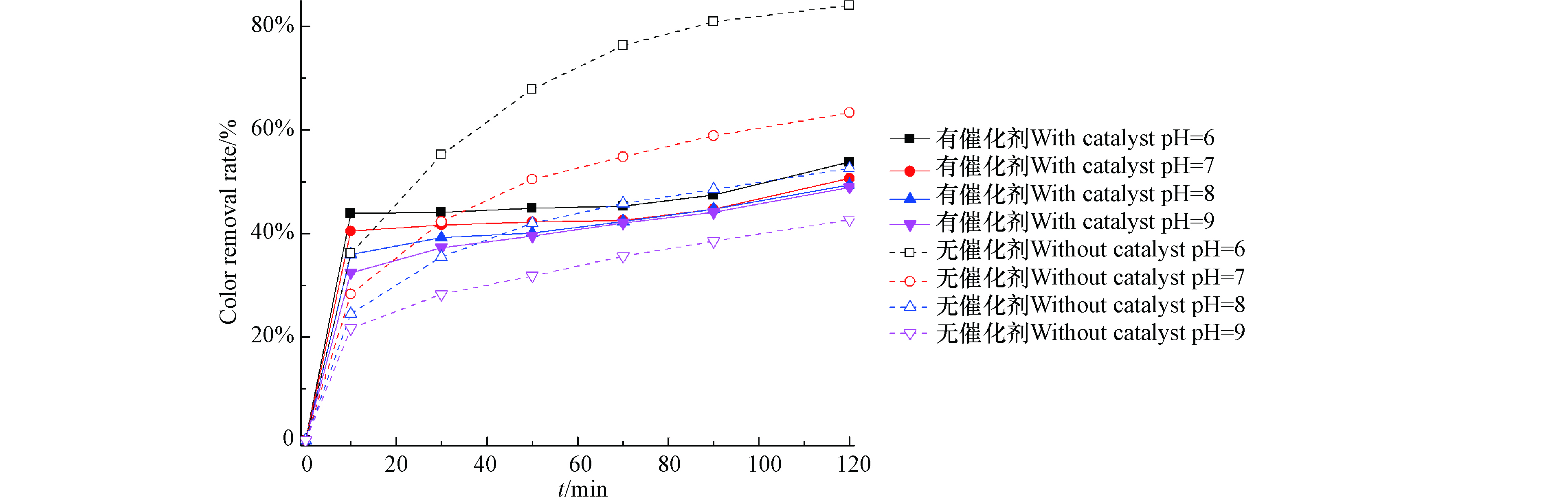
2.1.3 pH对脱色率的影响
检测了当有效氯为120 mg·L−1、染料浓度为200 mg·L−1、催化剂投加量为240 g·L−1、初始pH值为6、7、8、9时的脱色率,结果如图4所示。NaClO催化氧化法的脱色率随着pH的提升而减小,pH 6、7时的脱色效果略胜于pH 8、9时的脱色效果,初始pH为6时的脱色效果最好,当反应时间为120 min,脱色率达到53.8%,远低于弱碱性条件下NaClO催化氧化降解活性艳红K-2BP和酸性大红3R溶液的脱色率(图5),催化作用明显受到了抑制,这是因为反应机理不同而导致的。原子氧在活性艳红K-2BP和酸性大红3R的脱色中起了主导作用,NaClO的直接氧化在活性黄X-R的脱色中起了主导作用。当初始pH为9,加催化剂反应120 min,活性黄X-R的脱色率达到49%,无催化剂时脱色率为42.7%(图4)。NaClO法降解活性黄X-R的脱色率随着pH的增加明显降低,当pH值从6增加到9,脱色率从84.1%降到42.7%,这是因为NaClO在酸性条件下会以游离氯存在,氧化性能大大提升。
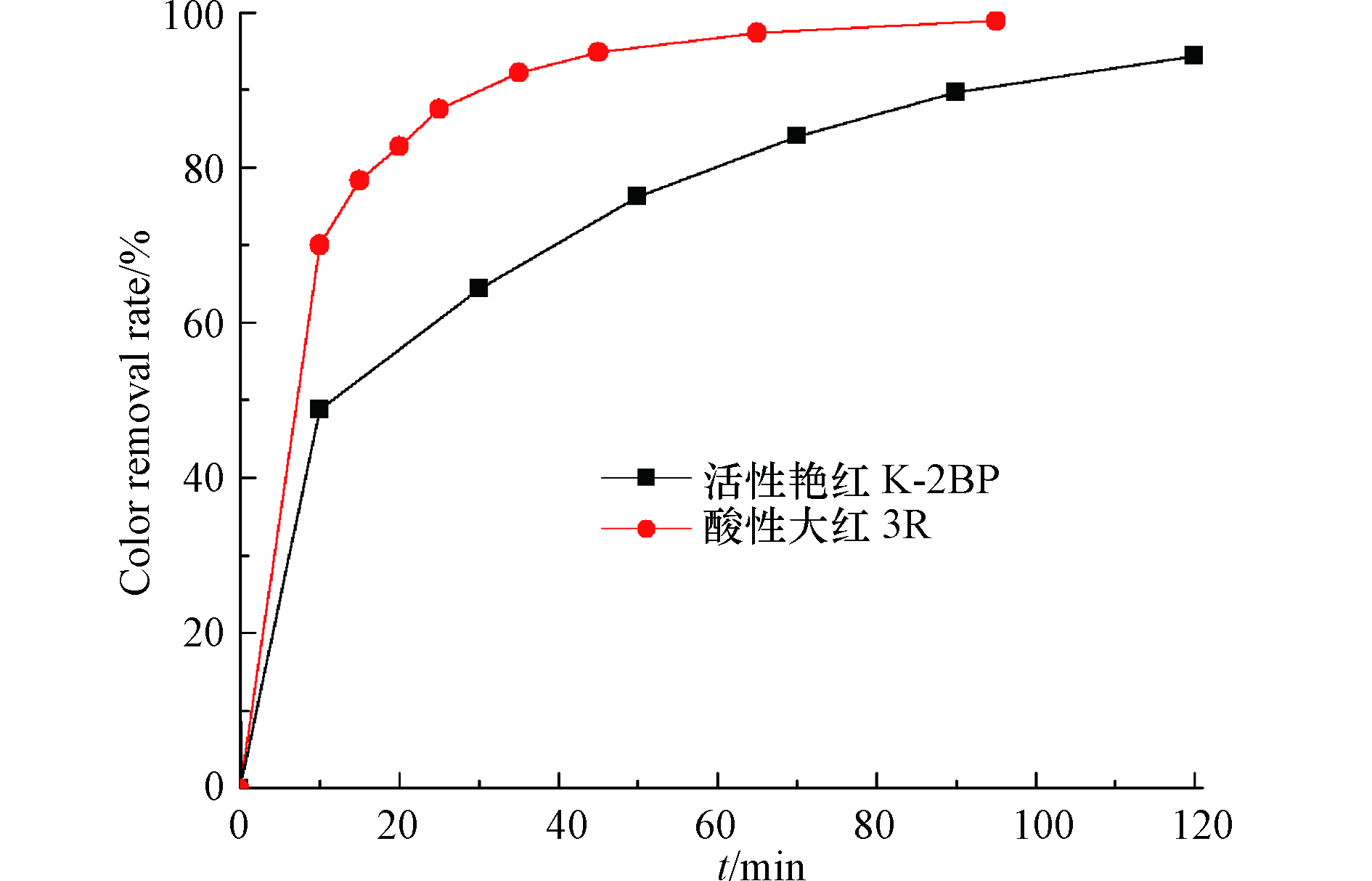 图 5 不同偶氮染料对脱色率的影响Figure 5. Effect of different azo-dyes on color removal rate初始pH 9,催化剂投加量240 g·L−1,活性艳红K-2BP和有效氯浓度为200 mg·L−1和120 mg·L−1,酸性大红3R和有效氯浓度为200 mg·L−1和60 mg·L−1initial pH 9, catalyst dosage 240 g·L−1, the concentrations of reactive brilliant red K-2BP and available chlorine are 200 mg·L−1 and 120 mg·L−1, while the concentrations of acid red and available chlorine are 200 mg·L−1 and 60 mg·L−1
图 5 不同偶氮染料对脱色率的影响Figure 5. Effect of different azo-dyes on color removal rate初始pH 9,催化剂投加量240 g·L−1,活性艳红K-2BP和有效氯浓度为200 mg·L−1和120 mg·L−1,酸性大红3R和有效氯浓度为200 mg·L−1和60 mg·L−1initial pH 9, catalyst dosage 240 g·L−1, the concentrations of reactive brilliant red K-2BP and available chlorine are 200 mg·L−1 and 120 mg·L−1, while the concentrations of acid red and available chlorine are 200 mg·L−1 and 60 mg·L−1当pH值为6、7、8时,加入催化剂反而导致活性黄X-R的脱色效果变差(图4)。当pH 6时,NaClO主要以HClO的形式存在。随着pH值的提升,ClO−的量增多,pH 9时NaClO主要以ClO−的形式存在。催化剂表面含有大量Ni(OH)2,带有正电荷[13]。当pH 6时,催化剂与次氯酸电荷相斥,不利于其在催化剂表面的有效吸附;当pH值为8、9,催化剂与ClO−存在电荷相吸作用,有利于NaClO在催化剂表面的有效吸附。催化剂表面和含有磺酸根离子的染料分子之间的静电吸引可能有利于染料在其表面的有效吸附。因此,当pH 6时,催化剂的存在降低了HClO与染料分子之间的反应几率,从而降低了脱色率,虽然此时的溶液具有较强的氧化性。当pH值为8、9,NaClO和染料分子在催化剂表面的有效吸附使两者之间的反应几率增大,从而使脱色率和酸性条件下的相差不大。催化剂存在时,弱碱性条件促进了活性氧的产生,但对染料的脱色率基本没有产生影响,可能是活性氧与染料分子之间的反应受到了阻碍。
采用NaClO催化氧化法降解活性艳红K-2BP和酸性大红3R,初始pH 9时的脱色效果最好(图6),弱碱性条件有利于NiOOH的生成和催化层的固定(式(1)和式(2)),进而促进原子氧的产生(式(3)—(8));同时,弱碱性条件还能抵消由于降解过程产生有机酸而导致的pH值的下降,起到平衡pH值的作用。
 图 6 pH对不同偶氮染料脱色率的影响Figure 6. Effect of different azo-dyes on color removal ratepH 9,催化剂投加量240 g·L−1,活性艳红K-2BP和有效氯浓度为200 mg·L−1和120 mg·L−1,酸性大红3R和有效氯浓度为200 mg·L−1和60 mg·L−1pH 9, catalyst dosage 240 g·L−1, the concentrations of reactive brilliant K-2BP and available chlorine are 200 mg·L−1 and 120 mg·L−1, while the concentrations of acid red 3R and available chlorine are 200 mg·L−1 and 60 mg·L−1
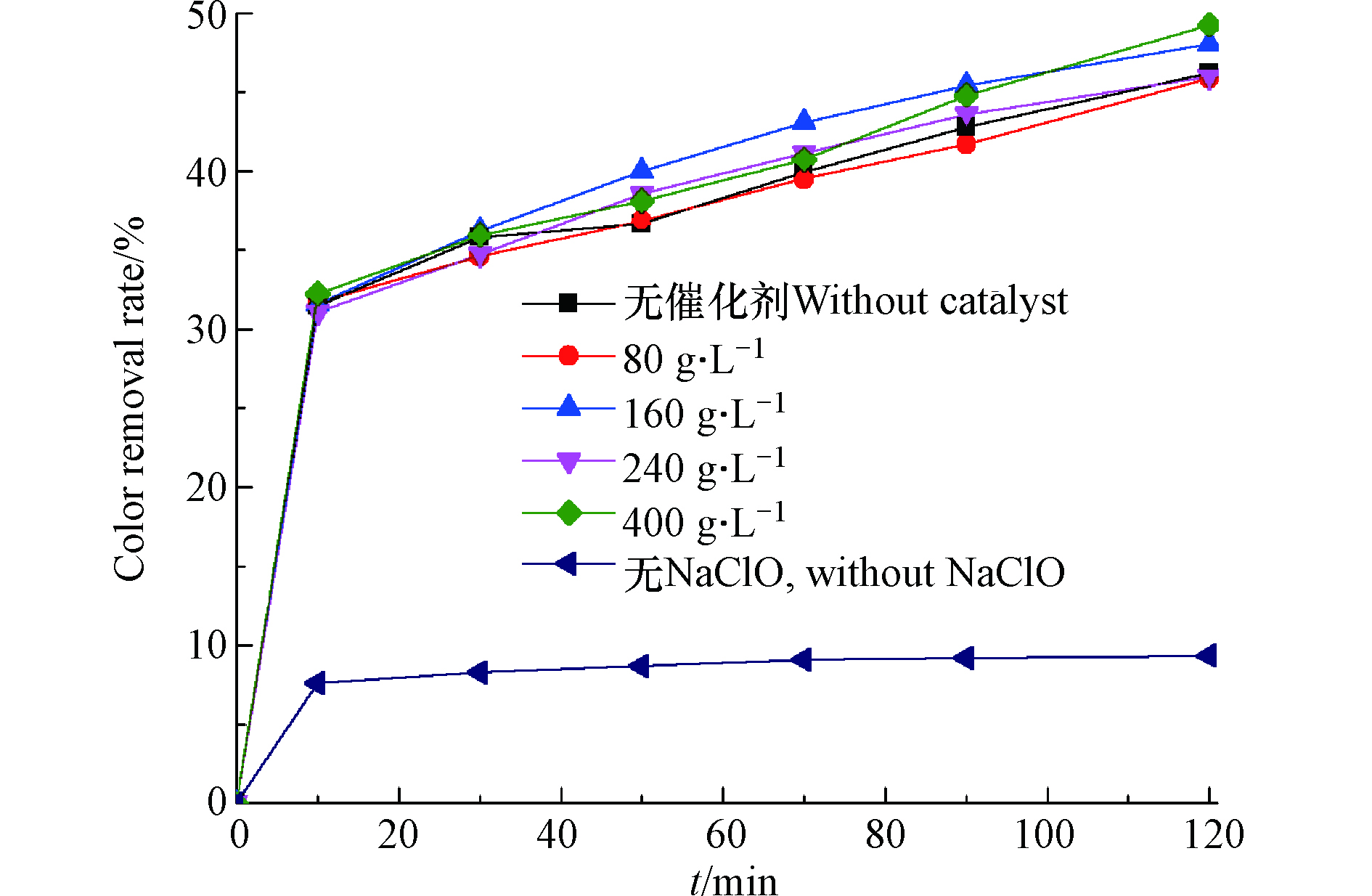
图 6 pH对不同偶氮染料脱色率的影响Figure 6. Effect of different azo-dyes on color removal ratepH 9,催化剂投加量240 g·L−1,活性艳红K-2BP和有效氯浓度为200 mg·L−1和120 mg·L−1,酸性大红3R和有效氯浓度为200 mg·L−1和60 mg·L−1pH 9, catalyst dosage 240 g·L−1, the concentrations of reactive brilliant K-2BP and available chlorine are 200 mg·L−1 and 120 mg·L−1, while the concentrations of acid red 3R and available chlorine are 200 mg·L−1 and 60 mg·L−12.1.4 催化剂对脱色率的影响
检测了当有效氯浓度为120 mg·L−1、染料浓度为200 mg·L−1、初始pH为9、催化剂投加量为80、160、240、400 g·L−1时的脱色率,结果如图7所示。催化剂投加量的增加对染料脱色率的影响很小,当催化剂投加量从80 g增加到400 g·L−1,脱色率在反应120 min时只提升了3.4%。单独使用NaClO时的脱色率与催化剂存在时的基本相同。单独使用400 g·L−1新制备的催化剂处理废水120 min,仅有7.6%–9.4%的脱色率,随着反应时间的延长,脱色率变化幅度很小,说明这部分脱色率主要是由吸附导致的,其贡献较小。实验结果再次验证了NaClO的氧化在脱色反应中的主导作用,当初始pH为9时,催化剂对脱色反应的影响甚微,催化作用受到了抑制。因此,催化氧化法不太适用于脱色降解活性黄X-R废水。
2.1.3节的研究结果表明,当pH为6,200 mg·L−1活性黄X-R废水中有效氯浓度达到120 mg·L−1,反应 120 min后脱色率达到84.1%。继续调低pH能进一步提升脱色率,但是NaClO氧化法会导致出水中产生毒性较强的氯代有机物。王元刚等[14]采用Mg(OH)2混凝脱色降解浓度为100 mg·L−1的活性黄X-R废水,当pH 值为12、Mg2+投加量为216 mg·L−1时,脱色率达到90%以上。王昶等[15]采用蛭石类芬顿降解活性黄X-R染料,结果表明,把蛭石粉碎到7.5 μm的颗粒,其投加量为1.0 g·L−1、pH 3、H2O2用量 2.94 mmol·L−1时,反应180 min 后,50—300 mg·L−1活性黄X-R 脱色率均能达到95%以上。后面两种方法的运行成本偏高。
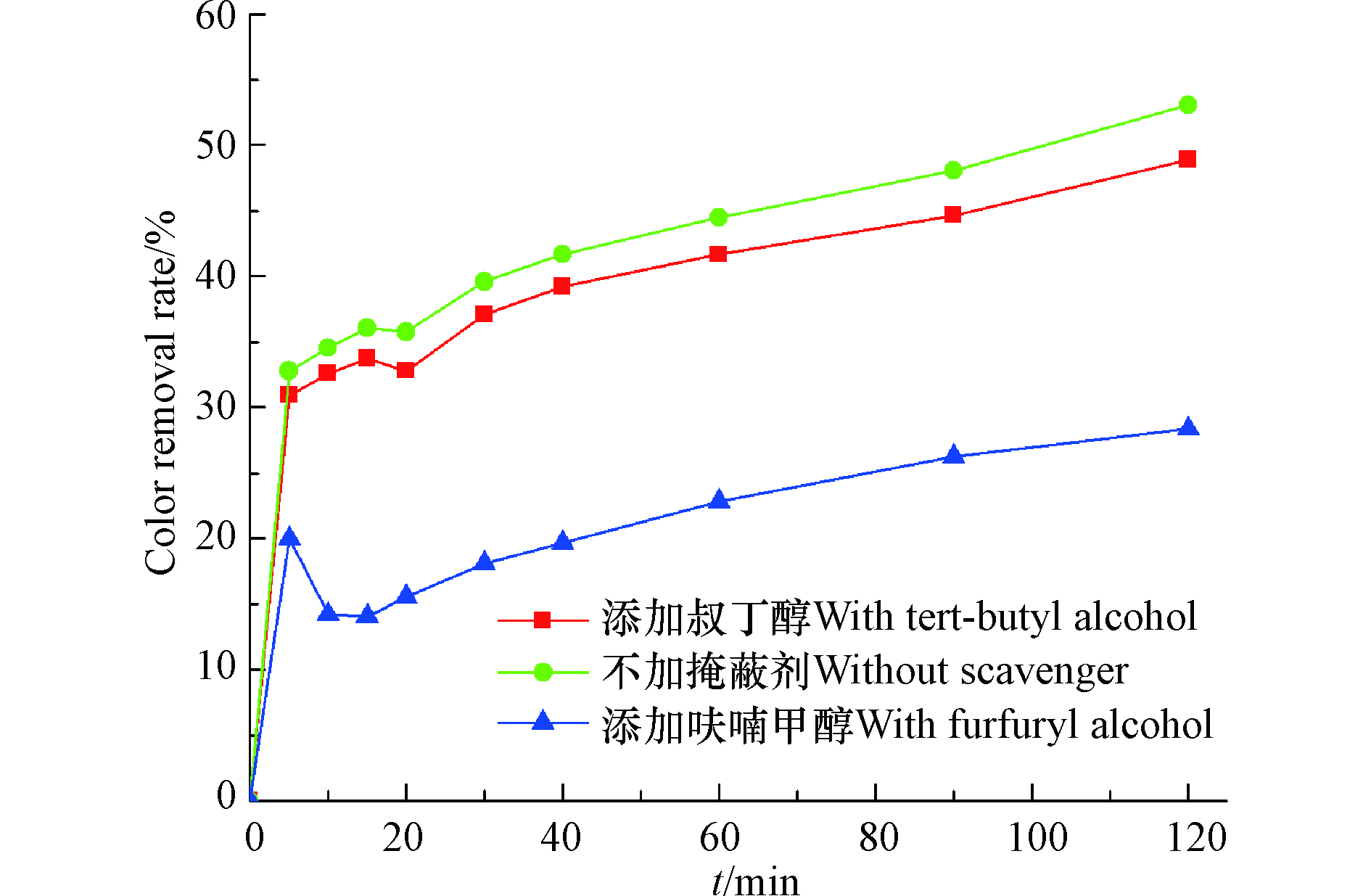
2.2 机理研究
叔丁醇的加入对活性黄X-R的降解过程几乎没有影响,而呋喃甲醇对脱色具有一定的抑制作用,两者之间的脱色率差值在12%―24%之间(图8),因此可以断定原子氧在染料脱色过程中起了一定的作用,OH·和
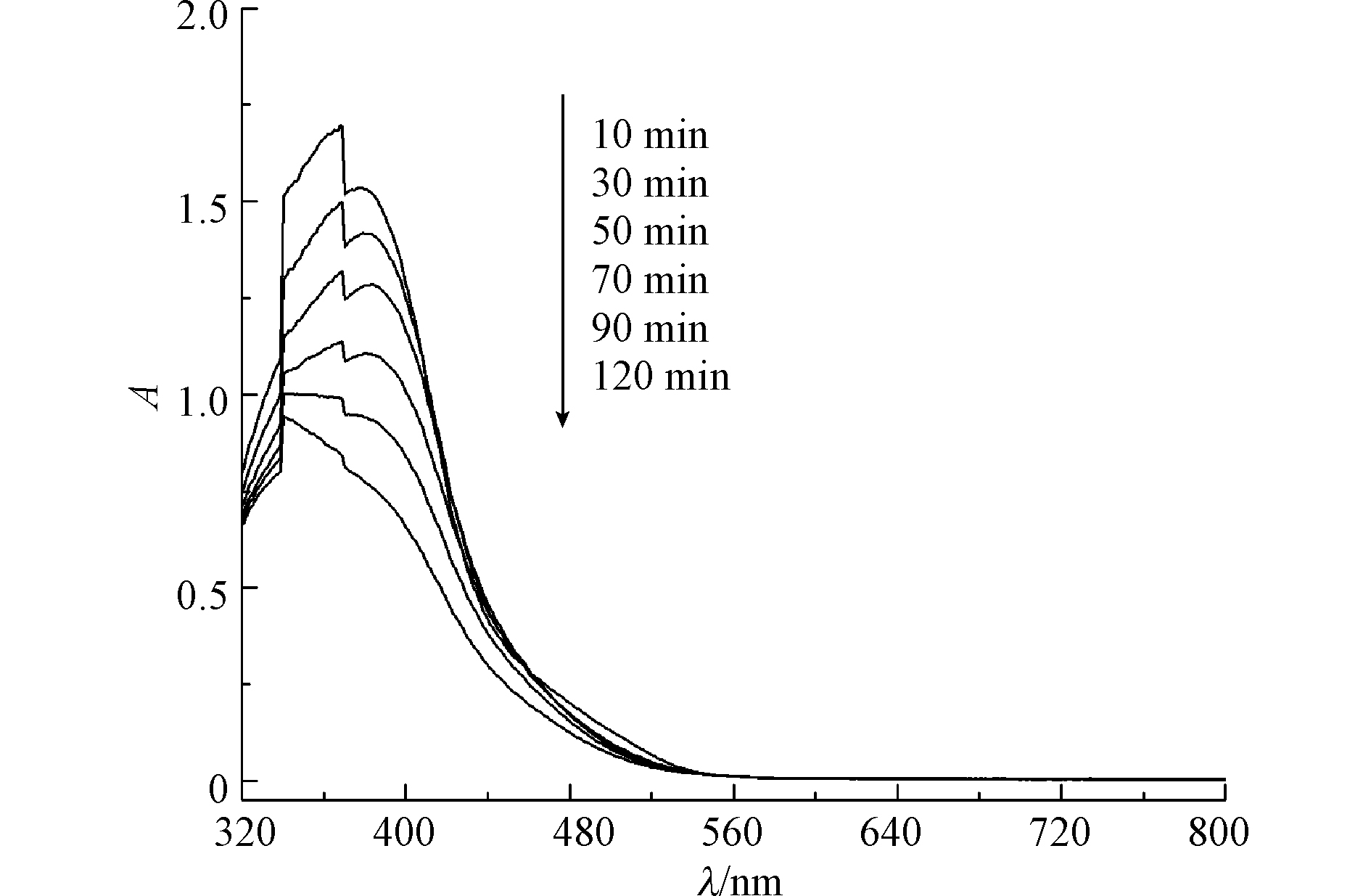
SO−4⋅ 活性黄X-R在390 nm的最大吸收峰对应偶氮键(图9),该峰随着反应的进行逐渐减小,但没有消失,可见偶氮键并未被完全破坏。367―370 nm之间为萘环的吸收峰,峰面积随着反应的进行减小,但反应120 min后该特征吸收峰还在,萘环没有完全打开。
2.3 染料分子结构与脱色率的关系
根据染料的分子结构特征及脱色率,选择磺酸基(
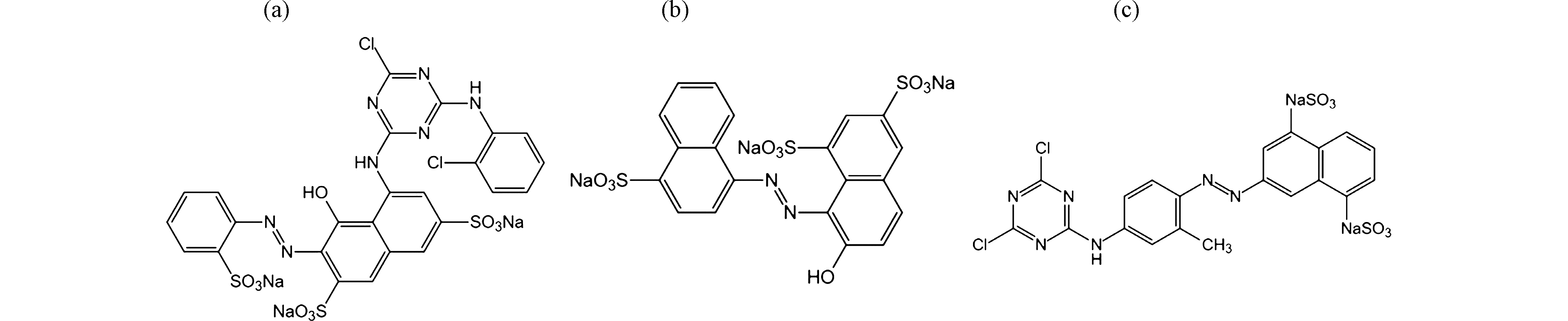
SO−3 分别配制浓度为200 mg·L−1的活性艳红K-2BP、酸性大红3R和活性黄X-R溶液,往里投加NaClO,使混合液中有效氯浓度达到120 mg·L−1,调节废水/NaClO混合液的pH值到9,投加催化剂240 g·L−1,在振荡器上反应90 min后取样,于染料的最大吸收波长下测定溶液的吸光度,换算成浓度,计算其脱色率。3种染料都属于偶氮染料,它们的分子结构见图10,它们的去除率和分子结构描述符见表1.
表 1 偶氮染料的去除率和分子结构描述符Table 1. Removal rate and molecular structure descriptor of the azo dyes染料名称Dye name 分子结构描述符Molecular structure descriptor 脱色率/%Color removal rate A B C 活性艳红K-2BP 3 3.95 5 91.3 酸性大红3R 3 6.25 4 99.69 活性黄 X-R 2 3.14 4 39.3 对表1中的分子结构描述符与脱色率进行线性回归分析,其线性回归方程和参数如表2所示。A、B与脱色率的线性回归数值比较高,说明目标染料的去除率与染料分子结构中磺酸基数目和I/O值之间具有较强的线性相关性,其中磺酸基数目A对去除率的影响尤为突出。染料分子的A值升高,其脱色率增加,这是因为磺酸基数目的增加使染料分子的电子云密度增加,原子氧具有较强的亲电子性,易与偶氮键发生加成反应。染料分子的B值升高,其无机性增强,电离度也随之增大,溶液中磺酸根离子的量增加,原子氧与染料分子之间的反应几率也因此增大,染料的脱色效率提高。C值增大,脱色率也随之增加,但去除率和C值的相关性较差,R2=0.1481,染料分子中C值一般小于10。因此,C值对脱色率的影响很小。
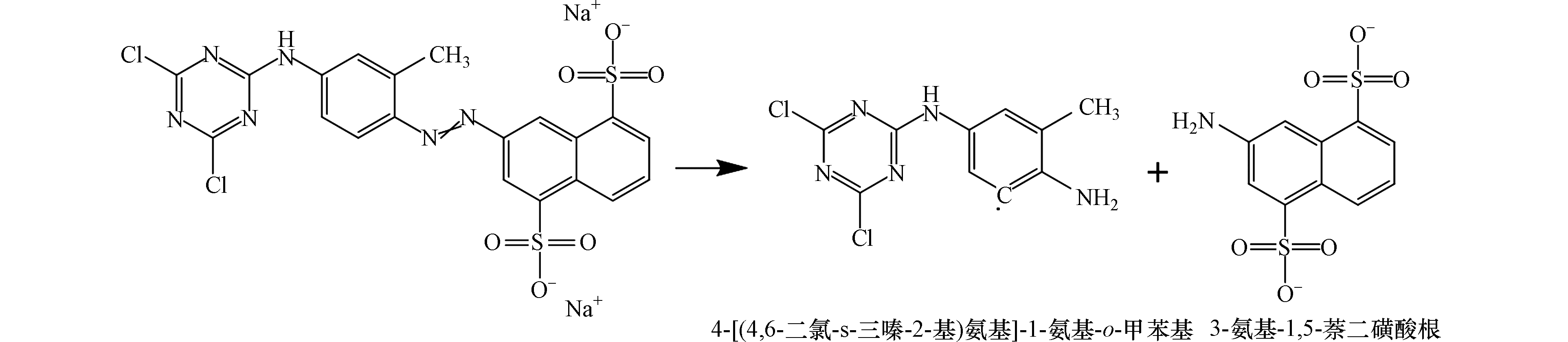
表 2 分子结构描述符与去除率的线性回归方程Table 2. Linear regression equation between molecular structure descriptor and removal rate分子结构描述符Molecular structure descriptor 回归方程Regression equation R2 F A ω 0.9836 59.815 B ω 0.6194 2.627 C ω 0.1481 0.174 偶氮键断开后,活性黄X-R分子被分解成2个芳胺:3-氨基-1,5-萘二磺酸根和4-[(4,6-二氯-s-三嗪-2-基)氨基]-1-氨基-o-甲苯基 (图11)。3-氨基-1,5-萘二磺酸根包含一个萘环,萘环上引入了两个磺酸基,其耐氯牢度大大提高,也就是说OCl−的进攻能力减弱;引入磺酸基的数目越多,耐氯牢度提升也越大[18]。活性黄X-R分子含有二氯均三嗪活性基,由于两个氯原子的吸电子诱导效应,环上的电子云密度较低,故其活性较高,水解率高,固色效果差,容易被浓度高氧化能力弱一些的OCl−进攻。活性艳红K-2BP的分子包含1个偶氮基、一氯均三嗪基、2个苯环和1个萘环(图10)。一氯均三嗪环上的电子云密度高,稳定性强,固色效果好,不易被OCl−进攻[19],却能被氧化性极强的原子氧脱色降解。董亚荣等[20]曾对10种染料的生物降解脱色性能进行了研究,结果表明,X型染料最易降解,K型染料次之。实验结果与该结论吻合。酸性大红3R分子包含1个偶氮基、1个羟基和2个萘环;萘环上有3个磺酸基,其中1个磺酸基位于偶氮基的邻位(图10),其耐氯稳定性好[19],降解过程不易产生有机氯产物。
综上,活性黄X-R分子的耐氯牢度较低,NaClO倾向将其直接氧化,从而抑制了NaClO的催化分解和原子氧的产生,降低了原子氧对脱色降解过程的贡献度。活性艳红K-2BP和酸性大红3R的耐氯稳定性好。NaClO催化氧化法更适合降解耐氯性强的K型活性偶氮染料和含有磺酸钠盐的酸性偶氮染料,不太适合于降解X型活性偶氮染料。苯环染料比萘环染料耐氯性好,这也是吴正雷等[5]用NaClO/镍基催化剂处理甲基橙(对二甲氮基偶苯磺酸钠)废水,没有发现有机氯产物的原因。
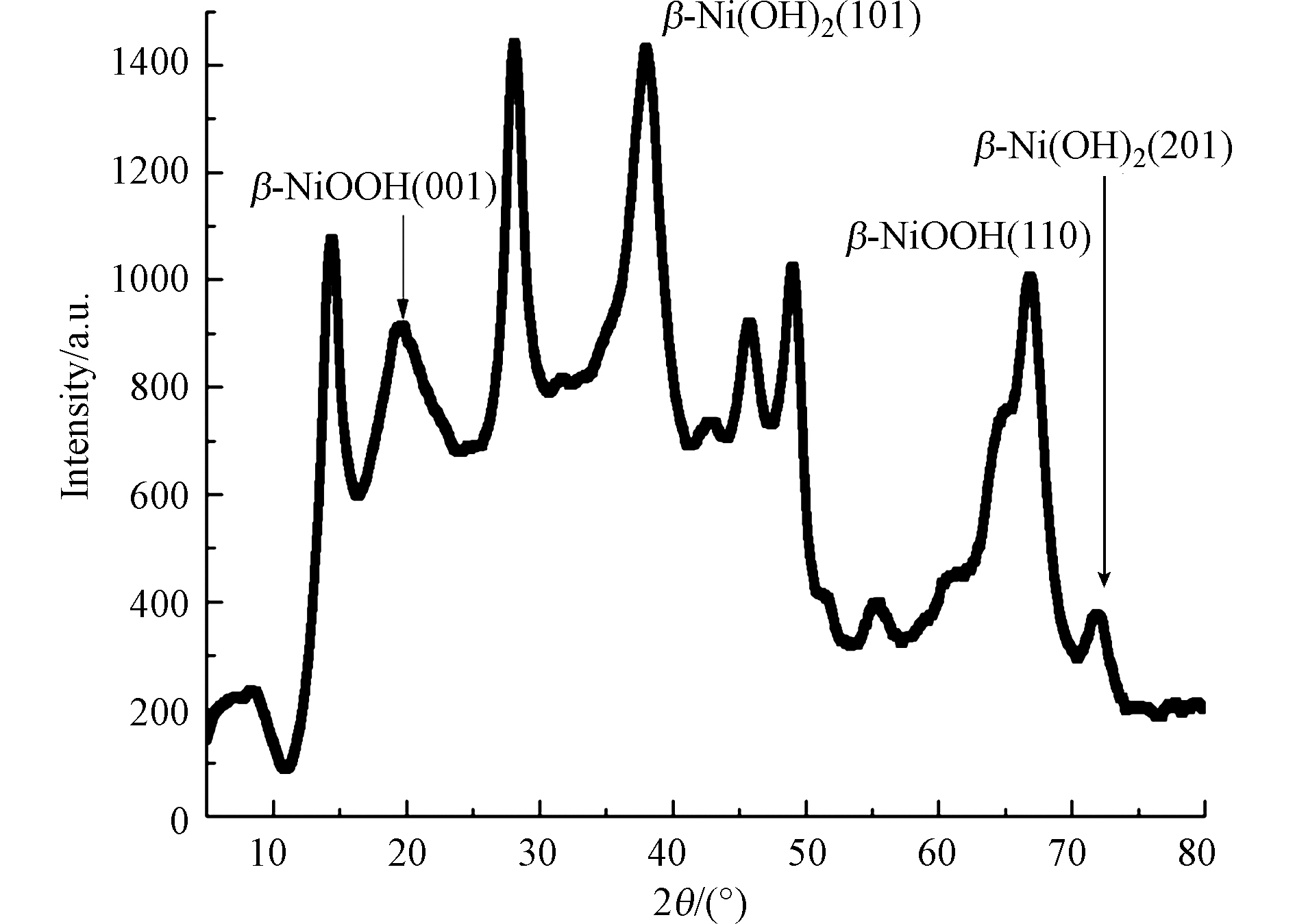
采用XRD对催化剂表层进行物相分析。样品在19.2°和66.7°附近有强的衍射峰(图12),与标准卡(卡号60141)对比可知,样品里含有β-NiOOH,两个衍射峰分别为001和110晶面。样品在38.5°和72.2°处出现两个衍射峰,与标准卡(卡号14117)对比可知,样品里含有β-Ni(OH)2,两个衍射峰分别为101和201晶面。
采用XPS分析法检测催化剂表面的元素及其相对含量。选取新制备的催化剂和分别处理过3000 min不同偶氮染料的三个催化剂小球作为检测样品。样品中氧元素的含量在78%以上(表3)。531.46 eV左右的峰为化学吸附氧引起的[21]。处理过3000 min染料的催化剂样品中氧元素的含量有不同程度的减小,主要是因为产生的原子氧参与降解染料。855.79―856.14 eV的峰是由Ni(Ⅱ)引起的,861.59―861.95 eV的峰是由Ni(Ⅲ)引起的[22]。新制的催化剂样品的Ni(Ⅲ)/Ni(Ⅱ)比值为0.62,处理过3000 min三种不同染料的催化剂样品中Ni(Ⅲ)/Ni(Ⅱ)比值分别为0.46、0.44和0.42,Ni(Ⅲ)的相对含量减少,催化性能略微降低。
表 3 催化剂表面元素的相对占比Table 3. Relative proportion of catalyst surface elements元素Elements 峰位置Position 结合能/eVBinding energy 相对含量/% Relative content 新制备的催化剂New catalyst 处理过3000 min活性艳红K-2BP的催化剂Catalyst of K-2BP treated for 3000 min 处理过3000 min酸性大红3R的催化剂Catalyst of 3R treated for 3000 min 处理过3000 min活性黄X-R的催化剂Catalyst of X-R treated for 3000 min Ni Ni(OH)2,2p3/2 855.98 6.34 10.61 13.46 10.50 Ni Ni(OH)2,2p1/2 873.61 Ni NiOOH,2p3/2 861.86 3.92 4.84 5.95 4.43 Ni NiOOH,2p1/2 879.81 O O1s 531.40 87.67 83.08 78.46 83.83 S S2p 168.67 2.07 1.47 2.13 1.24 图13为新制备的催化剂的SEM照片。由图13可见,催化剂的表面比较平整,镍的沉淀物较为均匀且致密地包裹在氧化铝小球表面,因此,Ni2+不容易渗透到Al2O3小球里。β-NiOOH为球形粒子,β-Ni(OH)2具有六方晶系结构[23],两者紧密缠绕。
3. 结论 (Conclusion)
(1) NaClO催化氧化法对活性黄X-R废水的脱色效果欠佳,催化剂对脱色率的影响甚微。NaClO的直接氧化在脱色过程起了主导作用,原子氧的作用次之。
(2) NaClO催化氧化法更加适合于降解具有较多磺酸基和较高I/O值的偶氮染料。该工艺更加适合于降解稳定性强、耐氯性好的K型活性染料、含有磺酸钠盐的酸性染料和苯环染料。可以采用Mg(OH)2混凝法和Fenton法降解活性黄X-R染料。
(3) XPS分析表明,与用过3000 min的催化剂比较,新制备催化剂表面化学吸附氧占比略高;用过催化剂表面的Ni(Ⅲ)的相对含量减少,催化剂的性能略有降低。化学吸附氧消耗在染料的脱色降解。
-
王娜, 魏样. 土壤重金属镉污染来源及其修复技术探究[J]. 环境与发展, 2019, 31(8):55-56 , 58 Wang N, Wei Y. Study on sources of heavy metal cadmium pollution in soil and its remediation technology[J]. Environment and Development, 2019, 31(8):55-56, 58(in Chinese)
陈志良, 莫大伦, 仇荣亮. 镉污染对生物有机体的危害及防治对策[J]. 环境保护科学, 2001, 27(4):37-39 Chen Z L, Mo D L, Qiu R L. Biological damage of soil cadmium (Cd) pollution and its control[J]. Environmental Protection Science, 2001, 27(4):37-39(in Chinese)
中华人民共和国国土资源部. 环境保护部和国土资源部发布全国土壤污染状况调查公报[J]. 资源与人居环境, 2014(4):26-27 Arasimowicz-Jelonek M, Floryszak-Wieczorek J, Gwóźdź E A. The message of nitric oxide in cadmium challenged plants[J]. Plant Science, 2011, 181(5):612-620 杨亚丽, 李友丽, 陈青云, 等. 土壤铅、镉、铬对蔬菜发育影响及迁移规律的研究进展[J]. 华北农学报, 2015, 30(S1):511-517 Yang Y L, Li Y L, Chen Q Y, et al. The research progress of lead, cadmium and chromium in soil on the growth and migration of vegetables[J]. Acta Agriculturae Boreali-Sinica, 2015, 30(S1):511-517(in Chinese)
张静, 赵秀侠, 汪翔, 等. 重金属镉(Cd)胁迫对水芹生长及生理特性的影响[J]. 植物生理学报, 2015, 51(11):1969-1974 Zhang J, Zhao X X, Wang X, et al. Effects of cadmium stress on the growth and physiological property of Oenanthe javanica[J]. Plant Physiology Journal, 2015, 51(11):1969-1974(in Chinese)
陈琪, 朱润良, 葛飞, 等. 两种典型粘土矿物对狐尾藻镉毒害效应的缓解作用[J]. 环境化学, 2017, 36(7):1596-1601 Chen Q, Zhu R L, Ge F, et al. Alleviating effect of two clay minerals toward cadmium treated Myriophyllum verticillatum[J]. Environmental Chemistry, 2017, 36(7):1596-1601(in Chinese)
Yang H Y, Wu W L, Li W L, et al. Accumulation and physiological response of cadmium in Hydrocharis dubia[J]. Biologia, 2017, 72(2):145-152 Varun M, Ogunkunle C O, Sarathambal C, et al. Effect of cadmium uptake on growth and physiology of water lettuce[J]. Indian Journal of Weed Science, 2017, 49(1):102-104 葛依立, 陈心胜, 黄道友, 等. 湿地植物水蓼(Polygonum hydropiper L.)对镉的富集特征及生理响应[J]. 生态毒理学报, 2020, 15(2):190-200 Ge Y L, Chen X S, Huang D Y, et al. Accumulation characteristics and physiological responses of the wetland plant, Polygonum hydropiper L. to cadmium[J]. Asian Journal of Ecotoxicology, 2020, 15(2):190-200(in Chinese)
秦晓凤, 徐瑞成, 王振华, 等. 锰锌铁氧体/锆钛酸铅复合陶瓷微结构及磁电性能研究[J]. 电子元件与材料, 2019, 38(8):20-28 Qin X F, Xu R C, Wang Z H, et al. Microstructure and magnetoelectric properties of MZFO/PZT composite ceramics[J]. Electronic Components and Materials, 2019, 38(8):20-28(in Chinese)
叶攀骅, 王洋, 刘可慧, 等. 改良剂对锰超富集植物短毛蓼锰吸收及抗氧化酶系统的影响[J]. 土壤, 2016, 48(1):109-116 Ye P H, Wang Y, Liu K H, et al. Effects of mineral amendment on manganese absorption and antioxidant enzymes activities in hyperaccumulator Polygonum pubescens Blume[J]. Soils, 2016, 48(1):109-116(in Chinese)
Li M S, Luo Y P, Su Z Y. Heavy metal concentrations in soils and plant accumulation in a restored manganese mineland in Guangxi, South China[J]. Environmental Pollution, 2007, 147(1):168-175 徐莜, 杨益新, 李文华, 等. 锰离子浓度及其转运通道对水稻幼苗镉吸收转运特性的影响[J]. 农业环境科学学报, 2016, 35(8):1429-1435 Xu Y, Yang Y X, Li W H, et al. Effects of manganese concentrations and transporters on uptake and translocation of cadmium in rice seedlings[J]. Journal of Agro-Environment Science, 2016, 35(8):1429-1435(in Chinese)
Peng K J, Luo C L, You W X, et al. Manganese uptake and interactions with cadmium in the hyperaccumulator-Phytolacca Americana L.[J]. Journal of Hazardous Materials, 2008, 154(1-3):674-681 Zornoza P, Sánchez-Pardo B, Carpena R O. Interaction and accumulation of manganese and cadmium in the manganese accumulator Lupinus albus[J]. Journal of Plant Physiology, 2010, 167(13):1027-1032 Liu J, Yu G, Jiang P P, et al. Interaction of Mn and Cd during their uptake in Celosia argentea differs between hydroponic and soil systems[J]. Plant and Soil, 2020, 450(1-2):323-336 Jarvis S C, Jones L H P, Hopper M J. Cadmium uptake from solution by plants and its transport from roots to shoots[J]. Plant and Soil, 1976, 44(1):179-191 Cataldo D A, Garland T R, Wildung R E. Cadmium uptake kinetics in intact soybean plants[J]. Plant Physiology, 1983, 73(3):844-848 Pal'ove-Balang P, Kisová A, Pavlovkin J, et al. Effect of manganese on cadmium toxicity in maize seedlings[J]. Plant, Soil and Environment, 2011, 52(4):143-149 李明顺, 钟闱桢. 锰和镉单独及联合染毒对豇豆生长及叶片脂质过氧化的影响[J]. 环境与健康杂志, 2009, 26(5):431-434 Li M S, Zhong W Z. Effect of manganese, cadmium and manganese-cadmium combined exposure on cowpea growth and leaf physiological parameters[J]. Journal of Environment and Health, 2009, 26(5):431-434(in Chinese)
李然, 徐应明, 王林, 等. 不同锰处理对镉胁迫下2种油菜重金属累积和根系形态的影响[J]. 生态毒理学报, 2018, 13(2):140-148 Li R, Xu Y M, Wang L, et al. Effects of different manganese treatments on heavy metals accumulation and root morphology of two cultivars of Brassica chinensis under cadmium stress[J]. Asian Journal of Ecotoxicology, 2018, 13(2):140-148(in Chinese)
Huang Q N, An H, Yang Y J, et al. Effects of Mn-Cd antagonistic interaction on Cd accumulation and major agronomic traits in rice genotypes by different Mn forms[J]. Plant Growth Regulation, 2017, 82(2):317-331 Liu J, Mo L Y, Zhang X H, et al. Simultaneous hyperaccumulation of cadmium and manganese in Celosia argentea Linn[J]. International Journal of Phytoremediation, 2018, 20(11):1106-1112 于磊, 刘宗林, 徐宗艺, 等. NaCl胁迫对大豆生理特征的影响[J]. 安徽农业科学, 2019, 47(24):39-41 Yu L, Liu Z L, Xu Z Y, et al. Physiological characteristics of soybean under NaCl stress[J]. Journal of Anhui Agricultural Sciences, 2019, 47(24):39-41(in Chinese)
Karimi N, Jamali N, Ghaderian S M. Effects of cadmium and zinc on growth and metal accumulation of Mathiola flavida Boiss[J]. Environmental Engineering and Management Journal, 2014, 13(12):2937-2944 张玉秀, 李林峰, 柴团耀, 等. 锰对植物毒害及植物耐锰机理研究进展[J]. 植物学报, 2010, 45(4):506-520 Zhang Y X, Li L F, Chai T Y, et al. Mechanisms of manganese toxicity and manganese tolerance in plants[J]. Chinese Bulletin of Botany, 2010, 45(4):506-520(in Chinese)
钟闱桢. 锰矿区尾矿坝及锰镉复合污染对植物的生态毒理学研究[D]. 桂林:广西师范大学, 2008:34-35 Zhong W Z. Ecotoxicological effect of manganese mine tailings and Mn-Cd combined pollution on plants[D]. Guilin:Guangxi Normal University, 2008:34 -35(in Chinese)
Socha A L, Guerinot M L. Mn-euvering manganese:The role of transporter gene family members in manganese uptake and mobilization in plants[J]. Frontiers in Plant Science, 2014, 5:106 Ramos I, Esteban E, Lucena J J, et al. Cadmium uptake and subcellular distribution in plants of Lactuca sp. Cd-Mn interaction[J]. Plant Science, 2002, 162(5):761-767 Wu S W, Shi K L, Hu C X, et al. Non-invasive microelectrode cadmium flux measurements reveal the decrease of cadmium uptake by zinc supply in pakchoi root (Brassica chinensis L.)[J]. Ecotoxicology and Environmental Safety, 2019, 168:363-368 Sasaki A, Yamaji N, Yokosho K, et al. Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J]. The Plant Cell, 2012, 24(5):2155-2167 Yao Y N, Xu G, Mou D L, et al. Subcellular Mn compartation, anatomic and biochemical changes of two grape varieties in response to excess manganese[J]. Chemosphere, 2012, 89(2):150-157 Saraswat S, Rai J P N. Complexation and detoxification of Zn and Cd in metal accumulating plants[J]. Reviews in Environmental Science and Bio/Technology, 2011, 10(4):327-339 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 2175
- HTML全文浏览数: 2175
- PDF下载数: 82
- 施引文献: 0








 下载:
下载: