电化学脱硝过程参数的响应曲面优化研究
Optimization of electrochemical denitrification process parameters with Box-Behnken design
-
摘要: 以Ti/IrO2-TiO2-RuO2为阳极,Cu/Zn合金电极为阴极,在无隔膜电解池中对这一新构造电极对的脱硝氮性能进行了研究。为了有效结合阴极硝氮还原能力和阳极氧化能力,采用响应曲面法中的Box-Behnken 设计优化了对电化学脱硝过程有显著影响的4个重要因素:氯化钠含量、电流密度、pH和初始硝氮浓度。优化结果表明,相对于pH和初始硝氮浓度,氯化钠含量和电流密度对脱硝性能影响更大,而阴极硝氮还原性能主要受初始硝氮浓度、pH的影响。以6 h内电极对脱氮百分率为响应量,优化得最佳电化学脱硝过程参数为:氯化钠含量,1 g/L; 电流密度,24.99 mA/cm2; pH,1.81;初始硝氮浓度100 mg/L。在此实验条件下,6 h内电极对脱氮百分率预测值为99.84%。通过3次重复验证实验,确认实际6 h内电极对脱氮百分率为91.34%。预测值与实测值两者相差不大,由此可知,Box-Behnken 设计是一种优化电化学脱氮实验参数的有效方法,经过优化后的电极对具有较佳的脱氮效率。
-
关键词:
- 电化学脱硝 /
- Ti/IrO2-TiO2-RuO2阳极 /
- 优化 /
- Box-Behnken /
- design
Abstract: This study investigated the performance of electrochemical denitrification using Ti/IrO2-TiO2-RuO2 as the anode and Cu/Zn as the cathode in an undivided cell. In order to obtain an ideal performing condition of cathodic reduction of nitrate and anodic oxidation of the formed by-product, Box-Behnken design of response surface method was employed to optimize the factors that were NaCl dosage, current density, pH and initial nitrate concentration and which were proved to have a significant effect on electrochemical nitrate removal. Current density and NaCl dosage had stronger effects on nitrate removal efficiency than initial nitrate concentration and pH in the present study. The optimal value of NaCl dosage, current density, pH and initial nitrate concentration for nitrate removal efficiency are 1 g/L, 24.99 mA/cm2, 1.81 and 100 mg/L, respectively, at which the predicted nitrate removal efficiency after 6 h electrolysis calculated with the fitted equation is 99.84%, as against the actual nitrate removal efficiency of 91.34% which was obtained through duplicate confirmatory experiments. The difference between the predicted and actual nitrate removal efficiency is minor, indicating Box-Behnken design can be effectively used to optimize the design for experiments on the electrochemical reduction of nitrate.-
Key words:
- electrochemical nitrate removal /
- Ti/IrO2-TiO2-RuO2 anode /
- optimization /
- Box-Behnken design /
-
近年来,全国90%以上的城市水域受污染严重,多种污染物并存成为水污染的新现状[1-2],当前氮磷已超过有机污染物成为主要污染物,控制污水中氮磷浓度成为水污染治理重点。纳米零价铁(nZVI)在环境修复中得到了广泛的研究[3-5],其具有还原性强、比表面积大和高反应活性等的特点,但单独使用易被氧化甚至自燃,或发生团聚形成链状或更大聚集体[6-7],从而降低其分散性和稳定性[8],限制了纳米零价铁的实际应用。为解决上述问题,在nZVI实际应用过程中常利用各类固定化手段,如负载法[9-10]等完成nZVI表面改性以克服其易团聚的缺陷性。
目前,常见的用于固定nZVI的材料有多孔材料(活性炭[11]、多孔碳板及浮石[12])和无机黏土矿物(蒙脱石[13]、膨润土[14])等,但利用这类材料进行nZVI改性存在成本高、制备工艺复杂的缺点[15],因此,在选取时考虑到实际工程应用的需要,应选择更节省成本且对环境友好的改性材料。高炉碱矿渣是高炉炼铁的副产物,属于固体废弃物类,露天堆放会侵占土地,污染大气和水环境,亦会造成明显或潜在的经济损失及资源浪费[16]。而碱矿渣材料具有比表面积大、孔隙率高,吸附能力强的特点,故可作为吸附剂、絮凝剂用于水处理[17]。鉴于nZVI和高炉碱矿渣两者在各自应用上的局限性,因此,本研究尝试将nZVI负载到高炉碱矿渣上,以探索解决两者应用缺陷性的有效途径。
实验中将nZVI负载高炉碱矿渣上,在不同质量比和不同投加量条件下,研究该负载材料对受污染地表水体中氮磷的去除效果,并通过改变温度条件和反应接触时间,研究其吸附机理。本研究在有效提高污水中氮磷去除率的同时,可提供一种价格低廉且安全绿色的新型环保材料。
1. 材料与方法
1.1 试剂与仪器
硫酸亚铁、硼氢化钠、无水乙醇、葡萄糖、硝酸钾、硫酸铵、磷酸氢二钾均为分析纯级别,购自上海国药。高炉碱矿渣购自河南远恒环保工程有限公司,组成成分以CaO、MgO、SiO2、Al2O3、MnO、Fe2O3等为主(大于90%),还有部分CaS、MnS等(小于10%)。实验仪器有pH计(HACH-HQ40d)、溶氧仪(HACH-HQ40d)、电子天平(ME204TE/02)、数显控温加热磁力搅拌器(MPLK-701)、冷冻干燥机(FD-1A-50)、1 L双缸玻璃反应釜、卧式智能精密型摇床(BSD-WX2200)、紫外分光光度计(UV-2000)。
1.2 材料的制备
1)高炉碱矿渣负载纳米零价铁颗粒的制备。参考肖燕萍等[18]的研究,采用液相还原法制备碱矿渣-nZVI,分别取24.88 g七水合硫酸亚铁、20 g碱矿渣粉、50 mL硼氢化钠溶液于玻璃反应釜内,为保证新鲜制备的nZVI不被氧化,反应过程中持续通入氮气以保证厌氧环境,体系中的反应如式(1)所示。
Fe2++2BH4−+6H20→Fe0↓+2B(OH)3+7H2↑ (1) 2)实验设计。制备6种不同m矿渣粉:mFe2+比例(10∶1、8∶1、6∶1、4∶1、2∶1、1∶1)的碱矿渣-nZVI。以葡萄糖、硫酸铵、硝酸钾、磷酸氢二钾配制模拟污水,设计浓度分别为硝氮15 mg·L−1、氨氮15 mg·L−1、总磷2 mg·L−1。取100 mL配制的污水于各150 mL锥形瓶中,再向每个锥形瓶中分别加入0.1、0.2、0.5、1.0、2.0 g的碱矿渣和碱矿渣-nZVI材料做为对照组与实验组。在165 r∙min−1、25 ℃的卧式摇床中振荡24 h,取样,用国标法(GB 3838-2002)分别测定硝氮、氨氮、亚硝氮、总氮和总磷的出水浓度。
3)数据分析方法。吸附等温线反应在一定温度条件下,吸附达到平衡时吸附剂与吸附量的关系。吸附等温线的类型有很多种,其中Langmuir吸附模型是指恒温下均一表面的单层吸附平衡,Freundlich吸附模型则描述了发生在多分子层的吸附过程,这2种吸附模型(式(2)和式(3))被用来分析此次得出的实验数据[19]。
Ceqe=1qm+KL+Ceqm (2) lnqe=lnKF+1nlnCe (3) 式中:
Ce 为吸附平衡时的浓度,mg∙g−1;qe 为吸附反应平衡时的吸附量,mg∙g−1;qm 为最大吸附量,mg∙g−1;KL 为Langmuir吸附模型的吸附常数;KF 、1n 为Freundlich吸附模型的吸附常数。为了推断高炉碱矿渣的具体吸附过程,研究其脱氮除磷的吸附速率和机理,可采用不同动力学模型解释吸附过程中的行为。准一级动力学方程应用广泛,该方程假定吸附质的吸附去除变化速率与吸附量及平衡吸附量之间的差值呈线性关系;准二级动力学方程则与化学吸附作用密切相关,涉及吸附质与吸附剂之间的电子共用或电子转移[20]。准一级和准二级动力学方程分别如式(4)~(5)所示。
ln(qe−qt)=lnqe−K1t (4) tqt=12K2q2e+tqe (5) 式中:
qe 为吸附反应平衡时的吸附量,mg∙g−1;qt 为t时间下,吸附剂上的吸附量,mg∙g−1;K1 、K2 分别为准一级、准二级动力学的方程系数。为了能够进一步评估温度对高炉碱矿渣吸附氮磷元素的影响,可以采用式(6)~(8)计算出相关的热力学参数[21]。
Kd=qeCe (6) lnKd=ΔSR−ΔHRT (7) ΔG=ΔH−TΔS (8) 式中
:Kd 为吸附过程中的分配系数,mL∙g−1;R 为气体摩尔常数,8.314 J∙(mol∙K)−1;T 为热力学温度,K;ΔS 为吸附过程中的熵变,J∙(mol∙K)−1;ΔH 为吸附过程中的焓变,mg·L−1;ΔG 为吸附过程中的吉布斯自由能变,KJ∙mol−1。2. 结果与分析
2.1 材料表征
1)扫描电镜分析(SEM)和比表面积(BET)。为观察负载前后材料的外貌形态,对负载nZVI前后的高炉碱矿渣进行扫描电镜分析,结果如图1所示。高炉碱矿渣和碱矿渣-nZVI的比表面积测定结果如表1所示。由图1(a)可见,未负载nZVI的高炉碱矿渣呈不规则块粒状分布,表面平整,有空隙存在。图1(b)是负载nZVI后的碱矿渣-nZVI,与碱矿渣的电镜图相比,其表面明显附着大小均匀颗粒,且大部分颗粒能够独立存在,这表明高炉碱矿渣对nZVI具有较好的分散效果,可以减弱nZVI颗粒之间相互团聚的倾向[22]。
表 1 碱矿渣和碱矿渣-nZVI的比表面积Table 1. The surface area of alkali slag and alkali slag-nZVI材料 比表面积/(m2∙g−1) 孔容/(cm3∙g−1) 孔径/nm 碱矿渣 2.289 0.011 3.933 碱矿渣-nZVI 9.054 0.035 3.931 如表1所示,可见其孔径分别集中在3.933 nm和3.931 nm左右,差异不显著,这表明nZVI负载进了碱矿渣的空隙中;未负载nZVI的碱矿渣的比表面积仅为2.289 m2∙g−1,负载后其表面积提高至9.054 m2∙g−1,小于普通零价铁的比表面积(25~35 m2∙g−1)[23]。
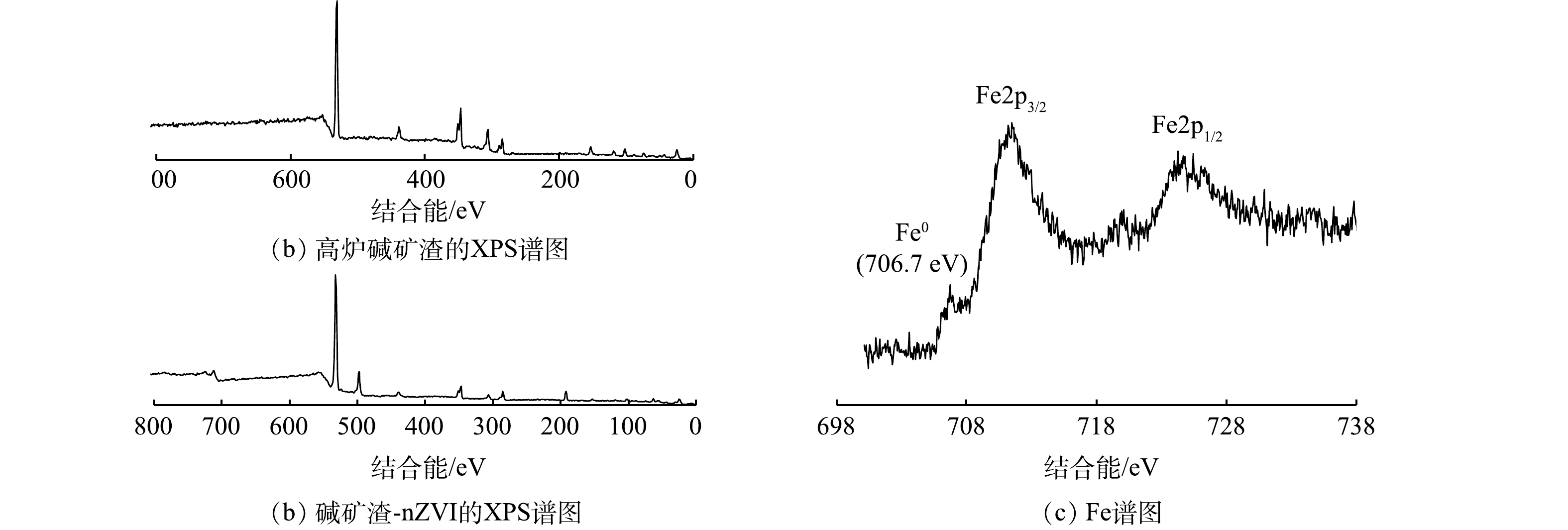
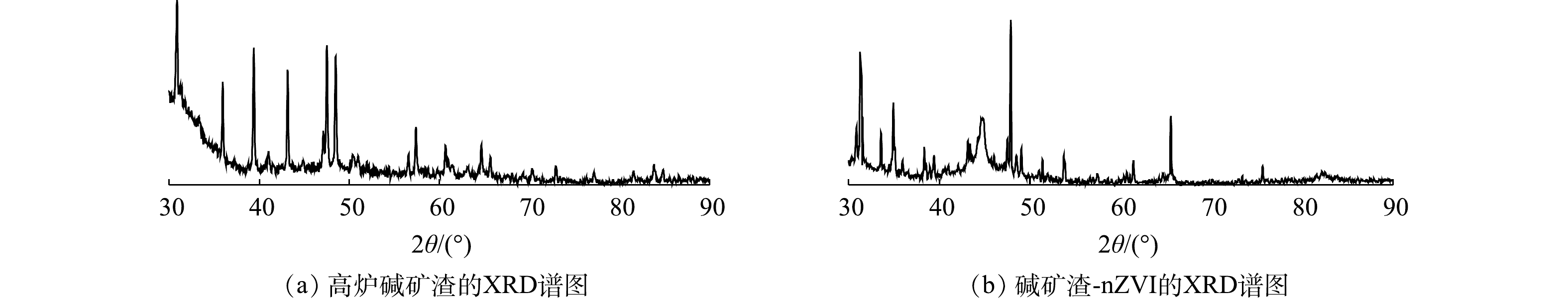
2) X射线光电子能谱(XPS)和X射线衍射分析(XRD)。为了直接得到负载材料内部nZVI颗粒存在的信息,本文利用X射线光电子能谱对碱矿渣-nZVI内部的Fe0进行分析,结果如图2和图3所示。由图2(c)可以看出,在706.7、711.8和724.8 eV处出现的特征峰分别对应Fe(0)2p3/2、Fe(Ⅲ)2p3/2、Fe(Ⅲ)2p1/2的结合能[24]。结果表明,在碱矿渣-nZVI内部确实存在Fe0,二价、三价铁氧化物的存在可能是因为部分Fe0裸露在碱矿渣表面被氧化形成的。图3为高炉碱矿渣和碱矿渣-nZVI颗粒的XRD图谱。由图3可知,碱矿渣-nZVI颗粒在2θ=44.56°处出现的衍射峰与体心立方晶格铁的(110)面的特征峰一致[23]。
2.2 污染物去除效果
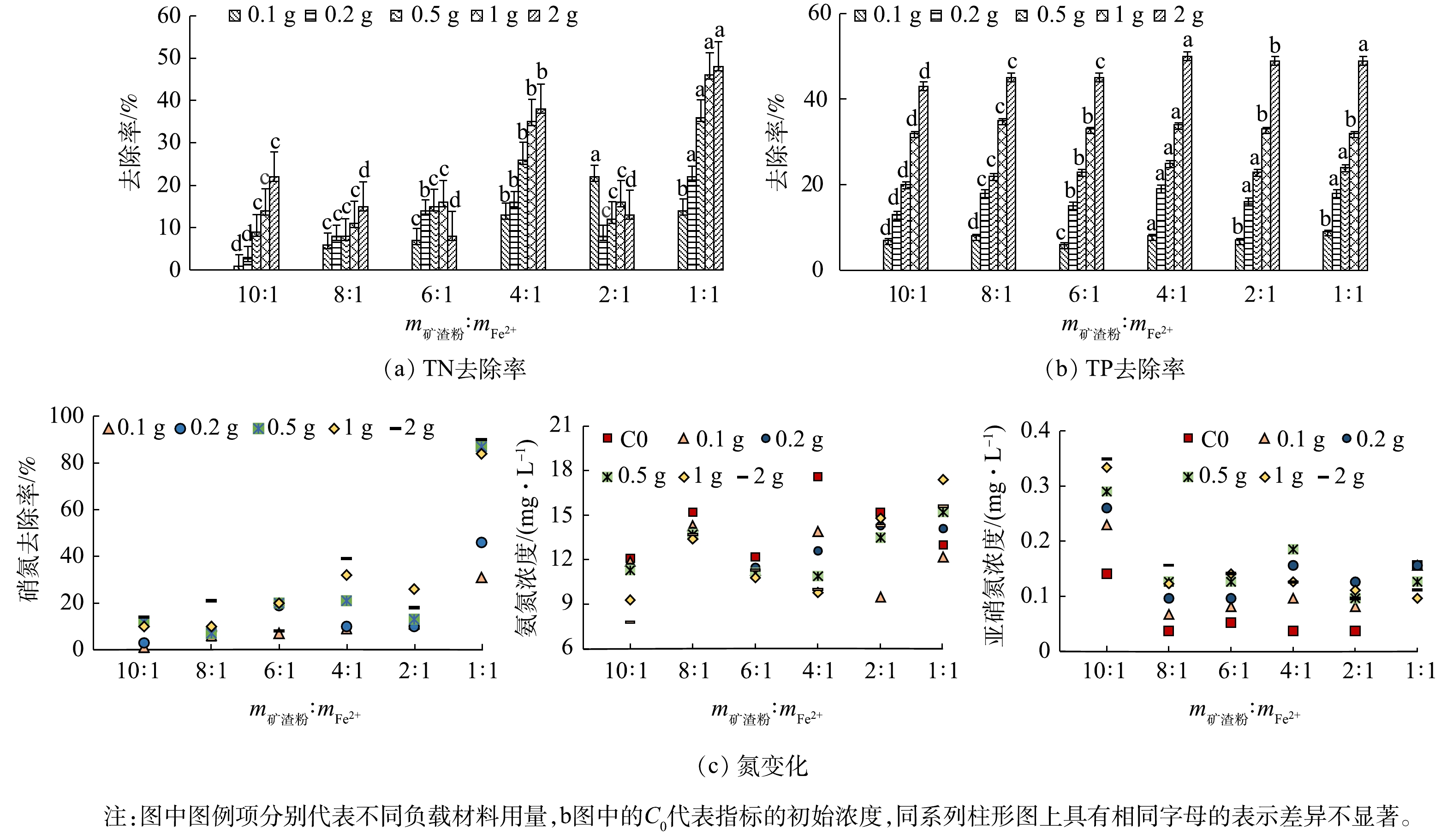
1)不同碱矿渣与Fe2+质量比对氮磷去除率的影响。为了探究碱矿渣与Fe2+质量比对负载型纳米零价铁处理效果的影响,本实验制备出6种不同质量比例的碱矿渣-nZVI,并分别将其用于去除污水中的氮磷元素。实验结果如图4和图5所示。
图4表示的是在不同质量比例条件下,不同负载材料用量处理污水的出水pH。由图4可知,所有条件下的出水pH均高于8,呈碱性,其主要原因是负载材料中存在有铁元素,Fe0在被氧化过程中会消耗溶液中的H+,最终造成出水pH升高。
由图5(a)可见,当m矿渣粉∶mFe2+为1∶1时,负载材料用量0.1、0.2、0.5、1、2 g对总氮的去除率分别为14%、22%、36%、46%和48%。当两者比例增加时,负载型纳米零价铁对总氮的去除率显著降低(P<0.05),对比同等条件下只添加碱矿渣处理的出水总氮数据来看,负载材料的总氮去除率均高于对照组的总氮去除率9%、17%、20%、23%和26%,其原因是多方面的,具体可通过图5(c)中3种形态氮的变化来解释。
由图5(b)可见,碱矿渣负载纳米零价铁对总磷的去除效果明显,当m矿渣粉∶mFe2+从10∶1降至4∶1时,各不同用量下总磷的去除率显著增大(P<0.05),分别达到77%、68%、62%、79%和68%;当比例再降低时,总磷的去除率不升反降,即使在两者比例为1∶1时,去除率也只能分别达到62%、62%、68%、65%和65%。但对比同等条件下只添加碱矿渣处理后的出水总磷的去除率8%、17%、23%、33%和47%,所有比例条件下总磷去除率都相对较高,说明负载材料在去除磷酸盐时有沉淀作用发生。
由图5(c)可见,m矿渣粉∶mFe2+为1∶1时,各负载材料用量下的硝氮去除率分别为31%、46%、87%、84%和90%,当两者比例增加时,硝氮去除率显著降低(P<0.05)。其可能的原因是,负载材料中的Fe0含量减少,一方面使Fe0与硝酸盐的还原作用受到影响,另一方面Fe0被氧化后生成的Fe2+、Fe3+也相对减少,从而抑制反硝化过程的进行,最终导致硝氮去除率降低。在m矿渣粉∶mFe2+为4∶1时氨氮的去除效果好于在其他质量比的负载材料下的效果,而当m矿渣粉∶mFe2+为1∶1时,出水氨氮浓度高于进水氨氮浓度,且有随负载材料用量增加而升高的趋势。这可能是因为该质量比的负载材料中存在有足量的Fe0,能够在还原足够多硝氮的同时生成多于硝化过程可以反应掉的氨氮,最终表现为出水的氨氮浓度增加,其他质量比条件下的氨氮呈现被消耗的状态,以m矿渣粉∶mFe2+为4∶1时去除效果最佳;而亚硝氮存在有相反的变化趋势,当m矿渣粉∶mFe2+为1∶1时,亚硝氮开始被消耗,其它各质量比条件下出水的亚硝氮浓度均成升高趋势,以m矿渣粉∶mFe2+为4∶1时浓度增幅最大,这种现象也可以用负载材料中的Fe0含量解释。
以上结果表明,不同质量比例的碱矿渣与Fe2+对总氮和总磷的去除率有明显影响(P<0.05),其原因可能是碱矿渣投入量过多时会覆盖纳米零价铁颗粒,抑制硝化与反硝化过程的进行,从而降低去除率;而当碱矿渣投入量过少时,又不利于纳米零价铁的分散,造成其在使用过程中易发生团聚并堵塞矿渣粉表面空隙,导致材料自身吸附性能下降。因此,实际应用时应选取最合适质量比,结合实验数据,本文确定碱矿渣与Fe2+的最佳质量配比为4:1,最有效用量为1 g,以用于后续实验。
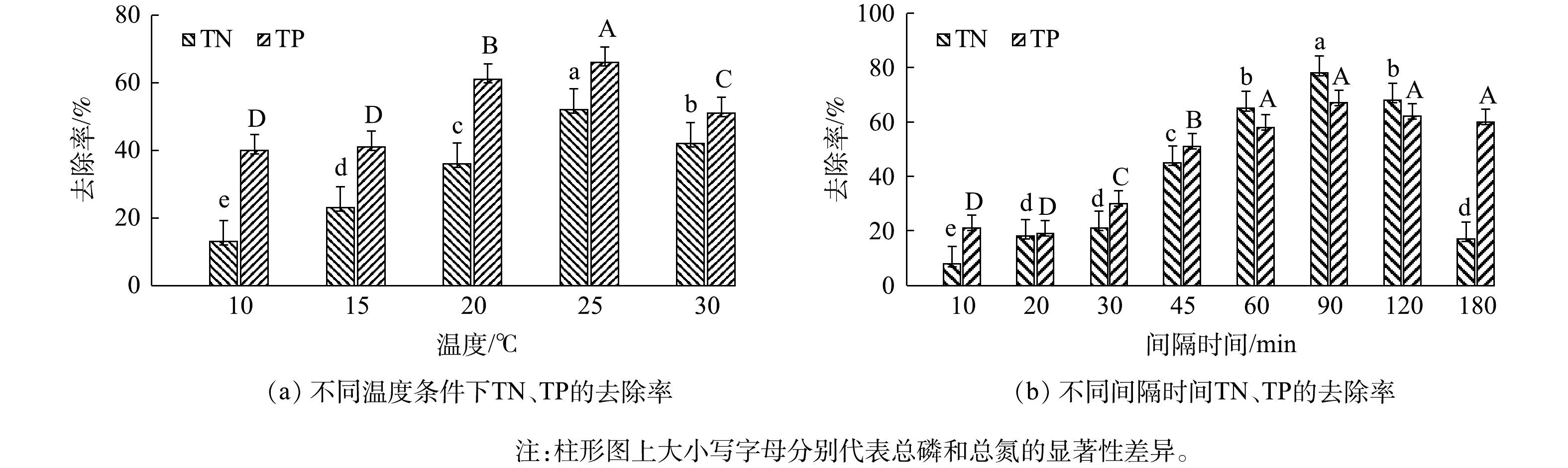
2)不同条件下碱矿渣-nZVI对总氮和总磷的去除效果。由上述实验得到最佳m矿渣粉∶mFe2+比例为4∶1,最佳用量为1 g后,为对比不同温度和间隔时间下负载材料对总氮和总磷的去除率,将1 g负载材料投加到总氮浓度为30 mg·L−1、总磷浓度为2 mg·L−1的水样中,在温度为10、15、20、25、30 ℃和间隔时间为10、20、30、45、60、90、120、180 min的条件下分别进行反应。实验结果如图6所示。由图6可知,随着温度的升高,总氮和总磷去除率在25 ℃分别达到最大值,为52%和66%,在30 ℃时两者去除率反而下降。间隔时间也会对总氮和总磷的去除率造成影响,具体表现为:在90 min前,负载材料对总氮和总磷的去除率呈显著提高趋势(P<0.05);在90 min时达到最大值,分别为78%和67%;在90 min后,总氮和总磷的去除率又有所下降。可见,不同的温度和间隔时间会影响总氮和总磷的去除率。结果表明,在温度为25 ℃、间隔时间为90 min的条件下,总氮和总磷的去除效果最佳。
2.3 吸附机理
1)等温吸附曲线。液-固界面的等温吸附行为通常采用Langmuir和Freundlich等温吸附模型进行描述[25]。将上述实验所得数据用Langmuir和Freundlich 2种等温吸附模型进行拟合分析,具体相关参数见表2。拟合结果表明,总氮和总磷采用Langmuir等温吸附模型得到的相关系数R2均高于Freundlich模型,这表明吸附过程更符合Langmuir模型,说明总氮和总磷的吸附过程主要在单分子层进行,主要原因可能是活性吸附位点均匀分布在吸附材料上造成的。同时,拟合得到的KL较小,说明负载材料的吸附亲和力不大。Freundlich模型的拟合结果表明,总氮和总磷的1/n分别为0.094和0.108,均小于1。n指示的是吸附过程中的支持力,1/n越小吸附性能越好,一般认为当1/n为0.1~0.5时,吸附较易进行;当1/n>2时,吸附将难以进行[26]。
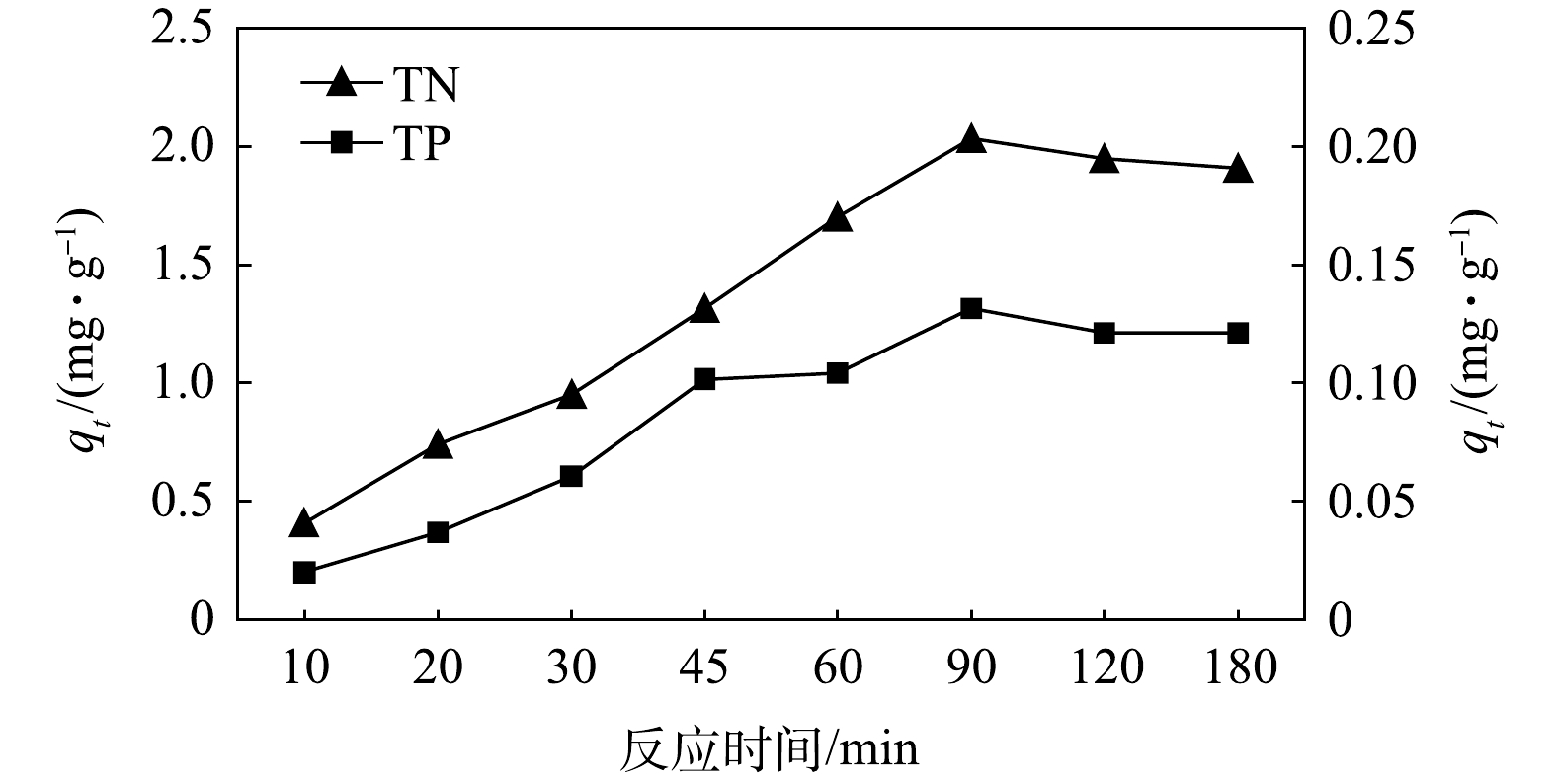
表 2 碱矿渣-nZVI去除TN、TP的Langmuir、Freundlich的方程参数及相关系数Table 2. Parameters of Langmuir and Freundlich equations for TN and TP removal by alkali slag-nZVI指标 Langmuir模型 Freundlich模型 KL Qm R2 KF 1/n R2 TN 0.050 12.469 0.902 0.714 0.094 0.853 TP 0.082 4.808 0.850 0.313 0.108 0.795 2)动力学特征。为获取负载材料在吸附过程中的动力学参数,本文研究了反应时间对初始浓度分别为30 mg·L−1和2 mg·L−1的总氮和总磷吸附量的影响,结果如图6所示,总氮和总磷在吸附反应进行90 min后吸附量达到最大值,分别为2.034 mg·L−1和0.131 mg·L−1。在吸附动力学实验中,碱矿渣-nZVI对总氮和总磷的吸附在90 min后基本达到平衡,参考姜侠等[27]的研究结果,为保证吸附反应充分进行,后续的吸附热力学实验中的反应时间确定为120 min。
根据2种不同吸附动力学模型计算并确定去除氮磷元素的斜率、截距、R2等动力学参数。如表3所示,可以看出准一级动力学方程能更好地描述m矿渣粉:mFe2+为4:1比例条件下总氮和总磷的吸附动力学过程。由图7可见,在吸附的初始阶段,总氮和总磷的吸附速率较快,这可能是因为氮磷元素附着在碱矿渣-nZVI材料表面和外部;随着吸附过程的进行,吸附效率降低,其可能的原因是氮磷元素沿负载材料的内部通道扩散吸附,阻力逐渐增大;到吸附后期,材料内的表面吸附成为主要吸附过程,吸附过程趋于平衡[28]。
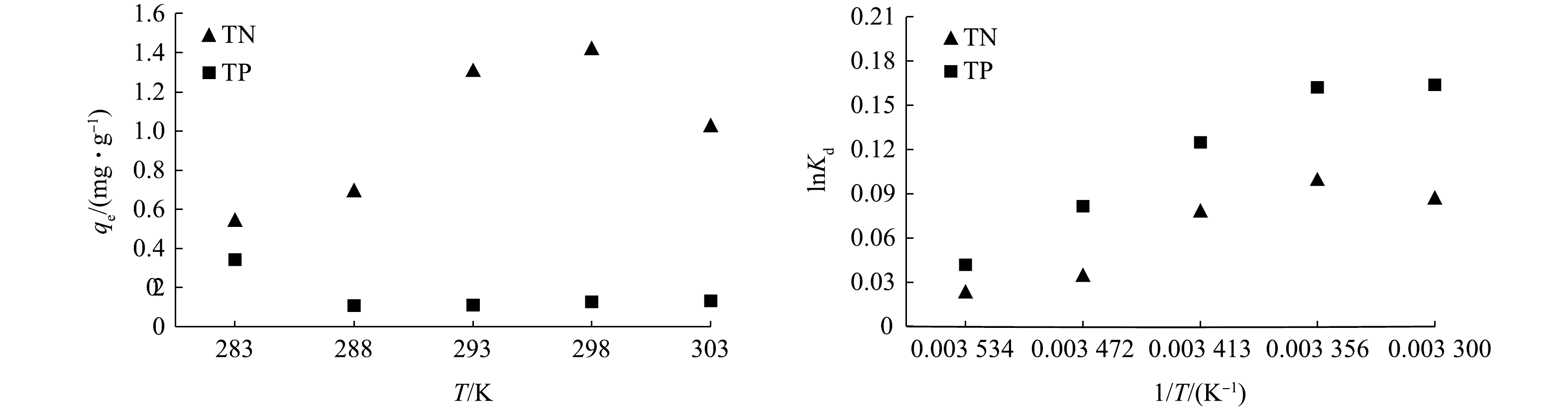
表 3 拟一级和拟二级动力学参数Table 3. Adsorption kinetic parameters of pseudo-first-order and pseudo-second-order equations指标 qe.exp 准一级动力学方程 准二级动力学方程 qe K1 R2 qe K2 R2 TN 2.034 3.363 0.497 0.811 7.194 0.006 0.763 TP 0.131 0.165 0.271 0.880 0.511 0.261 0.651 3)热力学特征。温度对负载材料吸附氮磷元素的影响如图8所示。在10、15、20、25、30 ℃的条件下,总氮的吸附量随温度的升高而增加,而总磷的吸附量在温度升高时有下降的趋势。为了获得吸附过程中的热力学参数,本文对实验数据进行热力学拟合计算,结果如表4所示。当ΔG<0时,说明该过程是自发过程,升高温度将有利于吸附过程的进行;当时ΔH>0时,说明反应时吸热的,吸附量会随温度的升高而增加;当ΔS>0时,说明吸附过程在较强亲和力条件下自发完成的,也表明吸附质和吸附剂在吸附过程中发生了变化[29]。
表 4 TN和TP热力学参数Table 4. Thermodynamics parameters of TN and TP指标 ΔH /(KJ∙mol−1) ΔS/(J∙(K mol)−1) ΔG/(KJ∙mol−1) R2 283 K 288 K 293 K 298 K 303 K TN 0.019 0.061 −17.158 −17.462 −17.765 −18.069 −18.372 0.821 TP 0.033 0.146 −41.381 −42.113 −42.845 −43.576 −44.308 0.943 3. 结论
1)利用高炉碱矿渣的孔隙结构,采用液相还原法负载纳米零价铁得到碱矿渣-nZVI材料,这种材料表面附着大小均匀的颗粒,其具有比表面积大、孔隙率高的特点。
2)碱矿渣-nZVI材料具有高效吸附氮磷元素的特性,在25 ℃、1.5 h的反应条件下,总氮和总磷的去除效率可稳定到65%以上;氮磷的去除效率随着温度和碱矿渣与Fe2+质量比的变化发生显著变化(P<0.05);但考虑到工程应用问题,最终确定碱矿渣与Fe2+最佳质量比为4∶1,有效用量为1 g。
3)碱矿渣-nZVI材料吸附氮磷元素的过程属于熵增、吸热的自发过程,吸附平衡数据适合用Langmuir吸附等温线来描述,吸附动力学遵循准一级动力学模型。
-
[1] Majumdar D., Gupta N. Nitrate pollution of groundwater and associated human health disorders. Indian Journal of Environmental Health, 2002, 42(1): 28-32 [2] World Health Organization, Rolling Revision of the WHO Guidelines for Drinking-Waters Quality, Nitrates and Nitrites in Drinking-Waters, World Health Organization, 2004 [3] USEPA, Drinking Water Standards and Health Advisories, Winter, 2004 [4] 中国,生活饮用水卫生标准,GB5749-2006 [5] Bouzek K., Paidar M., Sadilkova A., et al. Electrocatalytic activity of platinum-modified polypyrrole films for the methanol oxidation reaction. Journal of Applied Electrochemistry, 2001, 31(1): 501-503 [6] Taguchi S., Feliu J.M. Kinetic study of nitrate reduction on Pt (110) electrode in perchloric acid solution. Electrochimica Acta, 2008, 53(2): 3626-3628 [7] Souza-Garcia J., Ticianelli E.A., Climent V., et al. Nitrate reduction on Pt single crystals with Pd multilayer. Electrochimica Acta, 2009, 54(7):2094-2097 [8] Liu Y., Li L., Goel R. Kinetic study of electrolytic ammonia removal using Ti/IrO2 as anode under different experimental conditions. Journal of Hazardous Materials, 2009, 167(1-3): 959-965 [9] Li M., Feng C.P., Hu W., et al. Electrochemical degradation of phenol using electrodes of Ti/RuO2-Pt and Ti/IrO2-Pt. Journal of Hazardous Materials, 2009,162(1):455-462 [10] Nijjer S., Thonstad J. Cyclic and linear voltammetry on Ti/IrO2-Ta2O5-MnOx electrodes in sulfuric acid containing Mn+2 ions. Electrochimica Acta, 2001, 46(23):3503-3508 [11] Macova Z., Bouzek K. Electrocatalytic activity of copper alloys for NO3- reduction in a weakly alkaline solution-Part 1: Copper-zinc. Journal of Applied Electrochemistry, 2005, 35(12): 1203-1205 [12] Li M., Feng C.P., Zhang Z.Y. Electrochemical reduction of nitrate using various anodes and a Cu/Zn cathode. Electrochemical Communications, 2009, 11(10):1853-1856 [13] 王世磊.Design-Expert软件在响应面优化法中的应用.郑州:郑州大学硕士学位论文,2009 Wang S.L. The application of Design-Expert software in response surface optimization methodology. Zhengzhou:Master Dissertation of University of Zhengzhou, 2009(in Chinese) [14] Hamed E., Sakr A. Application of multiple response optimization technique to extended release formulations design. Journal of Controlled Release, 2001, 73(2-3): 329-338 [15] APHA, AWWA, WPCF, 1998. Standard Methods for the Examination of Water and Wastewater. American Public Health Association, Washington, DC, USA. [16] De D., Englehardt J.D., Kalu E.E., Electroreduction of nitrate and nitrite ion on a platinum-group-metal catalys-modified carbon fiber electrodechronoam-perometry and mechanism studies. Journal of Electrochemical Society, 2000,147 (4):4573-4579 [17] Li M., Feng C.P., Zhang Z.Y. Efficient electrochemical reduction of nitrate to nitrogen using Ti/IrO2-Pt anode and different cathodes. Electrochimica Acta, 2009, 54 (20):4600-4606 [18] Kim K.W., Kim Y.J., Kim I.T., et al. The electrolytic decomposition mechanism of ammonia to nitrogen at an IrO2 anode. Electrochimica Acta, 2005, 50(22): 4356-4364 [19] Czarnetzki L.R., Janssen L.J. Formation of hypochlorite, chlorate and oxygen during NaCl electrolysis from alkaline solutions at a RuO2/TiO2 anode. Journal of Applied Electrochemistry, 1992, 22(44):315-324 [20] Devkota L.M., Williams D.S., Matta J.H., et al. Variation of oxidation reduction potential along the breakpoint curves in low ammonia effluents. Water Environmental Resource, 2000, 72(5):610-617 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 2348
- HTML全文浏览数: 1407
- PDF下载数: 666
- 施引文献: 0




 下载:
下载: