氯化钙控制污泥膨胀
Control of activated sudge bulking by adding calcium chloride
-
摘要: 污泥膨胀是活性污泥工艺运行中经常遇到的最棘手的问题之一。本实验以人工合成污水为底物,采用序机式活性污泥法(SBR);研究投加无机混凝剂氯化钙控制污泥膨胀的情况,同时研究丝状菌和菌胶团的变化。研究发现,投加氯化钙后,丝状菌数量明显减少;形成较多大而密实规则的菌胶团,污泥膨胀得到控制。污泥容积指数(SVI)由最初的309.5 mL/g降到67.1 mL/g,污泥沉降性能改善。停止投加氯化钙后又运行了18周期,活性污泥没有发生再次膨胀。投加氯化钙对COD去除率没有明显影响。研究结果表明,投加氯化钙是一种有效的污泥膨胀应急控制措施。
-
关键词:
- 活性污泥膨胀 /
- 丝状菌 /
- 氯化钙 /
- 污泥容积指数(SVI)
Abstract: The sludge bulking is one of the thorniest problems in the activated sludge process. The experiment used synthesis wastewater as the substrate, and operation process used sequencing batch reactor (SBR). The effect of adding inorganic coagulant calcium chloride to control activated sludge bulking and the change of filamentous bacteria and the floc-forming bacteria was studied in a laboratory activated sludge system. The results showed that, after adding the calcium chloride, the number of filamentous bacteria obviously decreased; and the shape of zoogloea became larger and more roughly spherical, the sludge bulking was under control. The sludge volume index (SVI) decreased from 309.5 mL/g to 67.1 mL/g, the sludge settling property was improved. The system continued to run 18 cycles without adding the calcium chloride, the activated sludge did not bulking again. Adding calcium chloride had no significant effect on COD removal rate. The results indicated that adding calcium chloride was one kind of effective emergency methods to control sludge bulking. -
2019年我国废水总氮和氨氮排放量分别为117.6×104 t和46.3×104 t,其中工业源废水的总氮和氨氮排放量分别为13.4×104 t和3.5×104 t [1]。虽然占比不大,但氨氮废水成分复杂、生态毒性大,深度处理和资源化利用难度极高[2],排放至水体中可造成富营养化等多重生态危害。基于微藻培养的废水处理技术是依靠微藻代谢过程将废水中的碳氮磷硫等污染物作为生长必需的营养物,从而转化为微藻生物质和高附加值产物,有望在实现废水处理的同时产生经济效益,具有高效、低耗和绿色、可持续的优势,成为氨氮废水深度处理和资源循环利用技术领域的研究热点[3-7]。
嗜硫原始红藻(Galdieria sulphuraria)作为一种极端环境来源的单细胞微藻,具有极度耐酸、耐高温、耐高氨氮、耐高盐和耐重金属离子等突出生理特性,还可合成高价值的耐热型藻蓝蛋白(Phycocyanin,PC)[8-9]。有研究表明,嗜硫原始红藻可有效去除市政污水、厨余酶解液和工业废水中的氨氮,并可联产高蛋白(主要是藻蓝蛋白),表明该藻在废水处理和资源化利用领域极具应用潜力[10-14]。采用非灭菌的市政废水连续流加培养Galdieria sulphuraria CCMEE 5587. 1,可在去除氨氮的同时抑制粪肠球菌和大肠杆菌等致病菌的繁殖,表明该藻在非灭菌条件下处理废水可大大降低运行成本[12],提升水体安全性。最近,本团队在非灭菌光发酵系统中,利用混养Galdieria sulphuraria UTEX 2919处理高氨氮工业废水(
${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ 为强化铵根去除并联产高蛋白生物质的技术体系、降低碳源成本,本研究针对5 L光发酵罐中的非灭菌光发酵过程,分别采用间歇补糖和连续流加补糖模式,系统比较了其对细胞生长、铵根去除速率、蛋白质合成和藻胆蛋白积累的影响,以期为今后高氨氮废水的高效处理和资源化利用提供参考。
1. 材料与方法
1.1 藻种和种子液培养
嗜硫原始红藻(Galdieria sulphuraria UTEX 2919)购自美国UTEX藻种库(https://utex.org/)。高氨氮工业废水由中国石化催化剂有限公司长岭分公司提供,具体成分见表1。原废水在使用前先经过0.8 μm孔径水相滤膜过滤,再用去离子水稀释至
${\rm{NH}}_4^ + $ 表 1 高氨氮工业废水组成成分[11]Table 1. Composition of high-ammonium industrial wastewater组成成分 质量浓度/(mg·L−1) 组成成分 质量浓度/(mg·L−1) ${\rm{NH}}_4^ + $ 9 686.00 Zn2+ 89.98 Na+ 7 623.00 Mn2+ 2.48 Mg2+ 63.49 Co2+ 0.18 K+ 363.00 ${\rm{PO}}_4^{3 - } $ 0.00 Ca2+ 27.66 ${\rm{SO}}_4^{2 - } $ 725.10 Cu2+ 0.21 TOC 32.30 将嗜硫原始红藻无菌藻种接种至含已灭菌废水2MA混养培养基的锥形瓶中,置于温度为35 ℃、转速为150 r·min−1和光照强度为200 μmol·(m2·s)−1的恒温光照摇床中,培养5~7 d后细胞生长至对数后期,作为本实验的种子液。
1.2 补料分批培养
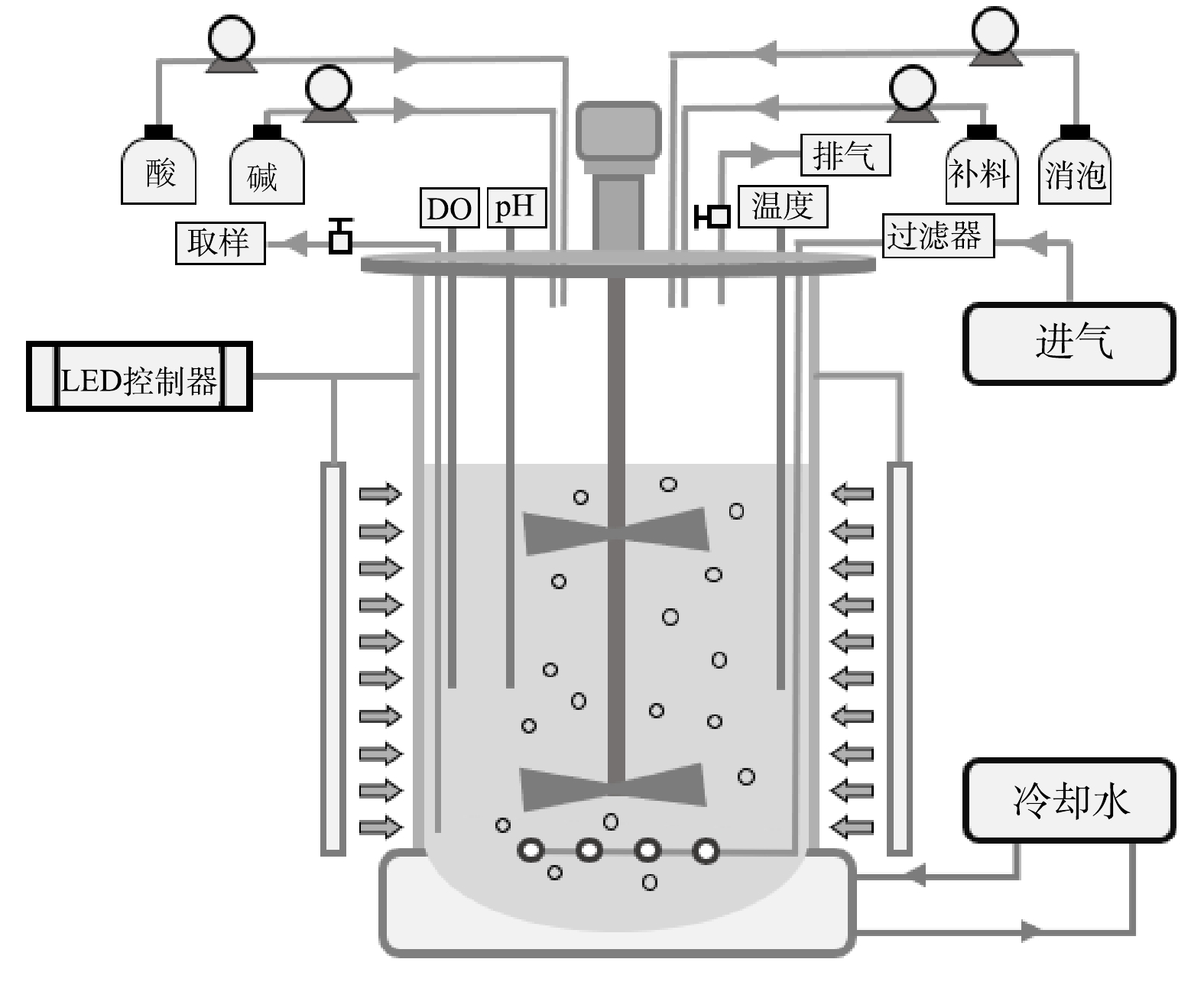
以白光LED灯板四面环绕在5 L玻璃发酵罐外,构建外置光源的光发酵罐(图1),2批次补料分批培养的操作参考郑雅莉[11]的研究方法。配制初始
${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ 1.3 2种补糖模式的比较研究
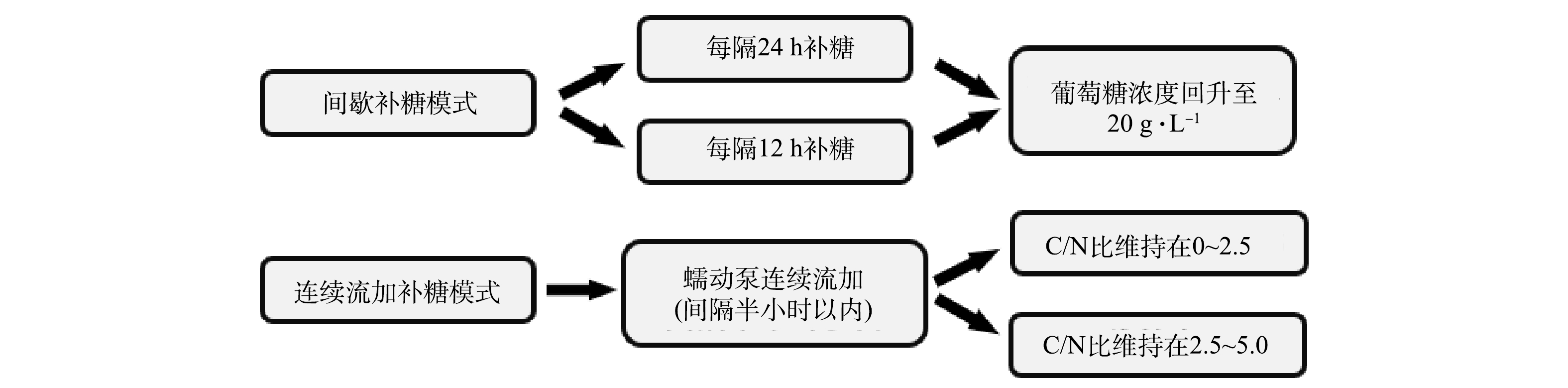
1)间歇补糖模式。在上述分批补料培养过程中,当初始葡萄糖质量浓度首次下降至≤10 g·L−1时,开始补加无菌葡萄糖母液到初始质量浓度20 g·L−1并继续培养。在2台5 L光发酵罐上分别设置补糖操作间隔时间为12 h和24 h的2个实验组(图2)。其中,在12 h实验组中进行了2个批次补料分批培养以验证重现性;在24 h实验组中进行了1个批次培养并至144 h时结束。在此过程中每24 h取样测定细胞密度、生物量质量浓度和水质指标(葡萄糖、铵根、磷酸根质量浓度等),并计算生物量产率、铵根去除速率等。藻液经离心、洗涤、冻干后测定其中蛋白和藻胆蛋白含量及产率等。
2)连续流加补糖模式。在2台5 L光发酵罐上设置2个C/N组,即采用蠕动泵连续流加高浓度葡萄糖母液,使一个发酵罐C/N维持在0~2.5(低C/N组),另一个发酵罐C/N维持在2.5~5.0(高C/N组),2个C/N组中分别进行2个批次光发酵实验(图2)。光发酵过程中每24 h取样分析水质指标(葡萄糖、铵根、磷酸根质量浓度等)并计算该时间点C/N;测定细胞密度和生物量质量浓度,并计算生物量产率、铵根去除速率等。藻液经离心、洗涤、冻干后测定其中蛋白和藻胆蛋白含量及产率等。
1.4 分析与检测[11]
光发酵液中细胞密度采用美国Beckman Coulter 的CytoFLEX流式细胞仪测定;生物量质量浓度采用干重法测定,即藻液在8 000 r·min−1下离心3 min获得藻泥,用超纯水将藻泥重悬、洗涤、再离心重复2次,置于60 ℃热风干燥箱中烘干至恒重;葡萄糖质量浓度采用深圳市西尔曼科技有限公司的M-100生物传感器测定;
${\rm{NH}}_4^ + $ ${\rm{PO}}_4^{3 - } $ 1.5 数据处理与统计分析
实验数据采用平均值±标准偏差表示,采用IBM SPSS Statistics 22和Origin 2017进行统计分析。采用单因素方差分析(P<0.05)对数据进行显著性检验,评价实验数据的统计学意义。
2. 结果与讨论
2.1 间歇补糖模式下细胞生长与废水中铵根的去除
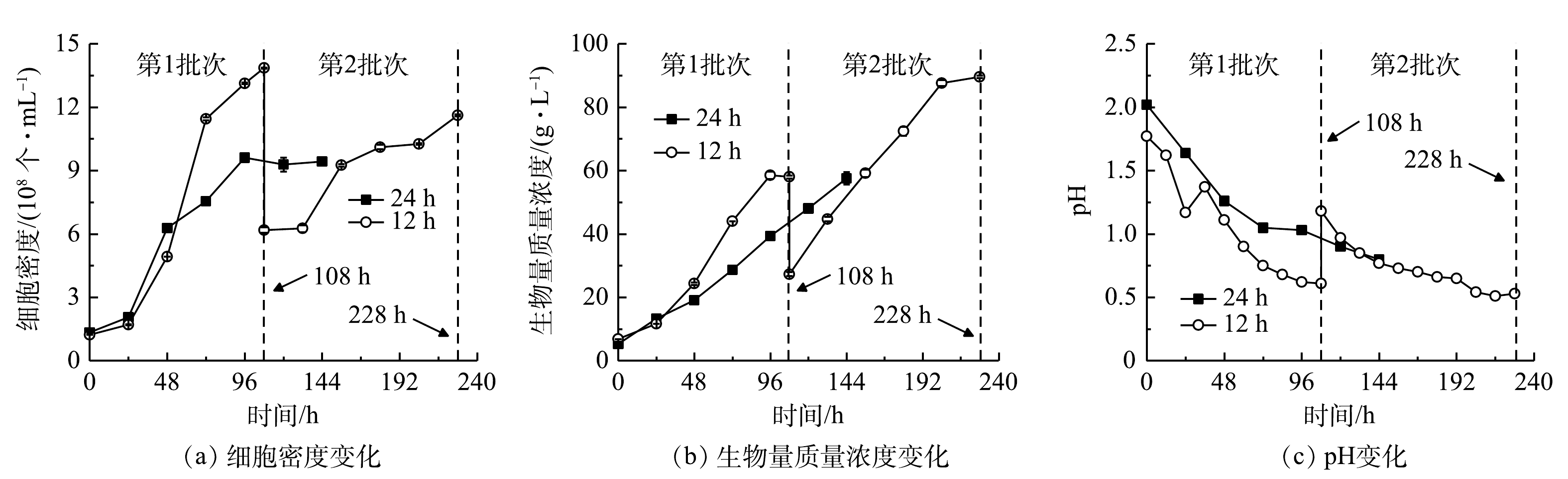
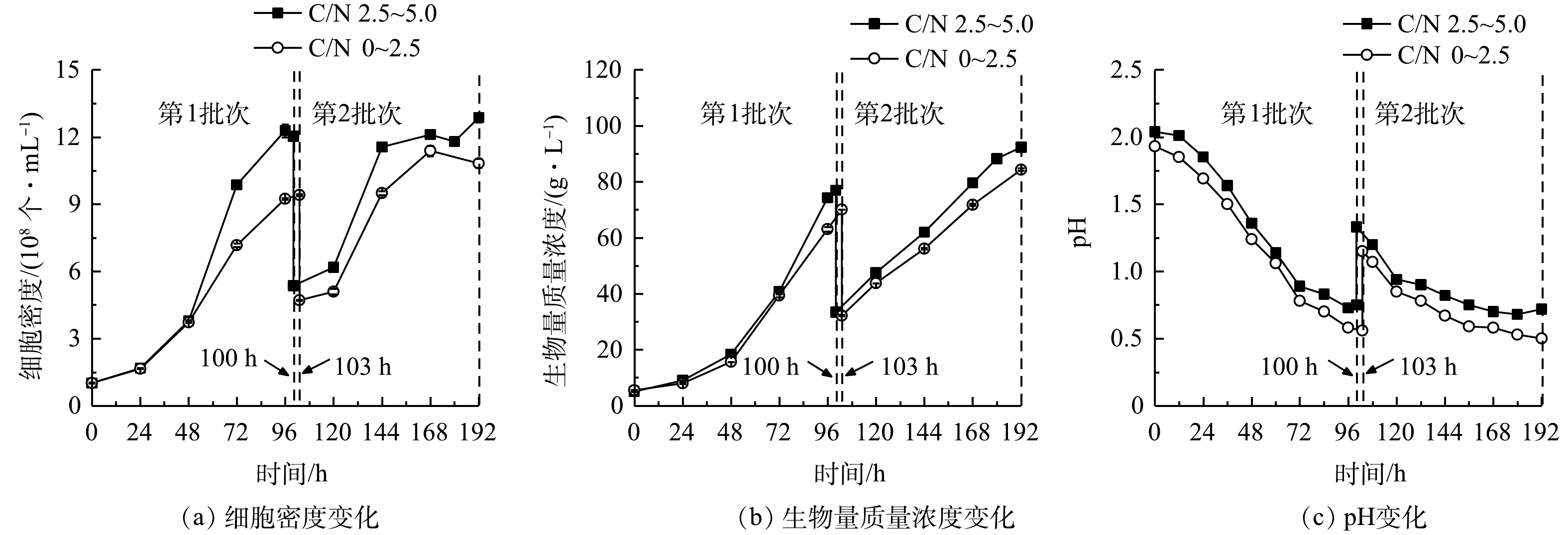
1)细胞生长。细胞密度与生物量质量浓度结果见图3(a)、图3(b),计算得到比生长速率和生物量产率。在24 h组进行了1个批次补料,细胞密度在96 h达到峰值(9.61×108 个·mL−1),最终比生长速率、生物量质量浓度和产率分别为0.33 d−1、57.60 g·L−1和8.73 g·(L·d)−1。在12 h组进行了2个批次分批培养,在108 h时结束第1批次培养,此时培养基中
${\rm{NH}}_4^ + $ 本研究进行了补加葡萄糖的非灭菌发酵。虽然高氨氮工业废水培养基中含有土著细菌,但该藻仍能快速增殖获得高细胞密度、高生物量质量浓度和产率。这种超强的抗微生物污染、易于形成种群优势的能力,可能与该藻的极度耐酸能力有关。光发酵体系pH快速下降情况见图3(c)。有研究表明,G. sulphuraria CCMEE 5587. 1在非灭菌反应器中处理市政废水时,在去除氨氮、BOD5和磷酸根的同时可有效去除原废水中粪肠球菌和大肠杆菌等致病菌[12],说明培养体系中极低的pH可显著抑制或杀死废水中大部分致病菌[16]。本团队的前期研究中在非无菌体系下培养嗜硫原始红藻UTEX 2919处理高氨氮工业废水,结果表明,原废水中主要细菌的相对丰度显著下降,表明体系中的细菌水平不会对该体系的高效运行产生负面影响[15]。
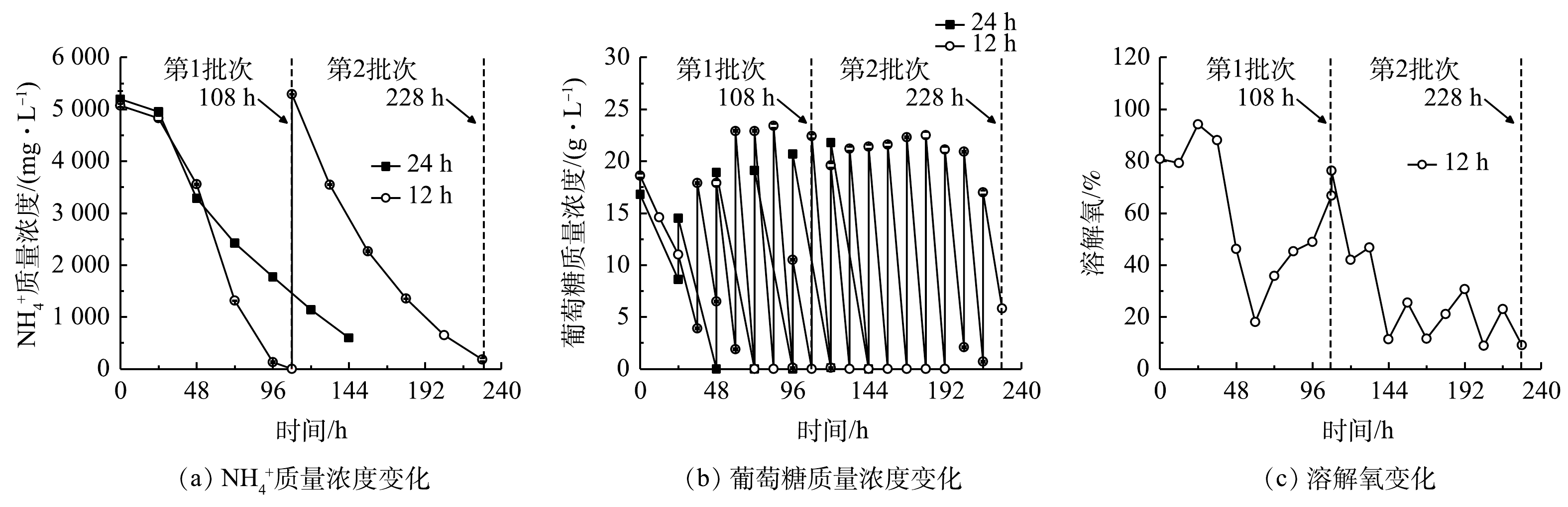
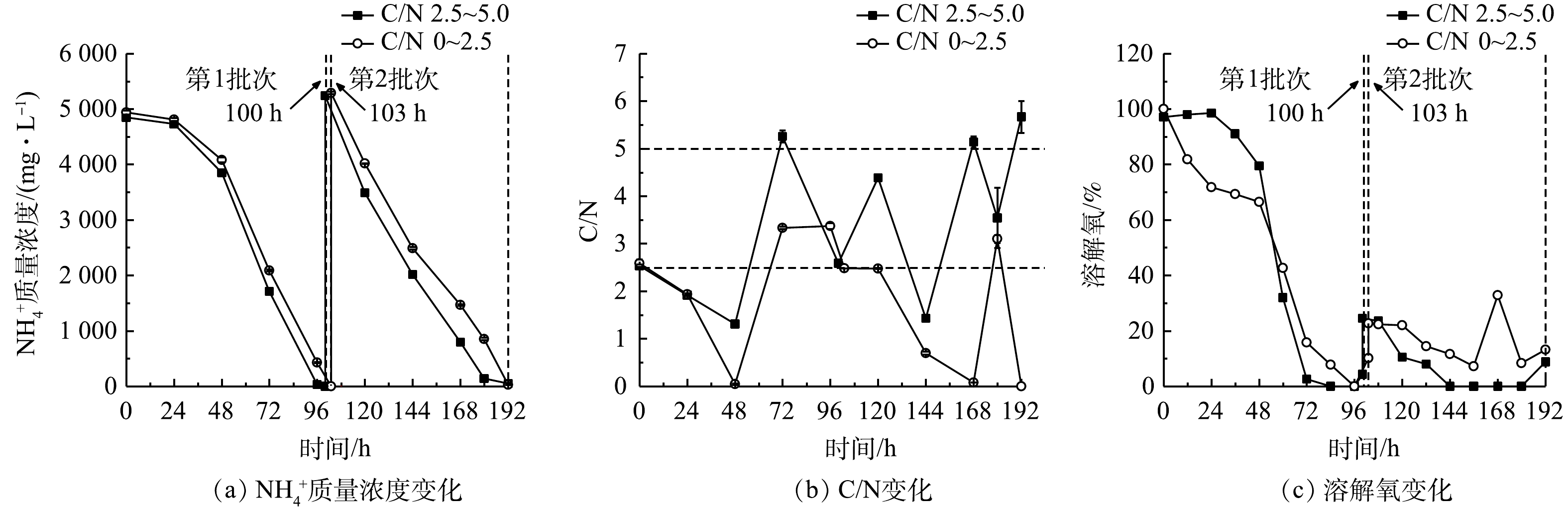
2)葡萄糖消耗和氨氮去除。细胞大量增殖和生物量积累伴随着废水培养基中葡萄糖和
${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ 表 2 间歇补糖模式下葡萄糖和${\rm{NH}}_4^ + $ Table 2. Parameters of glucose and${\rm{NH}}_4^ + $ 补糖间隔时间/h 葡萄糖消耗速率/( g·(L·d)−1) ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ 同化系数YN/G/(mg·g−1) 12(第1批次) 27.04±0.11b 5 070. 00±30.00a 100.00±0.00a 1 234. 38±3.13a 45.64±0.07a 12(第2批次) 40.26±0.38a 5 290. 00±5.00a 96.60±0.57b 1 022. 00±5.00b 25.39±0.12b 24 17.18±0.05c 5 195. 00±155.00a 88.49±0.39c 766.25±25.42c 44.59±1.35a 注:a-c同一列不同字母代表均值之间的显著性差异(P<0.05);YN/G表示每消耗单位葡萄糖对应同化 ${\rm{NH}}_4^ + $ 有研究[17]表明,微藻自养时的光合作用效率比混养时更高,产氧速率高于耗氧速率,使得藻液的溶解氧(dissolved oxygen,DO)水平不断上升;而当微藻混养生长时,细胞呼吸作用增强,外部有机碳源(如葡萄糖)的存在可在一定程度上限制光合作用活性,导致微藻耗氧速率高于产氧速率,最终使得藻液的溶解氧水平有所降低。此外,葡萄糖限制或缺乏会抑制微藻的生长[11,18]。本研究结果表明,12 h组的溶解氧水平快速下降至低于10%(图4(c)),这与更高的葡萄糖消耗速率和生物量质量浓度密切相关。这说明低溶解氧水平并未影响细胞高密度发酵和废水培养基中
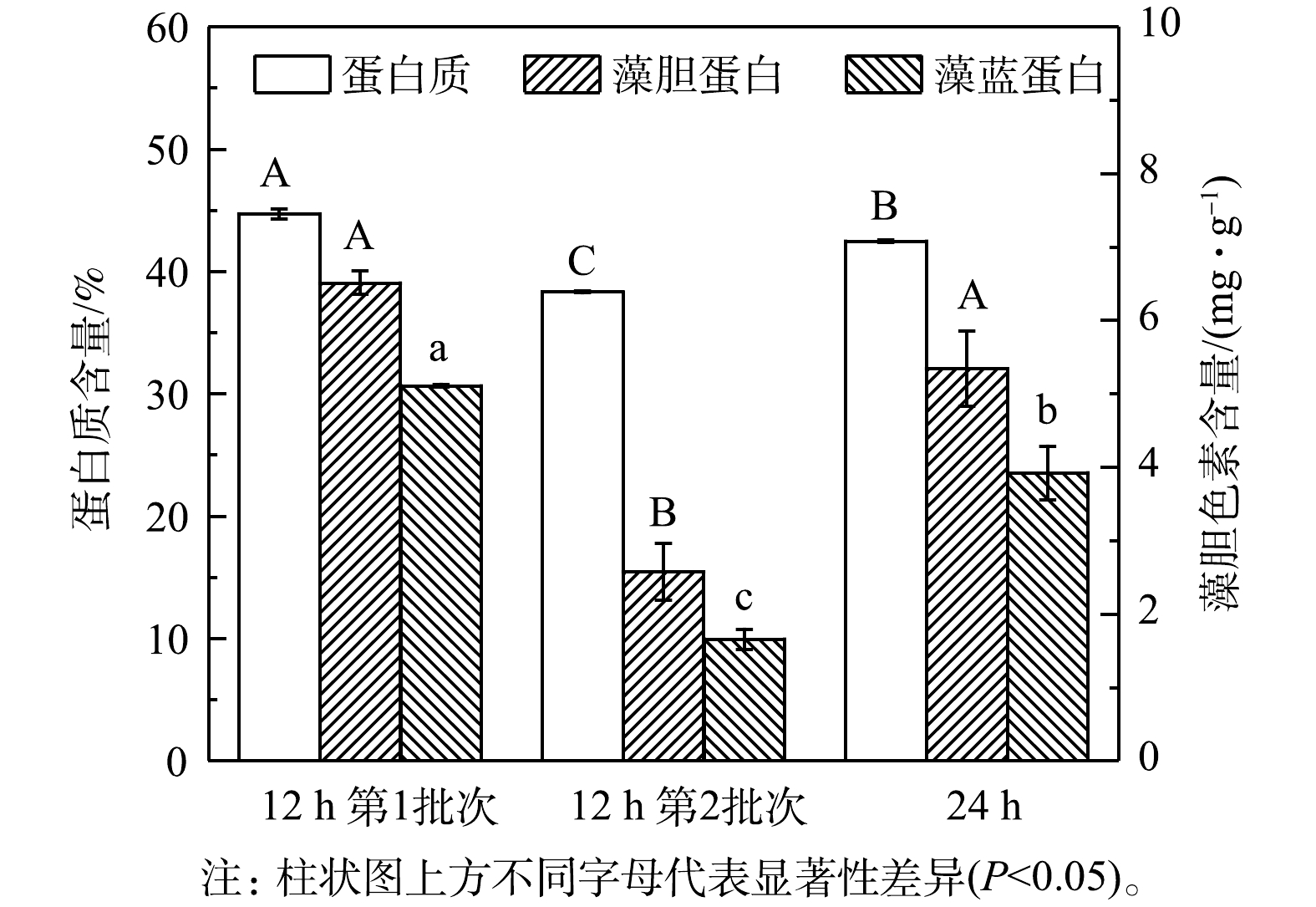
${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ 3)粗蛋白和藻胆蛋白生产。对光发酵体系中粗蛋白和藻胆蛋白生产进行了分析,结果见图5和表3。在12 h组第1批次培养中可获得最高粗蛋白、藻胆蛋白(PBP)和藻蓝蛋白(PC)含量,分别为44.71%、6.51 mg·g−1和5.11 mg·g−1,比第2批次分别高16.68%、152.71%和208.18%,也比24 h组分别高5.25%、21.90%和30.17%。同时,12 h组中第1批次培养可获得最高葡萄糖对
${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ 表 3 间歇补糖模式下粗蛋白和藻胆蛋白生产Table 3. Raw protein and phycobiliprotein production under intermittent feeding mode of glucose补糖间隔时间/h 粗蛋白 藻胆蛋白(PBP) 藻蓝蛋白(PC) 产量/(g·L−1) 产率/( g·(L·d)−1) 产量/(mg·L−1) 产率/( mg·(L·d)−1) 产量/(mg·L−1) 产率/( mg·(L·d)−1) 12(第1批次) 22.39±0.02a 4.98±0.00a 120.17±7.13a 26.70±1.58a 87.29±6.76a 19.40±1.50a 12(第2批次) 21.83±0.03a 4.37±0.03b 67.40±33.03a 13.48±6.61a 25.54±10.22b 4.91±2.04b 24 21.79±0.53a 3.63±0.09c 139.13±1.07a 23.19±0.18a 89.10±2.20a 14.85±0.37a 注:a-c同一列不同字母代表均值之间的差异显著(P<0.05)。 2.2 连续流加补糖模式下细胞生长和废水中铵根的去除
1)细胞生长。连续流加补糖模式下细胞生长、生物量生产和pH变化结果如图6所示,计算后可比较比生长速率和生物量产率(表4)。前述结果表明,高C/N组中第1批次最终细胞密度和生物量质量浓度可达1.20×109 个·mL−1和76.95 g·L−1,比同批次低C/N组分别提高了27.77%和9.77%;在第2批次培养中,高C/N组可达到最大细胞密度(1.29×109 个·mL−1)和生物量质量浓度(92.30 g·L−1),比同批次低C/N组提高了18.85%和9.39%。与低C/N组相比,高C/N组可获得最高的比生长速率(0.59 d−1)和生物量产率(17.24 g·(L·d)−1)(表4)。本研究结果与SLOTH等报道的结果[22]相符,该研究分别利用葡萄糖和硫酸铵为碳氮源,探讨了嗜硫原始红藻在不同C/N下连续流加培养中的细胞生长和PC积累情况,结果表明,在一定范围内随着C/N提高,细胞生长加快、PC合成增加。我们前期研究证实,提高培养基初始C/N能获得混养嗜硫原始红藻更高生物量质量浓度和PBP含量。这说明在一定程度上提高C/N,能促进该藻的细胞生长和生物量积累[11]。
表 4 连续流加补糖模式下细胞生长和生物量生产Table 4. Cell growth and biomass production under continuous feeding mode of glucoseC/N 批次 比生长速率/d−1 生物量产率/( g·(L·d)−1) 2.5~5.0 第1批次 0.59±0.00a 17.24±0.11a 第2批次 0.23±0.00c 15.37±0.15b 0~2.5 第1批次 0.52±0.00b 15.05±0.01b 第2批次 0.22±0.00c 14.07±0.06c 注:a-c同一列不同字母代表均值之间的差异显著(P<0.05)。 2)葡萄糖消耗和氨氮去除。本研究表明,细胞的大量增殖伴随着废水培养基葡萄糖和
${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ 表 5 连续流加补糖模式下葡萄糖和${\rm{NH}}_4^ + $ Table 5. Parameters of glucose and${\rm{NH}}_4^ + $ C/N 批次 葡萄糖消耗速率/( g·(L·d)-1) ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ 同化系数YN/G/(mg·g-1) 2.5~5.0 第1批次 32.54±0.00c 4 850. 00±25.00b 99.95±0.05a 1 204. 38±5.63c 37.02±0.17a 第2批次 42.84±0.03b 5 237. 50±7.50a 99.00±0.14c 1 529. 25±5.25a 35.70±0.10b 0~2.5 第1批次 32.20±0.00d 4 937. 50±37.50b 100.00±0.00a 1 150. 49±8.74d 35.73±0.27b 第2批次 47.16±0.00a 5 290. 00±20.00a 99.48±0.14b 1 419. 10±3.37b 30.09±0.07c 注:a-d同一列不同字母代表均值之间的差异显著(P<0.05);YN/G表示每消耗单位葡萄糖对应同化NH4+的量。 高C/N组第2批次中的
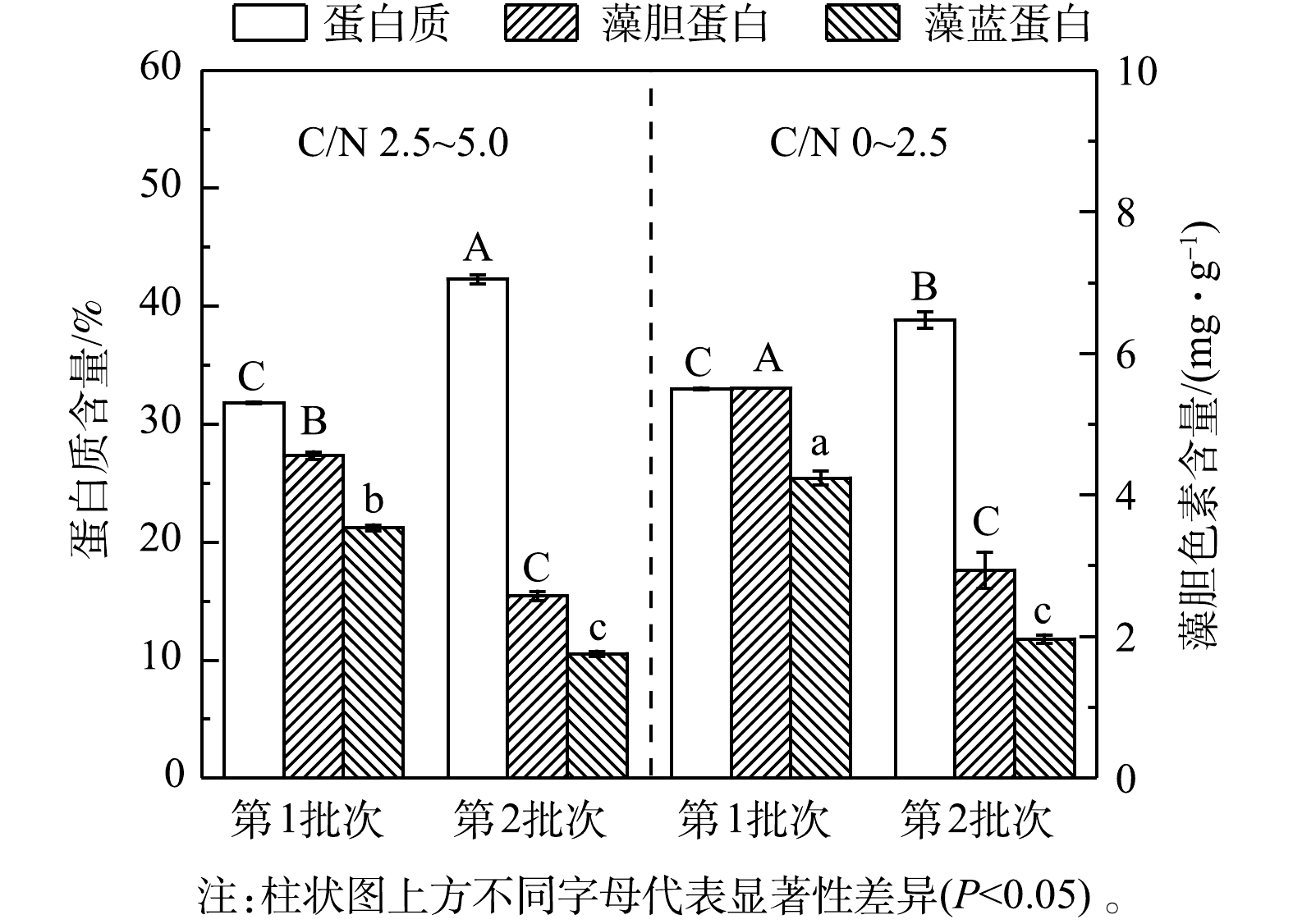
${\rm{NH}}_4^ + $ 3)粗蛋白和藻胆蛋白生产。实验结果表明(图8和表6),在高C/N组的第1批次培养中,最终粗蛋白质含量(31.81%)、PC含量(3.53 mg·g−1)和PC产量(109.21 mg·L−1)较同批次的低C/N组分别降低了3.56%、16.67%和8.11%;但最终蛋白质产量(21.64 g·L−1)却提高了7.07%;在第2批次培养中,最终粗蛋白含量(42.29%)和产量(26.55 g·L−1)达到最高,较同批次的低C/N组别分别提高了8.93%和27.32%; PC含量下降了10.44%,但PC产量却提高了43.68%。这进一步说明:高C/N组有利于提高粗蛋白含量和生物量质量浓度,但PC含量和产量下降可能与混养培养模式有关。一方面,高C/N组提高了细胞生长和蛋白质积累能力;另一方面,在第2批次培养中对糖的代谢加快,呼吸作用增强而光合作用受限制。PC为嗜硫原始红藻的捕光色素复合体组成之一,主要参与该藻的光合作用,当光合作用受抑制时,PC的合成受阻[25],因此,PC的含量与产量均呈下降趋势。
表 6 连续流加补糖模式下粗蛋白和藻胆蛋白生产Table 6. Raw protein and phycobiliprotein production under continuous feeding mode of glucoseC/N 批次 粗蛋白 藻胆蛋白(PBP) 藻蓝蛋白(PC) 产量/(g·L−1) 产率/( g·(L·d)−1) 产量/(mg·L−1) 产率/( mg·(L·d)−1) 产量/(mg·L−1) 产率/( mg·(L·d)−1) 2.5~5.0 第1批次 21.64±0.07b 5.19±0.02c 156.61±0.77b 37.59±0.18a 109.21±0.99b 26.21±0.24a 第2批次 26.55±0.06a 6.93±0.02a 80.19±4.89c 20.92±1.27b 38.94±1.28c 10.16±0.34b 0~2.5 第1批次 20.21±0.06c 4.71±0.01d 170.37±3.92a 39.70±0.91a 118.85±1.53a 27.69±0.36a 第2批次 20.85±0.31c 5.62±0.08b 66.79±0.96d 18.01±0.26b 27.11±1.95d 7.31±0.53c 注:a-d同一列不同字母代表均值之间的差异显著(P<0.05)。 4)间歇补糖和连续流加补糖模式的比较。经比较优化的连续流加补糖(高C/N组)和间歇补糖(补糖间隔时间为12 h)2种模式下废水中
${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ PC天然无毒,具有良好的荧光特性和抗氧化、抗癌、神经保护以及抗炎等多种生理活性,现已应用于医学检测、药品和功能性食品等领域[26]。来源于嗜硫原始红藻的PC相比于其它来源的PC具有更高热稳定性(在60 ℃下依然保持稳定)[27],因此,更具开发应用潜力。本研究利用嗜硫原始红藻在高效去除废水中铵根的同时高产富含蛋白质、PBP和PC的生物质,获得的生物质有望作为微藻有机肥和畜禽饲料原料,以提高农作物和畜禽的产量和质量,实现废水处理和资源化利用的双赢目标。
3. 结论
1)在间歇补糖模式下,缩短补糖间隔时间可促进细胞生长、生物量生产并提高
${\rm{NH}}_4^ + $ 2)采用高C/N(2.5~5.0)的连续流加补糖模式,能进一步强化细胞生长并提高对废水中
${\rm{NH}}_4^ + $ ${\rm{NH}}_4^ + $ 3)优化后的高C/N连续流加补糖模式,可降低培养过程中葡萄糖用量,从而降低发酵原料成本,进而可有效提高该技术在高氨氮废水的规模化处理和资源化利用中的应用潜力。
-
[1] 陈滢,彭永臻,刘敏,等. SBR法处理生活污水时非丝状菌污泥膨胀的发生与控制. 环境科学学报,2005,25(1):105-108 Chen Ying, Peng Yongzhen,Liu Min,et al. Non-filamentous activated sludge bulking in SBR treating the domestic wastewater. Acta Scientiae Circumstantiae,2005,25(1):105-108(in Chinese) [2] 戴红玲,胡锋平,李长凤. 活性污泥异常现象的成因与控制. 水处理技术,2009,35(4):107-109 Dai Hongling,Hu Fengping, Li Changfeng. Effect analysis of treating urban sewage by the modififd oxidation dirch. Technology of Water Treatment,2009,35(4):107-109(in Chinese) [3] 吕桂宾,史鸿乐,陈雯,等. 印染废水处理中的污泥膨胀与控制. 中国给水排水,2005,21(2):95-96 Lü Guibin,Shi Hongle,Chen Wen,et al. Sludge bulking and control in treatment of printing and dyeing wastewater. China Water & Wastewate,2005,21(2):95-96(in Chinese) [4] 李萌,孙宝盛,曹伟. 活性污泥膨胀的机理及控制措施的研究. 天津化工,2007,21(3):53-55 Li Meng,Sun Baosheng,Cao Wei. The mechangism and control of activated sludge bulking. Tianjin Chemical Industry, 2007,21(3):53-55(in Chinese) [5] 冯治宇,朱刚,朴芬.影响活性污泥沉降因素及设计沉淀池应注意问题的探讨.环境保护科学,1997,23(16):45-47 Feng Zhiyu,Zhu Gang,Piao Fen. Study on the influencing factors of the activated sludge precipitative capability and the design of the sedimentation tank. Environmental Protection Science,1997,23(16):45-47(in Chinese) [6] 陈安稳,时翔云,于鲁冀,等. 污泥膨胀的原因及其控制方法.中国农学通报,2006,22(12):296-299 Chen Anwen,Shi Xiangyun,Yu Luji,et al. Study on activated sludge bulking and control. Chinese Agricultural Science Bulletin,2006,22(12):296-299(in Chinese) [7] 徐慧,周利,王伟平. 丝状菌性污泥膨胀的影响因素及控制方法. 环保技术,2005,(6):18-21 Xu Hui,Zhou Li,Wang Weiping. The influencing factors and control of filamentous sludge bulking. Environment Protection Technology,2005,(6):18-21(in Chinese) [8] 张相忠,王淑莹,陈滢,等. 污泥膨胀的研究. 哈尔滨商业大学学报(自然科学版),2002,18(4):464-467 Zhang Xiangzhong,Wang Shuying,Chen Ying,et al. Study of bulking in activated sludge. Journal of Harbin University of Commerce (Natural Sciences),2002,18(4):464-467(in Chinese) [9] 李鹏,周利,赵永柱,等.药剂法在控制丝状菌污泥膨胀中的应用. 工业水处理,2008,28(7):4-5 Li Peng,Zhou Li,Zhao Yongzhu,et al. Application of medical method to the expanding control of filamentous bacterium sludge. Industrial Water Treatment,2008,28(7):4-5(in Chinese) [10] Caraveli A.,Giannuzzi L.,Earitzky N.Efect of chlorine on filamentous microorganisms present in activated sludge as evaluated by respirometry and INT-dehydrogenase activity. Water Research, 2004,38(1): 2395-2405 [11] Juang D. F. Effects of synthetic polymeron the filamentous bacteria in activated sludge. Bioresourse Technology,2005,96(1):31-40 [12] Matsehet N. F.Control of bulking sludge-practical experiences in Austria. Water Sci.Technol.,1982,(14): 311 [13] 李鹏,周利,夏晶晶. 滑石粉应用于污泥膨胀的控制研究. 苏州科技学院学报,2007,20(3):48-51 Li Peng,Zhou Li,Xia Jingjing. Application of talc to control filamentous sludge bulking. Journal of University of Science and Technology of Suzhou,2007,20(3):48-51(in Chinese) [14] 胡海涛,周利,刘灵菊,等.高岭土控制污泥膨胀的研究.环境保护科学,2010,36(1):11-13 Hu Haitao,Zhou Li,Liu Lingju,et al. Study on sludge bulking control by kaolin. Environmental Protection Science,2010,36(1):11-13(in Chinese) [15] 陈纯. 连续流完全混合活性污泥法污泥膨胀对策的研究. 中国给水排水,1994,10(2):35-38 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 2865
- HTML全文浏览数: 1754
- PDF下载数: 1813
- 施引文献: 0












 DownLoad:
DownLoad: