低品位硫铁矿烧渣制备导电掺合料
Preparation of electrical conductivity additive(ECA)with low-grade pyrite cinder
-
摘要: 采用川南低品位硫铁矿烧渣为主要原料,利用其中的高铁含量及大量活性烧粘土组分,通过在还原气氛下将硫铁矿烧渣与少量还原剂混合粉磨均匀后成型焙烧这一最优工艺,制备电阻率较低的具有胶结性质的导电掺合料,研究了温度、保温时间、配合比、粉磨细度等关键参数对电阻率的影响。结果表明:还原剂为混合料质量分数的9.1%(还原剂与烧渣比值=0.1),5~30 MPa成型后在800℃高温中焙烧60 min,可制备出电阻率为2.02 Ω·?m的导电掺合料。该方法不仅能解决川南硫铁矿烧渣的综合利用问题,而且工艺流程简单,产品附加值高。Abstract: Electrical conductivity additive (ECA) with lower resistivity suitable for cementitious materials was obtained using low-grade pyrite cinder containing high iron content and a number of active clay mineral components in south of Sichuan Province, China, through a optimal process, such as blending pyrite cinder with little reducing agent, mixing the powder sample to form uniform matrix, molding and roasting in the reducing atmosphere etc. The influences of the key parameters, such as temperature, time, mix, and grinding fineness, etc. on resistivity of ECA were discussed. The results show that conductive electricity additive with the lower resistivity of 2.02 Ω·m can be prepared in the laboratory scale when 9.1% of reducing agent, molding pressure of 5~30 MPa, roasting temperature at 800 ℃, and holding time of 60 minutes were adopted. The comprehensive utilization problem of pyrite cinder in south of Sichuan Province, China can be solved through the method, besides, the high value-added products can be obtained through this simple process.
-
氯代烃(volatile chlorinated hydrocarbons,VCHs)已广泛应用于工业生产[1],在化工生产的过程中,氯代烃的意外泄漏以及对氯化烃的不合理存储处置和排放都会导致严重的地下水污染[2]。三氯乙烯(TCE)是地下水中最常检测到的氯化烃之一,作为一种强效致癌物质,它能够持续存在于自然降解过程中[3]。TCE具有三致效应,即致畸、致癌、致突变。人体长期暴露于TCE等氯代有机污染物中,将会对自身的健康安全造成很大的影响[4]。
目前,从水中去除TCE的方法主要包括物理吸附、生物降解和化学还原氧化[5]等方法。近年来,纳米零价铁技术对氯代烃的降解应用引起了国内外研究者广泛的关注。其中,硫化纳米零价铁(Fe/FeS)具有较大的比表面积、较强的导电能力和便捷的磁分离特性,因此,受到了更广泛的关注[6]。已有研究表明[7-9],硫化纳米零价铁在对氯代烃的降解上取得了优于纳米零价铁的效果。但是,硫化纳米零价铁只是提高了纳米零价铁的电子选择性,使电子更多的传向污染物。然而,它并没有改善纳米零价铁的团聚问题[10]。硫化纳米零价铁在处理污染物的过程中依然会发生团聚,从而影响其去除污染物的效果[11-12]。
核壳材料通常能够改善其物理和化学性质(如抗氧化性、改进的稳定性、高分散性)[13]。自介孔氧化硅材料合成以来,由于其高比表面积、可调节的孔径和在催化、吸附和生物学方面的潜在应用,已受到越来越多的关注[14-15]。其中,具有蛋黄-蛋壳结构的材料是一种特殊的核壳材料,区别于普通的核壳材料,其核与壳之间有一个大小可调的空隙,这就使得核可与污染物充分接触反应[16]。因此,基于蛋黄-蛋壳结构材料的特殊性能,本研究以正硅酸乙酯(TEOS)为硅源合成介孔氧化硅中空壳,再通过化学反应在壳内形成大尺寸核的方法,合成介孔氧化硅包裹的硫化纳米零价铁材料(Fe/FeS@SiO2),解决硫化纳米零价铁的团聚问题,并提高其去除污染物的能力。利用SEM、XRD、TEM等分析手段进行了表征;然后利用硫化纳米零价铁的还原性质,将制备好的材料用于水体中TCE的去除并考察了其对TCE的去除效果。
1. 材料与方法
1.1 实验原料和仪器
六水合三氯化铁(FeCl3·6H2O,>99%)、氨水(NH4OH,25%~28%)、十六烷基三甲基溴化铵(CTAB,>99%)、正硅酸乙酯(TEOS,28%)、硼氢化钠(NaBH4,>96%)、连二亚硫酸钠(Na2S2O4)、无水碳酸钠(Na2CO3,99.8%)和三氯乙烯(trichloroethylene,>99%)均为分析纯。
扫描电子显微镜(JSM-6360LV,日本JEOL公司);透射电子显微镜(JEM-1400,日本JEOL公司);X射线粉末衍射仪(D/max 2550V,美国Rigaku公司);X射线电子能谱分析仪(Axis Ultra DLD,美国Kratos公司);傅里叶变换红外光谱仪(Nicolet 6700,美国尼高力公司);能量色散谱仪(EDAX TEAM Apollo,美国伊达克斯有限公司)。
1.2 Fe/FeS的制备
将0.483 g FeCl3·6H2O用25 mL去离子水和45 mL乙醇溶解在三口烧瓶中,并以600 r·min−1机械搅拌。将0.340 g NaBH4和0.005 g Na2S2O4分散在烧杯中的30 mL去离子水中,并通过Longer BQ50-1J-A蠕动泵(保定,中国)以1.5 mL·min−1加入三口烧瓶中。在这些条件下,30 min后,合成含有0.1 g Fe0的Fe/FeS。
1.3 中空介孔氧化硅球(HMSS)的制备
使用FANG等[17]的方法合成中空介孔二氧化硅球。在乙醇(74 mL)、去离子水(10 mL)和氨水溶液(25%~28%,3.15 mL)的混合物中加入6 mL TEOS;将溶液搅拌1 h,得到SiO2;将0.050 g SiO2和0.075 g CTAB加入到含有25 mL去离子水,15 mL乙醇和0.275 mL NH4OH的三口烧瓶中;将混合物在600 r·min−1下搅拌0.5 h;然后,将0.125 mL TEOS加入烧瓶中,并将混合物在300 r·min−1下再搅拌4 h后,通过离心收集产物;最后,将0.212 g Na2CO3加入到上述产物的悬浮液中,在50 ℃下剧烈搅拌10 h后,收集颗粒并分别用乙醇和去离子水洗涤3次。
1.4 Fe/FeS@SiO2的制备
将上述已合成好的中空介孔氧化硅和0.483 g FeCl3·6H2O用去离子水和乙醇混合后,溶解在三口烧瓶中,在氮气保护下,将悬浊液强烈搅拌15 min。然后将0.340 g NaBH4和0.005 g Na2S2O4分散在烧杯中的30 mL去离子水中,并通过Longer BQ50-1J-A蠕动泵(保定,中国)以1.5 mL·min−1加入三口烧瓶中。在这些条件下,30 min后,合成含有0.1 g Fe0的Fe/FeS@SiO2。
1.5 TCE的去除实验
本研究制备的Fe/FeS和Fe/FeS@SiO2用于降解TCE,降解实验在血清瓶(110 mL体系)中完成。将100 mL的TCE水溶液和含有0.1 g Fe0的材料加入到血清瓶中,血清瓶密封后,放于自制的滚筒上,以15 r·min−1的转速进行反应。每隔一段时间取1 mL水样,经0.22 μm滤膜过滤后测定浓度。
1.6 表征方法
采用SEM和TEM观察材料的形貌和结构;利用XRD(放射源CuKα)测定材料物质组成和晶体结构;使用XPS(放射源Al Kα)分析材料表面元素;采用FT-IR测定Fe/FeS@SiO2表面官能团;采用EDS分析材料的元素分布。制备好的Fe/FeS和Fe/FeS@SiO2材料用Mastersizer 2000 型激光粒径仪进行粒径分析,分散介质为去离子水。
1.7 分析方法
将水样加入到5 mL萃取瓶中,加入2 mL正己烷,振荡萃取3 min,取上层液1 mL于2 mL进样瓶中,用聚四氟乙烯瓶盖盖紧。采用美国安捷伦公司GC=7890A型气相色谱仪测定TCE含量:60 m×250 μm×1.4 μm DB-VRX柱,ECD检测器,自动进样器,分流比为20∶1,进样量为1 μL。在75 ℃恒温测样,进样口温度为240 ℃,检测器温度为260 ℃,载气为氮气(≥99.99%)。
2. 结果与讨论
2.1 材料表征结果
1)材料的FT-IR谱图。Fe/FeS@SiO2材料的FT-IR谱图如图1所示。从图1可以看出,3 462 cm−1的宽带峰可归因于吸附水分子的伸缩振动和水化硅烷醇组的O—H。1 620 cm−1波段的小峰可以归因于吸附水分子的H—O—H弯曲振动。以1 062和457 cm−1为中心的频带是Si—O—Si的伸缩振动,Si—O—Si是合成的介孔氧化硅的特征峰。在之前的实验中,已通过氮气吸附-脱附实验,测定Fe/FeS@SiO2材料的比表面积为85 m2·g−1、平均孔径为5 nm,也证实了合成的氧化硅壳具有介孔[18]。
2)材料的XRD和XPS谱图。Fe/FeS@SiO2材料的XRD谱图如图2(a)所示。可以看出,Fe/FeS@SiO2在44.6°处有一个较强的衍射峰,这对应Fe0的体心立方结构(JCPDS no.06-0696)。而22.8°的衍射峰则与中空的介孔氧化硅球有关。未检测到与卡片(JCPDS no.6-0696)中的Fe0相关的其他衍射峰,这可能是由于HMSS壳覆盖了铁核[19]。在与TCE反应后,Fe0的衍射峰消失,而在35°衍射峰处出现了磁铁矿的特征峰,这表明反应过程中Fe/FeS@SiO2材料中的Fe/FeS核被腐蚀生成了铁的氧化物。
Fe/FeS@SiO2材料的XPS表征结果如图2(b)所示。硅、氧、碳是该物质的主要组成成分,铁含量低。碳的峰与无定形碳有关,无定型碳是一层薄的碳质材料,通常在暴露于空气的大多数样品的表面上发现,而氧和硅的峰值则来自于HMSS。这是因为硫源的添加较少,S元素的含量很低,所以在Fe/FeS与Fe/FeS@SiO2材料的XPS全谱图中并未显示出S元素的峰。但从S2p的谱图分析中可以看出S2−的存在,推测为FeS。对比Fe/FeS的XPS谱图,Fe/FeS@SiO2材料的XPS谱图中铁的峰明显减弱,这说明Fe/FeS基本被包裹在HMSS中[20]。
3)材料的电镜和能谱结果分析。Fe/FeS和Fe/FeS@SiO2的SEM和TEM图像如图3所示。图3(a)是Fe/FeS的SEM图,可以看出,Fe/FeS颗粒呈球形,表面光滑。值得注意的是,铁基材料由于其固有的磁性和高表面能而容易聚集,这是他们在土壤和地下水处理应用中的一个主要缺陷。Fe/FeS在被HMSS壳覆盖后,保留了颗粒的球状形态,但由于外部的HMSS壳,Fe/FeS颗粒间磁性相互作用减弱,团聚现象明显减少,并且颗粒呈一个个单个的小球,如图3(b)所示。图3(c)显示了Fe/FeS@SiO2材料明显的蛋黄-蛋壳结构。Fe/FeS@SiO2材料中的黑色核心对应于Fe/FeS,而灰色的壳层则对应于HMSS[18]。TEM图像中可以清楚地看到核与壳之间的空隙,再结合能谱图(图3(d)~(g)),可以证明Fe/FeS@SiO2材料制备成功。
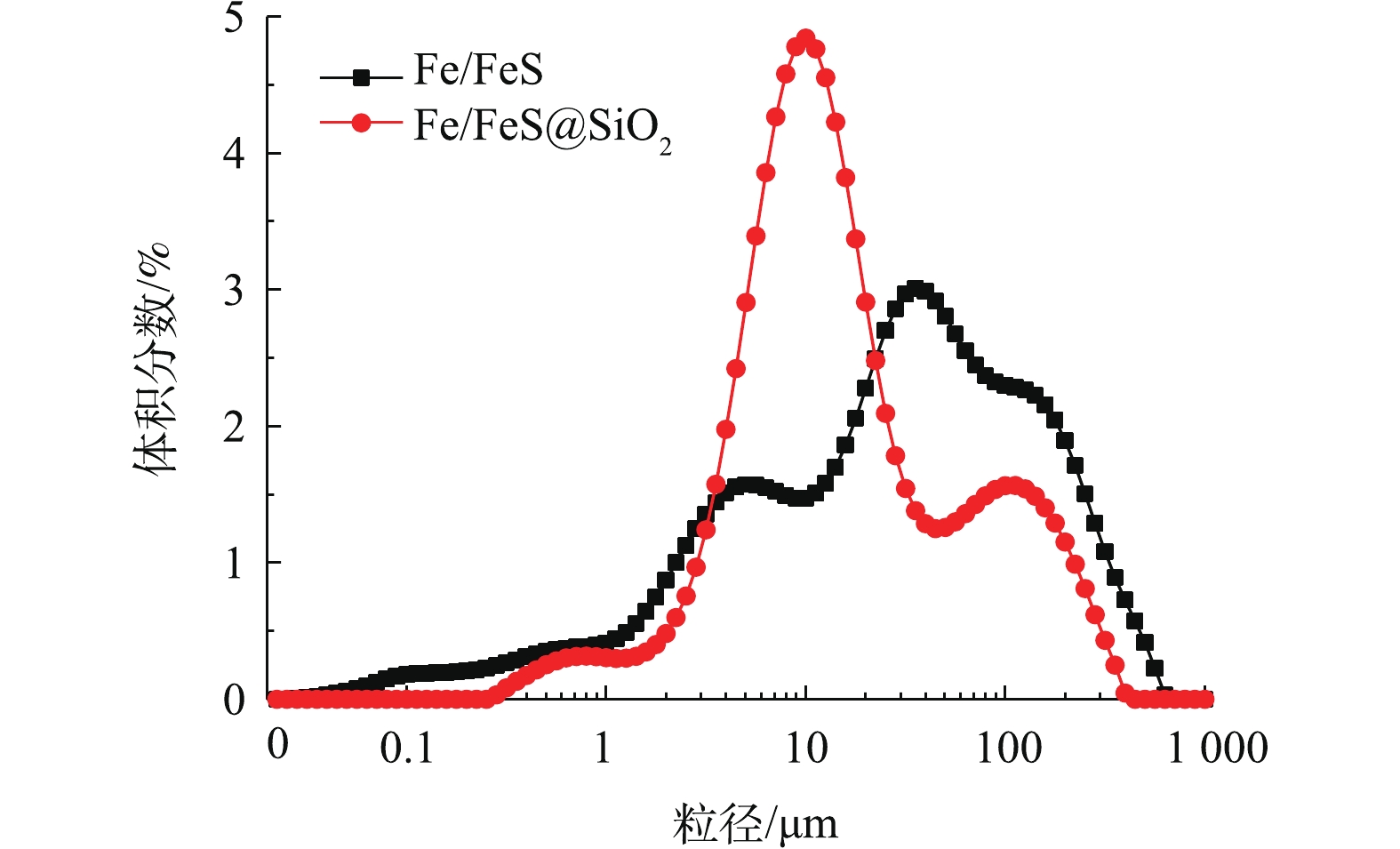
4)材料的粒径分布。由图4wo daonali可以看出,Fe/FeS@SiO2材料的平均粒径为11.89 μm,远小于未包裹介孔氧化硅壳的Fe/FeS(29.00 μm)。结合SEM图可知,包裹了介孔氧化硅壳以后,颗粒间的团聚明显减少。
2.2 材料降解TCE特性
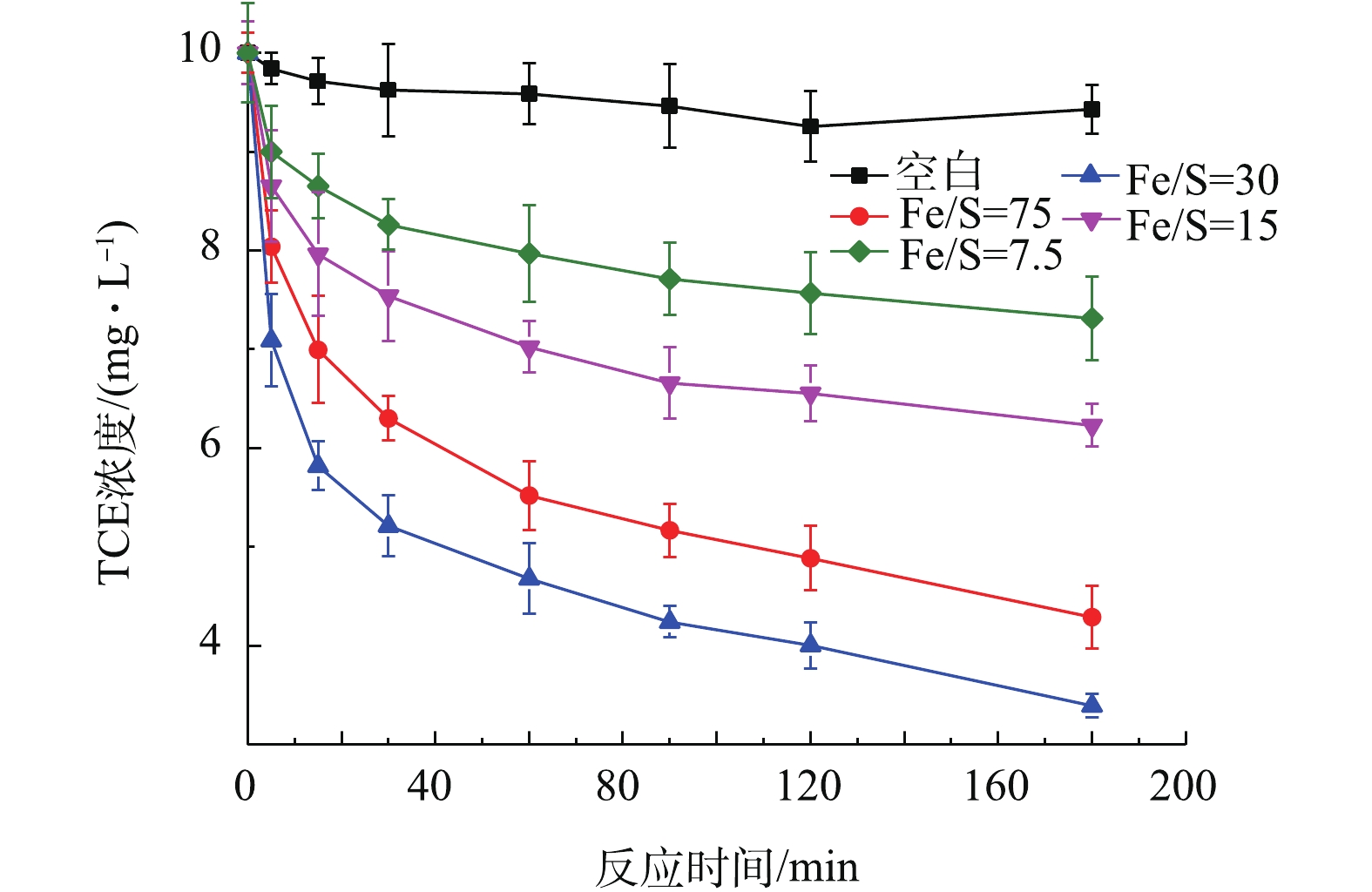
1)铁硫比对TCE去除的影响。将铁与硫的摩尔比为75、30、15、7.5的含有0.1 g Fe0的Fe/FeS分别投加到装有100 mL的10 mg·L−1 TCE溶液的血清瓶中,加盖密封后,放入滚筒中进行反应,研究铁与硫的摩尔比对TCE去除的影响,结果如图5所示。由图5可知,随着铁硫比的不断减小,TCE的去除率先增大而后减小,并且当铁硫比为30时,TCE去除率最高可达90.75%。RAJAJAYAVEL等[21]用硫化纳米零价铁降解TCE也得出了类似的结果。更高或更低的铁硫比都会导致去除率的降低。已有研究[7, 22]指出,随着铁硫比的减小,更多的FeS在Fe0表面生成,从而减少了表面上的活性位点,抑制了铁芯的溶出,从而降低了材料对TCE的去除效率。所以后续实验中所采用的铁硫比均为30。
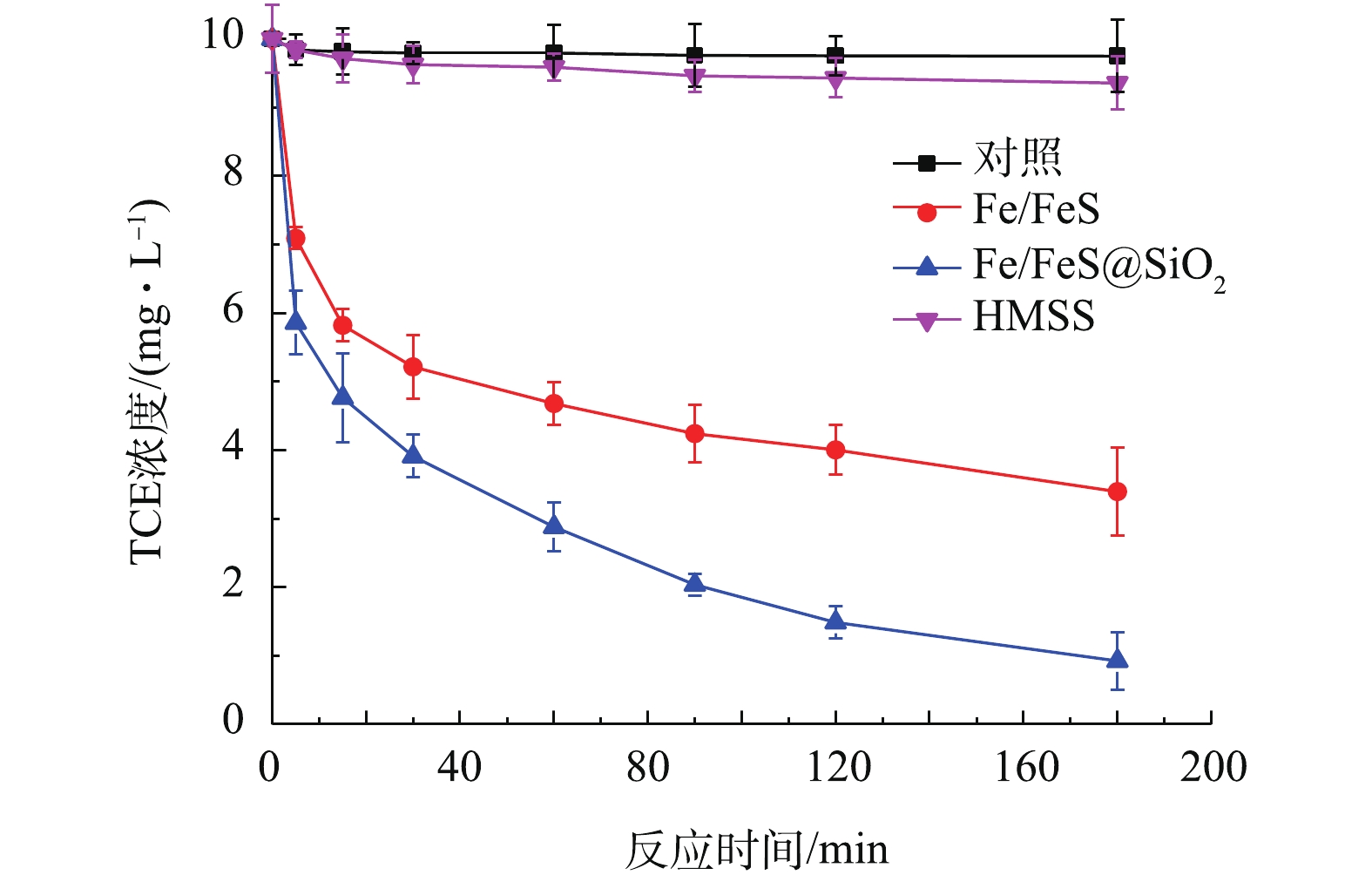
2)Fe/FeS@SiO2与Fe/FeS去除TCE的效果对比。图6为Fe/FeS@SiO2、Fe/FeS和HMSS对TCE的去除率。在常温常压下,反应180 min后,0.1 g的Fe/FeS对初始浓度为10 mg·L−1的TCE溶液的去除率为66.06%。而在相同的反应条件下,包裹了中空介孔氧化硅壳的Fe/FeS对TCE的去除率为90.75%。这说明包裹了HMSS后,材料去除污染物的能力得到了明显的提升。同时,对HMSS去除TCE的效果也进行了研究,在相同条件下,TCE去除率仅为6.5%。这说明Fe/FeS@SiO2对TCE的去除主要是通过还原反应进行的。
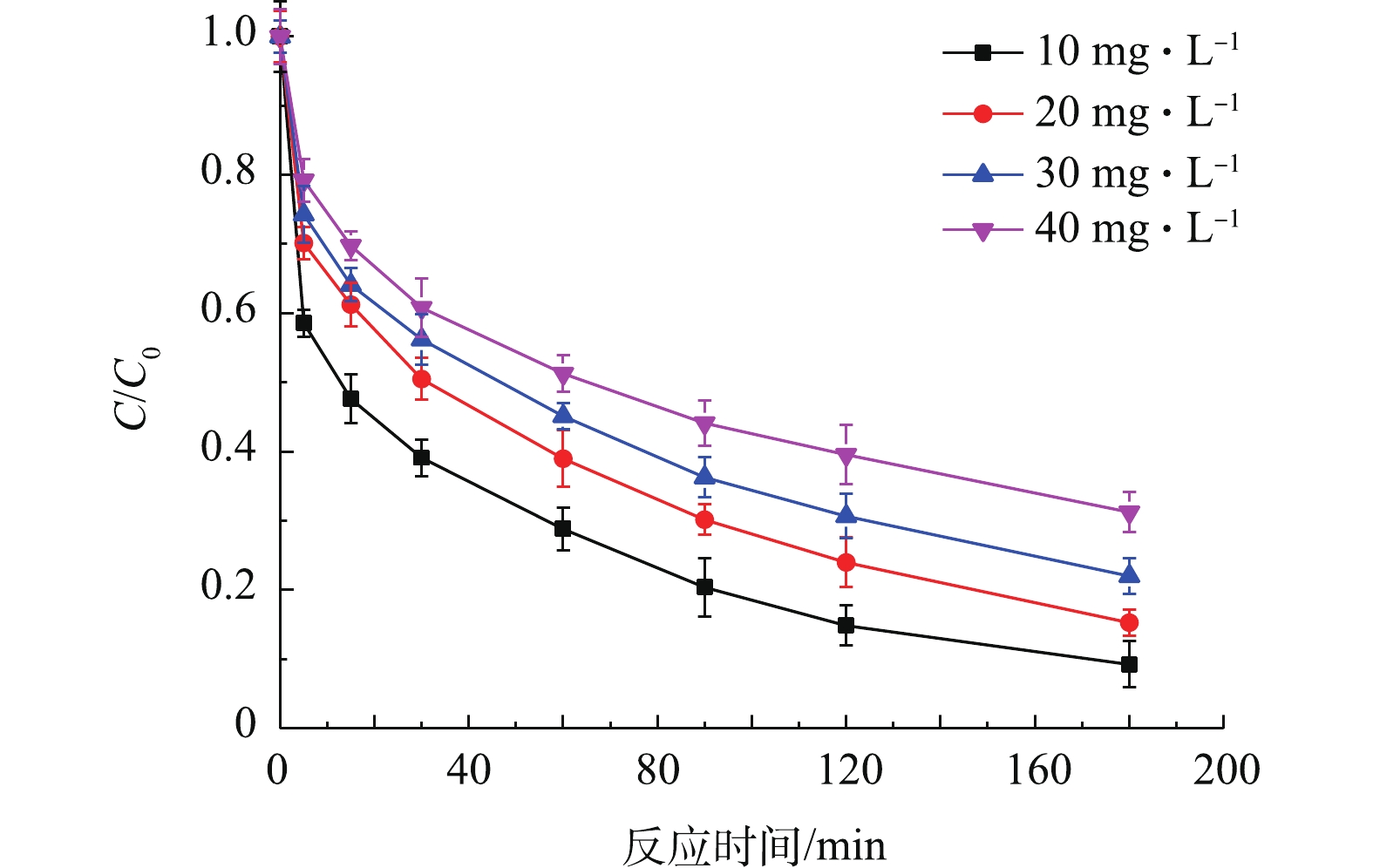
3)TCE初始浓度对去除TCE的影响。将含有0.1 g Fe0,铁硫比为30的Fe/FeS@SiO2分别投加至TCE初始浓度为10、20、30、40 mg·L−1的溶液中,结果如图7所示。由图7可知,TCE初始浓度为10 mg·L−1时,Fe/FeS@SiO2对TCE的去除效果最好,有90.75%的TCE在3 h内被去除。而当TCE初始浓度为40 mg·L−1时,Fe/FeS@SiO2对TCE的去除效果最差,仅有69.75%的TCE被去除。这说明在其他条件相同的情况下,TCE的去除效果随着TCE浓度的增加而变差。其原因可能是:Fe/FeS表面的活性位点是有限的,而TCE的浓度增大会加剧TCE分子对Fe/FeS表面的活性位点的竞争,最终使去除率降低[23]。
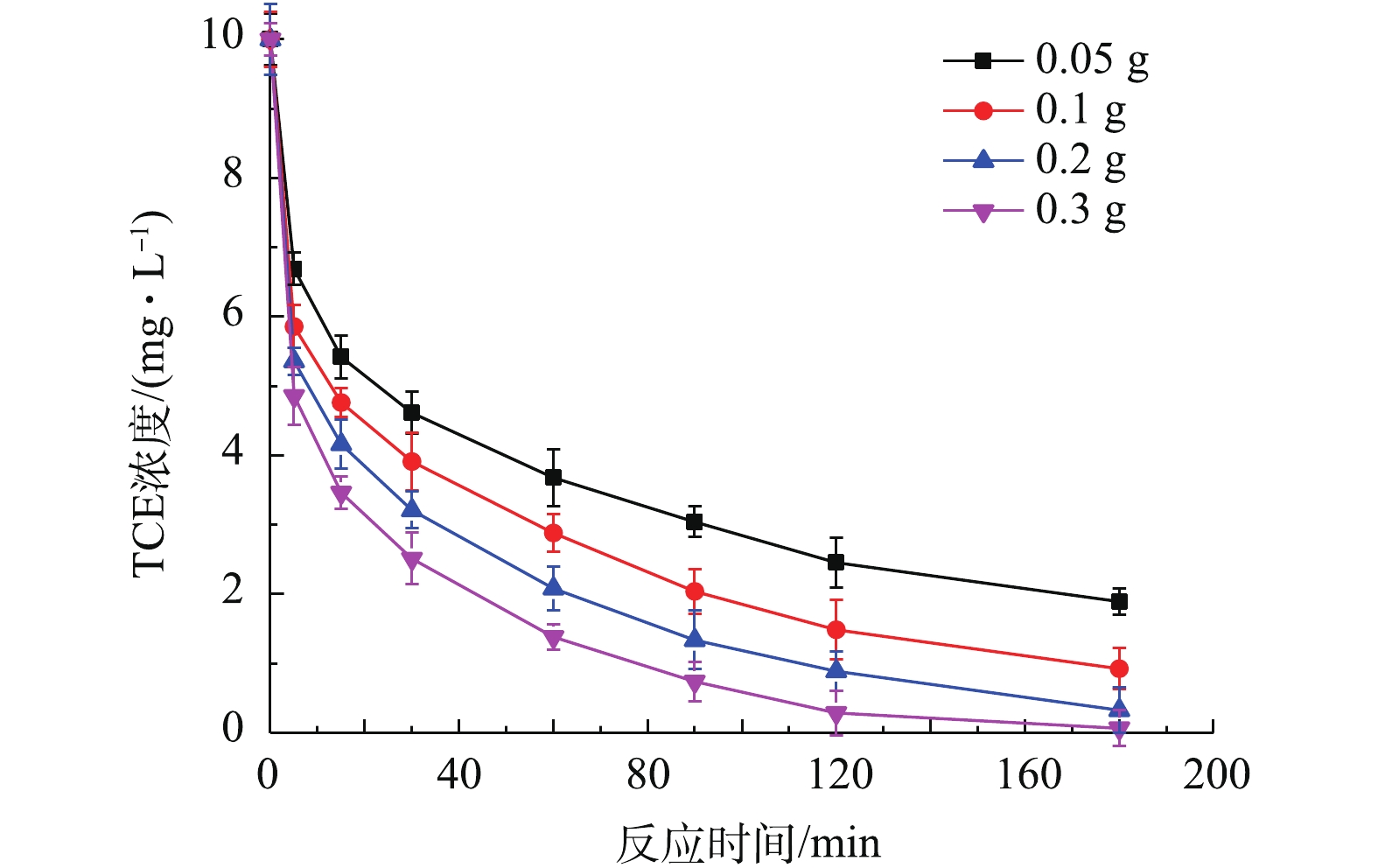
4)Fe/FeS@SiO2投加量对去除的影响。TCE分别将含有0.05、0.1、0.2、0.3 g Fe0的Fe/FeS@SiO2投加到TCE初始浓度为10 mg·L−1的溶液中,降解结果如图8所示。从图8中可以看出,当投加量为0.05 g时,Fe/FeS@SiO2对TCE的效果最差,去除率为81.00%;当投加量为0.3 g时,Fe/FeS@SiO2对TCE的效果最好,2 h就可基本将TCE去除。该结果表明,在相同条件下,TCE的去除效果随着Fe/FeS@SiO2投加量的增加而逐渐提高。其原因为:投加量的增加使得活性位点增加,同时也加大了与污染物TCE的接触面积,从而提高了TCE的去除率。
5)Fe/FeS@SiO2材料降解TCE作用原理分析。由图9可知,反应后颗粒明显变大并且堆积在一起,并且表面还有针状物生成,结合XRD图可推测其为铁氧化物。另外。从TEM图像可以看出,反应后Fe/FeS@SiO2中的Fe/FeS核心消失,并且在颗粒表面有片状的铁氧化物生成。这说明Fe/FeS@SiO2在与TCE的反应过程中,主要是Fe/FeS核与TCE反应,并被氧化成铁氧化物,溶出后附着在壳层的表面。再结合之前的实验和已有的关于Fe/FeS去除TCE的研究,可以推测Fe/FeS@SiO2材料的吸附降解机理。首先,Fe/FeS@SiO2壳层的多孔网络增强了其吸附目标污染物分子的能力,同时目标污染物可以通过介孔通道系统借助HMSS壳层渗透到Fe/FeS核表面的活性位点[15, 24];其次,蛋黄-蛋壳结构充当“纳米反应器框架”,并且与核壳纳米颗粒不同,其核与壳之间有很大的空隙,这就使核的整个表面可以与污染物充分接触[16, 25];最后,包裹在Fe/FeS表面上的HMSS壳层可以防止颗粒的钝化以及团聚,从而提高TCE的降解效率[26]。
3. 结论
1)FT-IR图谱分析、XRD和XPS表征以及SEM和TEM观测等实验结果均表明制备的Fe/FeS@SiO2材料具有蛋黄-蛋壳结构。材料的粒径分布实验证明了加介孔中空氧化硅壳以后,团聚减少,在水溶液中,颗粒的平均粒径为11.89 μm,小于未包裹的29.00 μm。
2)在初始浓度为10 mg·L−1溶液中,投加含有0.1 g Fe0的铁硫比为30的Fe/FeS@SiO2情况下,反应180 min后,TCE的去除率为90.75%,与未包裹氧化硅壳时的66.06%相比,去除效果明显提高。
3)Fe/FeS@SiO2材料开放的孔道和更大的比表面积使其可以吸附更多的TCE,使TCE与Fe/FeS核的接触增多,蛋黄-蛋壳材料的特殊结构也充分利用了Fe/FeS核的整个表面,使TCE的去除率得到显著提高。
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 1267
- HTML全文浏览数: 518
- PDF下载数: 762
- 施引文献: 0





 下载:
下载: