微囊藻毒素-RR的提取和臭氧氧化降解
Extraction and ozonation of microcystin-RR from cyanobacterial blooms
-
摘要: 在对采自云南滇池水华蓝藻细胞中的微囊藻毒素-RR(microcystin-RR, MC-RR)提取并发现其含量达到0.19 mg/g (干重)的基础上,重点研究了臭氧氧化降解所提取的MC-RR。结果表明,当反应体系中臭氧浓度为5.7 mg/L时,初始浓度1.9 mg/L的MCRR在15 min内被完全降解。利用HPLC/ESI/MS对提取的MC-RR及其氧化降解产物质荷比测定发现, 降解前MC-RR的质谱图中出现特征离子m/z=1 038.7、m/z=519.8以及m/z=135.0。而降解后的产物质谱图中只有Adda基团中带苯环结构化合物(C9H10O)的特征离子峰m/z=135.0存在,其他2个离子峰完全消失。由此推断反应体系中MC-RR(m/z=1 038.2)在大量臭氧及其·OH自由基全面攻击下,分子结构中Adda基团以及单环结构中的不饱和双键直接被氧化而发生断链,最终形成小分子的有机物。Abstract: Microcystin-RR (MC-RR) was successfully extracted from cyanobacterial cells collected from Dianchi Lake and its content in cyanobacteria samples was determined to be at least 0.19 mg/g (dry weight). Ozone was applied to degrade MC-RR extracted. The results showed that initial 1.9 mg/L MC-RR was completely degraded by ozone within 15 minutes when the O3 concentration in reaction system reached 5.7 mg/L at room temperature. The HPLC/ESI/MS analysis on MC-RR and its oxidative degradation products demonstrated that the parent ion m/z=1 038.7, ion m/z=519.8 and m/z=135.0 which represent MC-RR were obviously appeared while both of ion m/z=1 038.7 and ion m/z=519.8 were not found on the MS profiles of its oxidative degradation products. Ion m/z=135.0 which represents the compound (C9H10O) with aromatic ring contained in Adda remained unchanged. These provided the positive evidences that MC-RR was degraded completely into small molecule organic compounds for its unsaturated double bond sites cleaved by a large number of ozone and ·OH in reaction system.
-
Key words:
- microcystin-RR /
- ozone /
- degradation products /
- mass spectrum
-
厌氧氨氧化(anaerobic ammonium oxidation,anammox)技术是节能高效的脱氮技术之一,在处理高氨氮(
NH+4 厌氧氨氧化附着膜膨胀床(anaerobic attached film expanded bed,AAFEB)是二十世纪70年代JEWELL等[8]研制出的厌氧消化工艺。AAFEB工艺采用底部进水、上向流方式[9]。与UASB工艺相比,AAFEB工艺设有一套污水回流系统,将部分出水回流至反应器中。这一方面可稀释进水中污染物的浓度,降低进水负荷;另一方面可提高反应器中污水的上升流速,使污染物质与污泥接触更加充分[9-10]。有研究表明,AAFEB工艺可在常温和高负荷条件下高效处理低氨氮废水[8]。当处理污染物浓度较高的废水时,AAFEB反应器可将水力停留时间(HRT)和固体停留时间(SRT)分离,在缩短HRT的同时,SRT可延长至100 d以上[11-12]。
然而,生物处理工艺内微生物在面对饥饿时,其活性、菌群结构和稳定性都会受到不利的影响[13]。有学者发现,废水流量和废水中污染物成分的波动是造成AnAOB饥饿的主要原因[14]。对于部分小型污水处理设施,由于厂区的季节性关闭、年度维护或假期,厂内无法得到连续的废水供应,AnAOB由此可能经历几天、几周乃至几个月的饥饿期,而这在污水处理过程中是极为常见的[14-15]。CARVAJAL-ARROYO等[13]指出,在饥饿状态下,NO2−-N对AnAOB有严重的抑制作用。除此之外,将污泥作为接种污泥外运和使用也会造成饥饿[15]。同时,AnAOB也有其局限性。首先,由于AnAOB的世代时间长(在30~40 ℃时的倍增时间约为10~14 d),生长速率慢、细胞产率低[16-17];其次,AnAOB在饥饿状态下的ATP产量较低,对环境条件的改变较为敏感,这导致AnAOB在生存过程中极易受到抑制、进入饥饿状态,从而使得AnAOB的活性在恢复过程中面临着巨大的挑战[5,13,15]。
本研究以AAFEB工艺为对象,探究了该工艺在室温条件下经历了150 d停运后的性能恢复情况。在不添加任何有机碳的前提下,仅通过改变总氮(TN)浓度和HRT的方式,使系统anammox活性迅速恢复。同时,研究中还通过对恢复期前后AAFEB系统的脱氮性能、anammox颗粒污泥平均粒径、EPS分泌总量以及污泥中菌群结构的对比,找出该系统恢复的最佳HRT和TN,以期为AAFEB工艺在污水生物脱氮领域的应用和推广提供参考。
1. 材料与方法
1.1 实验装置及实验进水
本研究在1个有效容积为6.28 L、内径为10 cm的AAFEB反应器(图1)中进行。反应器的材料为有机玻璃。整套系统除了AAFEB反应器外,还设有进水桶、出水桶、恒温箱、蠕动泵(1个为进水蠕动泵,另1个为污水回流蠕动泵)和湿式气体流量计等设备。为使反应器中微生物活性尽快恢复到最佳状态,采用恒温箱使反应器中废水的温度保持35 ℃不变,通过化学药剂将进出水pH控制在7.5~8.5。
反应器的进水为人工合成的模拟废水。分别投加(NH4)2SO4、NaNO2和KH2PO4等药剂为模拟废水提供氨氮(
NH+4 NO−2 NH+4 NO−2 PO3−4 同时,配水时还加入了微量元素Ⅰ和微量元素Ⅱ,投加量为1 mL·L−1。微量元素Ⅰ的成分为:EDTA(5 g·L−1)、FeSO4·7H2O(5 g·L−1);微量元素Ⅱ的成分为:EDTA(15 g·L−1)、ZnSO4·7H2O(0.43 g·L−1)、CoCl2·2H2O(0.24 g·L−1)、MnCl2·4H2O(0.99 g·L−1)、CuSO4·2H2O(0.25 g·L−1)、NiCl2·3H2O(0.19 g·L−1)、NaSeO4·10H2O(0.21 g·L−1)、H3BO3(0.014 g·L−1)、NaMoO4·2H2O(0.22 g·L−1)。
本研究所指的“恢复期”定义为从恢复开始至系统NRR达到停运前的水平所用的时间。
1.2 检测指标和分析方法
1.2.1 常规指标检测方法
每天采集反应器进、出水各1次,水样采集后经定性滤纸过滤,过滤后的水样存放于透明玻璃水样瓶中,并将水样瓶保存在4 ℃的冰箱中,采用标准方法对水样中的指标进行检测[21]。通过紫外分光光度法检测水样中的硝酸盐氮(
NO−3 NO−2 NH+4 PO3−4 1.2.2 EPS提取方法
采用“加热法”提取颗粒污泥中的胞外聚合物(extracellular polymeric substance,EPS)。EPS的提取方式如下:先从反应器中取出上、中、下不同高度的泥水混合物于50 mL的离心管中,室温条件下离心10 min,转速为8 000 r·min−1,倒掉上清液;然后加入提前配好的0.9%的NaCl缓冲液至原体积,使污泥重新悬浮于溶液中,重复上述步骤3次,完成污泥清洗;再将清洗完成的污泥置于水浴锅中,在80℃的水浴下加热30 min;提取完成后,将污泥样品置于离心机,在8 000 r·min−1下离心20 min;离心结束后,将污泥上清液经0.45 μm水系膜过滤,滤液用于分析。分别通过苯酚-硫酸法和Folin-酚法分析EPS中的多糖和蛋白质。
1.2.3 微生物种群分析方法
利用高通量测序技术对AAFEB反应器内微生物的种群变化进行了分析。对细菌的16SrRNA基因的V3-V4区域进行PCR扩增,引物序列为341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC)。在97%的相似水平下对所有序列进行OTUs(Operational Taxonomic Units)划分,并进行统计分析。测序是在上海生工生物工程股份有限公司的Illumina Miseq PE300平台上进行的。高通量测序结果已上传至美国国家生物技术信息中心(NCBI)序列读取档案(SRA)数据库,登录号为PRJNA760991。
2. 结果与讨论
2.1 反应器恢复阶段脱氮性能的变化
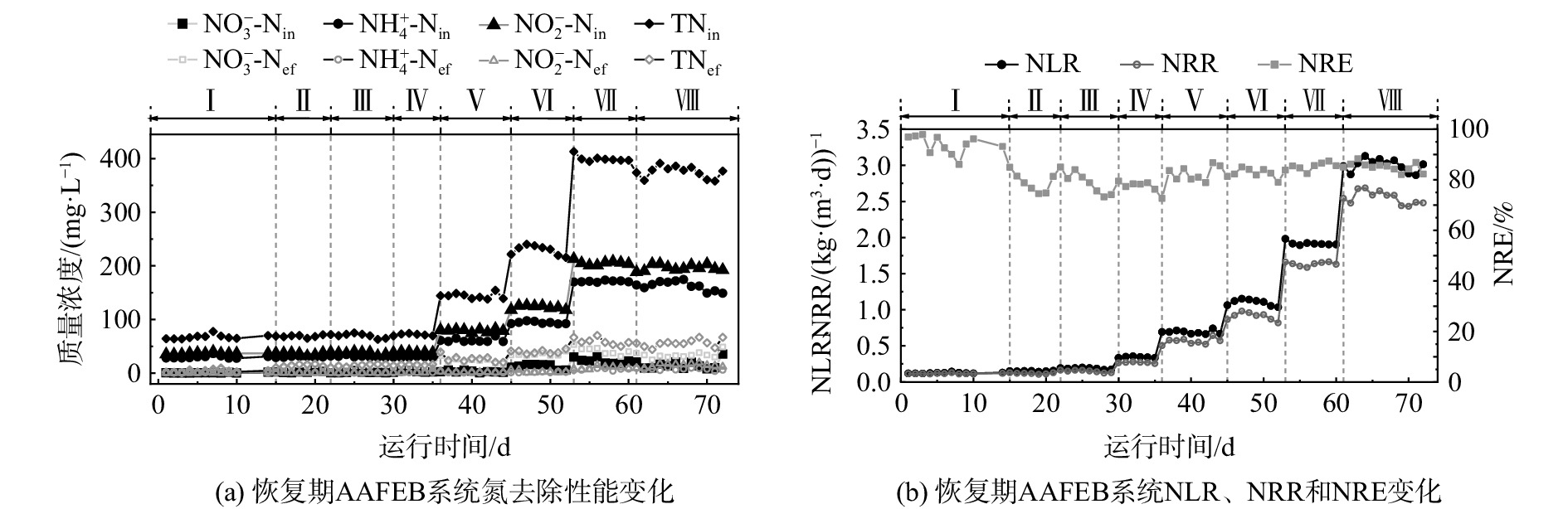
平均每3 d测1次反应器进、出水中氨氮、硝酸盐氮和亚硝酸盐氮的浓度。图2显示了恢复期AAFEB系统脱氮性能和氮负荷率、氮去除率变化,图中包含这72 d里进出水水质指标(
NH+4 NO−2 NO−3 在阶段Ⅰ~Ⅳ,反应器在35 ℃的水温下运行,进水
NH+4 NO−2 表 1 恢复期的运行阶段和进水水质指标Table 1. Operation stages and influent characteristics during the recovery period阶段 时间/d 温度/℃ HRT/h NH4+-N质量浓度/(mg·L−1) NLR/(kg·(m3·d)−1) NRR/(kg·(m3·d)−1) Ⅰ 1~14 35 13 30 0.125±0.007 0.117±0.005 Ⅱ 15~21 35 11 30 0.150±0.005 0.118±0.008 Ⅲ 22~29 35 9 30 0.186±0.011 0.148±0.016 Ⅳ 30~35 35 5 30 0.344±0.009 0.269±0.007 Ⅴ 36~44 35 5 60 0.691±0.025 0.563±0.041 Ⅵ 45~52 35 5 90 1.100±0.044 0.913±0.053 Ⅶ 53~60 35 5 150 1.918±0.027 1.635±0.028 Ⅷ 61~72 35 3 150 2.999±0.086 2.553±0.090 在阶段Ⅴ~Ⅶ,保持温度和HRT不变,将
NH+4 NO−2 在阶段Ⅷ,保持温度和
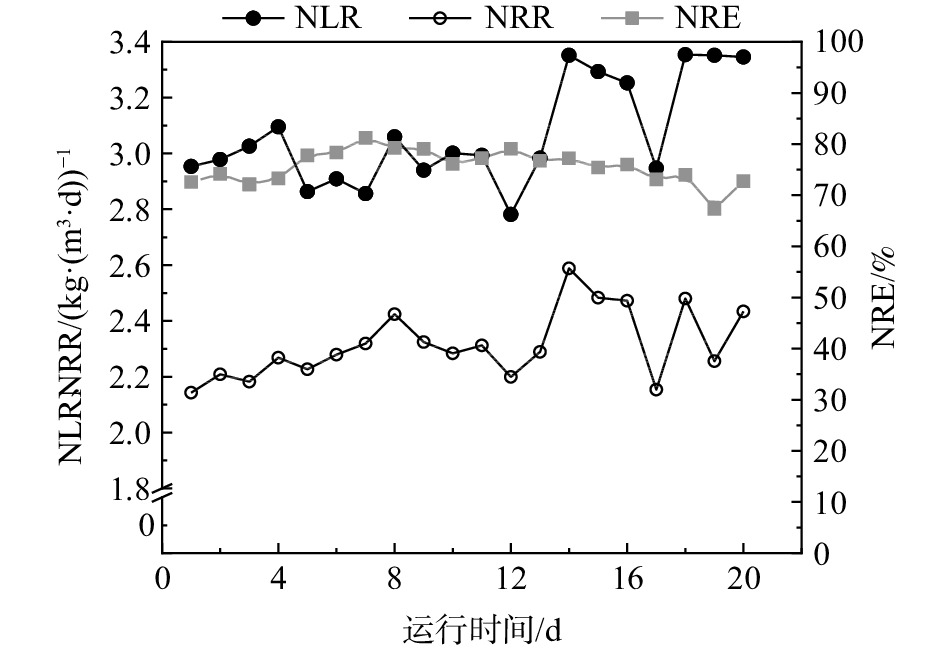
NH+4 图3所示为该AAFEB反应器停运前20 d的脱氮情况。图3表明,反应器停运前的NLR、NRR和NRE分别为(3.067±0.188) kg·(m3·d)−1、(2.316±0.125) kg·(m3·d)−1和(75.63±3.27)%。在本次恢复实验中,在阶段Ⅰ~Ⅷ,NRE一直稳定在80%以上,略高于停运前的NRE,且阶段Ⅷ中的NLR和NRR分别为(2.999±0.086) kg·(m3·d)−1和(2.553±0.09) kg·(m3·d)−1,与停运前的NLR和NRR十分接近。同时,由anammox反应方程式得知,anammox反应会产生少量硝酸盐氮(
NO−3 2.2 颗粒污泥特性的变化
AAFEB反应器内的anammox颗粒污泥的主要成分是AnAOB、矿物质和EPS[23]。在饥饿期间,系统内anammox污泥由红褐色变为黑色,这与其他研究者报道的结果相似[24-26]。图4为恢复期不同时期反应器中污泥形态图。
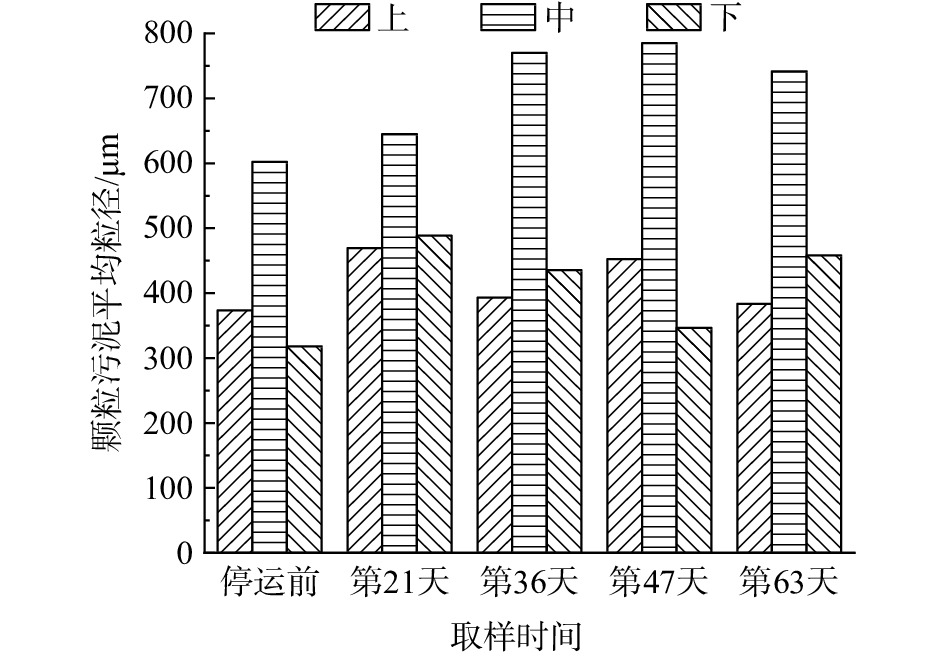
从反应器内不同位置(上部、中部和下部)取出适量的污泥进行粒径测试,测试结果如图5所示。图5表明,中部的颗粒污泥粒径最大,且远大于上部和下部的污泥粒径。一般认为,anammox颗粒污泥粒径的大小与污泥的沉降性能密切相关,颗粒污泥的沉降性能越高,反应器的性能越好[15]。
EPS是聚集在细菌细胞表面的生物聚合物,主要物质为多糖(PS)和蛋白质(PN)[7,20]。微生物分泌的EPS可维持anammox颗粒污泥的物理结构,有利于颗粒污泥的稳定性[27-29]。同时,EPS可充当粘合剂,将微生物和HAP结合到一起[30-31],可为反应器中anammox-HAP耦合工艺的顺利进行奠定基础,从而达到脱氮的目的。此外,EPS可保护微生物免受有毒物质的影响,为微生物细胞提供了保护屏障[32]。
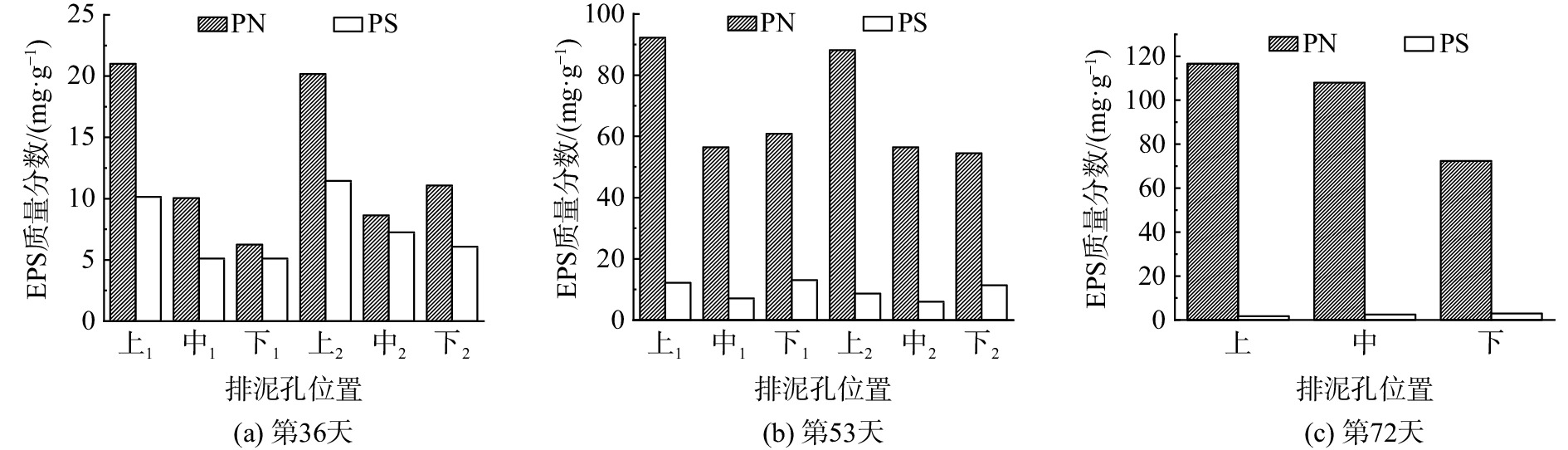
图6分别为反应器中的微生物在第36、52和72天的EPS分泌情况。其中,上1、中1和下1分别表示改变条件之前的EPS分泌情况,上2、中2和下2分别表示改变条件之后的EPS分泌情况。由表1可知,第36天时,反应器进水氨氮由30 mg·L−1增至60 mg·L−1,第53天时,反应器进水氨氮由90 mg·L−1增至150 mg·L−1。结合图6可知,改变条件前后微生物分泌EPS的总量并没有明显变化,说明当进水氨氮低于150 mg·L−1时,进水氨氮的突然增加对EPS分泌总量的瞬时变化影响不大。
图6表明,在恢复期的第36天,上部污泥中微生物所分泌的EPS最多,占EPS分泌总量的54.01%,而中部和下部分泌的EPS较少,分别占EPS分泌总量的26.29%和19.70%,且中部和下部的EPS分泌总量相差不大。这可能是由上部的颗粒污泥粒径更小,比表面积更大,且上部污泥的活性更高导致的。然而,第53天时,中部和下部微生物分泌的EPS占比增加;恢复期第72天时,中部和下部EPS的分泌总量进一步增加,分别占总量的36.33%和24.77%。
根据厌氧污泥平均粒径的大小,将恢复期分为污泥粒径成长期(第0~21天)和污泥粒径稳定期(第21~72天)。由图5可以看出,反应器上部、中部和下部的颗粒污泥在性能恢复期间的平均粒径较停运前均有增大。其中,中部颗粒污泥的平均粒径增长较为明显,平均粒径由停运前的602.24 μm增长至恢复期第63天的741.65 μm;而上部和下部的污泥平均粒径在恢复期均呈现出先增大后减小的趋势,分别由停运前的373.22 μm和317.97 μm增长至383.53 μm和458.29 μm,减小之后的平均粒径依然比停运前大。因此,从颗粒污泥平均粒径数据变化来看,也可认为系统恢复成功。从图5和图6可以看出,随着颗粒污泥粒径的增加,污泥EPS的分泌总量也相应加大。
在污泥粒径成长期,当运行至第11天时,反应器中的污泥为黑色的絮状污泥,此时,系统的NRR为(0.117±0.005) kg·(m3·d)−1。这与反应器停运前的NRR相差甚远,说明在Anammox系统中,与红色颗粒污泥相比,黑色絮状污泥的脱氮效果较差;当恢复至第21天时,反应器中的污泥颜色仍为黑色,且颗粒形成量较少,此时的NRR为(0.118±0.008) kg·(m3·d)−1,与阶段Ⅰ的NRR相比几乎没有变化。
在污泥粒径稳定期,当反应器运行至第36天时,反应器中的大多数污泥已从絮状变为肉眼可见的颗粒状,且出现少许的红褐色颗粒污泥,污泥中微生物分泌的EPS量较少,上部、中部和下部的EPS总量分别为31.14、15.16和11.36 mg·g−1。这是由于饥饿期间底物缺乏,EPS充当碳源被AnAOB和异养菌消耗[18,33],且在恢复期初期,AnAOB活性较低,无法产生太多的EPS[34]。此时,系统的NRR为(0.563±0.041) kg·(m3·d)−1。此值虽然比之前有着明显的上升,但与停运前的NRR相比还有一定差距。在恢复期末期,AnAOB的活性进一步提高,微生物分泌的EPS也随之增多,上部、中部和下部分泌的EPS总量分别上升至118.23、110.42和75.29 mg·g−1,大多数污泥已经变为红褐色的颗粒污泥。此时的NRR为(2.553±0.090) kg·(m3·d)−1,略高于停运前的NRR。综上所述,AAFEB系统在经历了150 d长期饥饿后,其脱氮性能很难在短期内得到恢复,且污泥形态可在一定程度上反应系统的脱氮效果。
与李冬等[35]的研究结果相比,本研究虽然恢复时间较长,但在恢复过程中无需添加任何有机物质,且AAFEB系统中的污泥粒径更大。一般认为,anammox颗粒污泥粒径的大小与污泥的沉降性能密切相关,颗粒污泥的沉降性能越高,反应器的性能越好[15]。
2.3 微生物种群结构变化
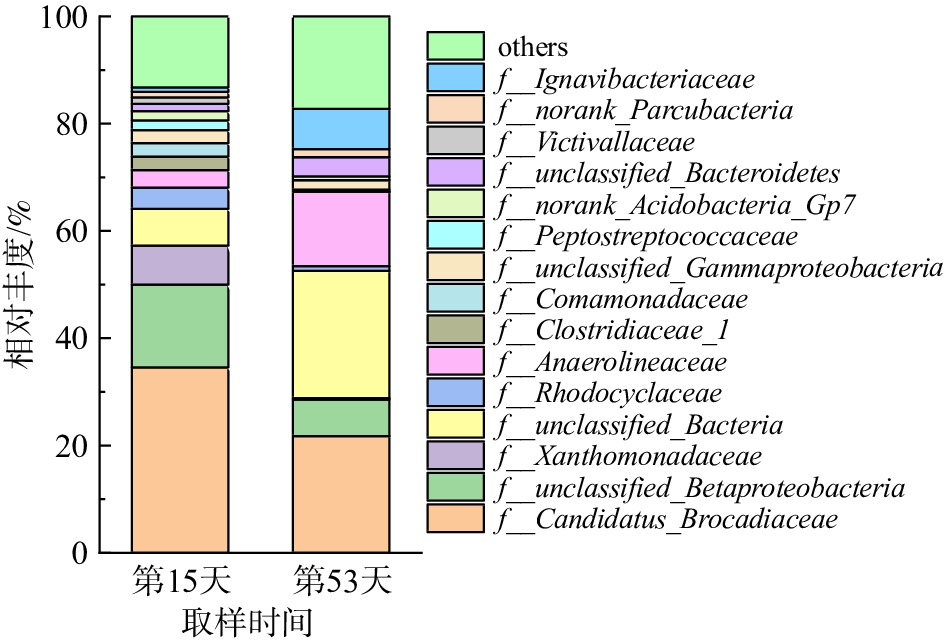
厌氧氨氧化菌科(Candidatus Brocadiaceae)为Planctomycetes下的一个新科[36]。图7为系统内微生物在科水平上的群落组成和相对丰度图,从图中可以看出,f__Candidatus Brocadiaceae的相对丰度最高,是系统中的优势菌群。这也在一定程度上说明采取逐渐降低HRT、提升TN的方式有利于f__Candidatus Brocadiaceae的生存。然而,在反应器性能恢复过程中,f__Candidatus Brocadiaceae的相对丰度由第15天的35.03%下降到第53天的21.80%,但依然是该系统中的优势菌群。
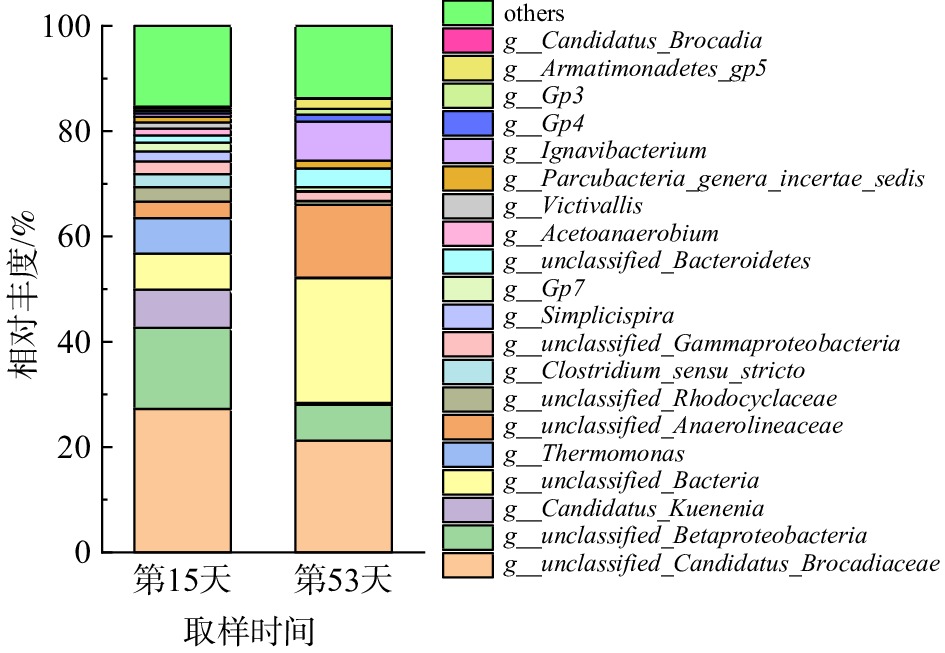
图8为属水平上的微生物群落组成和相对丰度图。2次高通量测序共检测出4种AnAOB属,包括g__Candidatus_Kuenenia、g__Candidatus_Anammoxoglobus、g__Candidatus_Brocadia和g__unclassified Candidatus_Brocadiaceae。其中,优势AnAOB为g__unclassified Candidatus_Brocadiaceae,在第15天和第53天的相对丰度分别为27.24%和21.24%,这与蒙小俊等[37]的研究结果一致。据报道,g__Candidatus_Brocadia是f__Candidatus Brocadiaceae科下的一个属,是AnAOB中第一个被富集鉴定的菌属[38]。通过与BLAST进行序列比对发现,Brocadiaceae科中96%的序列中有多条序列与BLAST序列同源相似[39],故暂无法确定g__unclassified Candidatus_Brocadiaceae是哪种属。
g__Candidatus_Kuenenia的相对丰度由第15天的7.11%下降至第53天的0.38%,g__Candidatus_Anammoxoglobus的相对丰度由0.05%下降至0。然而,g__Candidatus_Brocadia的相对丰度由开始的0上升至0.13%,说明g__Candidatus_Brocadia对长期停运后恢复期条件的耐受能力比另外2种AnAOB菌属更强。有研究者认为,g__Candidatus_Brocadia的相对丰度与HRT负相关,与NRR和废水上升流速(v)线性相关[40]。这与本研究中g__Candidatus_Brocadia的相对丰度变化一致。
3. 结论
1)在经历150 d的饥饿后,通过降低HRT和提高TN浓度的方式,AAFEB系统的NLR在60 d内由最初的(0.125±0.007) kg·(m3·d)−1上升至(2.999±0.086) kg·(m3·d)−1。同时,NRR也由最初的(0.117±0.005) kg·(m3·d)−1上升至(2.553±0.090) kg·(m3·d)−1,表明该AAFEB系统脱氮性能恢复成功。
2)在恢复期初期,污泥中EPS总量较低,随着AnAOB活性的升高,EPS总量逐渐增多;在整个恢复期间,随着颗粒污泥的平均粒径逐渐增加,污泥EPS的分泌总量相应加大。
3)在经历了150 d的停运后,AnAOB的活性可通过改变TN和HRT的方式得到恢复,说明该工艺具有较强的韧性。Candidatus_Kuenenia为恢复期初期AAFEB系统中AnAOB的优势菌种,而Candidatus_Brocadia对长期停运后恢复期条件的适应能力更强。
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 1812
- HTML全文浏览数: 684
- PDF下载数: 1098
- 施引文献: 0





 下载:
下载: