微生物絮凝剂捕集Cu(Ⅱ)的响应面优化及机理研究
Optimization of response surface and the mechanism study of microbial flocculants on capturing Cu (Ⅱ)
-
摘要: 采用BBD(box-behnken design) 法对微生物絮凝剂MBFGA1捕集25 mg/L含铜模拟废水中Cu(Ⅱ)的过程进行了优化,设定5个影响因子分别为pH值、MBFGA1投加量、CaCl2投加量、搅拌速度和搅拌时间,响应值为Cu(Ⅱ)的去除率,并利用傅里叶红外光谱仪对捕集机理进行了研究。结果表明,影响MBFGA1捕集Cu(Ⅱ)的显著性因素为MBFGA1投加量和搅拌速度;当pH为7.23,MBFGA1投加量为24.75 mg/L,CaCl2投加量为29Abstract: In this study,the box-behnken desigh (BBD) method was employed to investigate the removal of Cu(Ⅱ) by microbial flocculants MBFGA1 from simulation liquid waste. With the response target of Cu(Ⅱ) removal,five impact factors including pH,MBFGA1 concentration,CaCl2 concentration,stirring speed and time were examined and the initial concentration of Cu(Ⅱ) simulation liquid waste was 25 mg/L. The mechanism of capturing process was also studied through fourier transform infrared spectroscopy (FTIR). Results indicated that the capturing ability of Cu(Ⅱ) was greatly influenced by the concentration of MBFGA1 and the stirring speed. The optimal flocculating conditions were pH 7.23,MBFGA1 24.75 mg/L,CaCl2 29.25 mg/L,stirring speed 130.90 r/min and stirring time 47.79 s. Under these conditions the actual measurement of Cu (Ⅱ) was 0.08 mg/L and removal rate was more than 99.68%,capture capacity was 303.43 mg/g. Results of FTIR analysis demonstrated that hydroxyl,carbonyl and acetyl in MBFGA1 were responsible for capturing ability. Based on the results,the MBFGA1 was regarded as a potential absorbent for the removal of heavy metals.
-
苯扎氯铵(benzalkonium chlorides, BACs)主要由3种正烷烃基(n-C12H25、n-C14H29和n-C16H33)取代二甲基苄基氯化铵组成的同系物混合物[1],因其具有较强的杀菌作用,常被作为洗涤剂、纺织物软化剂、界面转化活性剂、矿物浮选剂、杀菌剂以及个人护理品中的防护和抗静电成分[2]。由于杀菌剂生产及使用量的逐年递增,BACs被美国和加拿大列为高产量化学品[3]。BACs的大量生产和消耗,将不可避免地随着时空迁移进入环境中。近年来,BACs陆续在多种环境介质中被检出,如污水处理厂进水[4-5]、医院废水[6]、洗衣店出水[6](如表1所示)、天然水体[7-8]、污水厂污泥[9]、河口沉积物[10-11]以及土壤[12]中。其中,河水中BAC-12和BAC-14的含量分别达到2.7~5.8 μg·L−1和6.3~36.6 μg·L−1[7];地表水中BAC-12、BAC-14和BAC-16的总量达到(3.24±14)~(72.5±14)μg·L−1[8];RUAN等[9]在中国52个污水处理厂污泥中检测出BACs的含量为0.09~191 μg·g−1;LI等[10]在中国珠江口的沉积物中发现BACs的含量为49.3~1 050 ng·g−1;FERRER等[11]曾报道BAC同系物在美国的河水沉积物中的浓度为22~206 μg·kg−1。KANG等[12]在韩国土壤中检测到BACs的含量为0.001~8.5 mg·kg−1。
表 1 环境中BACs含量Table 1. Concentrations of BACs in the environmentμg·L−1 环境中BACs的存在对生物具有潜在的毒性风险。毒理学研究表明,BACs对哺乳动物和水生动物均有急性和慢性毒性。BACs对大鼠的半数致死量(LD50)为234~525 mg·kg−1[13-14]。MELIN等[15]发现,BACs能够干扰雌性小鼠的排卵系统和发情周期,并降低雄性小鼠的精子浓度和活动能力,从而降低小鼠的繁殖率。BACs对水生生物(如藻类、水蚤、轮虫和原生动物)均具有急性毒性,半数效应浓度(EC50)为21~2 940 μg·L−1[16-18]。在欧盟修订的(EC)No.1272/2008条例中,将BACs归类为“对水生生物毒性极大”的物质,并认为对与其共存污染物的迁移性和生物有效性具有显著影响[19]。
在水环境中发现的BACs主要来自城市污水处理厂[4]。季铵盐化合物的存在可能会引起活性污泥潜在的急性反应,影响污泥的微生物活性和生存能力,从而影响其去除污染物的能力[20-21]。迄今为止,有关BACs对活性污泥微生物活性影响的研究鲜有报道。本研究在序批式反应器(SBR)处理模拟废水的基础上,以BACs的主要成分十二烷基二甲基苄基氯化铵(dodecylbenzyldimethylammonium chloride, DDBAC)为研究对象,通过污泥的微生物活性指标、氧化还原酶活性以及DDBAC浓度变化的测定,探究在DDBAC暴露下活性污泥的急性反应及微生物活性变化,以期为评估BACs在污水处理厂中的行为及影响提供参考。
1. 材料和方法
1.1 接种污泥和进水水质
实验室所用的接种污泥取自某城市污水处理厂的回流污泥。母反应器SBR的工作体积为36 L,温度控制在(22±1)℃,污泥浓度(MLSS)控制在3 000~3 500 mg·L−1,每天包含2个周期的循环,每个周期运行方式为:进水阶段(15 min)、好氧曝气阶段(180 min)、缺氧搅拌阶段(300 min)、沉降阶段(90 min)、排水阶段(15 min)和闲置阶段(120 min)。好氧阶段使用曝气设备进行曝气,溶解氧控制在2 mg·L−1左右;搅拌阶段使用搅拌器进行搅拌,溶解氧控制在0.5 mg·L−1左右,使用1.0 mol·L−1 NaHCO3和1.0 mol·L−1HCl调节系统pH,使初始pH维持在7.0±0.2。运行3个月后,系统对氮的去除率达到99%左右,表明SBR运行状态稳定。
本研究采用模拟废水,水质特性为:化学需氧量(COD)为400 mg·L−1左右,氨氮(
NH+4 -N)为40 mg·L−1左右,溶解性磷(SOP)为5 mg·L−1左右。模拟废水主要由葡萄糖、NH4Cl、KH2PO4、MgSO4、CaCl2和微量元素组成,其中微量元素包括0.03 g·L−1CuSO4·5H2O、0.06 g·L−1 Na2MoO4·2H2O、0.12 g·L−1 ZnSO4·7H2O、0.12 g·L−1 MnCl2·4H2O、0.15 g·L−1H3BO3、0.15 g·L−1 CoCl2·6H2O、0.18 g·L−1 KI、1.5 g·L−1 FeCl3·6H2O、10 g·L−1EDTA。微量元素投加量为0.5 mL·L−1。1.2 实验方法
在进行DDBAC在SBR系统中的短期暴露实验时,从稳定运行的母反应器里取出适量污泥混合均匀,平均分配在7个完全相同的SBR子反应器中,每个反应器有效容积为3 L,7个反应器运行方式和母反应器相同。污泥浓度(MLSS)控制在3 000~3 500 mg·L−1,污泥负荷(以COD计)大约为0.3 kg·(kg·d)−1(以MLSS计),污泥停留时间(SRT)大约为15 d,水力停留时间(HRT)为20 h。反应器中DDBAC浓度分别为0、0.1、1、2、5、10和20 mg·L−1,运行一个周期后,取上清液测定DDBAC在水相中的残余量,取底泥进行TCC-脱氢酶活性、CAT活性的测定,然后弃去上清液,重新换入模拟废水,然后进行污泥耗氧速率OUR的测定。
在进行DDBAC对硝化过程的影响实验时,取母反应器活性污泥静置倒掉上清液,用自来水重复清洗3遍,再用不含C、N、P的配水清洗3遍,以充分去除原水样中C、N、P的含量。污泥浓度控制在3 000~3 500 mg·L−1,平行操作2组实验,实验期间需要曝气,曝气量控制在2 mg·L−1。温度调整至(20±1)℃,通过1.0 mol·L−1NaHCO3和1.0 mol·L−1HCl,调节pH至7.0±0.2。起始基质(
NH+4 -N和NO−2 -N)浓度均为30 mg·L−1,其中DDBAC投加浓度与SBR子反应器中一致,每隔10 min取样分析NH+4 -N和NO−2 -N浓度变化,直到出水各指标稳定,实验结束。1.3 分析方法
本研究中的常规项目如混合液悬浮固体浓度(MLSS)、
NH+4 -N、NO−2 -N、NO−3 -N指标参照文献中的方法[22]测定,溶解氧采用便携式溶氧仪监测。污泥耗氧速率(OUR)采用有氧厌氧呼吸仪(美国RSA公司)测定。比氨氧化率(SAOR)、亚硝酸盐氧化率(SNOR)和硝酸盐还原率(SNRR)的测定方法参照文献中的方法[23]。
TCC-脱氢酶采用常温萃取法[22-24]测定,过氧化氢酶(CAT)活性采用紫外分光光度法[25]测定。
低于0.2 mg·L−1的DDBAC浓度采用Agilent 1260 Infinity液相色谱/6410三重四极杆液质联用系统测定,色谱柱为ZORBAX RRHD Eclipse Plus C18 2.1 mm×50 mm, 1.8 μm,流动相为2种溶液的混合液,溶液A为20 mmol·L−1乙酸铵水溶液(含0.2%甲酸),溶液B为甲醇和乙腈的混合液(甲醇∶乙腈=3∶7),流动相为A∶B=20∶80(体积比),流速为0.3 mL·min−1,温度为25 ℃,进样体积为2 μL,雾化气压力为310 kPa,干燥器温度为350 ℃,干燥器流速为10 L·min−1,采用正离子扫描方式,根据峰面积计算出其含量。高于0.2 mg·L−1的DDBAC浓度采用改进的二硫蓝离子对提取方法[26]进行测定。
2. 结果与讨论
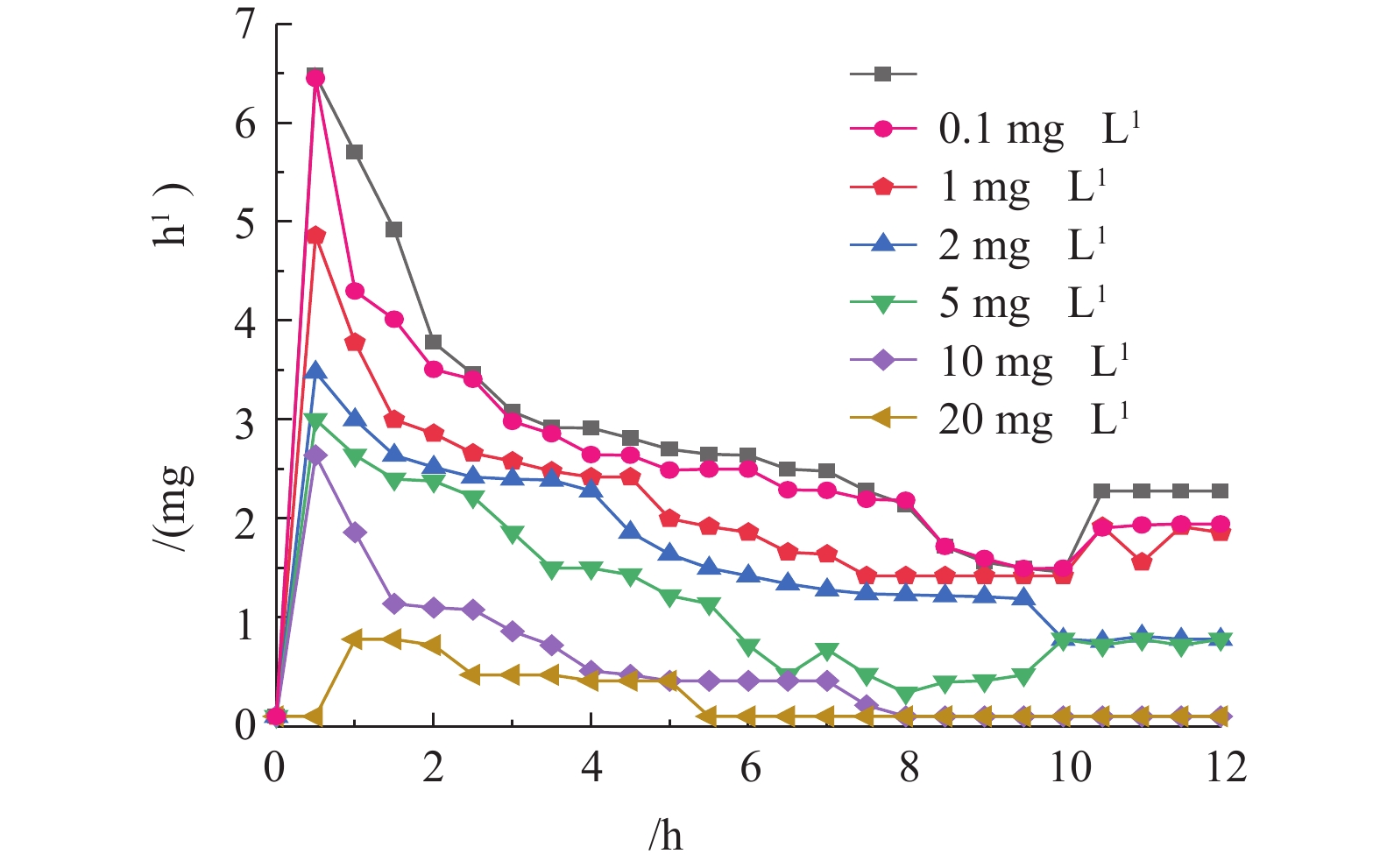
2.1 DDBAC浓度变化对污泥OUR的影响
OUR是指活性污泥在单位时间内所利用氧的量,是评价污泥微生物代谢活性的一个重要指标。根据不同系统运行12 h后测定相同体积活性污泥OUR的变化,可以判断不同浓度DDBAC暴露下污泥性质的变化,结果如图1所示。前1 h,OUR呈明显的上升趋势,不含DDBAC的系统中污泥OUR最高达6.48 mg·h−1。随着DDBAC浓度的增加,最高OUR呈下降趋势。在1 mg·L−1 DDBAC的系统中,OUR最大为4.86 mg·h−1。当DDBAC浓度达到20 mg·h−1时,污泥OUR上升缓慢,1 h时最高OUR为0.78 mg·h−1;1 h后,7组反应器中污泥的OUR均逐渐降低,且DDBAC浓度越高,OUR的降低趋势越明显。当DDBAC浓度达到20 mg·L−1时,经过5.5 h后,污泥的呼吸速率降为0。结果表明,随着DDBAC浓度的增加,活性污泥中呼吸酶活性越低,氧的吸收和利用率越低。DDBAC作为有机抗菌剂,与细胞膜具有较好的相容性,可损伤细胞膜,造成细胞裂解;或与细胞膜融合,损坏细胞中的酶、蛋白质,使氧化磷酸化过程和电子传递系统受到影响,导致呼吸作用受到抑制。ZHANG等[27]和CROSS等[28]亦认为呼吸酶活性的下降是由DDBAC引起细胞裂解所致。
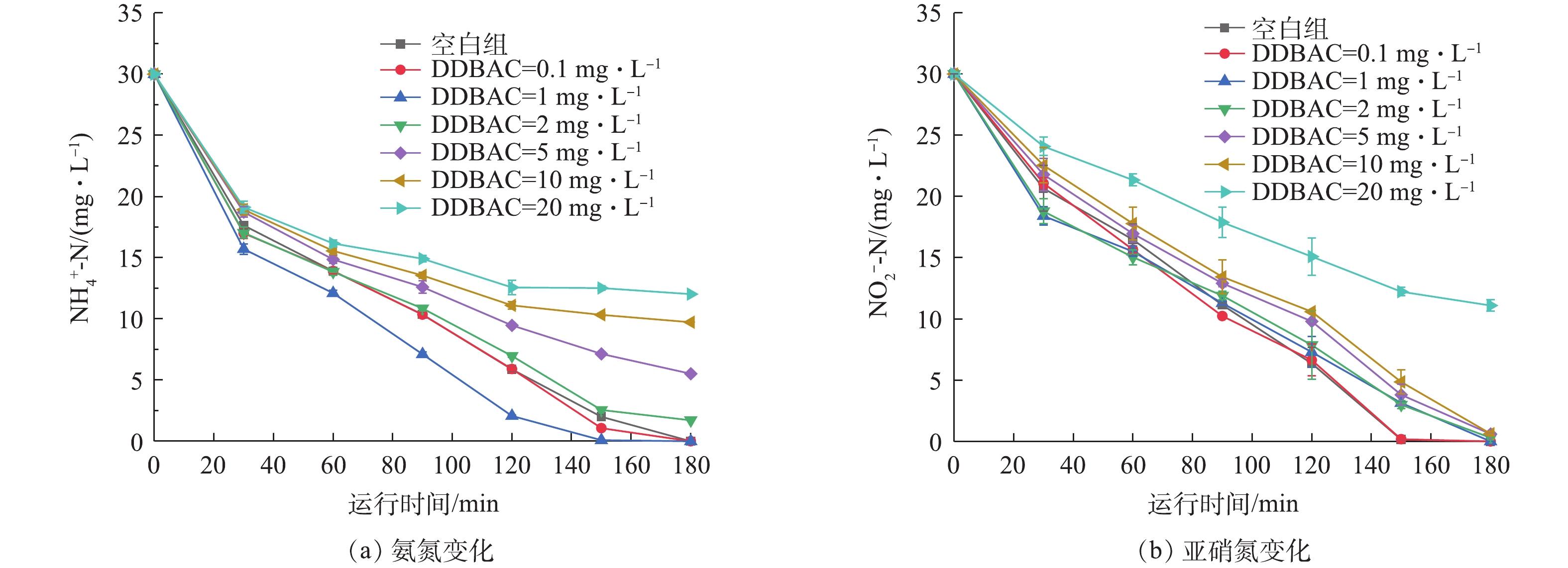
2.2 DDBAC对硝化过程的影响
DDBAC对硝化反应中的氨氮的降解过程影响如图2(a)所示,对亚硝氮的降解过程影响如图2(b)所示。从图2(a)中可以看出,当DDBAC浓度为0.1 mg·L−1和1.0 mg·L−1时,氨氮的转化速率大于空白对照组,即DDBAC的存在能够促进氨氮的氧化过程。当DDBAC浓度为2、5、10和20 mg·L−1时,氨氮的氧化速率随着DDBAC浓度的升高而逐渐下降,氨氮去除率分别为94.28%、81.61%、67.59%和59.92%。这表明,DDBAC的过量存在(≥2.0 mg·L−1)抑制了氨氧化菌的活性,影响好氧条件下氨氮的转化过程,且浓度越高,抑制效果越明显。此结果与SÜTTERLIN等[29]研究结果一致。从图2(b)中可以看出,低浓度DDBAC对亚硝酸盐氧化菌几乎无影响,20 mg·L−1的DDBAC短期暴露在系统中,使得亚硝氮降解率从100%降到(62.98±0.02)%,亚硝酸盐氧化菌受到一定抑制。此现象可能与微生物群落中氨氧化菌AOB与亚硝酸盐氧化菌NOB的相对丰度有关。与亚硝酸盐氧化菌相比,氨氧化菌的产率低、比增长速率小,更容易受到外界环境的影响[30]。
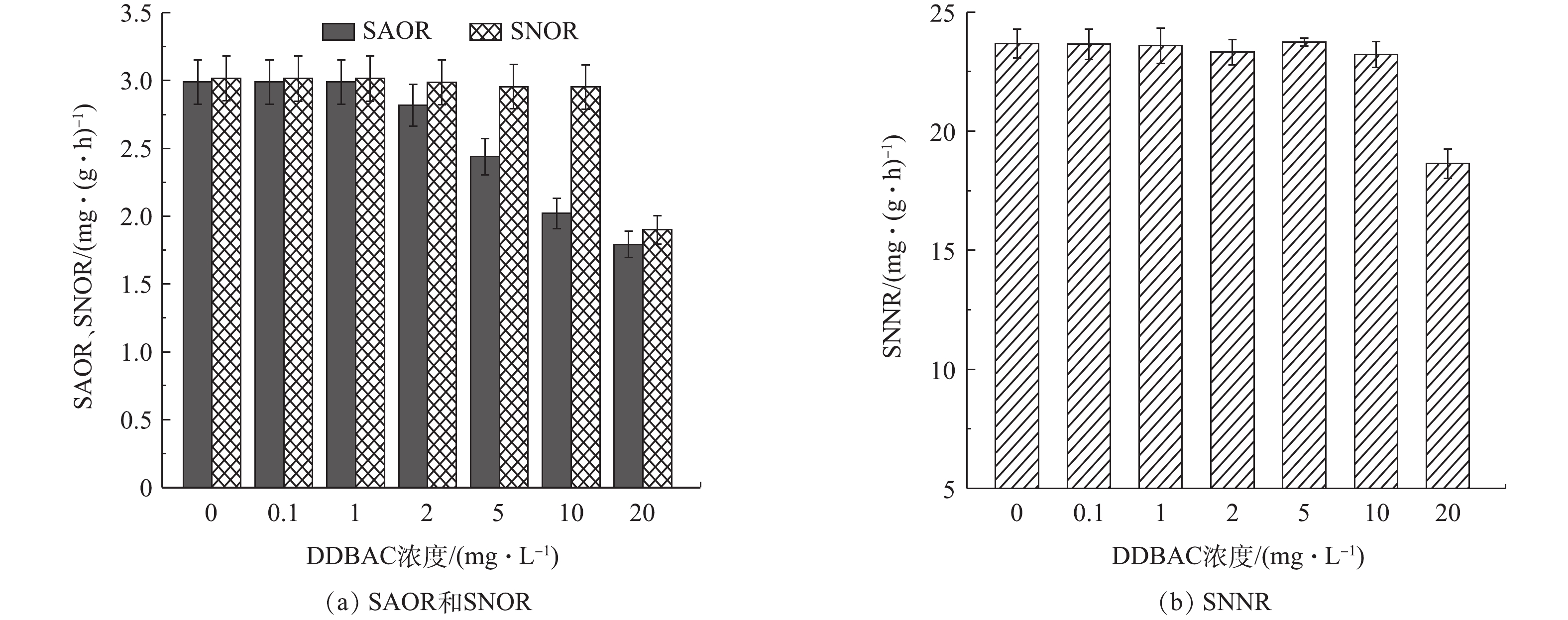
2.3 DDBAC对污泥SAOR、SNOR、SNNR的影响
图3展示了不同浓度DDBAC对系统内SAOR、SNOR和SNNR的影响。当DDBAC浓度为0.1 mg·L−1和1.0 mg·L−1时,对系统内SAOR、SNOR和SNNR基本无影响。当DDBAC浓度为2 mg·L−1时,SAOR(以
NH+4 -N计)由(2.99±0.16) mg·(g·h)−1(以MLSS计)降至(2.82±0.15) mg·(g·h)−1,降低了5.72%;当DDBAC浓度为20 mg·L−1时,SAOR降至(1.79±0.09) mg·(g·h)−1,降低40.08%。DDBAC对SNOR的影响较小,当DDBAC浓度≤10 mg·L−1时,SNOR基本不受影响;当DDBAC浓度达到20 mg·L−1时,系统内SNOR受到较大影响,与对照组相比,下降了37.02%。当进水DDBAC浓度高于2 mg·L−1时,SAOR低于SNOR,此现象表明,氨氧化过程更易受到DDBAC的影响,与2.2节中的研究结果相呼应。由图3(b)可看出,当DDBAC浓度达到20 mg·L−1时,SNNR(以NO−3 -N计)由(23.69±0.61) mg·(g·h)−1(以MLSS计)降到(18.64±0.62) mg·(g·h)−1,下降了(21.32±0.59)%。此研究结果表明,与硝酸盐还原过程相比,DDBAC对硝化过程,尤其是氨氧化菌主导的氨氧化过程的抑制作用更加显著。这是由于与异养型微生物相比,主导硝化过程的硝化细菌世代时间长,增长速率低,一般只占活性污泥微生物总量的5%左右,对环境条件要求较为苛刻。因此,DDBAC对硝化过程的抑制性更强。2.4 DDBAC对氧化还原酶活性的影响
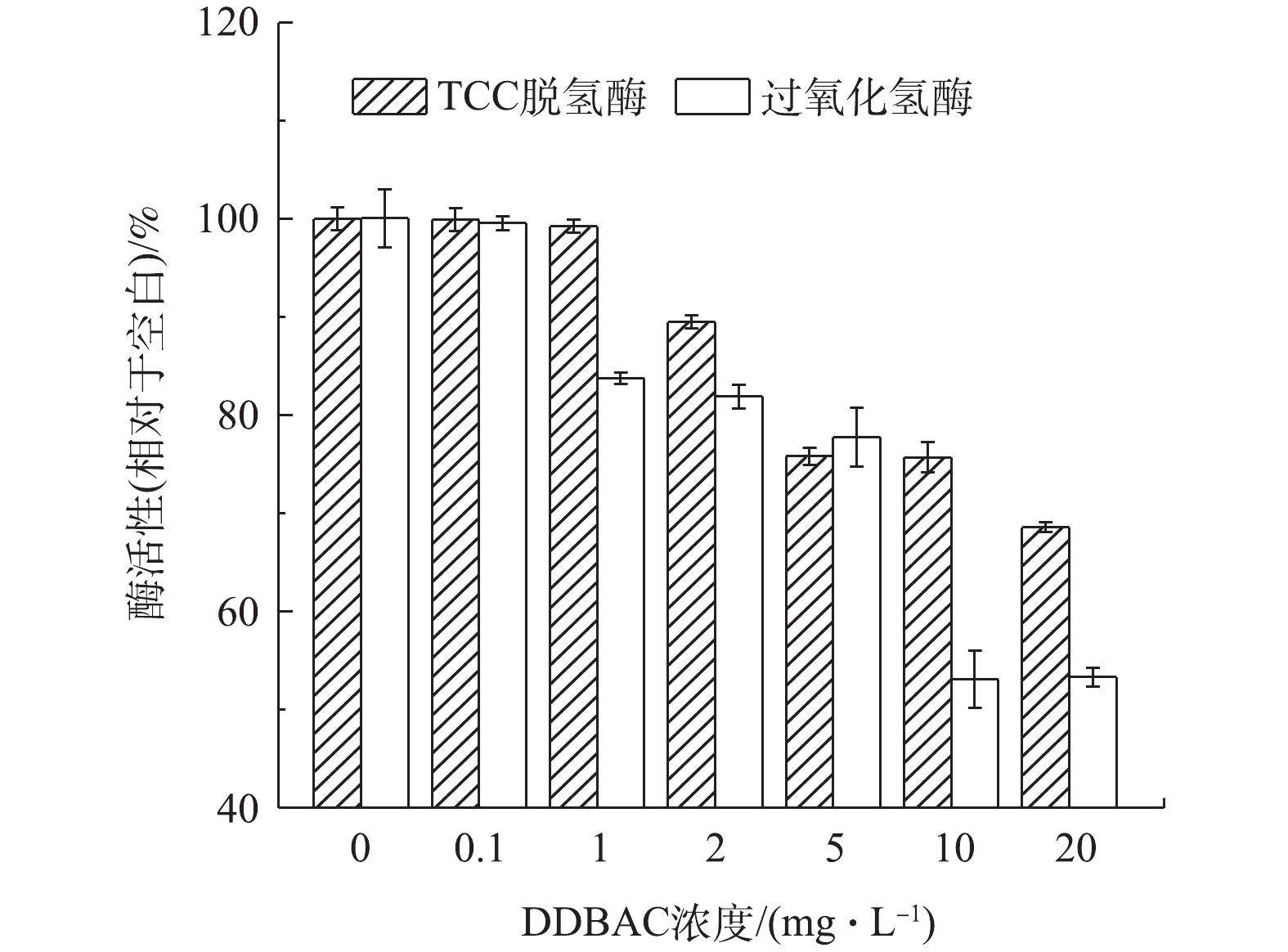
在有机化合物的好氧生物降解过程中,TCA循环是主要的代谢过程[31]。TCC-脱氢酶参与了TCA循环,能较好地反映微生物异养代谢行为。因此,在本研究中,脱氢酶活性可以作为有机化合物生物降解能力的指标之一,来评价DDBAC造成的急性效应[32]。TCC-脱氢酶活性的抑制率5%~25%属轻度抑制,25%~60%属中度抑制,大于60%属重度抑制[33-34]。DDBAC对污泥样品中TCC-脱氢酶活性的影响如图4所示。当DDBAC浓度低于2 mg·L−1时,DDBAC对TCC-脱氢酶活性的影响几乎可以忽略不计。当DDBAC浓度为2、5和10 mg·L−1时,TCC-脱氢酶活性与空白组对比,分别降低了(10.50±1.70)%、(24.20±0.01)%和(24.31±0.68)%。此时为轻度抑制;当DDBAC浓度增加到20 mg·L−1时,抑制率增加到(31.42±0.29)%,为中度抑制。根据以往的研究,季铵盐类化合物在活性污泥中的行为一般为3个过程:吸附、抑制和生物转化[35]。也有报道[26]认为,95%的季铵盐都会吸附于颗粒物,季铵盐浓度越高,对微生物的吸附量越大,对活性污泥活性的抑制作用越强。脱氢是微生物氧化分解有机物过程中的关键步骤,TCC-脱氢酶活性降低,降低了微生物对有机物的氧化分解速率,也反映了DDBAC对微生物种群的毒害作用。
CAT是生物呼吸和代谢过程中的末端还原酶,它能将对细胞有毒害作用的H2O2分解为水和氧气[36]。图4显示了DDBAC对TCCC-脱氢酶活性、过氧化氢酶活性的影响。当DDBAC浓度为1.0 mg·L−1和2.0 mg·L−1时,对CAT的影响几乎相同,抑制率在18%左右;DDBAC浓度达到5 mg·L−1时,抑制率为22.4%;DDBAC浓度为10 mg·L−1和20 mg·L−1时,抑制率均为47%左右。此研究结果表明,含DDBAC废水的输入对污泥中的微生物的呼吸和代谢过程产生了负面影响,破坏了污泥的抗氧化机制。腾跃等[37]曾观察过苯扎溴铵与过氧化氢酶之间的微观作用机理,发现苯扎溴铵能够通过改变部分的氨基酸残基和蛋白质的二级结构,使过氧化氢酶的骨架结构变松散,进而抑制了过氧化氢酶的活性。
2.5 微生物对DDBAC的去除潜力
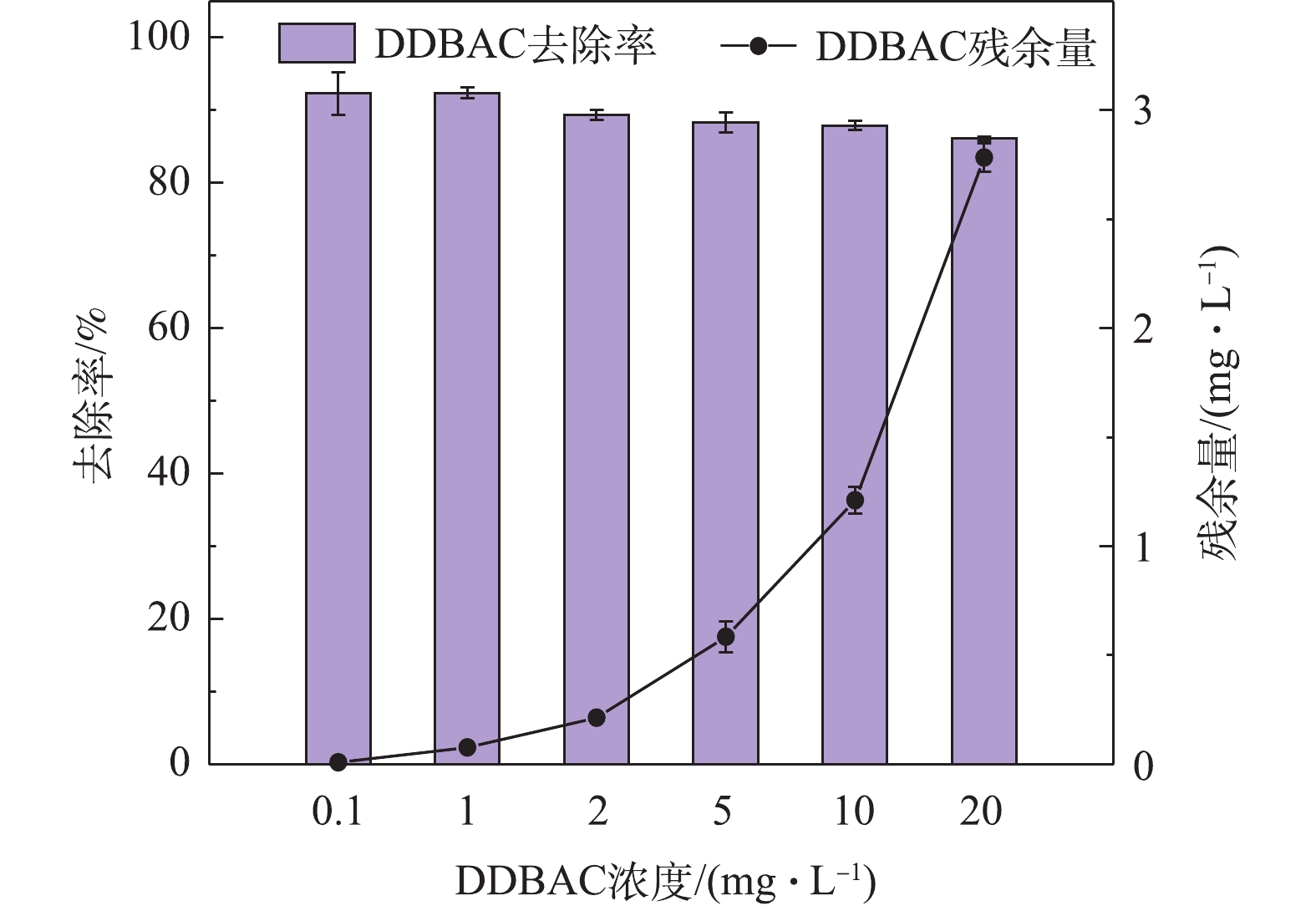
图5展示了微生物对不同浓度DDBAC的去除情况。当DDBAC的进水浓度为0.1 mg·L−1时,系统对DDBAC的去除率达到(92.30±2.97)%;当DDBAC初始浓度≥1 mg·L−1时,活性污泥微生物对DDBAC的去除潜力随着其浓度的增加而逐渐减弱,去除率由92.3%(初始浓度1 mg·L−1)降至(86.09±0.32)%(初始浓度20 mg·L−1),出水中的DDBAC浓度由(0.008±0.003)mg·L−1增加到(2.78±0.06)mg·L−1。造成此结果可能的原因是,活性污泥处理系统具有一定的容纳、消化和去除DDBAC的潜力,但是能力尚有限,当DDBAC浓度逐渐增大时,系统中的微生物不能够在有限的处理时间内将DDBAC完全去除,因此导致了出水中DDBAC的残留。当DDBAC浓度较大时,水相中残留的DDBAC将随着出水排至流域水环境中,造成河流、湖泊等地表水以及沉积物中DDBAC的积累,且DDBAC具有生物毒性,将增加水环境健康管理负担和安全用水的风险。
3. 结论
1) DDBAC能够影响污泥的耗氧率,对污泥的呼吸产生抑制作用,且其浓度越高,抑制作用越强。
2)相对于反硝化过程,DDBAC对硝化过程,尤其是氨氧化菌主导的氨氧化过程的抑制作用更加显著。当DDBAC浓度≥2.0 mg·L−1时,即能够抑制氨氮的转化过程,且浓度越高,抑制效果越明显。
3)当2 mg·L−1≤DDBAC≤10 mg·L−1时,DDBAC对脱氢酶活性为轻度抑制;DDBAC浓度为20 mg·L−1时,对脱氢酶活性为中度抑制,严重影响污泥代谢过程。
4) DDBAC对过氧化氢酶活性的抑制作用随其浓度的升高而加强,可影响微生物的呼吸和代谢过程,破坏污泥的抗氧化机制。
5)活性污泥微生物对DDBAC具有一定的去除潜力,但处理能力尚有限,出水中残留的DDBAC将增加水环境健康管理负担,提高安全用水的风险。
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 2382
- HTML全文浏览数: 1037
- PDF下载数: 1176
- 施引文献: 0





 DownLoad:
DownLoad: