聚丙烯酰胺对活性污泥特性的影响研究
Study on effect of polyacrylamine on characteristics of activated sludge
-
摘要: 高分子混凝剂PAM投加是强化污泥造粒的有效方法,但PAM的投加对活性污泥中微生物群落以及对其生化降解性能的影响尚缺乏系统性研究。为此,通过实验室小型实验,在SBR中连续投加PAM,运用FISH等微生物检测技术,研究了PAM对活性污泥的影响。在PAM投量为3 mg/L的条件下,反应器中活性污泥的生长过程与对照反应器没有根本性差别,且PAM投加后MLSS浓度和单位重量污泥的生物量均有一定增大,污泥的沉降性能也得到改善。FISH检测的结果表明,与对照反应器相比,总细菌、亚硝化菌、硝化菌的个数分别由9.1×105、1.8×105和1.1×105 CFU/mL增长到1.0×106、2.0×105和1.2×105 CFU/mL,说明PAM没有对各种菌落的生长产生不利影响。连续运行80 d的结果也表明,投加PAM的反应器中COD和氨氮的去除均有所改善。Abstract: The addition of polymer coagulant PAM is an effective way to enhance particle pelletization. However, it is still unclear whether PAM has influence on the characteristics of activated sludge and its biological degradation process. A laboratory experiment was thus conducted to investigate the effect of continuous PAM addition on the activated sludge using a sets of SBR and application of fluorescence in situ hybridization (FISH) and other microbiological techniques. As a result, no significant difference was noticed in the growth of activated sludge between the two SBR, with PAM dosage of 3 mg/L.Moreover, certain increase in both the MLSS density and the amout of microorganism in the weight of sludge per unit was found by PAM addition. The experiment with FISH also indicates that the numbers of total bacteria, ammonia-oxidizing bacteria and nitrifiers were detected as 1.0×106, 2.0×105 and 1.2×105 CFU/mL, respectively, in the SBR with PAM addition, comparing with 9.1×105, 1.8×105 and 1.1×105CFU/mL, respectively in the SBR with no PAM addition,which shows that PAM addition did not impose negative impacts on microbial growth. Slight improvement was also noticed for the removal of COD and NH+4-N in the process of 80 d operation with PAM addition.
-
Key words:
- polyacrylamine /
- activated sludge /
- fluorescence in situ hybridization (FISH) /
- SBR
-
目前,我国每年大约产生3.0×107 t城市污泥[1],且随着中国污水处理厂的升级和扩建,城市污泥产量每年以13%的速率递增[2]。大量城市污泥的处理与处置是我国目前亟待解决的环境问题。食品处理厂剩余污泥中有机物含量高,营养丰富,大多为蛋白质、多糖、脂肪等[3],不含有毒有害物质。目前,我国食品污泥处理的方法主要有厌氧消化、好氧发酵、焚烧、卫生填埋、土地利用等。另一方面,我国农作物秸秆近20种,年产量约7.0×108 t,约占世界秸秆总量的25%。随着社会经济迅速发展和人口的增加,农作物秸秆总量将以每年5%~10%的速度递增[4]。然而,目前农村地区的秸秆利用率还很低,存在秸秆焚烧、随意丢弃等现象[5]。好氧堆肥方法成本低、无害化程度高、处理量大、处理后的产品可作为有机肥,在农业生产上具有广阔的应用前景。利用食品厂污水处理剩余污泥与农作物秸秆进行混合好氧堆肥,既解决了剩余污泥问题与农作物秸秆问题,又可得到生物有机肥[6],适用于农业大田生产、果树种植及园林绿化,对减轻长期施用化肥造成的农田环境污染、增加土壤肥力[7-8]、提高农产品品质及增加农业收入,具有良好的经济、环境和社会效益。
在堆肥初期,由于堆体中土著微生物数量较少,微生物活性较低,存在着发酵周期长、堆肥效率慢等缺点。复合微生物菌剂因微生物间的协同作用,可有效调节堆肥原料中的菌群结构,加快堆肥速率,缩短堆肥周期,促进堆体腐熟[9]。目前,我国已在堆肥微生物菌剂的研究方面取得了一定进展。ZHAO Y等[10]从堆肥中筛出4株嗜热放线菌,制成一种微生物菌剂,能够提高堆体腐熟程度,缩短了堆肥周期。XI B D等[11]在堆肥过程中投加了一种复合微生物菌剂,增加堆肥过程中优势菌的多样性,提高堆肥效率。ZHOU C等[12]在堆肥过程中接种了一种由放线菌、哈茨木霉、米曲霉等组成的复合微生物菌剂,缩短了堆肥周期,提高了木质纤维的降解。
与液态微生物菌剂相比,固态菌剂中的微生物更易存活,保存时间长,保存成本低,运输方便,更适用于大规模的生产与应用。针对食品厂剩余污泥与秸秆的组成,本研究筛选出5株优势芽孢杆菌,研制出一种固态微生物菌剂。本研究首先以活菌数和芽孢率为评价依据,优化固态微生物菌剂制备过程中的关键影响因素,在此基础上,通过正交实验获得最佳固态微生物菌剂的制备方法,最后,通过比较不同保存时间固态微生物菌剂的实际堆肥效果,研究固态微生物菌剂的稳定性,为其工业化生产提供依据。
1. 材料与方法
1.1 实验材料
1.1.1 实验材料
实验用脱水污泥为某食品厂污水处理剩余污泥,玉米秸秆购自河南郑州。营养肉汤培养基购自青岛海博生物技术有限公司。
1.1.2 堆肥反应器
堆肥反应器为聚丙烯塑料箱(560 mm×360 mm×325 mm),总容积为65 L,曝气泵底部间歇供氧,每12 h曝气1次,曝气1 h,曝气量为0.3 L·(L·min)−1,并通过距离箱底高约10 cm的多孔筛板实现均匀供氧。当堆体温度高于55 ℃时,每天翻堆1次。
1.2 实验方法
1.2.1 菌株来源
本研究用于制备固态微生物菌剂的菌株为实验室已有5株芽孢杆菌,编号分别为ZX5、ZX6、GX2、GX5和GX9,其获得方法如下:以食品厂污水处理剩余污泥为堆肥原料、市售玉米秸秆为辅料,二者的添加比例分别为60%和40%,再加入5%江苏省无锡市某区含落叶的表层土壤;所得混合物料共计30 kg,混合物的含水率为60%±5%,碳氮比(C/N比)为25±5,混合均匀后,装入堆肥反应器中,持续曝气,定期翻堆,进行好氧堆肥;当堆体温度维持35 ℃和55 ℃达7 d左右时,分别从堆体中心和四周取5个等量堆肥样品,混匀后,依次进行微生物的初筛、复筛及分离纯化,进而获得上述菌株。
将5株芽孢杆菌分别接种至高温灭菌后的营养肉汤培养基中,接种量为1.0×107 CFU·mL−1。ZX5和ZX6的培养温度为35 ℃,培养1~2 d;GX2、GX5和GX9的培养温度为50 ℃,培养1~2 d。将获得的不同菌株的发酵液按1∶7∶617∶295∶443的比例混合,制成复合微生物菌液,备用。
1.2.2 固态微生物菌剂的影响因素研究
载体筛选。分别选择秸秆、炭化秸秆、腐熟物料、褐煤作为载体,将其研磨,过30目筛网,121 ℃灭菌30 min,然后放在105 ℃烘箱中烘干备用。将复合微生物菌液与载体按照5:1的比例混匀,放在35 ℃烘箱中烘干。将制备好的微生物菌剂室温下密封干燥保藏30 d后,测定菌剂中活菌数及芽孢率。
海藻糖含量。以腐熟物料作为载体,将其研磨,过30目筛网,121 ℃灭菌30 min,然后放在105 ℃烘箱中烘干备用。在复合微生物菌液中投加0%、4%、8%、12%、16%和20%的海藻糖,混匀后,再与载体按照5∶1的比例混匀,放在35 ℃烘箱中烘干。将制备好的微生物菌剂室温下密封干燥保藏30 d后,测定菌剂中活菌数及芽孢率。
含水率。以腐熟物料作为载体,将其研磨,过30目筛网,121 ℃灭菌30 min,然后放在105 ℃烘箱中烘干备用。将复合微生物菌液与载体按照5∶1的比例混匀,放在35 ℃烘箱中烘至含水率为15%、20%、25%、30%、35%和40%。将制备好的微生物菌剂室温下密封干燥保藏30 d后,测定菌剂中活菌数及芽孢率。
1.2.3 固态微生物菌剂影响因素的正交实验
根据单因素实验的结果,进行3因素3水平正交实验(见表1),将制备好的微生物菌剂室温下密封干燥保藏30 d后,测定菌剂中活菌数及芽孢率。研究载体种类、海藻糖浓度及含水率对菌剂保存效果的影响,进而获得最佳菌剂制备条件。
表 1 正交实验设计Table 1. Design of the orthogonal experiment水平 因素 (A)载体 (B)海藻糖浓度/% (C)含水率/% 1 炭化秸秆 0 15 2 秸秆 4 20 3 腐熟物料 8 25 1.2.4 所得固态微生物菌剂的堆肥效果
以食品厂污水处理剩余污泥为堆肥原料,市售玉米秸秆为辅料(二者重量之比为6:4),获得用于好氧堆肥的混合物料,其组成性质如表2所示。将15 kg物料装入堆肥箱中进行好氧堆肥,具体操作同1.2.1节,共4个堆肥箱,其中,对照实验不添加任何菌剂,记为CK,添加新鲜固态复合微生物菌剂的实验记为ZJ,添加室温下保存30 d菌剂的实验记为ZJ-30,添加室温下保存60 d菌剂的实验记为ZJ-60,研究所得固态微生物菌剂保存时间对堆肥效果的影响。微生物菌剂直接添加在堆肥原料中,菌剂添加量均为堆体湿重的0.3%,整个堆肥过程持续10 d。
表 2 混合物料的物化性质Table 2. Physicochemical properties of the mixture有机质含量/% 凯氏氮/(mg·g−1) C/N pH 含水率/% 蛔虫死亡率/% 粪大肠菌群数/(MPN·g−1) 种子发芽指数/% 半纤维素含量/(mg·g−1) 纤维素含量/(mg·g−1) 木质素含量/(mg·g−1) 87.29±0.12 19.24±0.36 26.32±0.51 6.35±0.32 67.24±2.23 45.14±1.59 2.0×103 44.79±1.53 238.1±5.54 318.2±4.48 59.4±2.32 1.3 分析测试项目与方法
菌剂中有效活菌数采用平板计数法[13]测定。芽孢率的测定:将菌液在70 ℃下加热10 min,再利用平板计数法检测菌剂中的芽孢数,其芽孢率[14]计算见式(1)。
w=m1m0×100% (1) 式中:w为芽孢率,%;m0为灭菌前菌落数,CFU·g−1;m1为加热后菌落数,CFU·g−1。
粪大肠菌群数和蛔虫死亡率均按照生物有机肥标准(NY 884-2012)中标准方法测定。种子发芽指数(GI)测定方法:堆肥样品按水∶物料=10∶1浸提,160 r·min−1振荡1 h后过滤,吸取5 mL滤液于铺有滤纸的培养皿中,滤纸上放置10颗籽粒饱满、均匀一致的种子,25 ℃下培养72 h后,测定种子的根长,同时用去离子水做空白对照,种子发芽指数计算[15]见式(2)。
RGI=q1l1q0l0×100% (2) 式中:RGI为种子发芽指数,%;q0为去离子水处理的种子发芽率,%;q1为堆肥浸提液处理的种子发芽率,%;l0为去离子水处理的种子根长,cm;l1为堆肥浸提液处理的种子根长,cm。
有机质含量采用重铬酸钾氧化法(NY 525-2012)测定。有机碳含量=有机质含量/1.724(氧化系数)[16]。凯氏氮(TKN)采用凯氏定氮法[17]测定。C/N比为有机碳含量/凯氏氮含量[18]。pH的测定是将样品与水按1∶10的比例混合,浸提1 h后,采用pH计法[19]测定。含水率采用烘箱干燥法[20]测定。
半纤维素、纤维素、木质素的测定:采用ANKOM A2000i型全自动纤维分析仪测定堆体中半纤维素、纤维素和木质素的含量[21]。
堆体温度每隔12 h测定1次,在堆体的中央和四周均匀测温5次,取平均值[17]。
2. 结果分析
2.1 固态微生物菌剂的制备技术研究
活菌数是衡量菌剂质量的有效指标[22]。芽孢杆菌是一种革兰氏阳性菌,在其生长的一定阶段内,会在营养细胞内形成一个圆形、卵圆形或圆柱形的休眠体,即为芽孢[23]。芽孢能适应不良环境,对高温、紫外线、干燥、电离辐射和很多有毒的化学物质都有很强的抵抗性[24],而在条件适宜时又可转变为营养细胞,从事正常的代谢活动,因此,在测定活菌数的同时,可观察芽孢率的变化情况[25]。
2.1.1 载体类型对活菌数及芽胞率的影响
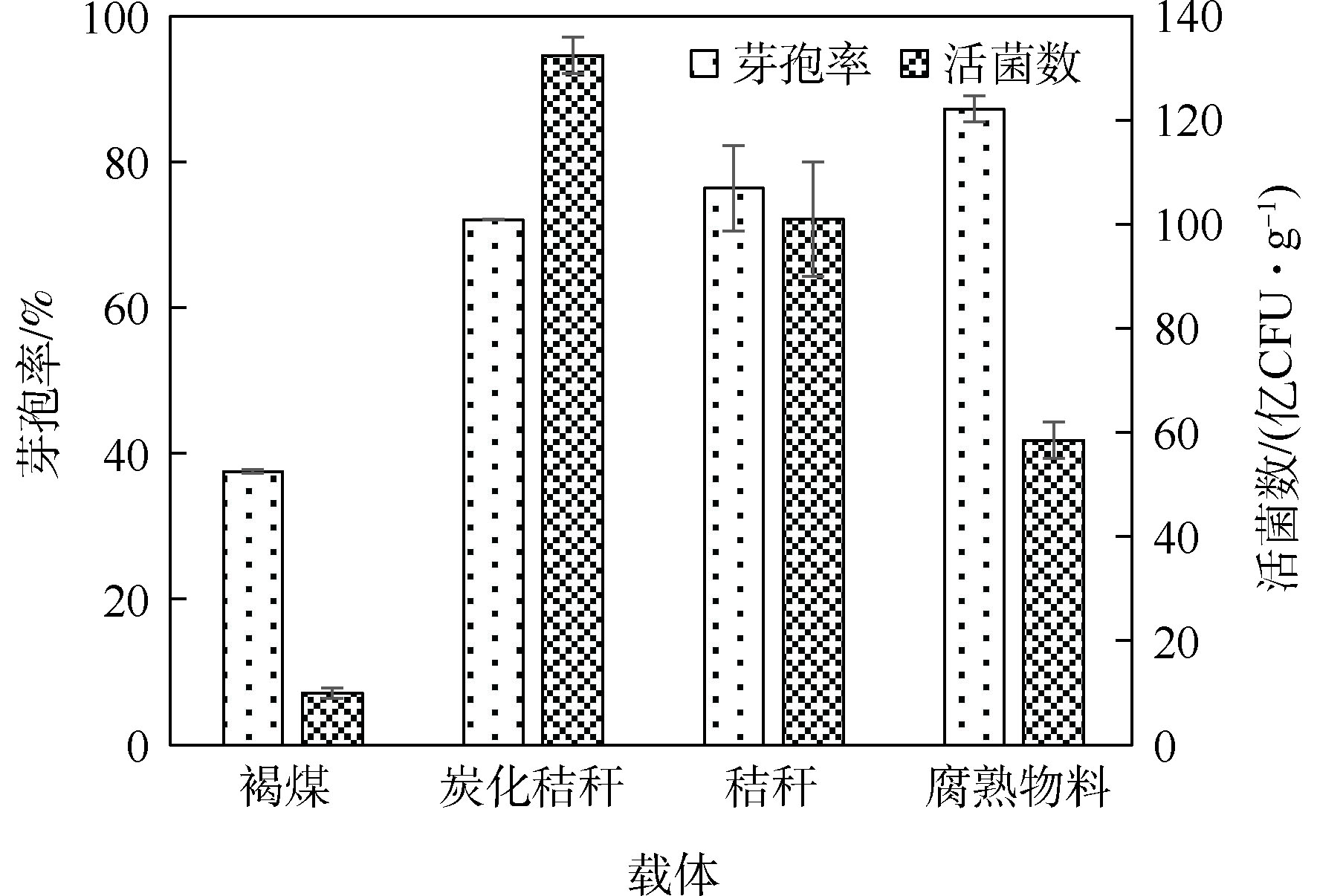
由图1可知,4种载体对菌剂活菌数及芽孢率的影响顺序依次为腐熟物料>秸秆>炭化秸秆>褐煤,其中,以腐熟物料作为载体的菌剂活菌数和芽孢率最高,以秸秆为载体的菌剂次之。以腐熟物料、秸秆和炭化秸秆为载体的菌剂保藏30 d后,活菌数均较高,均为5.0×109 CFU·g−1以上,芽孢率则分别为87.3%、76.4%和72.1%。以褐煤为载体的菌剂保藏30 d后,活菌数仅为1.0×109 CFU·g−1,芽孢率仅为37.5%,不利于长期保藏。因此,选择腐熟物料、秸秆和炭化秸秆作为正交实验时的3个水平。由于腐熟物料更易得,以下研究均以腐熟物料为固态微生物菌剂的载体。
2.1.2 海藻糖浓度对活菌数及芽胞率的影响
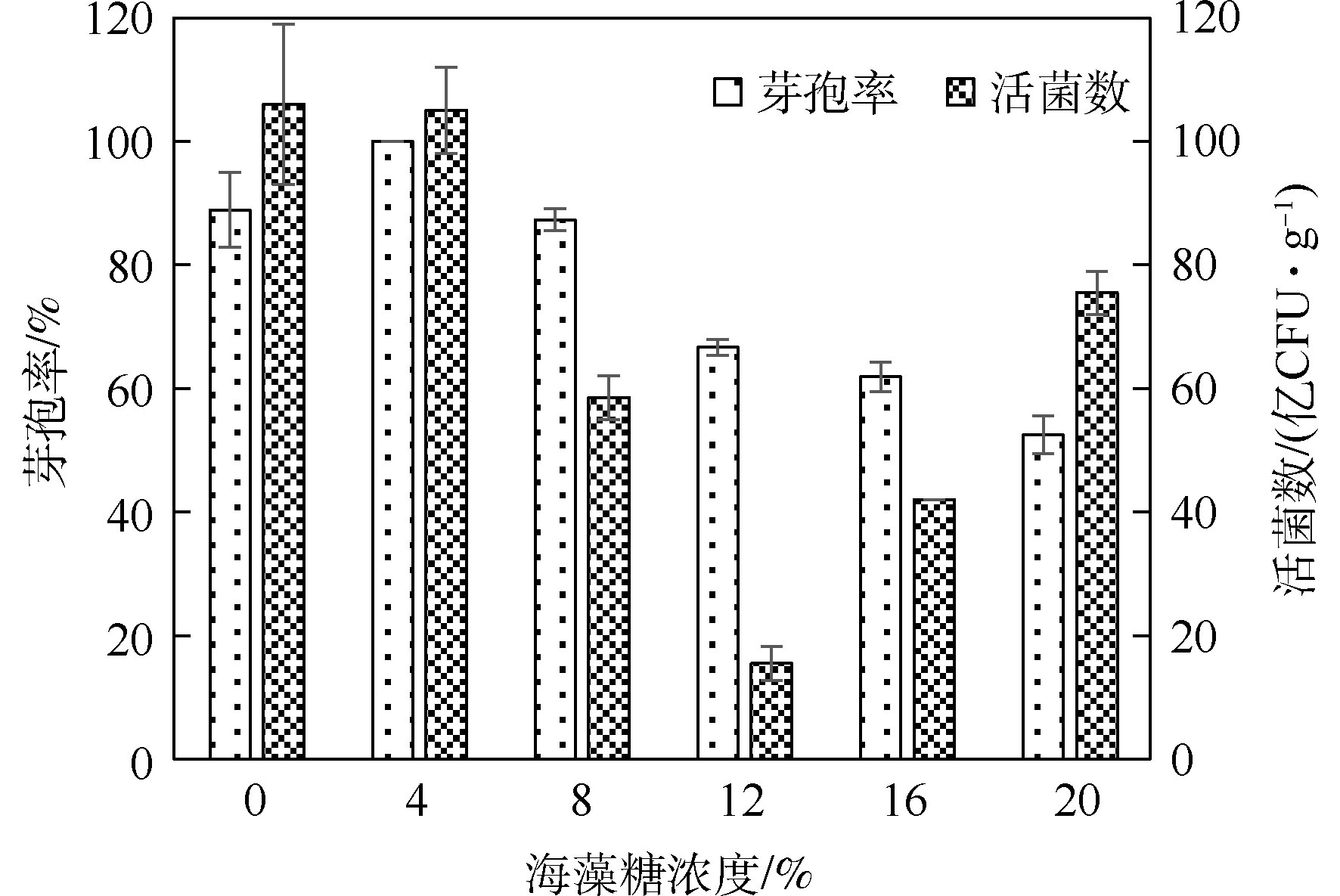
研究表明,在高温、冷冻、干燥等恶劣条件下,海藻糖能够在细胞表面形成独特的保护膜,有效保护生物分子不被破坏,提高微生物菌剂的存活率,延长微生物菌剂的储存期[26]。由图2可知,随着海藻糖浓度的提高,菌剂中芽孢率呈现先上升后下降的趋势,而活菌数含量却呈现先下降后上升的趋势。海藻糖也是生物体储备的碳源[27],可以被微生物所利用。海藻糖浓度过高时,微生物可利用的碳源增多,芽孢就会萌发,转化为营养细胞而过早失活,降低菌剂的使用效果。因此,当海藻糖投加量为12%~20%时,菌剂中芽孢率较低。当海藻糖投加量为0%~8%时,菌剂中芽孢率较高,且此时菌剂中活菌数也较高,均为5.0×109 CFU·g−1以上。故选用0%、4%、8%作为正交实验中3个水平。
2.1.3 含水率对活菌数及芽胞率的影响
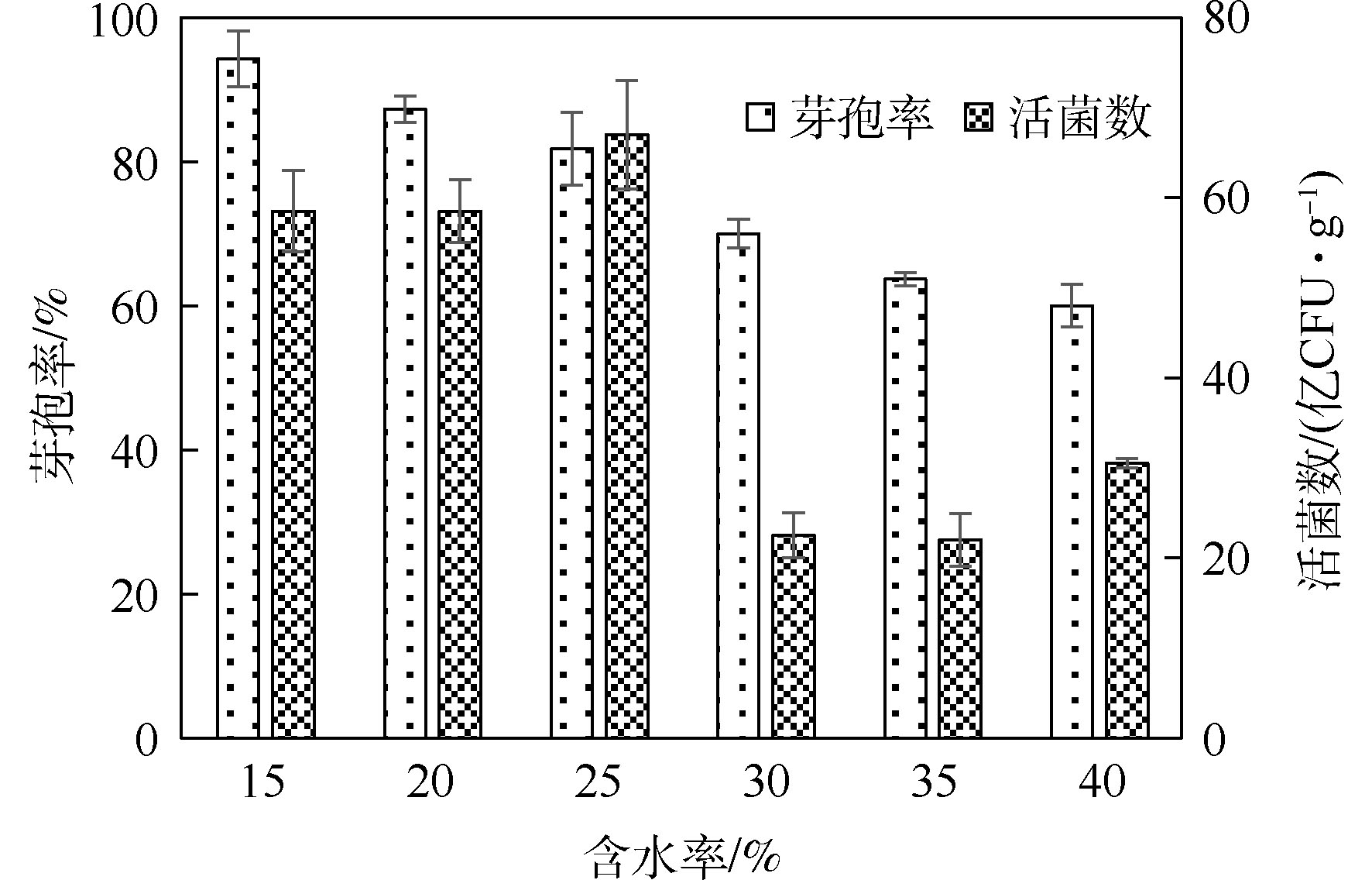
固态菌剂的含水率会显著影响菌剂的保存效果,含水率越高,越不利于菌剂的长期保藏[28]。菌剂中含水率越高,越促进芽孢的萌发,使其转化为营养细胞,不利于长期保存。此外,菌剂中含水率越高,越易在保存过程中发霉,滋生出大量杂菌[29]。由图3可知,随着固态菌剂最终含水率的提高,菌剂中芽孢率在不断降低。含水率为15%~25%时,菌剂中芽孢率较高,高于80%;活菌数高于5.0×109 CFU·g−1。当菌剂的含水率为30%~40%时,菌剂中芽孢率较低,均在70%以下,活菌数也较低,不利于菌剂的长期保存。这可能是由于菌剂中水分适宜,会促进芽孢萌发,使其转换为营养细胞,降低了菌剂中的芽孢率;在长期保存过程中,营养细胞失活,降低了菌剂中活菌数。减少含水率,更有利于菌剂的长期保存[30]。故选用15%、20%、25%作为正交实验中的3个水平。
2.1.4 正交实验
在上述单因素实验的基础上,按表3进行了影响因素的正交实验。对正交实验结果进行分析,结果如表4所示。从活菌数来看,载体、海藻糖浓度和含水率对其影响程度分别为海藻糖浓度(B)>含水率(C)>载体(A),菌剂最佳配方为B2C1A3。从芽孢率来看,载体、海藻糖浓度和含水率对其影响程度分别为含水率(C)>载体(A)>海藻糖浓度(B),菌剂最佳配方为C1A3B2。综合考虑活菌数和芽孢率的变化情况,最佳菌剂配方为:以腐熟物料作为载体,投加4%的海藻糖,含水率为15%。
表 3 正交实验结果Table 3. Results of the orthogonal experiment名称 载体(A) 海藻糖8.5含量(B) 含水率(C) 活菌数/8.5(亿CFU·g−1) 芽孢率/% 1 1 1 1 24.2±0.57 100 2 1 2 2 37.5±2.12 93.4±1.48 3 1 3 3 26.4±0.85 43.2±0.21 4 2 1 3 30.0±2.83 91.6±1.27 5 2 2 1 35.0±1.41 64.3±0.14 6 2 3 2 40.5±3.54 95.0±0.42 7 3 1 2 24.0±0.57 63.5±1.13 8 3 2 3 44.0±1.41 100 9 3 3 1 38.5±2.55 100 表 4 正交实验数据分析Table 4. Analysis of the orthogonal experiment指标 因素 K1 K2 K3 R 活菌数 载体(A) 29.37 35.17 35.50 6.13 海藻糖浓度(B) 26.07 38.83 35.13 12.76 含水率(C) 36.23 35.33 28.47 7.76 芽孢率 载体(A) 78.87 83.63 87.83 8.96 海藻糖浓度(B) 85.03 85.90 79.40 6.50 含水率(C) 98.33 95.00 57.00 41.33 对上述正交实验结果进行了方差分析,结果如表5所示。在置信区间ɑ=0.05范围内,载体、海藻糖浓度和含水率对活菌数影响显著。在置信区间ɑ=0.05范围内,含水率对芽孢率影响显著,而载体和海藻糖浓度对芽孢率影响不显著。因此,确定腐熟物料作为载体,投加4%的海藻糖,含水率为15%作为最佳菌剂配方。
表 5 方差分析结果Table 5. Variance analysis of the orthogonal experiment指标 因素 偏差平方和 自由度 F比 F临界值 显著性 活菌数 载体(A) 71.37 2 22.66 19 有 海藻糖浓度(B) 258.88 2 82.18 19 有 含水率(C) 108.28 2 34.37 19 有 误差 3.15 2 芽孢率 载体(A) 120.76 2 0.83 19 海藻糖浓度(B) 74.74 2 0.51 19 含水率(C) 3163.56 2 21.63 19 有 误差 146.27 2 2.2 固态微生物菌剂的堆肥效果研究
2.2.1 堆体温度的变化
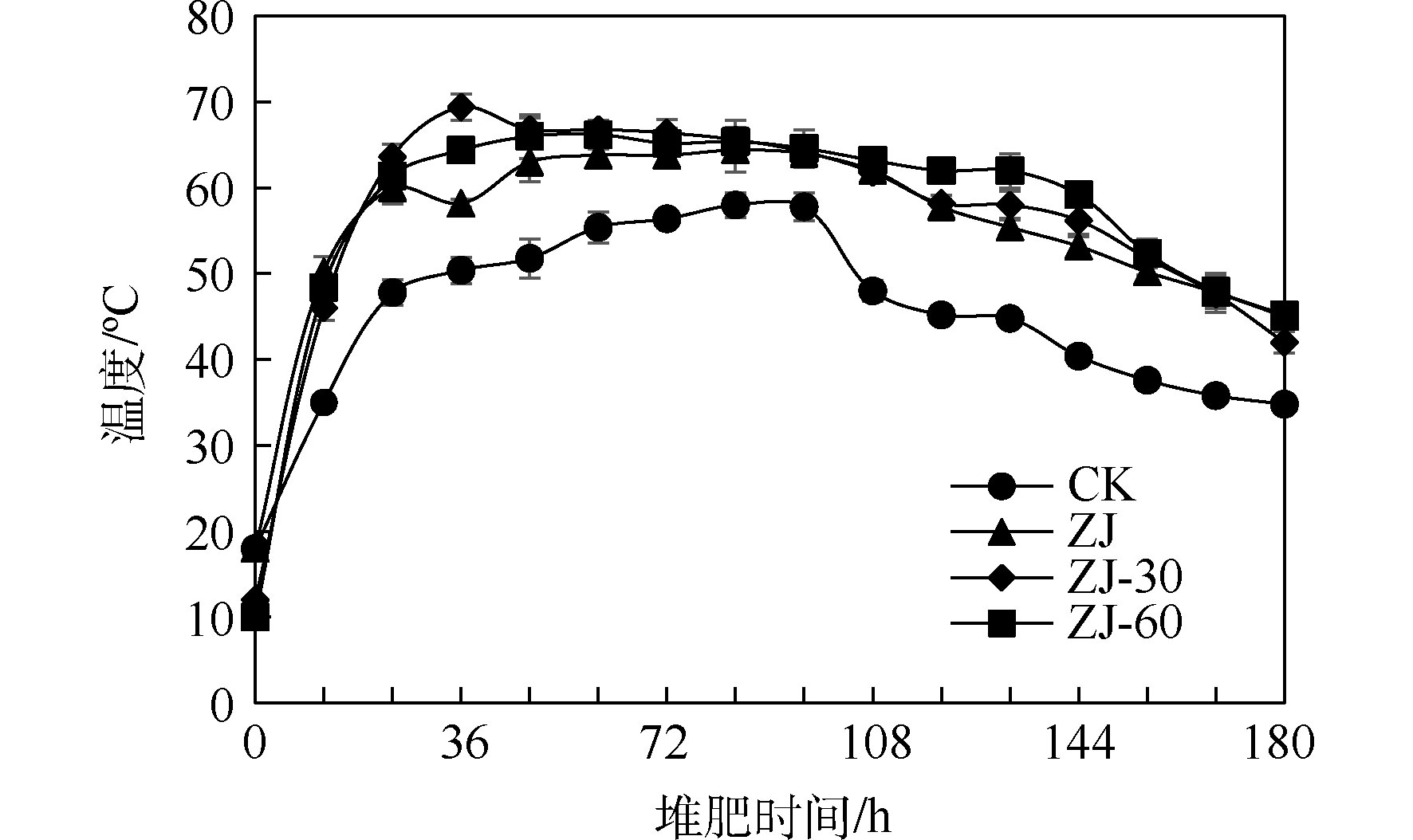
以空白为对照,分别将新鲜固态微生物菌剂、保藏30 d的菌剂以及保藏60 d的菌剂用于好氧堆肥,研究菌剂保存时间对堆肥效果的影响。随着保存时间的延长,4个堆体中温度变化如图4所示。
结果表明,堆体CK在60 h左右进入55 ℃以上的高温期,在84 h左右出现堆体最高温度,为58 ℃,55 ℃以上的高温持续时间为40 h,50 ℃以上的持续时间为70 h。堆体ZJ在18 h左右进入55 ℃以上的高温期,在60 h左右出现堆体最高温度,为64 ℃,55 ℃以上的高温持续时间为114 h,50 ℃以上的持续时间为144 h。堆体ZJ-30在18 h左右进入55 ℃以上的高温期,在36 h左右出现堆体最高温度,为69 ℃,55 ℃以上的高温持续时间为129 h,50 ℃以上的持续时间为147 h。堆体ZJ-60在19 h左右进入55 ℃以上的高温期,在48 h左右出现堆体最高温度,为66 ℃,55 ℃以上的高温持续时间为132 h,50 ℃以上的持续时间为148 h。相比于堆体CK,堆体ZJ、堆体ZJ-30、堆体ZJ-60分别提前了42、42和41 h进入高温阶段,高温持续时间分别延长了74、89和92 h,50 ℃以上的持续时间分别延长了74、77和78 h。比复合微生物菌剂PTCMA,自制复合微生物菌剂能够提前7 d进入高温期,且最高温度可提高2~7 ℃[31];比复合菌剂F12,能够延长高温持续时间,其50 ℃以上的持续时间可延长2 d[32]。
可见,尽管固态菌剂的保存时间不同,但均能在18~19 h左右促使堆体进入高温期,随着菌剂保存时间的延长,堆体的高温持续时间略有增加,而50 ℃以上的持续时间变化不大。该固态菌剂的性能稳定,保存一段时间后依旧能使堆体快速进入高温阶段,且持续时间长,可使堆体达到无害化要求。
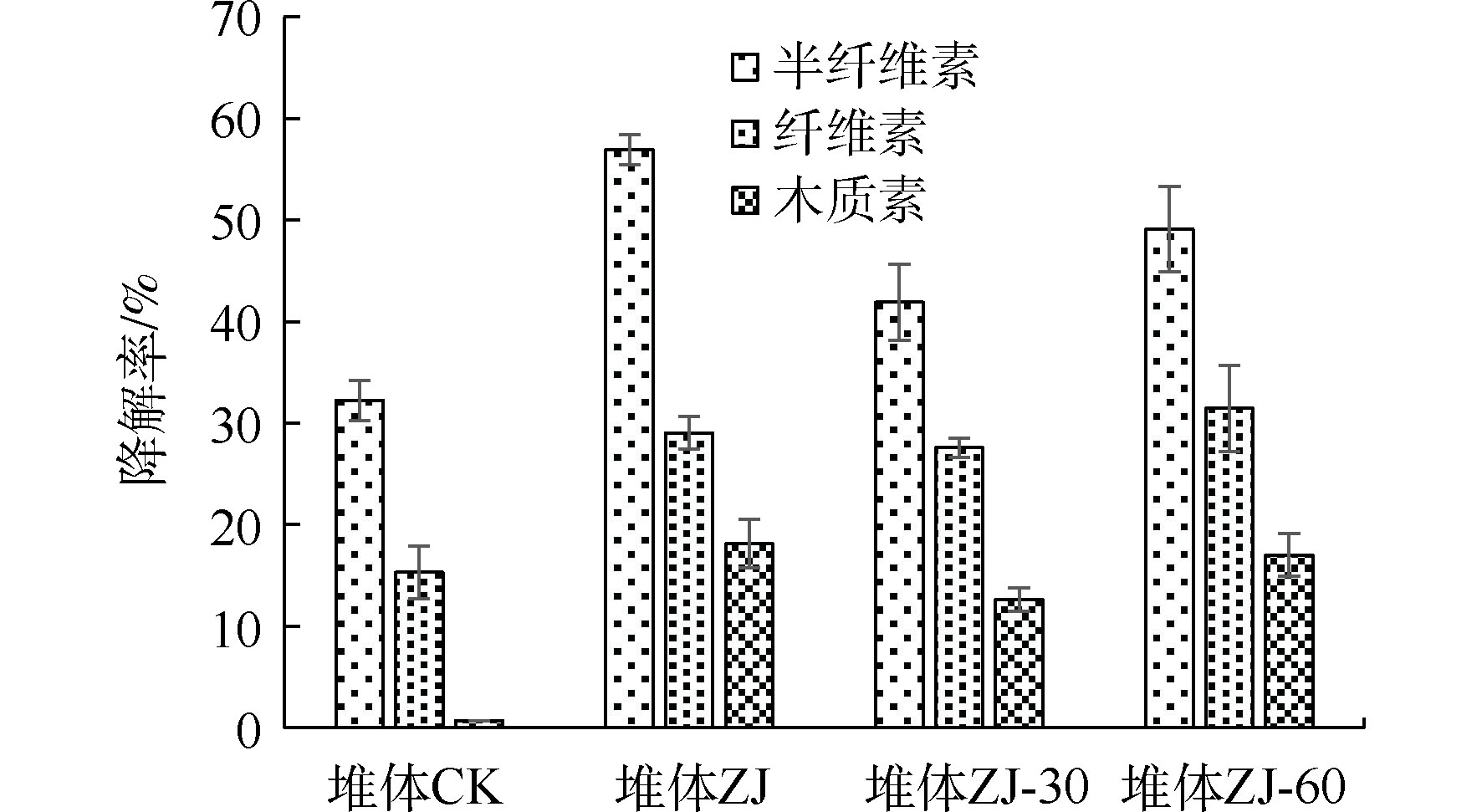
2.2.2 半纤维素、纤维素和木质素的降解率
如图5所示,堆肥结束后,堆体中半纤维素、纤维素和木质素含量均有所降低。半纤维素最易降解,而木质素是一种高分子有机化合物,结构非常复杂[31],较难降解,因此,堆体中半纤维素降解率最高,木质素降解率最低。
由于添加自制复合微生物菌剂中含有芽孢杆菌,在堆肥高温阶段具有良好的活性,可有效促进木质素和纤维素的降解;优化堆体的微生物生态,可激活并促进木质纤维素降解菌的生长繁殖;且投加菌剂的堆体中高温持续时间更长,有助于促进堆体中半纤维素、纤维素和木质素的降解[33-34]。因此,与空白相比,不同保藏时间的菌剂依旧能够有效促进堆体中半纤维素、纤维素和木质素的降解。随着菌剂保存时间的延长,堆体中半纤维素降解率分别为56.93%、41.91%、49.10%;纤维素降解率分别为29.03%、27.58%、31.45%;木质素降解率分别为18.12%、12.64%、17.02%;堆体中半纤维素、纤维素和木质素的降解率呈现先下降后上升的变化规律。
与复合微生物菌剂DN-1堆肥12 d后相比,自制复合微生物菌剂提高了半纤维素和木质素的降解率,半纤维素降解率分别提高了58.27%、16.51%、36.50%;木质素降解率分别提高了87.97%、31.12%、76.56%[35]。与复合微生物菌剂HJ相比,自制复合微生物菌剂提高了堆体中半纤维素和纤维素降解率,半纤维素降解率分别提高了244.61%、153.69%、197.22%,纤维素降解率分别提高了28.51%、22.09%、39.22%[36]。自制固态微生物菌剂具有较好的降解木质纤维素的能力。
2.2.3 堆肥产品的品质
堆肥结束后,测定了各堆体中有机质含量、TKN、C/N、pH、含水率、蛔虫死亡率、粪大肠菌群数和GI,其结果如表6所示。
表 6 4个堆体的堆肥产品品质Table 6. Quality of composting products of four piles名称 有机质含量/% 凯氏氮/(mg·g−1) C/N pH 含水率/% 蛔虫死亡率/% 粪大肠菌群数/(MPN·g−1) 种子发芽指数/% CK 66.30±3.38 25.53±0.06 15.06±0.04 7.95±0.18 58.43±1.56 84.36±0.68 200±10 59.72±1.02 ZJ 58.67±1.17 28.64±0.15 11.89±0.04 8.07±0.06 52.97±0.66 95.98±1.07 4 85.89±0.75 ZJ-30 58.19±0.23 32.47±0.04 10.40±0.01 8.12±0.04 54.84±0.31 96.82±0.79 9 91.73±1.82 ZJ-60 57.56±0.94 31.55±0.16 10.59±0.04 8.12±0.11 58.28±1.32 96.54±0.65 4 89.38±0.71 堆肥结束后,堆体CK、堆体ZJ、堆体ZJ-30、堆体ZJ-60中有机质含量分别为66.30%、58.67%、58.19%、57.56%,其降解率分别为24.05%、32.79%、33.34%、34.06%。投加菌剂的堆体中有机质降解率更高,这是由于其高温持续时间更长,嗜热菌活动剧烈,使得更多有机物被降解。与放线菌菌剂[33]相比,自制复合微生物菌剂提高了有机质降解率,降解率分别提高了20.55%、22.57%、25.22%。与堆肥初期(表2)相比,4个堆体中TKN即全氮含量均呈现上升趋势,添加自制复合微生物菌剂的3个堆体中全氮含量上升幅度更大。与勾云龙[37]制备的复合微生物菌剂相比,自制复合微生物菌剂中氮素含量分别提高了153.03%、255.93%、231.33%。表明自制复合微生物菌剂能够有效促进对氮素的吸收与利用,有利于堆肥产品保氮,提高堆肥产品的养分含量[12]。
采用不同保存时间的固态微生物菌剂进行好氧堆肥,所得堆肥产品的理化性质包括有机质及TKN的含量等均相差不大;蛔虫死亡率均大于95%,粪大肠菌群数均低于100 MPN·g−1,满足我国生物有机肥标准(NY 884-2012)中的生物学指标要求。同时,C/N比低于20,种子发芽指数均高于85%,完全腐熟。与常温微生物菌剂(36 d时C/N比低于20,30 d时GI高于50%)[19]相比,自制复合微生物菌剂能够缩短堆肥周期,提高堆体腐熟度。然而,由于高温持续时间不足,对照堆肥产品的卫生状况未能达到上述标准,且种子发芽指数较低。
3. 结论
1)固态微生物菌剂的最佳制备条件为以腐熟物料作为载体,投加4%的海藻糖,含水率为15%。
2)随保存时间的延长,固态微生物菌剂的性能稳定,均能在18~19 h左右促使堆体进入高温期,并有效促进堆体中半纤维素、纤维素和木质素的降解,所得堆肥产品的理化性质相差也不大,各项指标均符合我国生物有机肥标准(NY 884-2012)中的相关要求,且种子发芽指数均高于85%,完全腐熟。
3)所得固态微生物菌剂的制备方法有助于菌剂的大规模生产与应用,具有较为重要的实践价值。
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 2149
- HTML全文浏览数: 1112
- PDF下载数: 1093
- 施引文献: 0



 DownLoad:
DownLoad: