黄孢原毛平革菌处理染料废水过程中细胞结构损伤效应研究
Damaging effects of dye wastewater on cell ultra-structures of Phanerochaete chrysosporium
-
摘要: 利用透射电子显微镜观察分析白腐真菌(黄孢原毛平革菌)在处理染料废水活性艳红X-3B过程中,染料和盐度对黄孢原毛平革菌的细胞结构产生的毒性作用。结果表明:活性艳红X3B染料对黄孢原毛平革菌产生生物毒性作用,且随着染料浓度的增加,细胞受损伤程度不断加深。加入100 mg/L的染料活性艳红X-3B后,黄孢原毛平革菌菌丝细胞形态发生变化,出现质壁分离现象;染料浓度进一步加大,菌丝细胞超微结构受到损伤逐渐严重。染料废水中的盐度对黄孢原毛平革菌细胞也会造成损伤,且损伤程度随盐度增大而增大。NaCl浓度为3 g/L时,菌丝细胞发生质壁分离;而当NaCl加入量高于8 g/L时,细胞膜受损,线粒体、细胞核呈现空泡化,表现为受到不可逆的损伤。染料和盐双因子对黄孢原毛平革菌细胞的损伤效应表现为其损伤程度与单因子作用一致,且染料的影响作用占主导。Abstract: When white rot fungi (Phanerochaete chrysosporium) degraded dyes wastewater, dyes wastewater may have an adverse influence on the cellular ultrastructure. The damaging effects of reactive brilliant red X-3B (RBR X-3B) and salt concentration on the cells of Phanerochaete chrysosporium were studied by transmission electron microscope. The results show that after exposure to RBR X-3B for 10 days, the ultrastructure of hyphal cells are evidently damaged, RBR X-3B induce plasma membrane separating from cellular wall at 100 mg/L. The above adverse effects become more evident with the increase of RBR X-3B concentration. NaCl in dyes wastewater has the same influence on the cells of Phanerochaete chrysosporium. When NaCl concentration is 3 g/L, plasma membrane separating from cellular wall is induced. In the range of high NaCl concentration (c≥8 g/L), the damage of the cells to Phanerochaete chrysosporium is remarkable. The damaging effects from both RBR X-3B and salt concentration act in accord with them from each of them solely, and the influence from dyes is more dominant.
-
随着人口的增长,城市化的加剧以及现代采矿业和冶金业的快速发展,含高浓度硫酸盐酸性矿山废水(acidic mine drainage, AMD)引起的污染问题亟待解决[1-2]。硫酸盐还原菌(SRB)通常指能够通过异化作用进行硫酸盐(
SO2−4 )还原的一类细菌[3-4]。用SRB来处理矿山废水具有成本低、效果好、无二次污染等优点,已成为现今研究的热点课题。王正辉[5]利用硫酸盐还原菌处理高浓度硫酸盐化工废水,当COD、硫酸盐浓度分别从5 000、700 mg·L−1逐渐增高至13 000、1 700 mg·L−1时,经过对污泥的驯化,启动结束时反应器的硫酸盐负荷率为5 kg·(m3·d)−1,硫酸盐平均去除率达到85%以上;ELKE等[6]应用两相工艺处理制革废水,当进水硫酸盐浓度为1 180 mg·L−1时,硫酸盐去除率为58%(单相厌氧工艺去除率为30%)。
在生物法处理AMD废水的研究中,生物固定化方法具有稳定性好、易于实现连续化和处理效率高等优点,受到了国内外学者的广泛关注[7-11]。SRB包埋固定化技术,除了上述优点外,还可以解决其沉降性能差的问题,减少了SRB的流失。同时,细菌包埋后,可以降低重金属沉淀的分离难度,便于实现重金属的回收[12]。林洁松[13]利用内聚甲醇固定化硫酸盐还原菌小球去除硫酸盐和铬,在初始Gr6+浓度为100 mg·L−1和初始
SO2−4 浓度为200 mg·L−1时,最大去除率分别为99.40%和97.49%;胡希佳等[14]采用聚乙二烯醇-硼酸二次交联方法,将SRB进行局部包埋固定化处理
SO2−4 ,在
SO2−4 进水浓度为2 000 mg·L−1时,生物滤池对硫酸盐的还原率稳定在85%以上。
然而,上述实验一般只考察了较低负荷的进水
SO2−4 浓度和包埋后处理情况,对于散泥培养、细菌包埋、包埋填料活性恢复连续过程以及高负荷条件下的废水处理却鲜有报道。本研究将纤维丝活性填料驯化富集(中试)阶段、活性污泥包埋填料驯化富集实验阶段联系起来,详细考察了硫酸盐还原菌、活性包埋填料的驯化情况及其生物群落分析,为工程实际提供技术参考。
1. 材料与方法
1.1 污泥富集培养材料与方法
污泥来自实验室原有的硫酸盐还原生物反应器,实验采用间歇[15-16]、小空间厌氧移动床[17]培养方式进行高效富集培养及挂膜。
实验用水为人工配制的模拟硫酸盐有机废水。市政自来水静置12 h后,投加乳酸钠、无水硫酸钠、氯化铵、硫酸二氢钾和微量重金属离子[18]。实验用原水中的有机物为乳酸钠,保证原水的COD:
SO2−4 ≥2∶1,以满足硫酸盐还原过程对有机碳源的需求。在实验各阶段用水中,保持HRT=10 h、COD∶N∶P=200∶5∶1、DO≤0.5 mg·L−1、pH=7.0~7.5、温度为30~35 ℃[19-20]。
1.2 污泥富集培养实验装置
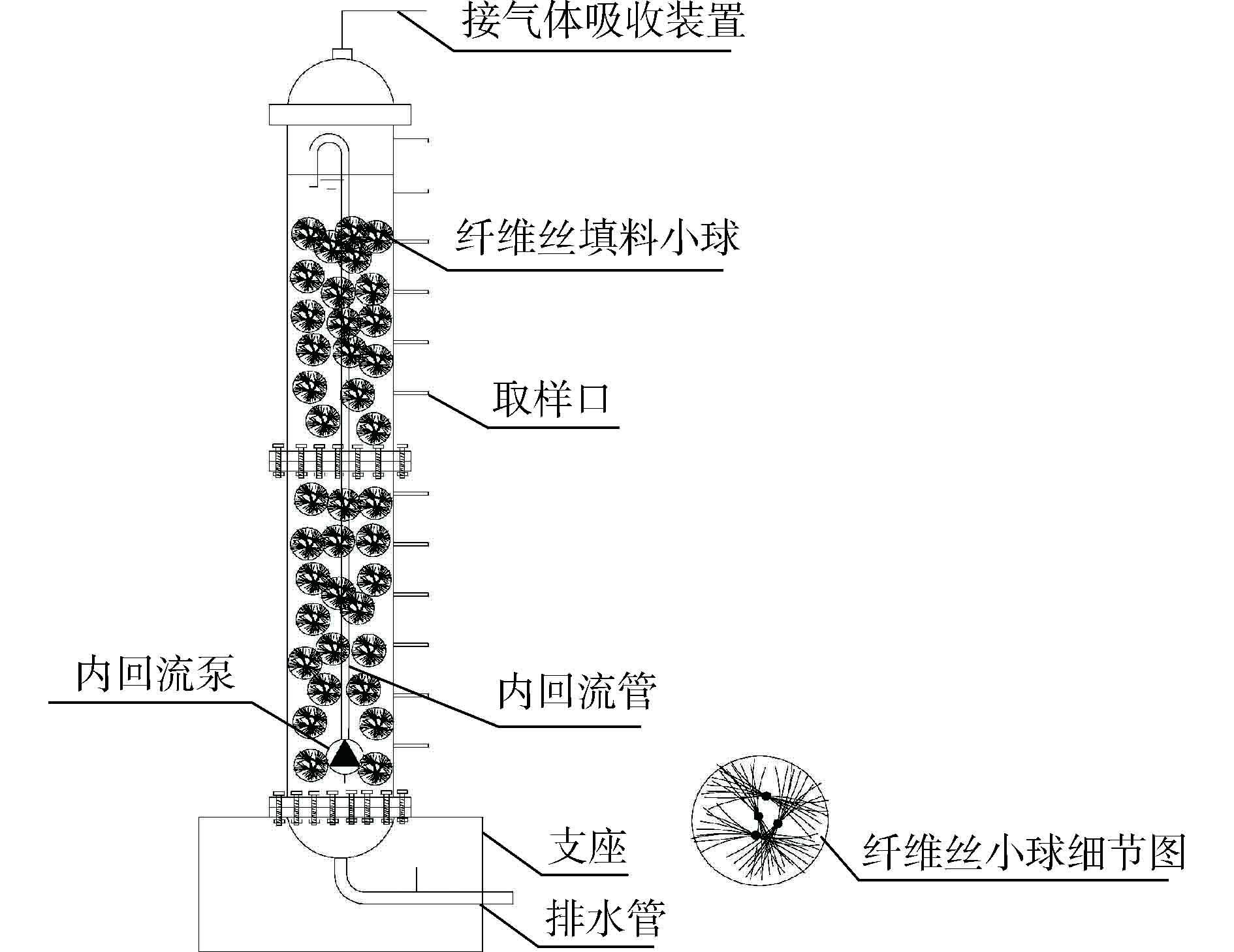
本实验中纤维丝填料的高效富集培养采用间歇培养的方式,培养过程中间歇投加底物,每隔5 d左右,更换上清液,并注入晾晒后的自来水,实验装置如图1所示。反应器总有效体积为200 L,顶部设有尾气(H2S)回收装置,反应器一侧每隔10 cm设有取样口。反应器内部装满纤维丝小球。内设回流装置Q回流泵≈2 000 L·h−1,强化反应器内溶液混合,使溶液达到均质的效果。反应器内部设有加温棒,外部设有保温棉,以保证内部恒温30~35 ℃,维持SRB适宜的环境。
1.3 包埋填料的制备与应用
取培养后污泥,后经隔膜压滤机(景津环保股份有限公司)浓缩成含水率为85%的污泥,与质量分数20%PVA凝胶混合,污泥与PVA体积比为1∶4,以保证其适宜的生物量及稠度。同时,经响应面[21]分析,加入添加剂活性炭18.32 g·L−1, 碳酸钙38.30 g·L−1,放入过饱和的硼酸溶液交联2 h,再用晾晒的自来水清洗后,放入70 g·L−1的硫酸钠溶液中,二次交联4 h,期间不断地调节交联剂的pH在3.5以下。将包埋液均匀涂在圆柱体网格条子上(长50 cm,直径1.0 cm),然后切成1 cm长度的小圆柱体[22-25],如图2(a)所示。包埋体活性恢复采用500 mL摇瓶于培养箱中培养,如图2(b)所示,包埋填料填充率为20%。实验采用人工模拟硫酸盐有机废水,COD为4 000 mg·L−1,
SO2−4 为2 000 mg·L−1,其他条件同上。
1.4 常规指标及检测方法
所有检测项目均采用国家规定的标准方法[26],采用铬酸钡分光光度法(CdCl2除S2−干扰)测定
SO2−4 浓度;采用联华科技的5B-3F型COD快速测定仪测定COD;采用pHS-2C型pH计测定pH,测定前用标准pH缓冲溶液进行校正;采用手提式DO测定仪测定溶解氧(DO);采用温度计测定水温; 采用高通量测序方法进行微生物种群鉴定。
2. 结果与讨论
2.1 硫酸盐还原菌富集培养结果及分析
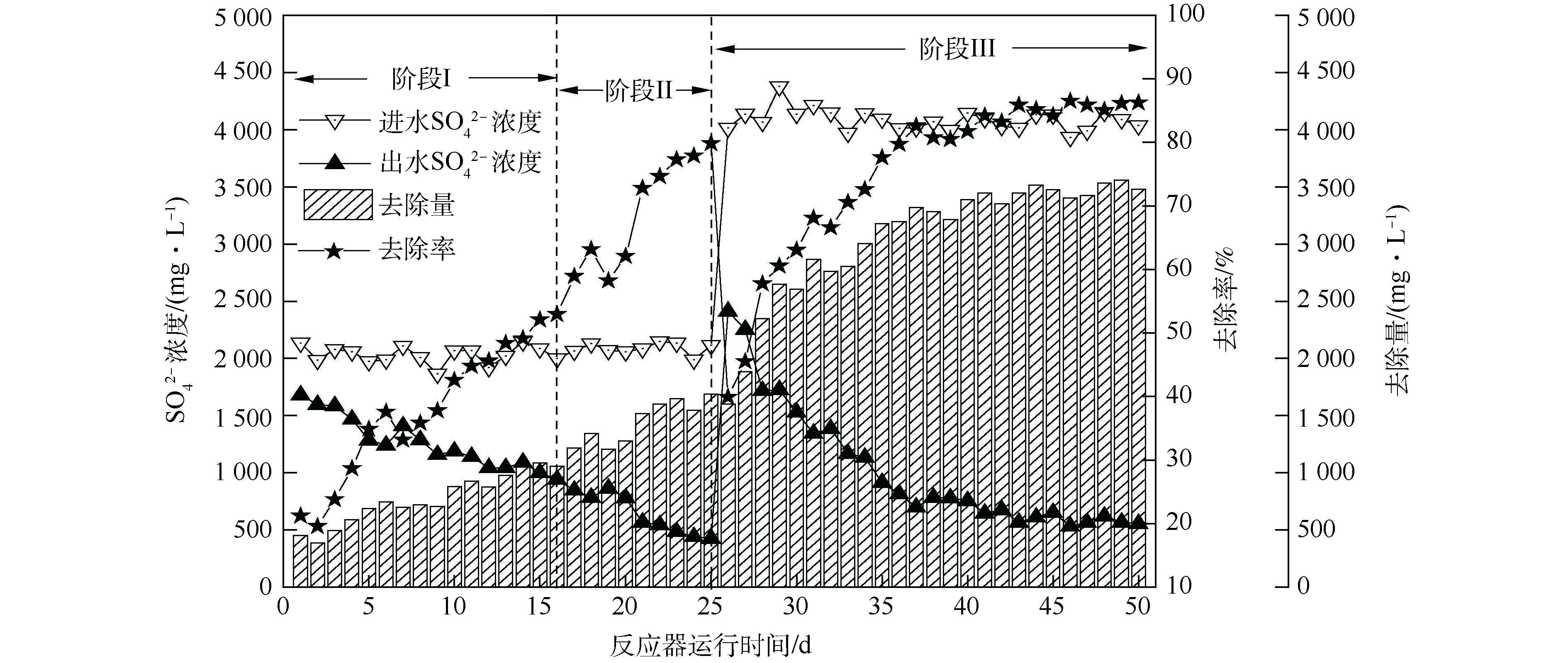
由图3可知,生物反应器启动后,硫酸盐去除量整体呈上升趋势。初始硫酸盐去除率在20%左右,随着运行时间的延长,硫酸盐去除率逐渐升高,出水
SO2−4 浓度整体呈现出下降趋势,经过25 d的驯化富集,硫酸盐去除率可达79.83%。
第Ⅰ阶段(0~16 d),由于起始生物量过少[14],硫酸盐还原速率呈缓慢上升趋势;第Ⅱ阶段(17~25 d),在生物量增多、生物还原性能提高的双重作用下,硫酸盐还原速率由52.93%迅速上升至79.83%;在第Ⅲ阶段(25~50 d),提高
SO2−4 负荷至4 000 mg·L−1后,在第26天,硫酸盐还原速率为39.93%,随运行时间的延长,硫酸盐还原菌逐渐适应高负荷的
SO2−4 ,在第37天,系统的
SO2−4 还原率稳定在80.47%~86.48%。杨宏等[17]发现,当进水
SO2−4 质量浓度由1 500~2 250 mg·L−1增至2 500 mg·L−1时,由于S2−大量积累,抑制了SRB活性,
SO2−4 还原率由87.48%~88.89%下降至78.77%。而本研究进水
SO2−4 为4 000 mg·L−1时,连续运行26 d,富集培养过程中未发现硫化物、乙酸等代谢产物对其的抑制。
关于硫化物的毒性抑制浓度各类报道相差甚远,其值为100~1 100 mg·L−1,这可能与实验条件、污泥驯化方法与驯化程度、反应器类型等因素有关[27]。本研究可能由于反应器中内回流泵的搅拌作用(Q泵≈2 000 L·h−1),加快H2S气体排出系统,使系统内游离H2S的浓度大大减弱,减轻了S2−对微生物的抑制作用,为SRB处理高浓度硫酸盐废水提供了理论参考。
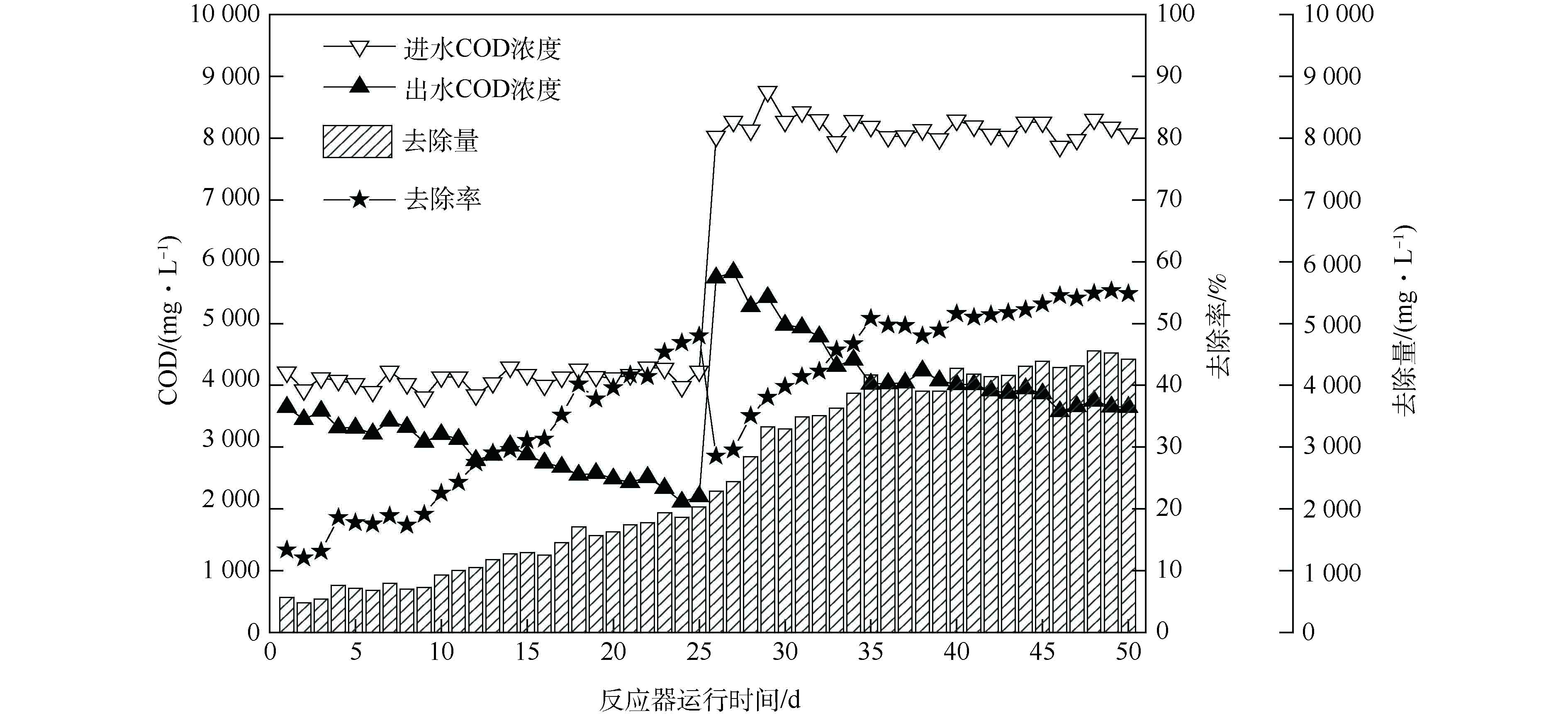
图4为硫酸盐还原菌富集培养过程中COD的逐日变化情况。随着反应时间的延长,COD的去除量有所增加,去除率基本稳定在50%左右。提高进水COD负荷至8 000 mg·L−1,去除量虽然明显提升,但去除率仍然维持在较低水平,最终去除率稳定在53.17%~55.31%。
2.2 高通量测序分析
2.2.1 微生物群落丰富度和多样性分析
通过对2组样品16S rRNA基因文库高通量测序,污泥原样(MC-1)与筛选后的污泥样品(MC-2) alpha多样性指标计算结果见表1。
表 1 多样性指标计算结果Table 1. Calculation results of diversity index样品编号 Sequence个数 Chao1指数 ACE指数 Shannon指数 Simpson指数 覆盖率 MC-1 84 964 28 757.03 69 448.43 3.92 0.10 0.96 MC-2 73 096 54 620.06 128 278.84 2.09 0.36 0.97 由表1可知,2个样品的文库覆盖率均大于0.95,表明测序深度已经基本覆盖到样本中所有的物种。MC-2的Chao1和ACE指数均大于MC-1,并且MC-2具有较大的OTU数,即高效富集培养后的污泥物种丰富度大于原始污泥,具有较多的物种总数。而MC-1的Shannon多样性指数和Simpson多样性指数大于MC-2,说明原污泥群落多样性高于富集培养后的污泥。由此可知,多样性指数较高的原始污泥群落各种之间个体分配较均匀,而筛选后的污泥各种之间生物量差异较大,但优势种群明显。
2.2.2 菌群变化分析
硫酸盐还原菌(sulfate reducing bacteria,SRB)通常指能够通过异化型硫酸盐还原过程进行硫酸盐代谢的一类细菌[28]。在目前已经掌握的硫酸盐还原菌中,属于革兰氏阴性的主要菌属有脱硫叶菌属(Desulfobulbus)、脱硫微菌属(Desulfomicrobium)、脱硫单胞菌属(Desulfomonas)、脱硫菌属(Desulfobacter)、脱硫弧菌属(Desulfovibrio)、脱硫杆菌属(Desulfobacterium)、脱硫球菌属(Desulfococcus)、脱硫念珠菌属(Desulfomonile)、脱硫螺旋体属(Desulfonema)、脱硫八叠菌属(Desulfosarcina);革兰氏阳性菌的代表菌属有脱硫肠状菌属(Desulfotomaculum);嗜热细菌的代表属有热脱硫杆菌(Thermodesulfo bacterium);嗜热古细菌的代表属有古生球菌属(Archaeoglobus)[29-30]。在水处理领域常见的硫酸盐还原菌包括脱硫弧(Desulfovibrio)和脱硫微菌属(Desulfomicrobium)。
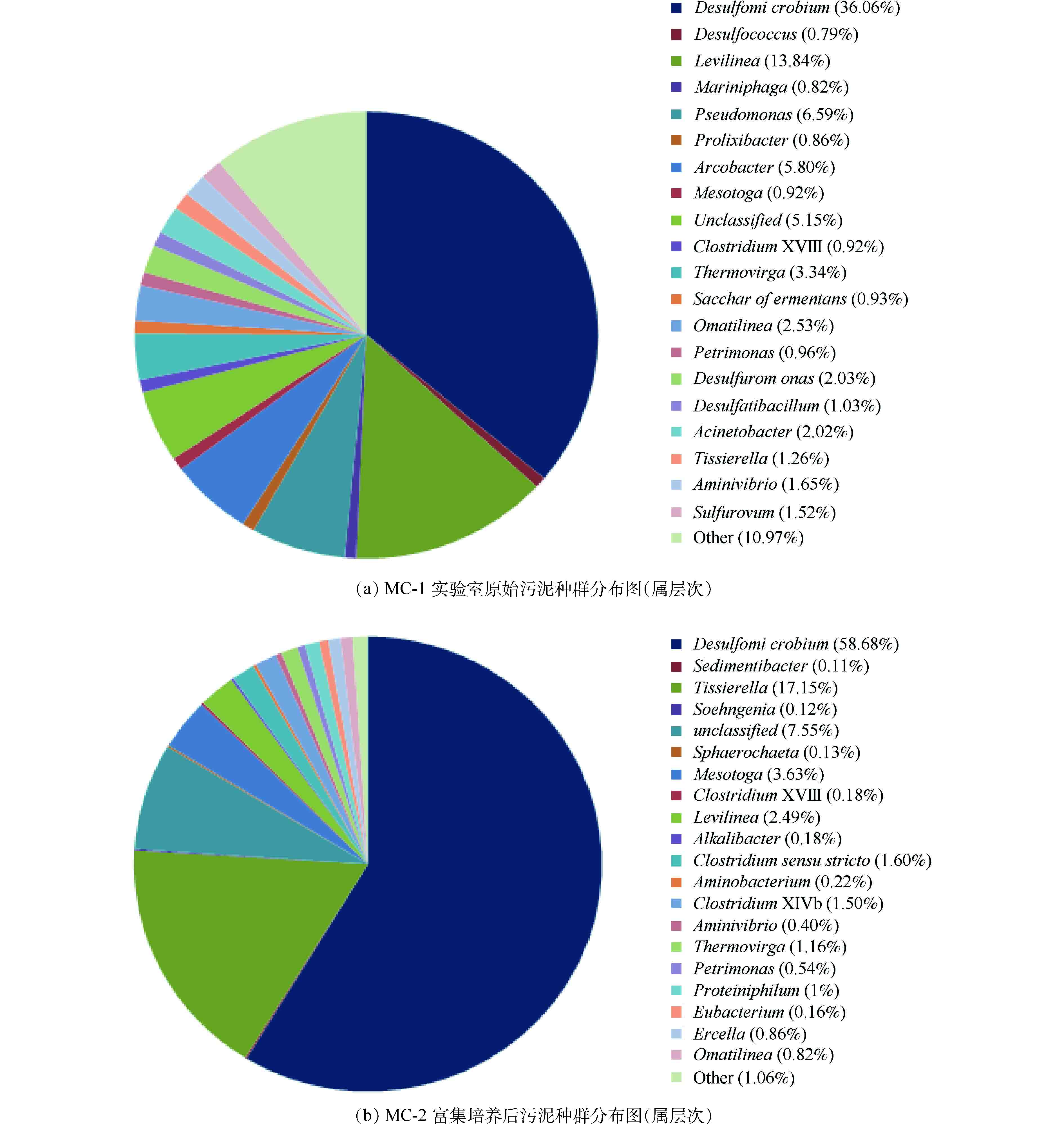
图5(a)和图5(b)表明,具有脱硫作用的I类SRB(Desulfomicrobium)与II类SRB(Desulfococcus)菌属在实验室原始污泥中比例分别为36.06%和0.79%,经过富集培养以后,Desulfomicrobium为58.68%,Desulfococcus未检出,证明了硫酸盐还原菌的富集,为后续包埋提供了菌源。
富集培养后Desulfomicrobium依旧是优势菌种,而Desulfococcus等比例下降。究其原因,是由于ASRB(利用乙酸的硫酸盐还原菌)种群的竞争能力远远低于1-SRB(利用乳酸的硫酸盐还原菌)[31]。富集过程并未出现产甲烷菌(MPB)与硫酸盐还原菌的竞争生长现象,硫酸盐还原菌(Desulfomicrobium)占绝对优势,这与VIKAS[32]的发现(即:当ρ(COD)∶ρ(
SO2−4 )>1时,MPB就占优势的现象)有所不同。究其原因主要有两个方面。一方面是由于其热力学和动力学因素的影响[28],SRB利用COD和氢的自由能低,且对氢的竞争中,SRB占优势。另一方面,实验原水中含有较高的硫酸盐浓度,有研究[33]表明,采用高硫酸盐负荷启动硫酸盐还原菌生物反应器可以有效地抑制MPB的活性,提高SRB的活性。另外,也可能是由于1-SRB或者Desulfomicrobium菌属竞争能力远高于MPB。
2.3 含硫酸盐还原菌包埋填料富集培养结果及分析
纤维丝生物活性填料经过50 d的驯化富集培养,硫酸盐还原菌富集培养结果较好。高通量结果表明,Desulfomicrobium比例由36.06%上升至58.68%。由图3可知,还原速率由49.32 mg·(L·h)−1上升至338.7 mg·(L·h)−1。以此为菌源,进行了包埋活性驯化实验并考察了包埋填料对于饥饿环境的抵抗能力。
2.3.1 包埋填料效率恢复阶段
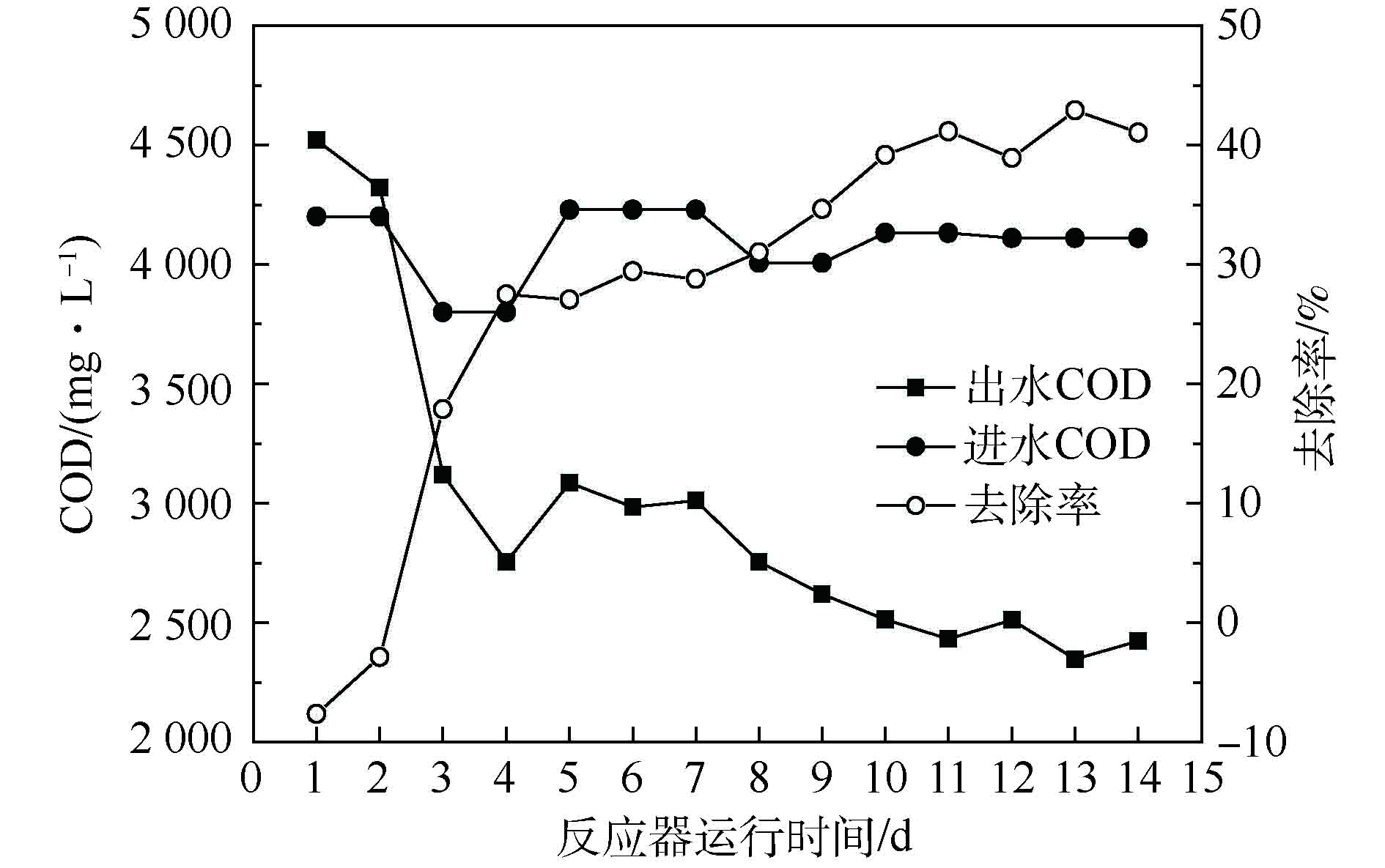
在此阶段,对包埋填料进行活性恢复。由图6可知,反应器初始启动时,出水COD高于进水COD;随反应器运行时间的延长,COD去除率稳定在38.91%~42.90%,大部分COD还未被有效利用。究其原因:一方面是因为PVA的溶出;另一方面,实验中主要功能菌为非完全氧化型硫酸盐还原菌(Desulfomicrobium),出水中含有大量的溶解性硫化物以及未被完全利用的乳酸钠和代谢产物乙酸。因此,实验可适当降低C/S[14],以减少COD的浪费,降低反应运行成本。
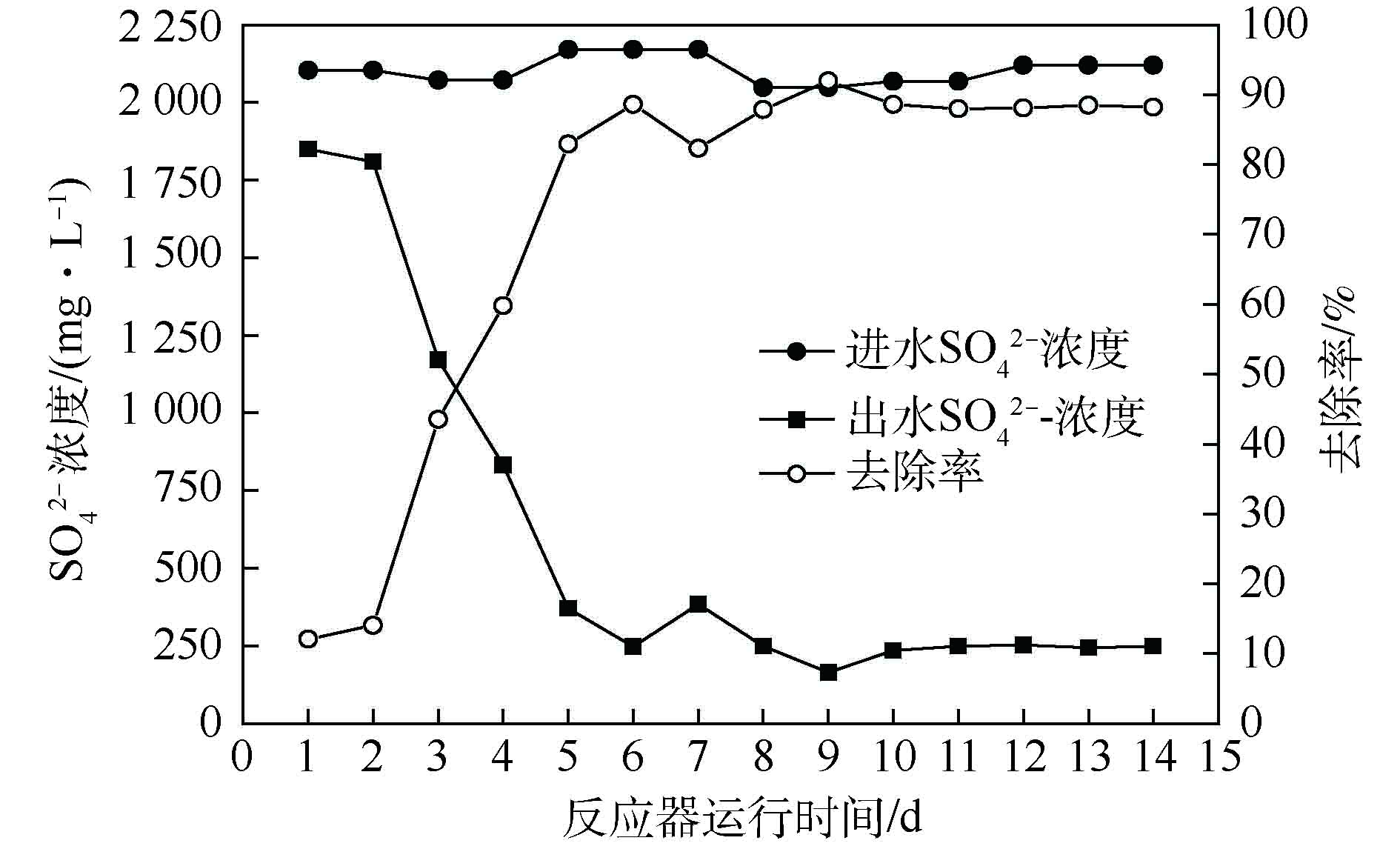
如图7所示,经过5 d的恢复培养,
SO2−4 去除率稳定在80%以上,去除率最高可达91.96%。出水硫酸盐浓度维持在250 mg·L−1以下,满足地表水环境标准,证明了包埋生物活性填料良好的工程实用性。
2.3.2 包埋生物活性填料二次恢复考察
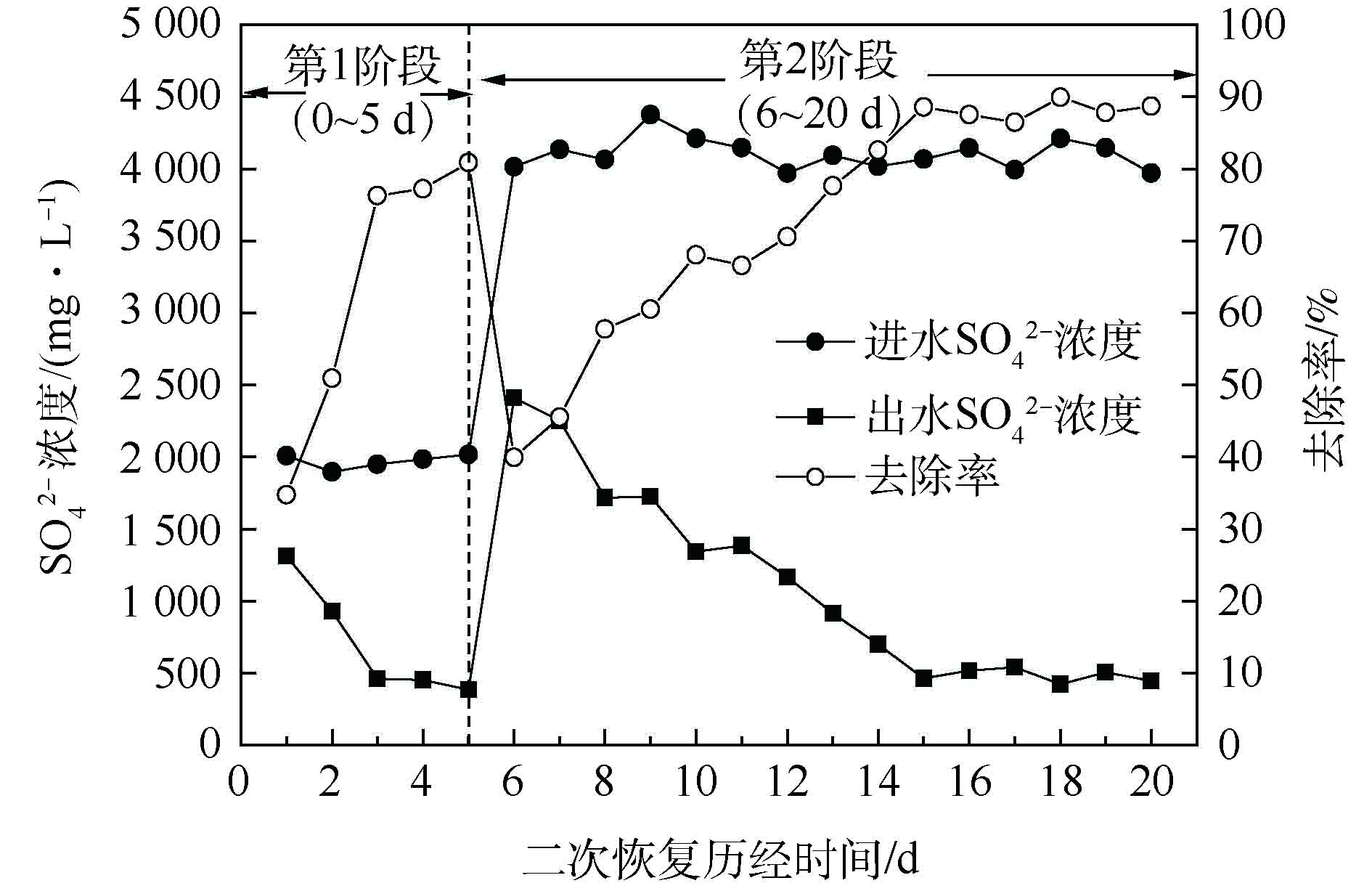
为进一步探究包埋活性填料对饥饿环境的忍耐能力,本研究将填料静置15 d后,在适宜条件下对填料进行为期20 d的二次恢复。硫酸盐还原菌富集培养过程采用硫酸盐浓度指标表征,C/S=2。结果如图8所示。实验采用间歇培养方式,控制温度在30~35 ℃、pH=7.0~7.5、DO≤0.5 mg·L−1、C/S=2、HRT=10 h。实验共分为第1阶段(0~5 d)和第2阶段(6~20 d)2个阶段。
由图8可以看出,在第1阶段,经3 d的恢复,硫酸盐还原率由34.72%上升至80.89%。为考察较高
SO2−4 负荷下包埋填料的处理情况,在第2阶段,继续提高进水
SO2−4 负荷,由2 000 mg·L−1增至4 000 mg·L−1。经过9 d的培养,硫酸盐还原率即可达到87.87%,最终出水稳定在500 mg·L−1以下。与纤维丝填料驯化富集过程相比,包埋生物活性填料具有明显的驯化时间短、处理效率高等特点。究其原因:一方面由于填料为外圆中空的圆柱状,比表面积相对较大,SEM结果也表明,包埋填料内存在大量利于传质的通道,从而保证了包埋填料与培养液的传质畅通[34];另一方面可能是由于细菌包埋后,减少了细菌的流失,为SRB提供了良好的厌氧环境。以上实验表明,该SRB活性包埋填料具有较强的生存能力和耐高负荷能力,在适宜条件下,经短期培养,即可实现恢复利用。
3. 结论
1)采用小空间厌氧移动床的运行方式,逐渐提高基质浓度,到
SO2−4 浓度为4 000 mg·L−1、COD值为8 000 mg·L−1时,实现了硫酸盐还原菌的规模化富集,
SO2−4 和COD的去除率分别稳定在80.47%~86.48%和53.17%~55.31%。
2)高通量测序结果表明,筛选后的污泥系统多样性较原污泥小,Desulfomicrobium依然为系统的优势菌种,比例从36.06%提高到58.68%,培养过程中未出现SRB与MPB种群竞争生长的现象。
3)包埋筛选富集后的活性污泥,通过短期的驯化,硫酸盐还原率可达91.96%。将静置15 d后的包埋生物活性填料进行二次恢复,最终在高负荷(
SO2−4 浓度为4 000 mg·L−1)下,硫酸盐去除率稳定在85%以上, 包埋活性污泥具有较强的还原性能及恢复性能,具有较强的工程实用性。
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 1817
- HTML全文浏览数: 969
- PDF下载数: 1515
- 施引文献: 0



 下载:
下载: