-
地表水中可溶性阳离子(Li+、Na+、NH4+、K+、Ca2+、Mg2+)是水环境监测的常规项目[1],实验室主要采用ICP-MS(电感耦合等离子体质谱仪)测定Li+,采用ICP-OES(全谱直读等离子体发射光谱仪)测定K+、Na+、Ca2+和Mg2+,采用紫外分光光度法或快速化学分析仪测定NH4+, 以上6种阳离子需要使用3种不同的方法分别测定,耗时长,易受干扰,因此建立6种阳离子高效快速的检测方法十分必要[2-3].
近年来关于一些学者采用离子色谱法测定水体阳性离子的报道,大多数是同时测定4种或是5种可溶性阳离子,如赵云[4]研究了离子色谱同时检测地表水中的Na+、K+、Mg2+、Ca2+等4种阳离子的快速测定方法,马丽萍和杨磊[5]以及王晓梅[6]建立了利用离子色谱法同时测定不同水体中K+、Na+、Ca2+、Mg2+、NH4+等5种可溶性阳离子,然而关于城市河道中6种可溶性阳离子Li+、NH4+、Na+、K+、Mg2+、Ca2+同时测定鲜有报道.
分析水体中不同阳性离子组分对了解区域内水体污染情况和生态环境状况具有重要的指导意义,本文对北京市不同区域河道水体中的阳离子变化进行了季节性监测,取样点多,检测工作量大,而利用离子色谱法最大的优点是可同时测定多种离子,节约人力成本及时间成本,同时具有样品预处理简便、检出限及检测限低、速度快、灵敏度高、无污染、稳定性好的优势,使其在地表水环境的监测中发挥了重要作用.
因此,本文为了全面、准确地监测北京市不同区域河道水体可溶性阳离子变化,建立了离子色谱法同时测定水体中Li+、Na+、NH4+、K+、Ca2+、Mg2+ 的6种阳离子的方法,分析北京市不同区域河道水体中可溶性阳离子随季节变化情况,掌握河道水体生态环境状况,有利于水体生态环境保护.
-
(1)离子色谱仪:ICS-1000型(美国戴安公司),配有DionexIonPac CG12A 阳离子保护柱(4 mm×50 mm),CS 12A 阳离子分离柱(4 mm×250 mm),CSRS 300 型抑制器(4 mm),电导检测器,AS自动进样器.
(2)超纯水仪:美国密理博公司Milli-Q超纯水仪,型号:Advantage A10,电导率为18MΩ·cm(25 ℃).
(3)甲基磺酸(MSA):质量分数为 99%,美国赛默飞世尔科技有限公司.
(4)Li+、Na+、NH4+、K+、Mg2+、Ca2+标准溶液:编号分别为GSB 04-1734—2004、GSB 04-1738—2004、GSB 04-2832—2011、GSB 04-1733—2004、GSB 04-1735—2004、GSB 04-1720—2004,质量浓度均为1000 mg·L−1,购于国家有色金属及电子材料分析测试中心.
Li+标准物质(0.762±0.034)mg·L−1,编号为BY400060,批号为B21060436;Na+标准物质(11.9±0.6)mg·L−1,编号为BY400059,批号为B21110027;NH4+标准物质(0.65±0.03)mg·L−1,编号为BY400064,批号为B21060262;K+标准物质(6.36±0.51)mg·L−1,编号为BY400061,批号为B21070308;Mg2+标准物质(5.56±0.27)mg·L−1,编号为BY400063,批号为B21080031;Ca2+标准物质(20.4±2.0)mg·L−1,编号为BY400062,批号为B21080029. 所有标准物质均购于坛墨质检科技股份有限公司.
-
进样体积25 µL ,抑制器电流59 mA ,柱流速1.00 mL·min−1,柱温保持在30 ℃,淋洗液浓度 20 mmol·L−1.
-
分别移取5mLLi+标准工作液(1000 mg·L−1)和5mLNH4+标准工作液(1000 mg·L−1)于两个50 mL容量瓶中,用水稀释后定容至标线混匀,Li+储备液和NH4+储备液浓度为100 mg·L−1,标准曲线溶液配制具体见表1.
-
本次研究分别于2021年3月、6月、9月和11月采集城区、城乡结合部和郊区水样,其中城区样品29个位点,城乡结合部11个位点,郊区9个位点,具体采样点见图1. 不同区域河水样品中阳离子(Li+、Na+、NH4+、K+、Ca2+、Mg2+)含量采用离子色谱法测定,根据区域分类求出测定数据的算术平均值.
根据《水环境监测规范》SL 219—2013 [7]要求采集地表水样品,采集样品分装于1 L聚乙烯瓶中,每瓶样品中加入pH≤2的浓HNO3并放置于4 ℃冰箱中避光保存,备用. 待测水样经0.45 μm微孔滤膜过滤,在1.2节仪器工作条件下进样测定.
-
根据1.3节溶液配制方法配制成 8个不同浓度的混合标准系列,横坐标为待测离子的质量浓度(X),纵坐标为色谱峰面积(Y),以此绘制标准工作曲线,计算线性方程和相关系数,结果如表2所示,6种阳离子在0.01—0.50 mg·L−1到5.0—100.0 mg·L−1浓度范围内具有较好的线性关系,相关系数均大于0.999.
-
以同样方法对在超纯水中加入标准溶液的样品进行测定和分析,计算加入标准溶液后7个平行结果的标准偏差,方法检出限 =3.143×标准偏差,以4倍检出限作为测定下限,测定结果如表3所示,方法检出限为0.002—0.020 mg·L−1,测定下限为0.008—0.080 mg·L−1.
-
分别对6种阳离子进行低、中、高的标准溶液7次重复测定,计算3种标准溶液6种阳离子浓度的平均值和相对标准偏差,结果如表4所示,6种阳离子在低、中和高的3种标准溶液的测定结果相对标准偏差分别为0.52%—2.98%、0.17%—1.25%和0.10%—0.94%,证明此方法灵敏度高,可满足地表水中6种阳离子的同时测定要求.
-
分别对有证标准溶液 Li+(B2103065)、Na+(B21050087)、NH4+(B2101055)、K+(B1905134)、Ca2+(B2105014)、Mg2+(B21040276)进行6次平行测定,测定结果见表5,其结果均在保证值范围,相对标准偏差为0.19%—1.73%,相对误差在-2.50%—4.38%范围之内,说明该方法具有较高的准确性。
-
将已知浓度的阳离子标准溶液加入到实际地表水水样中,并按照试验方法,进行7次重复测定,回收率结果如表6所示. 根据《水环境监测规范》SL 219—2013的相关要求,回收率要求控制在 90%—110% 之间[7],由表6 可知,样品回收率为 90.7%—107.5%,均在控制范围内,表明该方法准确度较高,可用于地表水中6种阳离子测定.
-
北京市不同区域水体水化学统计特征见表7,河水pH 值变化范围为 6. 94—9. 69,城乡结合部、城区和郊区的pH均值分别为8.31、8.74和7.55,均呈弱碱性,变异系数分别为 4.33%、4.12%和4.61%,3个区域变异系数相差不大,表明pH在不同区域水体内较稳定.
由表7可知,城乡结合部区域6种阳离子总体质量浓度为150.05 mg·L−1,高于城区和郊区25.35%和63.54%;3个区域阳离子浓度均值均为:Ca2+> Na+>Mg2+> K+>NH4+>Li+. 不同区域阳离子组分中,Ca2+含量较高,自然水体的主要离子来源包括自然因素和人为因素。自然因素主要是大气沉降和岩石矿物风化,人为因素主要是人为活动输入,当水体受岩石风化影响时阳离子组分多在 Ca2+一端[8-9].
Li+质量浓度最低,均低于各自区域阳离子总质量浓度的0.1%;NH4+浓度在各区域均呈稳定状态且低于0.2 mg·L−1,均达到地表水二类标准;Ca2+和 Na+是3个区域水体的优势离子,浓度分别为52.49—59.61 mg·L−1和23.84—58.39 mg·L−1,Ca2+和Na+质量浓度占阳离子总浓度的78.13%—85.82%,二者变异系数均值分别为28.76%和53.19%,表明Ca2+含量在流域内变化不大,水体中各类风化岩石等天然矿物含量丰富,地表水中Ca2+主要由岩石土壤等与地表水充分接触并缓慢溶解,使得3个区域Ca2+浓度明显高于其他阳离子.
城乡结合部和城区Na+质量浓度明显高于郊区,居民排放的生活污水中含有一定的Na+,有研究证明Na+作为人类活动影响水体的指标,可以指征生活污水排放对自然水体环境的影响[10-12].
-
不同水体阳离子之间的相关性以及离子来源是否一致可以通过相关性分析表示,利用 SPSS 软件分别计算郊区、城乡结合部和城区水体6种阳离子之间的 Pearson 相关性系数,用 r值表示(表8),其中,r > 0 表示两变量呈正相关,r < 0 表示两变量呈负相关.
由表8可知,郊区水体中,Na+与Ca2+、Mg2+呈显著负相关,相关系数分别是-0.889和-0.778,与Li+呈显著正相关,相关系数为0.500;Ca2+与Mg2+呈显著正相关,相关系数分别是0.932;NH4+与Li+呈显著负相关,相关系数为-0.641. 城乡结合部水体中,K+与Na+、Ca2+、Mg2+、Li+呈显著正相关,相关系数分别为0.906、0.684、0.651和0.648;Na+与Ca2+、Mg2+、Li+呈显著正相关,相关系数分别为0.755、0.793和0.614;Ca2+与Mg2+呈显著正相关,相关系数为0.862. 城区水体中,K+与Na+、Ca2+、Mg2+、Li+呈显著正相关,相关系数分别为0.841、0.478、0.551和0.658;Na+与Ca2+、Mg2+、Li+呈显著正相关,相关系数分别为0.470、0.834和0.797;Ca2+与Mg2+、Li+呈显著正相关,相关系数分别是0.639和0.289;Mg2+与Li+呈显著正相关,相关系数为0.663.
综上分析可知,城乡结合部和城区的水体各离子间相关性变化规律较为接近,说明城区水体和城乡结合部水体有较密切的联系;郊区水体中Na+与Ca2+、Mg2+呈显著负相关,而城乡结合部和城区水体Na+与Ca2+、Mg2+呈显著正相关,推测可能受到了人为因素的影响;城乡结合部、城区和郊区水体Ca2+与Mg2+呈显著正相关,说明来源于相同的岩石风化过程.
-
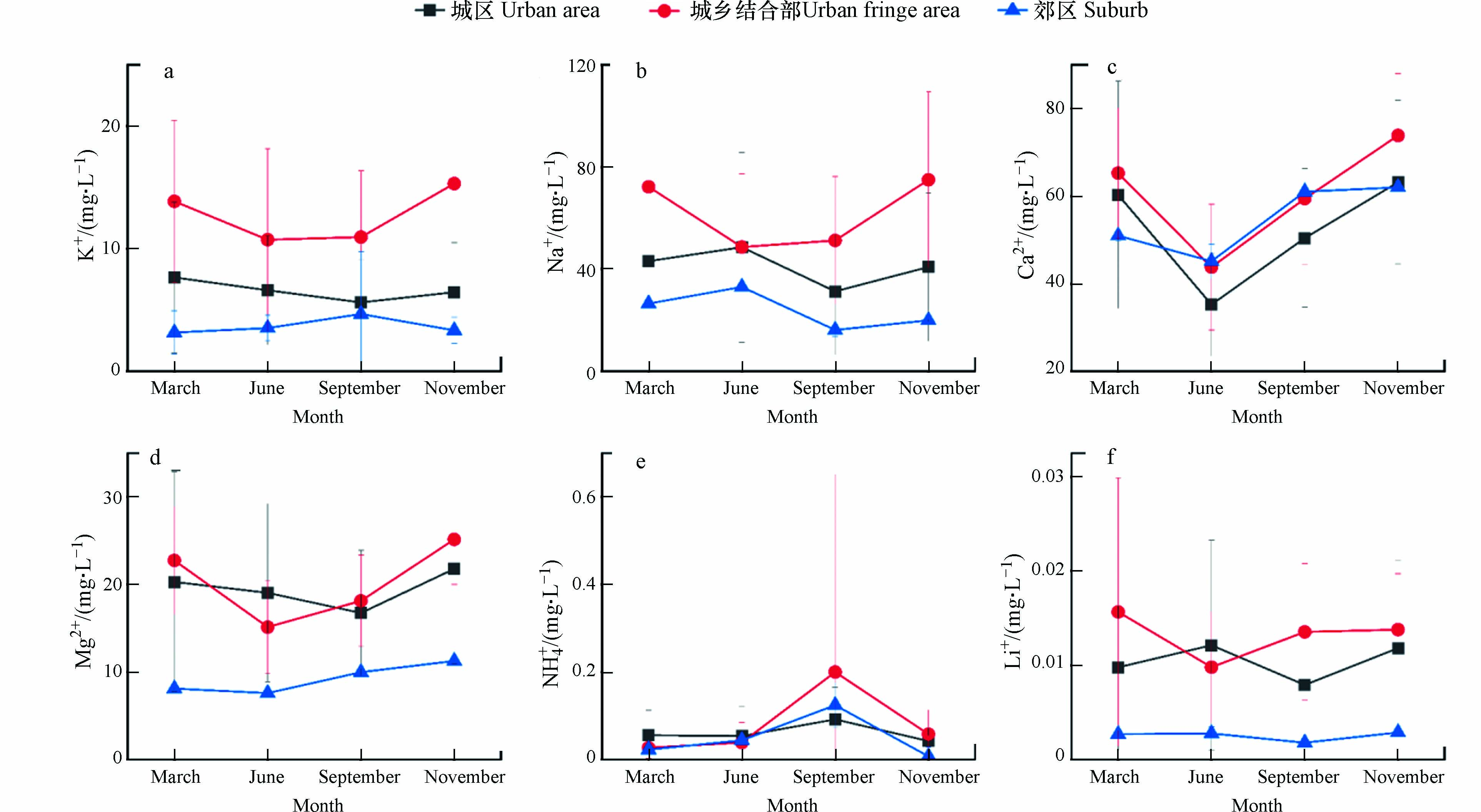
选取北京市城区、郊区和城乡结合部等不同区域水体,对其3月、6月、9月和11月的阳离子指标进行空间分布格局的对比分析(图2)发现,6种阳离子浓度变化存在一定的差异,除郊区外,城区和城乡结合部区域阳离子浓度变化具有明显季节性.
由图2可以看出,城乡结合部和城区水体中K+、Ca2+、Na+和Mg2+等4种阳离子质量浓度3月和11月份的监测均值高于6月和9月份,这4种阳离子浓度春季、冬季高于夏季、秋季,北京地区属于典型的北温带半湿润大陆性季风气候,夏季雨水较多、温度高,6—10月是主要的降雨期,降雨期时自然水体水量增加,在无外来离子来源情况下,降水对自然水体化学组分起到稀释作用,特别是对阳离子的稀释更为明显,因此冬季时阳离子浓度低于夏季[13-14].
城乡结合部水体3月和11月阳离子总质量浓度达到了174.1 mg·L−1和189.3 mg·L−1,6月和9月为118.3 mg·L−1和139.8 mg·L−1;城区水体3月和11月阳离子总质量浓度达到了131.4 mg·L−1和132.3 mg·L−1, 6月和9月为109.5 mg·L−1和104.1 mg·L−1. 城乡结合部水体中Na+和Ca2+是占绝对优势的离子,3月、6月、9月和11月的Na+占各月份总量的41.49%、41.11%、36.66%和39.61%,Ca2+占各月份总量的37.49%、37.01%、42.53%和39.01%;城区水体中3月、9月和11月Ca2+占优势,占水体中各月份总量的45.89%、48.45%和47.77%, 6月水体中Na+是占优势的离子,占总量的44.37%.
郊区水体中K+、Na+、Ca2+和Mg2+4种阳离子浓度变化不大,3月、6月、9月和11月阳离子总质量浓度分别为88.7 mg·L−1、89.3 mg·L−1、91.8 mg·L−1和96.6 mg·L−1;水体中Ca2+是占绝对优势的离子,分别占各月份离子总量的57.45%、50.54% 、66.45%和64.22%.
3个区域水体的NH4+质量浓度在3月、6月和12月变化不大,均值分别为0.035 mg·L−1、0.046 mg·L−1和0.036 mg·L−1,九月份NH4+质量浓度最高,均值达到0.139 mg·L−1,高于其他月份3—4倍,主要原因是夏季过后秋季降雨量明显减少,径流量降低,含NH4+污染物排入河道中得不到有效稀释,从而导致地表水中有机污染物浓度升高,NH4+质量浓度也随之增大.
本研究中3个区域各月份Li+质量浓度均低于0.02 mg·L−1,且在各月份中浓度变化不大,因此本文未对Li+变化情况进行讨论.
-
(1)本文建立了利用离子色谱测定地表水中Li+、Na+、NH4+、K+、Ca2+、Mg2+等6种可溶性阳离子的方法,其标准曲线、精密度、准确度、最低检出限和加标回收率均符合相关技术要求,实现了6种阳离子同时检测,同时适用于地表水中水溶性阳离子测定.
(2)通过对北京市不同区域水体6种阳离子分布特征分析可知,3个区域水体整体呈弱碱性,城乡结合部区域6种阳离子总浓度高于城区区域和郊区区域;3个区域阳离子浓度均值大小均为:Ca2+> Na+>Mg2+> K+>NH4+>Li+,主要的阳离子Ca2+和 Na+,二者质量浓度占阳离子总浓度的78.13%—85.82%.
(3)通过对不同水体阳离子之间的相关性可知,城乡结合部和城区的水体各离子间相关性变化规律较为接近;城乡结合部和城区水体Na+与Ca2+、Mg2+呈显著正相关,郊区水体中则相反;城乡结合部、城区和郊区水体Ca2+与Mg2+均呈显著正相关.
(4)不同区域水体阳离子浓度变化存在一定差异,城区和城乡结合部区域阳离子浓度受季节变化影响,具有明显的季节性特征,春冬季阳离子浓度高于夏秋季,而郊区水体阳离子浓度年度变化不大.
离子色谱法同时测定北京市不同区域水体6种阳离子
Ion chromatography for simultaneously determining six cations in water bodies of different areasof Beijing
-
摘要: 建立离子色谱法测定不同区域水体Li+、Na+、NH4+、K+、Ca2+、Mg2+等6种阳离子的方法,以及验证方法在实际应用的可行性. 以 ICS1000型离子色谱仪配有DionexIonPac CG12A 阳离子保护柱(4 mm×50 mm)和CS 12A 阳离子分离柱(4 mm×250 mm),CSRS 300 型抑制器(4 mm),甲基磺酸为淋洗液,流量为1.0 mL·min−1,6种阳离子的质量浓度在0.01—0.50 mg·L−1到5.0—100.0mg·L−1范围内线性较好,相关系数>0.9995,方法检出限为0.002—0.020 mg·L−1,与有证标准溶液相对误差−2.50%—4.38%(n=6),不同环境水样加标回收率90.7%—107.5%. 利用以上色谱条件分析北京市不同区域地表水阳离子分布特征,结果显示城乡结合部、城区和郊区水体pH稳定,呈弱碱性;城乡结合部水体6种阳离子总浓度为150.05 mg·L−1,明显高于城区和郊区25.35%和63.54%,阳离子浓度均值大小为:Ca2+> Na+>Mg2+> K+>NH4+>Li+,其中Ca2+和 Na+是3个区域水体的优势离子,NH4+和Li+质量浓度最低;城乡结合部和城区水体阳离子浓度在夏季和秋季低于春季和冬季. 实验结果表明,离子色谱法样品处理简便,分析速度快,准确可靠,灵敏度高,重复性好,适用于地表水中6种水溶性阳离子的快速批量测定.Abstract: A method for determination of Li+, Na+, NH4+, K+, Ca2+ and Mg2+in different areas of water bodies by ion chromatography was established, and verify the feasibility of the method’s chromatographic conditions and characteristic indexes in the laboratory. The method precautions were also discussed for the reference of model ICS1000 chromatography with DionexIonPac CG12A cation protection column (4 mm × 50 mm) and CS 12A cation separation column (4 mm×250 mm), CSRS 300 suppressed conductivity detector (4 mm), methane sulfonic acid as eluent, and flow rate of 1.0 mL·min−1. The mass concentration of six cations had a good linear relationship with the chromatographic peak area in the range of 0.01—0.50 mg·L−1and 5.0—100.0 mg·L−1, correlation coefficient > 0.9995, and the detection limits of the method were 0.002—0.020 mg·L−1, the relative error of −2.50%—4.38%(n=6)with the certified standard solution, and the recovery rate of standard addition of water samples measured in different environments was 90.7%—107.5%. Six cations in different areas of water bodies in Beijing were analyzed according to the above-mentioned chromatography conditions, and the result reflects that water bodies were weakly alkaline and pH was stable, the total concentration of six cations (150.05 mg·L−1) in the urban and rural joint area was higher than the city proper and the suburbs (25.35% and 63.54%); Order of mean values of cation concentrations: Ca2+> Na+>Mg2+> K+>NH4+>Li+, Ca2+ and Na+ were the dominant ions, while NH4+ and Li+ had the lowest concentrations. The total concentration of six cations of the urban and rural joint area and city area in summer and autumn was lower than in spring and winter. The results showed that the method is simple sample preparation, rapid determination, high sensitivity and accuracy, good repeatability, which is suitable for rapid determination of cations in surface water.
-
Key words:
- ion chromatography /
- cations /
- surface water /
- distribution characteristics.
-
岩溶地下水是泉城济南工农业生产和社会发展不可缺少的重要资源[1]. 上世纪80年代以来,随着城市化进程的不断加快,济南岩溶地下水开采量不断增大,工农业生产、旅游活动、生活污水等对岩溶地下水造成了一定程度的污染,水质逐年变差[2]. 特别是在泉域补给径流区,城郊和农村点源与面源污染交错,使得硝酸盐污染问题日益突出[3]. 饮用水中NO3-N含量过高容易造成儿童患高铁血红蛋白症,成人患胃癌、食管癌等,威胁人类健康[4-5]. 同时,岩溶区具有特殊的“地表—地下”双层结构,其含水层结构的特殊性决定了NO3−污染状况更为复杂[6-7].
近年来,许多学者针对岩溶水系统硝酸盐污染问题开展了大量研究,主要集中在西南亚热带岩溶区[8-10],而对于北方半湿润半干旱岩溶区的相关研究较少. 前人对于济南泉域主要开展了水文地质条件、岩溶含水层结构、水循环特征及水环境等方面的研究[11-13],特别是在岩溶地下水的水化学特征及水环境演化方面,部分学者对济南泉域岩溶地下水中主要元素、微量元素及稳定环境同位素进行分析,研究了济南泉域地下水补给来源、水文地球化学特征等问题[14-15]. 还有学者对济南泉域岩溶地下水水质变化规律及其影响因素进行了分析[16-17]. 但是在泉域尺度上采用水化学和NO3−氮氧双同位素分析岩溶地下水系统NO3−污染特征及污染来源的研究尚不多见.
本文以济南泉域为例,基于水化学和NO3−氮氧双同位素示踪技术,从水文地球化学角度,系统分析泉域岩溶水水化学特征,探究NO3−污染来源、分布及影响因素,并定量计算NO3−的各类贡献源比例,剖析NO3−的生物地球化学过程,以期为济南泉域岩溶水资源开发利用及生态环境保护提供科学依据.
1. 材料与方法(Materials and methods)
1.1 研究区概况
济南位于暖温带大陆性季风气候区,多年平均气温14.3 ℃,多年平均降水量667.1 mm,降水主要集中在6—9月份,降水量在空间上自东南向西北递减. 流经济南的河流主要有黄河、玉符河、北大沙河、小清河. 黄河从济南市北部流过,玉符河和北大沙河自南部山区汇入黄河,小清河自西向东横穿市区,汇集了济南泉水后向东流入渤海[3].
济南泉域是微向北倾斜的单斜构造地质体,是我国典型的北方岩溶发育区,总面积约1500 km2(图1). 古生界寒武系、奥陶系碳酸盐岩地层成单斜状覆盖于变质岩系之上,与地形倾向基本一致,至北部隐伏于山前第四系地层之下[18]. 泉域北部及东、西郊有燕山期侵入的辉长岩体大面积分布;西部玉符河以西沿黄河地带,奥陶系埋藏于石炭、二叠系之下,呈北西—东南向分布. 特定的地质构造条件,是济南泉域含水层空间分布、地下水循环运动以及富水性的主要控制因素[19].
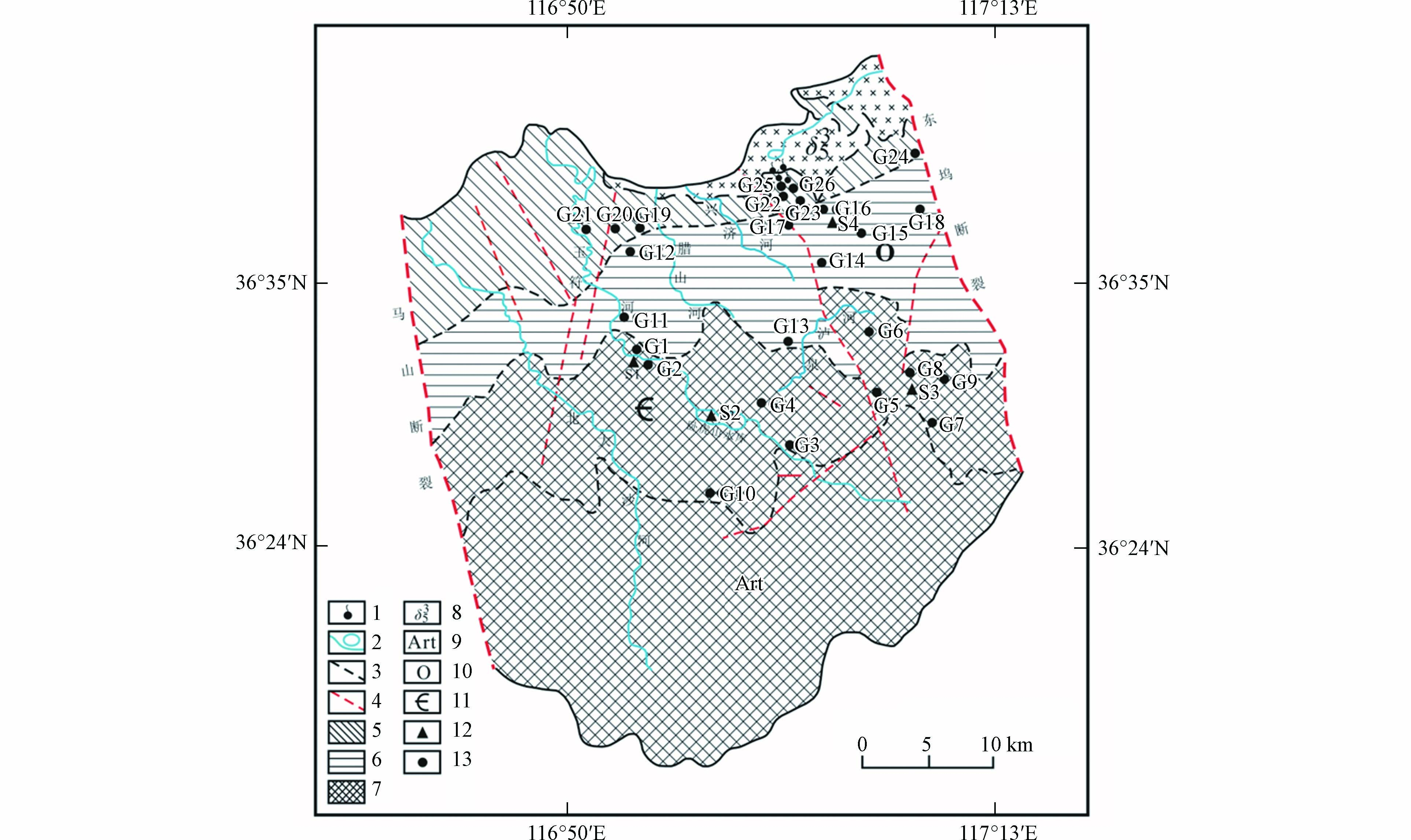 图 1 研究区水文地质简图及采样点分布Figure 1. Hydrogeological sketch of the study area and location of sampling sites1.泉群; 2.河流水库; 3.地层分界线; 4.断层; 5.排泄区; 6.直接补给区; 7.间接补给区; 8.岩浆岩; 9.太古代变质岩; 10.奥陶系碳酸盐岩; 11.寒武系碳酸盐岩; 12.地表水采样点; 13.地下水采样点1.Spring groups; 2.River and reservoir; 3.Stratigraphic boundary; 4.Fault; 5.Discharge area; 6.Direct recharge area; 7.Indirect recharge area; 8.Magmatite; 9.Metamorphite; 10.Ordovician Carbonatite; 11.Cambrian Carbonatite; 12. Surface water sampling sites; 13.Groundwater sampling sites
图 1 研究区水文地质简图及采样点分布Figure 1. Hydrogeological sketch of the study area and location of sampling sites1.泉群; 2.河流水库; 3.地层分界线; 4.断层; 5.排泄区; 6.直接补给区; 7.间接补给区; 8.岩浆岩; 9.太古代变质岩; 10.奥陶系碳酸盐岩; 11.寒武系碳酸盐岩; 12.地表水采样点; 13.地下水采样点1.Spring groups; 2.River and reservoir; 3.Stratigraphic boundary; 4.Fault; 5.Discharge area; 6.Direct recharge area; 7.Indirect recharge area; 8.Magmatite; 9.Metamorphite; 10.Ordovician Carbonatite; 11.Cambrian Carbonatite; 12. Surface water sampling sites; 13.Groundwater sampling sites泉域碳酸盐岩裂隙岩溶含水系统由寒武系中统张夏组、上统凤山组及奥陶系含水层组成,岩性为灰岩、泥质灰岩、白云质灰岩、灰质白云岩和白云岩. 岩溶裂隙发育,连通性好,有利于地下水的补给、径流和汇集排泄[20]. 泉域由南向北依次为间接补给区、直接补给径流区和汇集排泄区[16]. 区内岩溶水接受大气降水补给后由南向北运动,遇辉长岩体受阻,上升出露成泉. 区域地表水与地下水水力联系密切,岩溶含水层极易受地表水的混合污染[21-22].
泉域内人类活动主要为农业生产活动,没有大型的污染工厂. 居民点呈点状分散式分布,家禽养殖普遍且化粪池广泛分布. 南部补给区和径流区耕地和林地面积占区域总面积的80%以上,区内施肥期主要集中在4月和8月,多用复合肥、尿素和碳酸氢铵等化学肥料.
1.2 样品采集与测试
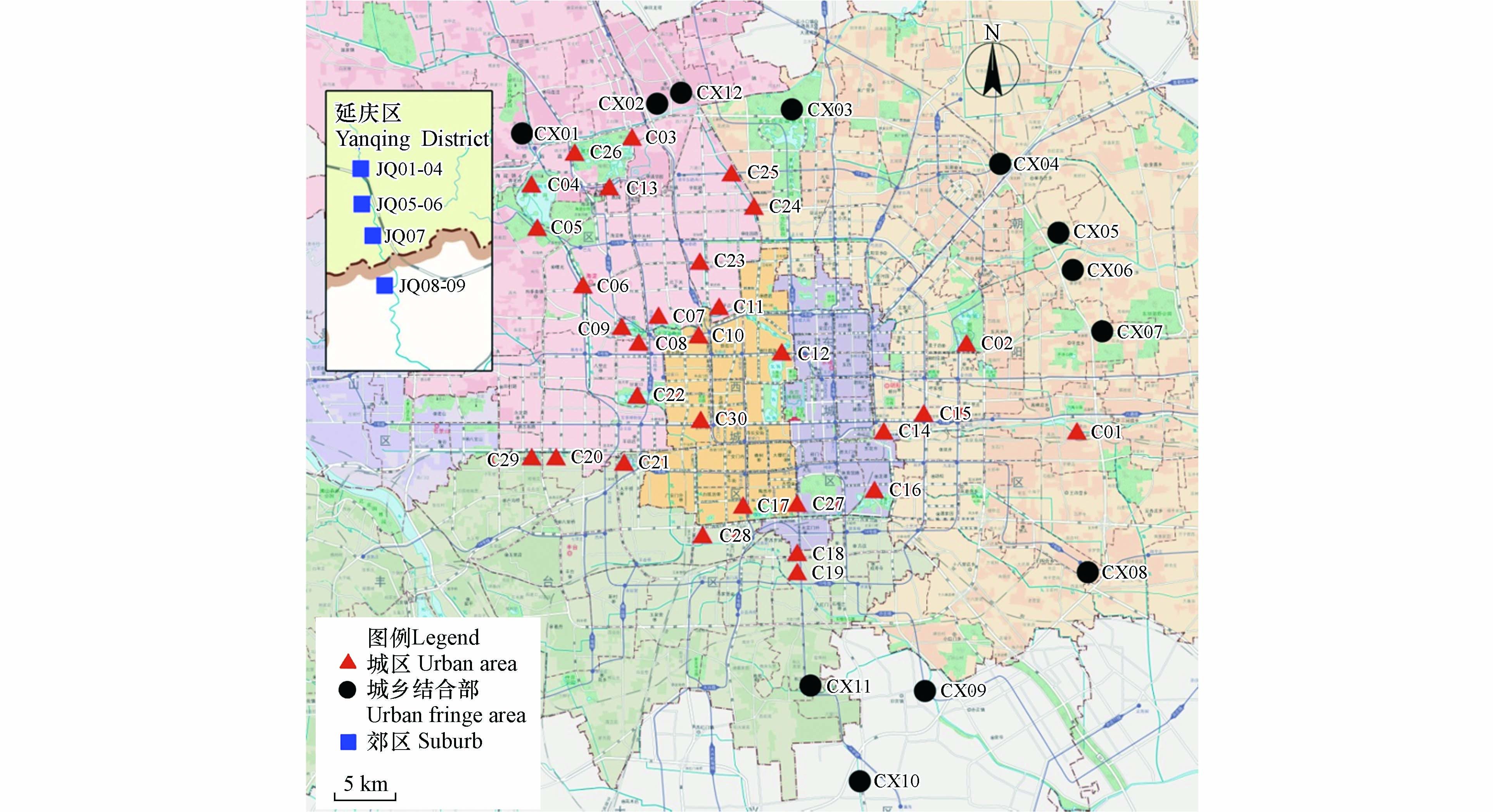
2020年9月共采集研究区地表水和地下水样品30个,其中地表水4个、地下水26个(含泉水3个),采样位置分布见图1. 用液体采样器采集水样,地表水均采自水面以下0.5 m深处的水体样品. 地下水样品为深层地下水,包括民用井和专业监测井,采样井井深全部在150 m以上,水位埋深在60 m以上. 对于封闭式水井,抽取5 min后再取样,保证所取地下水新鲜;对于敞口式水井,用液体采样器采集水面以下0.5 m深处的水体样品. 现场使用便携式多参数水质参数仪(哈希HQ40D,America)测定各采样点水样的温度(T)、电导率(EC)、溶解氧(DO)、pH值,精度分别为0.1 °C、1 µS·cm−1、0.01 mg·L−1、0.01个pH单位. 水化学分析水样用洁净的600 mL聚乙烯瓶采集,并确保瓶内无气泡,用于室内阴、阳离子浓度检测. K+、Na+、Ca2+、Mg2+、采用ICP-OES分析;Cl−、NO3−、SO42−采用阴离子色谱仪测试,精度0.01 mg·L−1;NH4+采用纳氏试剂比色法测定,精度0.01 mg·L−1;NO2−采用α-萘铵比色法测定,精度0.01 mg·L−1;HCO3−、总硬度采用滴定法测定,精度0.01 mg·L−1. 以上水化学测试工作在山东省鲁南地质工程勘察院实验测试中心完成.
同位素分析水样用事先洗净的40 mL聚乙烯瓶采集,现场经0.22 μm混合纤维素滤膜过滤,冷藏后送至实验室进行硝酸盐δ15N、δ18O同位素分析. 其中,硝酸盐δ15N、δ18O同位素检测样品时利用特异性的反硝化细菌将硝态氮转化为N2O,再采用ISOPRIME100-Tracegas痕量气体-同位素质谱联用仪(英国Isoprime公司)完成N2O的N、O同位素测定,检测精度为0.01‰,δ15N测定结果标准偏差<0.4‰,δ18O测定结果标准偏差<0.22‰. 以上同位素测试工作在中国农业科学院农业环境稳定同位素实验室完成.
1.3 数据处理与分析
使用Aq·QA v.1.1软件绘制Piper三线图;采用MATLAB 9.3软件计算地下水水化学成分相关系数;其它图件均采用Origin 8.5软件进行绘制.
本研究基于15N、18O同位素值识别NO3−来源,使用稳定同位素混合模型MixSIAR计算NO3−各种来源的贡献率. MixSIAR模型是用于NO3−来源计算的可靠工具[23-24],通过定义k个来源n个混合物的j个同位素,考虑同位素分馏作用的影响,可表达如下[25]:
Xij=∑Kk=1pkqjk(Sjk+Cjk)∑Kk=1pkqjk+εij Sjk~N(μjk,ω2jk)Cjk~N(λjk,T2jk)εij~N(0,σ2j)c 式中, Xij表示第i个样品中第j种同位素值(i=1,2,3,…,N;j=1,2,3,…,J);Sjk是第k种源中第j种同位素的值(k=1,2,3,…,K),μjk. 为平均值,
ω2jk T2jk σ2j 2. 结果与讨论(Results and discussion)
2.1 水化学及硝酸盐污染特征
2.1.1 水化学特征
对研究区内地下水和地表水的水化学参数进行分析,结果表明(表1),研究区地下水和地表水的pH值均大于7,最大值为8.93,呈弱碱性. 除G14采样点TDS异常低外,沿地下水流向岩溶地下水TDS同样呈现上升的趋势,且TDS分布在185.79—892.74 mg·L−1之间.Ca2+、Mg2+、SO42−、NO3−浓度在G4和G5采样点均较高,表明G4和G5采样点附近岩溶地下水环境污染较严重. 阳离子中Ca2+和Mg2+占绝对优势,阴离子中HCO3−和SO42−占绝对优势,其二者之和在地下水和地表水中均占阳离子和阴离子总量的80%以上.
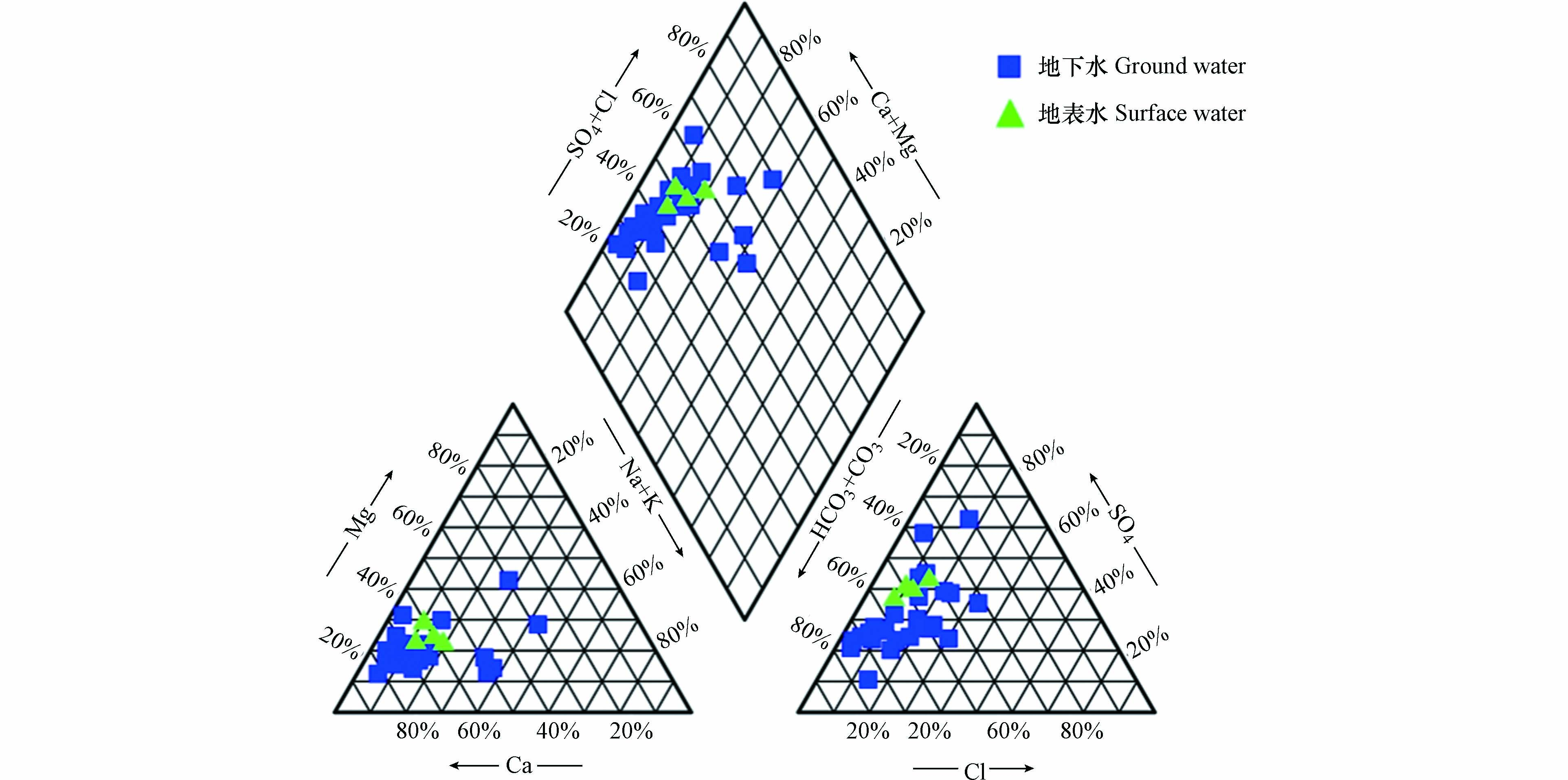
表 1 研究区水化学指标数据Table 1. Hydrochemical indexes in the study area采样点Sampling sites T/℃ pH EC/(µS·cm−1) ρ/(mg·L−1) DO K+ Na+ Ca2+ Mg2+ NH4+−N Cl− HCO3− SO42− NO2−−N NO3−−N 总硬度Total hardness TDS 间接补给区Indirect recharge area G1 19.5 7.79 716 7.05 3.08 57.99 77.06 16.92 0.01 39.54 220.77 133.03 <0.005 2.95 262.14 463.86 G2 24.5 7.62 851 7.74 0.92 30.66 129.50 15.65 0.02 35.25 234.71 174.23 <0.005 6.68 387.85 550.61 G3 17.6 7.28 742 3.99 2.14 18.30 109.26 16.71 <0.01 26.41 283.51 85.23 <0.005 7.36 341.67 451.70 G4 18.1 7.20 1251 6.70 3.41 21.05 203.13 36.36 0.05 27.10 304.43 346.05 0.006 17.96 657.02 892.74 G5 17.1 7.18 1044 6.56 4.35 18.60 146.35 28.55 0.01 30.71 309.07 118.82 <0.005 32.90 483.07 671.46 G6 22.2 7.47 755 5.45 1.91 11.02 124.82 15.17 0.03 9.15 339.28 79.34 0.180 3.19 374.17 433.32 G7 16.0 7.59 605 7.07 0.83 4.80 89.72 26.28 <0.01 9.31 288.16 59.99 <0.005 5.86 332.28 369.61 G8 21.3 7.75 608 8.77 0.92 6.10 95.85 15.46 0.01 10.70 246.33 65.73 <0.005 6.15 303.02 353.71 G9 21.8 7.56 719 7.87 2.96 12.27 111.80 15.40 <0.01 17.11 267.24 84.84 <0.005 7.48 342.62 420.78 G10 17.7 7.48 550 8.41 1.49 8.52 82.00 15.69 0.01 12.44 218.44 61.87 <0.005 7.75 269.40 337.55 直接补给区Direct recharge area G11 17.9 7.59 884 4.75 2.37 80.86 93.06 16.72 <0.01 75.30 220.77 168.19 <0.005 2.24 301.27 569.83 G12 20.5 7.28 795 8.13 0.48 24.70 105.21 17.54 <0.01 40.75 313.72 70.27 <0.005 4.79 334.97 451.47 G13 18.8 7.60 644 9.06 0.78 8.69 109.62 10.18 0.01 21.78 223.09 71.79 0.006 9.50 315.69 386.67 G14 17.7 8.93 476 1.92 8.38 24.30 17.07 10.29 1.45 14.87 76.69 68.23 0.094 0.17 84.99 185.79 G15 17.5 7.27 1176 7.40 2.03 43.97 161.77 34.61 0.15 81.75 290.48 205.02 0.043 15.55 546.50 754.93 G16 18.9 7.92 1143 2.45 28.54 84.67 123.25 18.80 0.02 69.11 151.05 352.93 <0.005 3.02 385.20 782.09 G17 19.2 7.14 934 6.44 0.54 34.81 135.93 20.41 0.02 68.86 288.16 108.07 0.006 9.62 423.51 571.36 G18 20.9 7.95 654 8.83 0.67 7.34 97.12 20.75 0.02 18.79 250.98 67.90 <0.005 8.95 327.99 386.36 排泄区Discharge area G19 19.7 7.01 1107 6.19 0.46 28.12 178.32 22.62 0.01 99.67 313.72 106.83 <0.005 19.34 538.48 694.81 G20 21.7 7.24 809 8.65 0.71 15.67 117.16 21.29 0.02 39.18 290.48 78.38 <0.005 10.76 380.26 483.21 G21 21.4 7.61 606 6.41 1.07 18.61 89.13 15.81 0.02 39.17 209.15 67.95 <0.005 5.67 287.70 375.12 G22 18.8 7.05 873 1.65 4.15 31.06 106.91 35.19 4.01 42.27 453.15 42.32 0.006 1.76 411.90 514.11 G23 21.9 7.92 803 3.72 3.46 49.98 49.18 42.94 0.05 90.18 153.37 131.52 0.006 3.57 299.64 464.22 G24 17.7 7.58 639 6.91 1.05 13.05 92.11 16.74 0.02 36.85 188.23 82.60 <0.005 7.60 298.96 382.54 G25 19.2 7.37 872 6.32 1.50 32.49 125.64 22.48 0.02 62.16 269.57 104.44 <0.005 10.28 406.31 543.44 G26 19.3 7.29 972 6.31 1.29 41.90 136.66 23.29 0.02 75.43 290.48 121.88 <0.005 11.57 437.17 610.62 地表水Surface water S1 24.3 8.56 676 16.28 4.57 27.83 80.16 18.44 0.04 35.58 164.99 135.83 <0.005 1.44 276.10 397.93 S2 26.3 8.36 508 8.74 3.02 17.40 63.77 15.61 0.28 22.29 146.40 95.30 0.088 2.69 223.52 310.53 S3 21.8 8.31 441 8.82 1.90 10.75 59.48 12.36 0.02 13.26 144.08 75.73 0.009 2.17 199.46 260.79 S4 22.3 8.11 476 7.66 1.47 11.12 59.75 17.37 0.10 16.02 137.11 88.27 0.009 2.87 220.76 279.50 从研究区水化学Piper三线图可以看出(图2),采样点均落在菱形的左上区域,碱土金属(Ca、Mg)超过碱金属(K、Na),表明地下水化学性质以碱土金属和弱酸为主. 结合统计数据和Piper三线图可知,研究区地下水和地表水主要的阴、阳离子分别为HCO3−、Ca2+,根据舒卡列夫分类,研究区水化学类型以HCO3·SO4-Ca型为主,占所有样品的60%,主要分布在径流区和排泄区. 其次,HCO3-Ca型占所有样品的17%. 另外,还有个别水样为HCO3-Ca·Mg型、HCO3·SO4-Ca·Mg型、HCO3·SO4·Cl-Ca·Na型、SO4-Ca·Mg及SO4·Cl-Ca,表现出复杂的水化学类型体系.
2.1.2 硝酸盐污染特征
济南泉域地下水NO3−浓度平均值(37.93 mg·L−1)高于地表水(10.15 mg·L−1). 对比我国地下水质量标准,在26个地下水样品中,ρ(NO3−N)≤2.0 mg·L−1的占8%,ρ(NO3−N)为2.0—5.0 mg·L−1的占23%,ρ(NO3−N)为5.0—20 mg·L−1的占65%,其中有4%的样品ρ(NO3−N)>20 mg·L−1,水质低于GB/T 14848—2017的Ⅲ类水标准;若按世界卫生组织标准[ρ(NO3−N)为10 mg·L−1]来衡量,则有27%的样品ρ(NO3−N)超标. 而4个地表水样品的ρ(NO3−N)均未超过3 mg·L−1,远低于地表水环境质量标准中集中式生活饮用水地表水源地ρ(NO3−N)≤10 mg·L−1的限值. 总体来说,研究区水质总体良好,仅少数采样点ρ(NO3−N)超标,存在点源污染的风险.
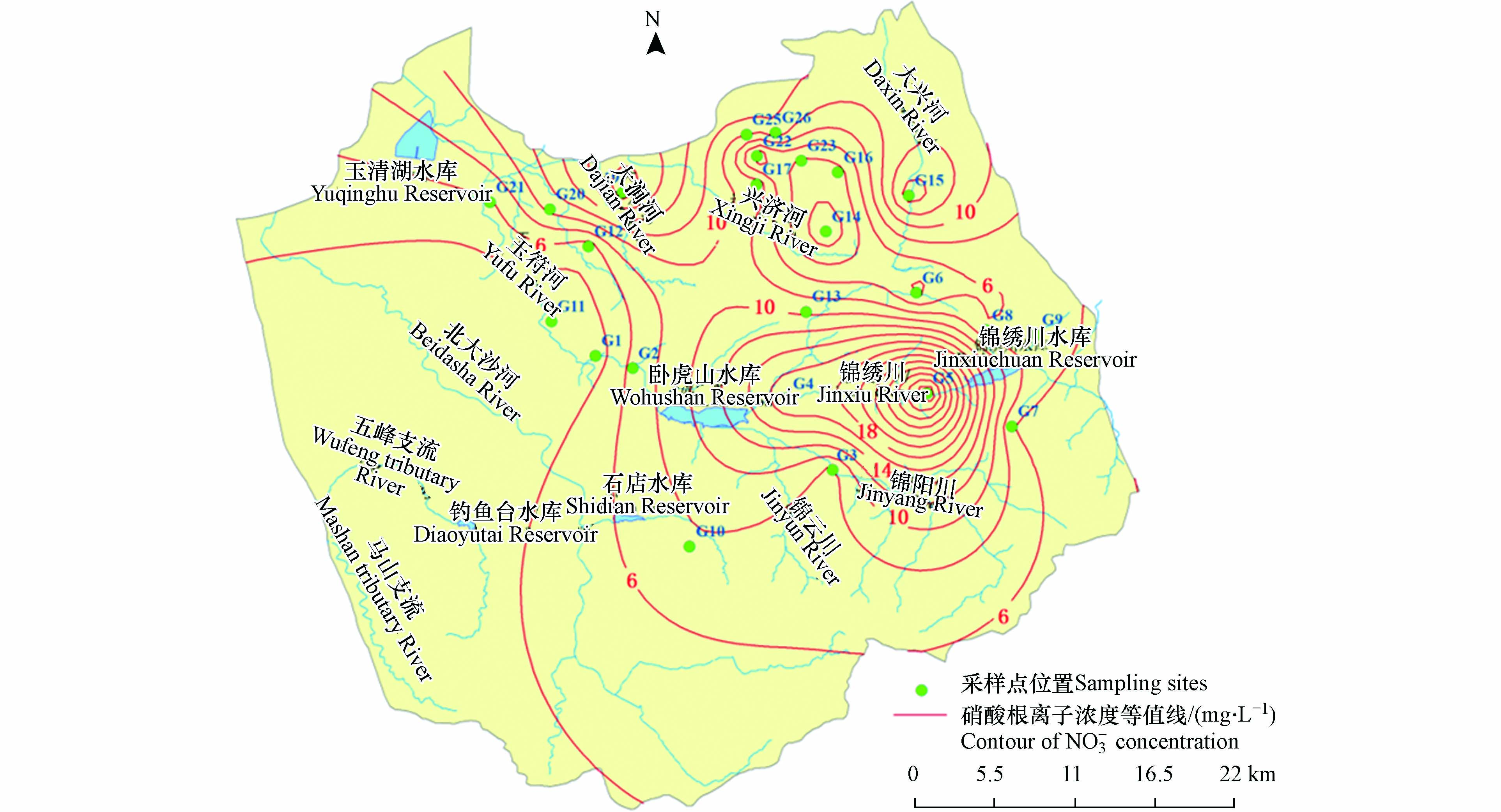
利用ArcGIS10.3软件反距离权重法进行插值,分析研究区地下水NO3−浓度的空间分布变化,结果如图3所示. 由图3和表2可知,上游补给区及下游汇集排泄区采样点地下水NO3−浓度较高,而径流区采样点地下水NO3−浓度相对偏低.NO3−浓度高值点出现在G4、 G5、G15、G19、 G20、G25、G26,浓度值均高于10 mg·L−1,其中G5采样点NO3−-N浓度高达32.90 mg·L−1. 结合采样点类型及周边环境,对其进行分析,G5采样点位于村内,地下水埋深约为7 m,该井为民井,井口保护设施不完善,生活污水及人畜粪便随降雨入渗后进入含水层,污染较严重. 其他NO3−浓度较高的采样点也均位于农村或城郊居民生活区,周边为耕地和工厂,NO3−污染原因可能是受到工业污染以及化肥施用的影响.
表 2 地下水NO3-N浓度>10 mg·L−1采样点分布Table 2. Distribution of groundwater concentration of NO3-N>10 mg·L−1 sampling sites采样点Sampling sites NO3−N/(mg·L−1) 分区Partition G4 17.96 间接补给区Indirect recharge area G5 32.90 间接补给区Indirect recharge area G15 15.55 直接补给区Direct recharge area G19 19.34 排泄区Discharge area G20 10.76 排泄区Discharge area G25 10.28 排泄区Discharge area G26 11.57 排泄区Discharge area 在空间上,从研究区南部上游至北部下游地下水NO3−浓度呈低—高—低—高的变化特征. 前面所述NO3−浓度超标的采样点,基本形成了3个NO3−高值区,均分布在上游补给区和下游排泄区.
土地利用类型对地下水和地表水中NO3−浓度有着直接影响[26-27]. 研究区内土地利用类型复杂多变,补给区和径流区以农业生产为主,耕地和林地面积占区域总面积的80%以上;汇集排泄区为城区,土地利用类型以建设用地为主. 研究区南部补给区和中部径流区地处泰山余脉,山地地形占地较广,村镇和人口相对较少,土地利用类型以次生林地、灌木丛和耕地为主,沿地下水流路径方向向北直至城郊,村镇和人口逐渐增多,适宜居住和开展农业活动,土地类型多样,以农田、村镇和次生林地为主. 由各采样点的土地利用类型可知,30个采样点中有22个位于农田或村镇附近,占比73.3%. 农田和村镇是人类农业活动密集的区域,其产生的污水中含有高浓度的NO3−,在岩溶地区,由于土壤层较薄,在降水过程中NO3−易通过雨水的携带进入土壤,并经岩溶裂隙和管道入渗影响地下水,同时通过地面冲刷和地表径流汇入河流.
2.2 水化学组分成因及演化
通过研究区地表水和地下水HCO3−/Na+和Ca2+/Na+、Mg2+/Na+和Ca2+/Na+的关系,结合碳酸盐岩、硅酸盐岩和蒸发岩3个端元的范围值[28],来判断水岩作用对水化学成分的影响. 如图4所示,地表水和地下水均分布在靠近碳酸盐岩一侧,且地下水分布相对地表水更偏右上,说明两种水体的离子组成主要受到了碳酸盐岩溶解的影响,其中地下水受到的影响更为显著.
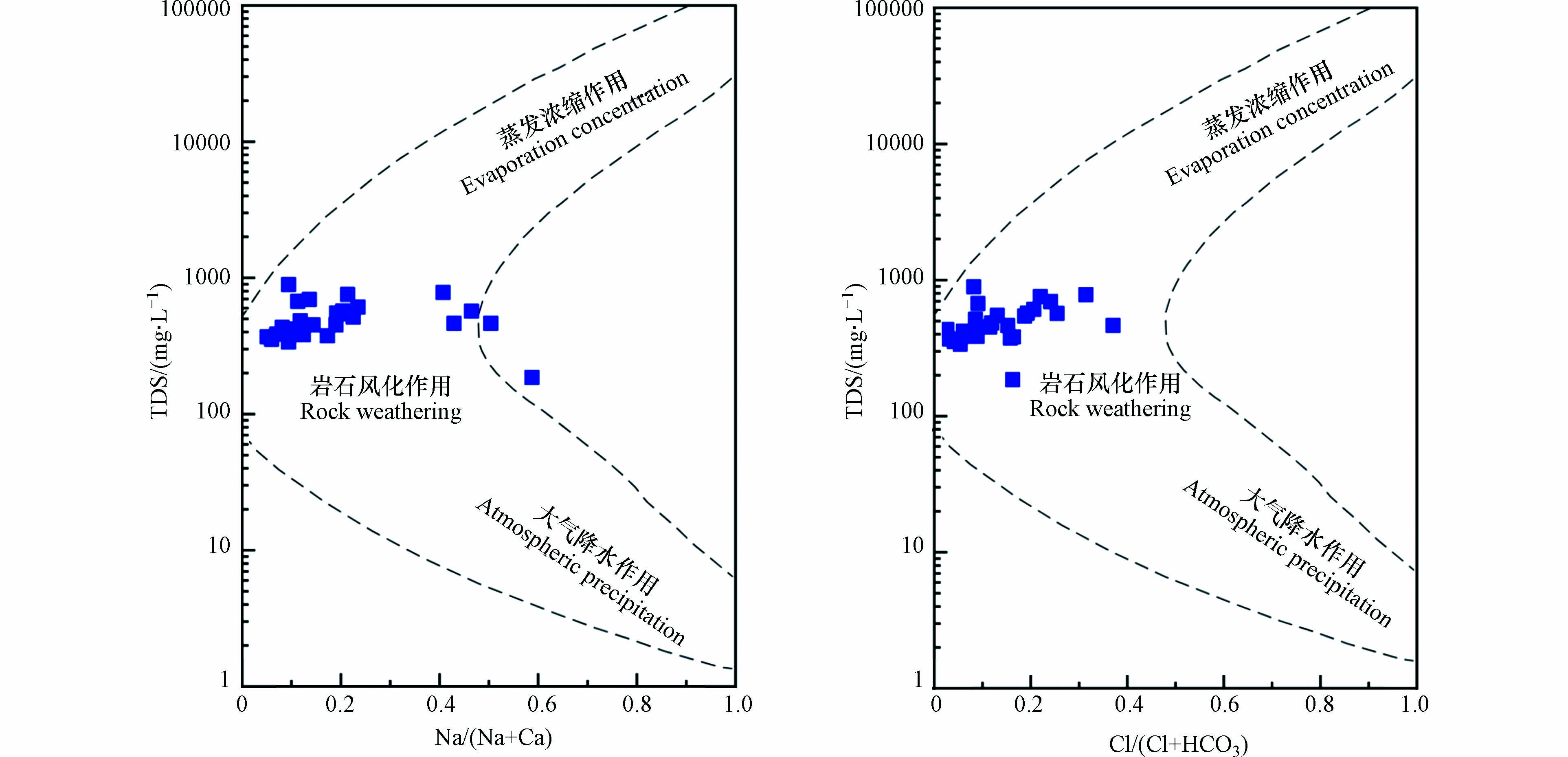
采用Gibbs图表征地下水主要离子的化学组成与变化规律,判断地下水是否受蒸发浓缩、岩石风化或者降水的作用,是分析水化学成分演化过程中主控作用的一种重要手段[29],可深入认识研究区地下水化学组分的成因及演化规律[30-31]. 从研究区地下水水化学Gibbs图可以看出,地下水样品大部分分布在模型的中部,TDS处于100—1000 mg·L−1之间,大部分样品的γ(Na+)/[γ(Na+)+γ(Ca2+)]和γ(Cl−)/[γ(Cl−)+γ(HCO3−)]值在0—0.5之间(图5),表明地下水主要阴、阳离子分别以HCO3−、Ca2+为主,且水化学组分特征主要受岩石风化作用的自然过程控制.
相关关系可以分析地下水水化学组分间的相似性,揭示不同离子是否具有同一来源. 采用统计学软件SPSS对研究区地下水水化学成分进行Pearson相关系数计算,从研究区地下水各化学组分之间的相关关系矩阵可以看出(表3),TDS与Ca2+、Mg2+、Cl−、SO42−、NO3−存在明显的线性相关关系,其中,TDS与Ca2+和SO42−的相关关系最为显著,相关关系分别为0.83和0.8,说明同样是这两种化学组分是TDS的重要来源. 地下水中的NO3−一般来源于大气降水及土壤淋滤,但是随着人类活动的增加,动物粪便、生活污水、化肥、农药等排放或使用导致地下水NO3−含量不断升高,从表1的水化学统计数据和表3相关系数矩阵可以看出,NO3−和SO42−均已成为地下水中主要的离子成分之一. Na+与Cl−显著相关,相关系数为0.7,表明研究区内含水层可能存在石盐矿物,受到水岩作用或淋滤作用影响,也可能是外源污染造成.
表 3 地下水水化学成分相关系数矩阵Table 3. Correlation coefficient matrix of groundwater hydrochemical compositionpH EC TDS K+ Na+ Ca2+ Mg2+ HCO3− Cl− NO3− SO42− pH 1 −0.54 −0.54 0.36 0.1 −0.75 −0.35 −0.82 −0.28 −0.52 −0.03 EC 1 0.98 0.29 0.49 0.82 0.57 0.37 0.63 0.55 0.74 TDS 1 0.31 0.49 0.83 0.54 0.33 0.57 0.54 0.80 K+ 1 0.57 −0.06 −0.01 −0.37 0.15 −0.18 0.61 Na+ 1 0.01 0.19 −0.25 0.70 −0.22 0.60 Ca2+ 1 0.32 0.59 0.28 0.68 0.49 Mg2+ 1 0.36 0.44 0.33 0.32 HCO3− 1 −0.01 0.32 −0.17 Cl− 1 0.15 0.36 NO3− 1 0.19 SO42− 1 2.3 泉域硝酸盐溯源分析
2.3.1 硝酸盐来源定性辨识
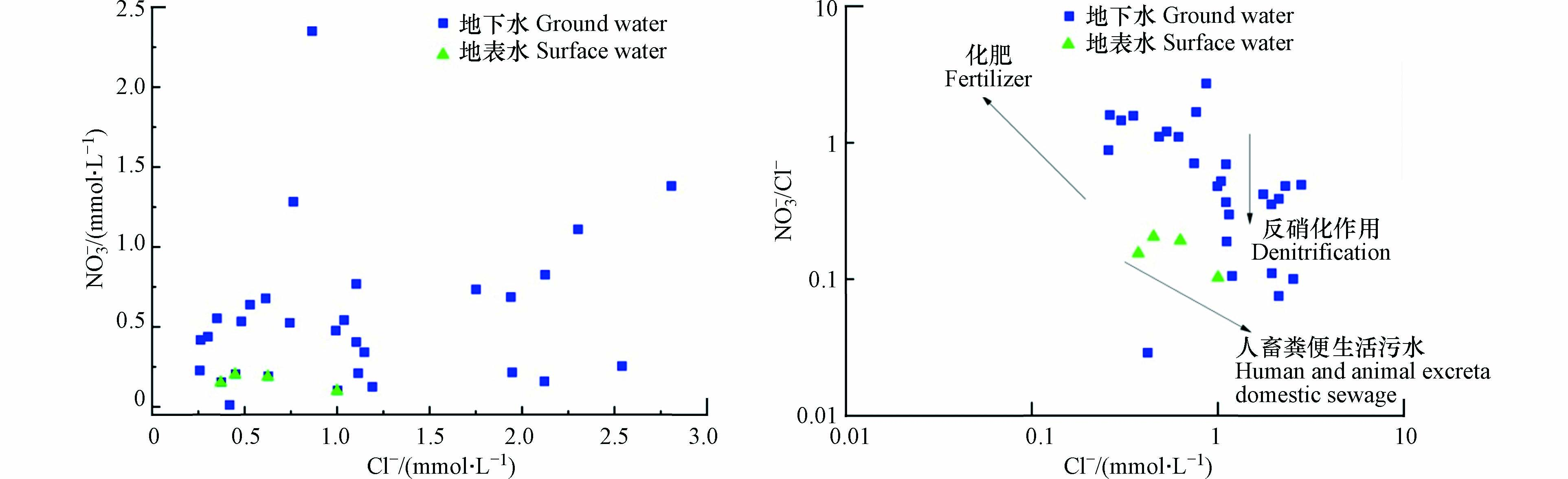
正常情况下由于天然地下水中NO3−含量很低,不会对人体产生危害,但是受城市化发展和农业活动影响,大量含氮肥料的使用以及人类、动物粪便和生活污水的排放等使得大量NO3−入渗进入含水层中,特别是在具有地表地下二元结构的岩溶含水层,入渗能力更强[32]. 人类长期暴露于过量NO3−环境中会引起高铁血红蛋白症,增加消化系统癌症的发病率[12]. 通过水水化学组分统计数据可以看出,研究区地下水中NO3−含量普遍较高,一部分样品NO3−超过了生活饮用水卫生标准. 由于地下水中Cl−相对其他离子成分要稳定得多,并且不同来源的NO3−与Cl−之间存在一定的区别,可采用γ(NO3−)/γ(Cl−)值来定性判断NO3−的来源. 从γ(NO3−)/γ(Cl−)比值关系(图6)可以看出,研究区大部分水样落在γ(NO3−)/γ(Cl−)<2以下,而且γ(Cl−)分布范围较大,表现出低γ(NO3−)/γ(Cl−),γ(Cl−)不稳定的特点,因此,判断研究区NO3−主要来自于动物粪便和生活污水.
Cl−结合NO3−/Cl−比值的方法是水化学中常用来识别NO3−来源的手段之一[33]. 低浓度的Cl−和较高的NO3−/Cl−值表明NO3−主要来源于化学肥料,而高浓度的Cl−和较低的NO3−/Cl−值表明NO3−主要来源于人畜粪便和生活污水. 由图6可知,NO3−与Cl−之间无良好的线性关系,且相关性也较弱,说明NO3−和Cl−的来源并不完全相同. 样品点主要分布在低Cl−和高NO3−/Cl−比值区域,分布较分散,表明研究区地下水和地表水中NO3−主要来源于粪便和污水,并且不同区域受化肥与污水和有机肥的影响程度差异较大. 地下水与地表水的样品点分布相似,表明两种水体有相似的NO3−来源.
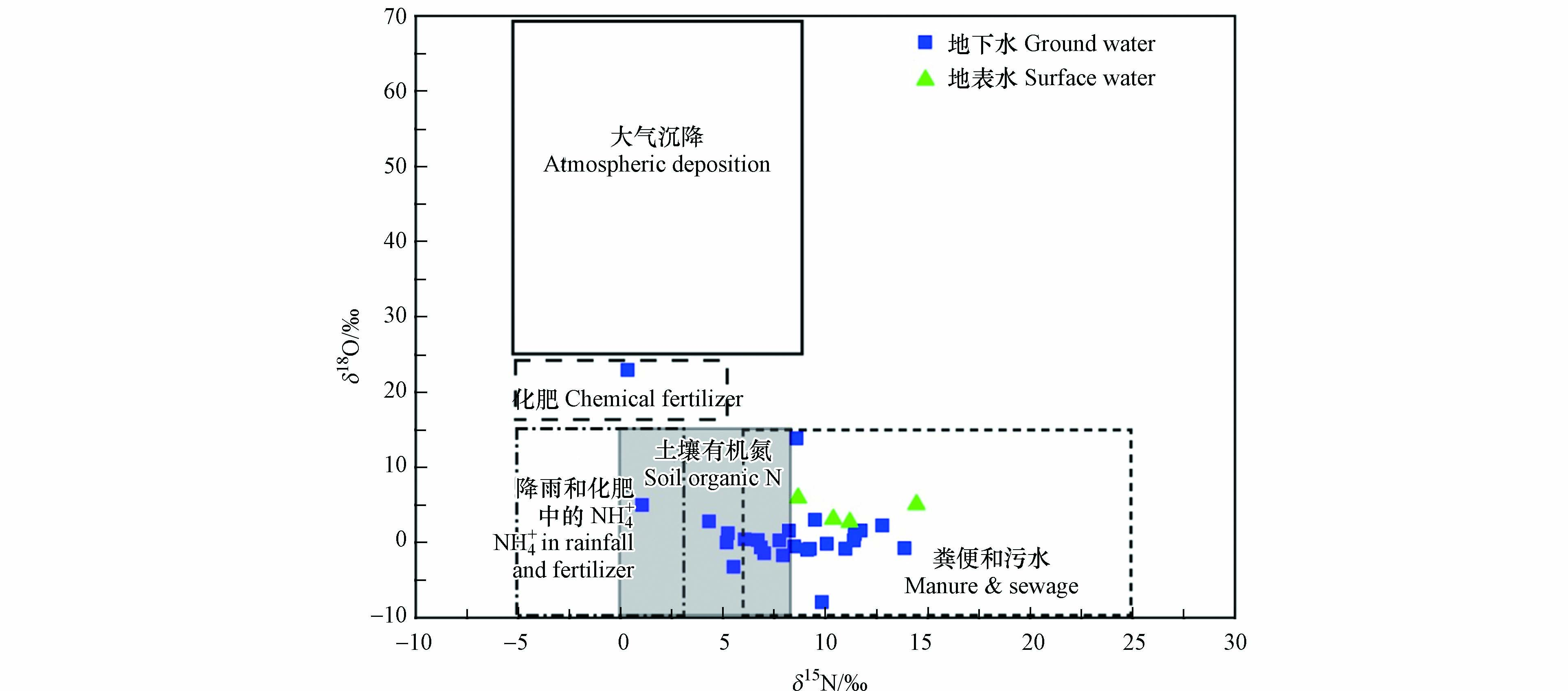
一般情况下,如果环境中没有大量NH4+积累,矿化和硝化作用产生的NO3−的δ15N值与初始反应物质的δ15N值一致,具有较小的同位素分馏[6]. 因为大量NH4+在环境中积累,反应不完全,一方面会毒害环境中的微生物,中止或减缓生化反应;另一方面由于同位素动力学分馏将使产物NO3−富集14N. 在本研究中,绝大多数地下水样品中的NH4+浓度极低,上述几个反应带来的同位素分馏可以认为是不显著的. 鉴于雨水中具有较低含量的NH4+,且是主要的氮素形态,而NO3−含量也非常低,雨水在稀释地下水的同时不可能成为主要的地下水NO3−来源. 研究区范围较大,补给区和径流区主要人类活动为种植业、养殖业及手工业,汇集排泄区位于城区,大量的农用化肥、工业污水和生活污水造成了较严重的点源污染,是NO3−含量分布差异较大的主要原因. 从研究区地下水和地表水中硝酸盐氮氧同位素的特征值(图7)可知,δ15N值范围在1.05‰—14.43‰,δ18O值范围在−7.92‰—22.94‰,大部分位于粪便和污水的范围内,少部分位于土壤氮及降雨和化肥中NH4+范围内,说明研究区粪便和污水是地下水和地表水NO3−污染的主要来源,其次为土壤氮,这一研究结论与水化学分析结果一致.
2.3.2 反硝化作用的判别
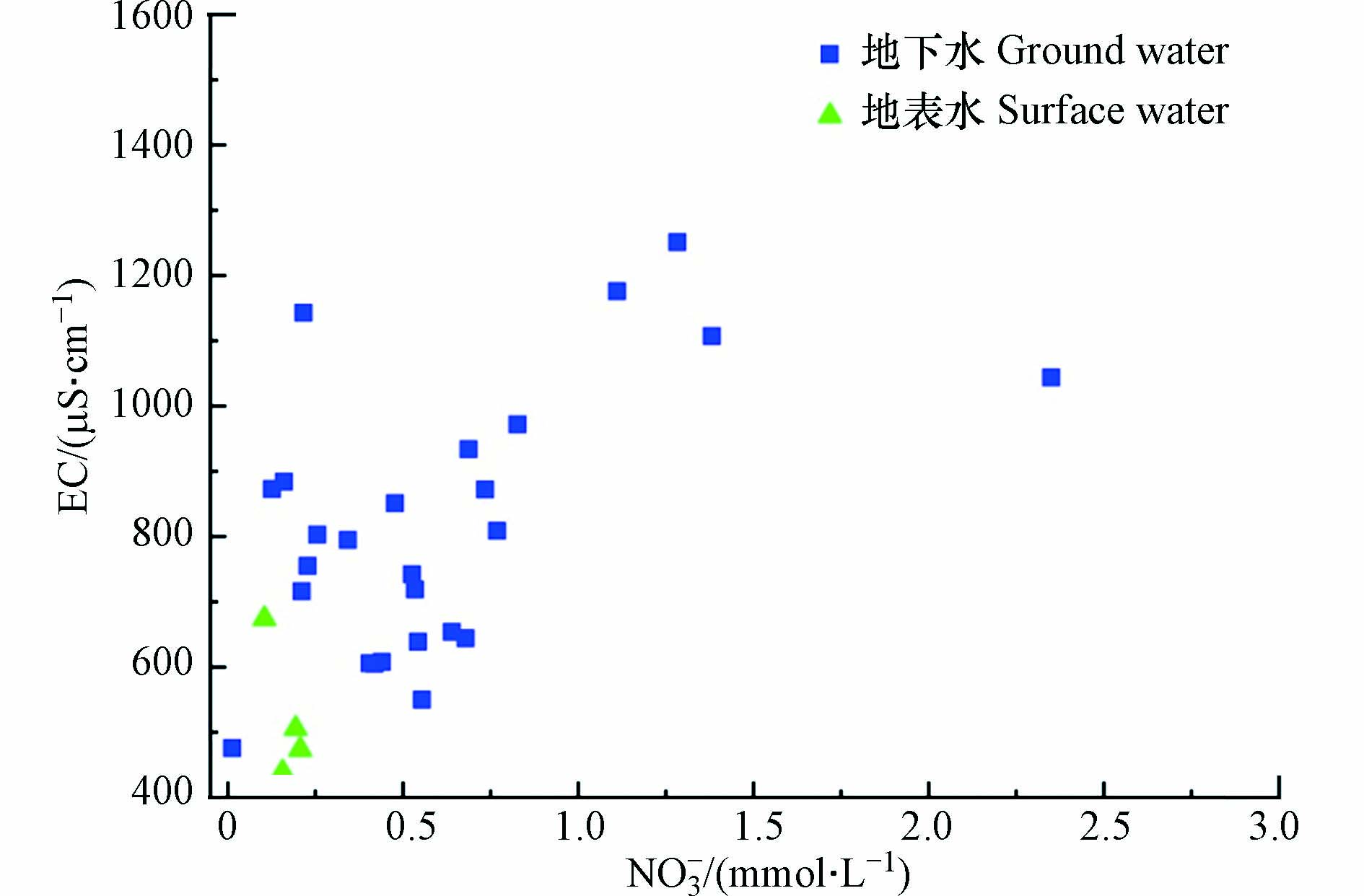
Cl−和NO3−的关系以及EC和NO3−的关系能初步判断水中NO3−浓度的变化是源于无N形态转化的混合过程还是由反硝化作用引起[20]. 若NO3−浓度的增加伴随Cl−浓度和EC的增加,则说明水中NO3−浓度可能主要受到无N形态转化的混合过程的影响,反之则可能有反硝化作用发生. 如图6和图8所示,整体上NO3−与Cl−以及NO3−与EC之间均没有显著的线性关系和良好的相关性,但仍然趋向于随NO3−浓度的升高,Cl−和EC均有所升高,表明研究区NO3−主要受到无N形态转化的混合过程的影响,而无明显的反硝化作用发生.
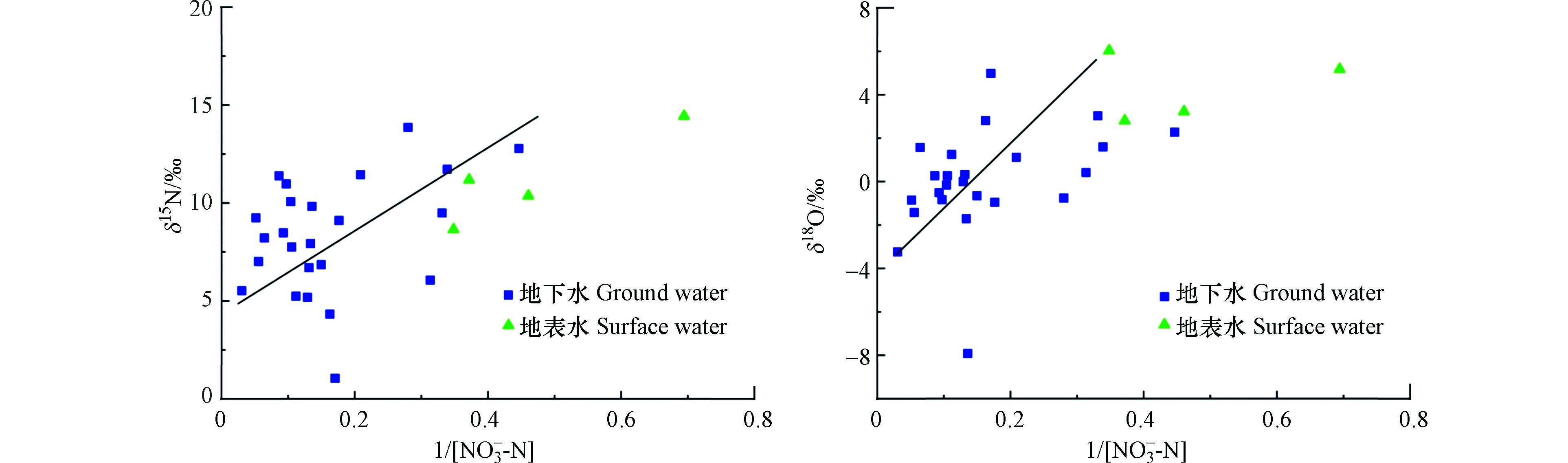
由图9可以看出,研究区地下水与地表水中NO3−的δ15N值和δ18O值均与NO3-N浓度的倒数呈正相关,表明NO3−N属于混合来源. 其中,26个地下水样品δ15N平均值为8.04‰,4个地表水样品δ15N平均值为11.16‰,较高的δ15N值域落在粪便和污水区域,再次说明粪便和污水是该区地下水和地表水中NO3−N的主要污染源,其他来源的N(包括土壤氮和化肥)的比例相对较少,可能有少部分的混合.
水中溶解氧(DO)含量的多少是衡量水体自净能力的重要指标,也是判断是否发生反硝化作用的前提. 有研究发现地下水中发生反硝化作用时DO浓度上限为2 mg·L−1,而反硝化作用引起的δ15N和δ18O之比接近2:1[34-35]. 本次采集的地下水中DO浓度在1.65—9.06 mg·L−1的范围内,平均值为6.34 mg·L−1;地表水中DO浓度在7.66—16.28 mg·L−1之间,平均值为10.38 mg·L−1,说明研究区地下水和地表水环境发生反硝化作用的可能性非常小.
硝化作用是指NH4+在氧化环境下经硝化细菌作用,形成NO3−的过程,属于耗氧反应,氧元素在反应过程中会有明显的变化[36]. 因此,可以利用
δ18ONO3 δ18ONO3 δ18ONO3 2.3.3 硝酸盐来源定量解析
结合济南泉域地下水和地表水的
δ15NNO3 δ18ONO3 表 4 地下水和地表水NO3−不同来源的贡献率(%)Table 4. Contribution rate of potential source to NO3− in groundwater and surface water来源Source 地下水Ground water 地表水Surface water 最小值Min 最大值Max 平均值±标准差Mean±SD 最小值Min 最大值Max 平均值±标准差Mean±SD 粪便和污水Manure & nitrogen 21.3 61.0 39.9±13.1 41.2 62.7 51.5±9.0 土壤有机氮Soil organic nitrogen 15.5 35.3 27.4±6.4 10.8 24.2 19.2±5.9 降雨和化肥中的NH4+NH4+ in rainfall and fertilizer 12.2 34.2 22.9±6.9 13.3 18.2 15.7±2.1 化肥Chemical fertilizer 1.3 25.3 6.6±5.1 7.8 10.5 8.9±1.2 大气沉降Atmospheric deposition 0.5 21.0 3.3±4.6 3.6 5.9 4.7±1.1 从MixSIAR模型计算结果可以看出,地下水和地表水的主要NO3−贡献源均为粪便和污水,贡献率分别高达39.9%和51.5%,其次为土壤氮及降雨和化肥中的NH4+. 此外与人类活动有关的化肥输入分别占地下水和地表水NO3−总来源的6.6%和8.9%,贡献率相对较低,大气沉降的贡献率最低,说明粪便和污水中的NO3−是济南泉域NO3−污染的主要来源. 总体而言,人为因素的NO3−来源高于自然因素的NO3−来源,表明研究区具有较高的硝酸盐污染风险,这与已有相关研究[38-39]结果较为一致.
3. 结论(Conclusion)
(1)研究区地下水和地表水的水化学条件在自然和人为因素影响下,水化学场变化较大. 地下水NO3−污染较为严重;地表水中NO3−浓度较低,不存在NO3−污染. 较高的ρ(Cl-)和EC水平说明局部区域存在点源污染.
(2)研究区地下水和地表水中NO3−主要来源于粪便和污水,其次为土壤氮.NO3−浓度变化主要受到混合过程影响,硝化作用是研究区地下水NO3−-N转换的主要过程,无明显反硝化作用发生.
(3)研究区正处于城市化进程的加速阶段,人类活动的加剧对地下水的影响也越来越明显. 因此,在农村居住区应加强牲畜粪便管理、加强排污管道建设、提高污水处理率、防止污水渗漏;在农业种植区应控制化肥施用量、提高氮肥利用率;在城镇区域应加强居民生活污水处理和排放管理,以防止该区地下水NO3−污染进一步恶化.
-
表 1 标准曲线溶液配制(mg·L−1)
Table 1. Preparation of calibration solution (mg·L−1)
离子Cations 标准溶液 Standard Solution 1 2 3 4 5 6 7 8 Li+ 0.01 0.05 0.10 0.20 0.50 1.00 2.00 5.00 Na+ 0.20 0.50 1.00 2.00 5.00 10.00 20.00 50.00 NH4+ 0.01 0.05 0.10 0.20 0.50 1.00 2.00 5.00 K+ 0.50 1.00 2.00 5.00 10.00 20.00 50.00 100.0 Mg2+ 0.50 1.00 2.00 5.00 10.00 20.00 50.00 100.0 Ca2+ 0.50 1.00 2.00 5.00 10.00 20.00 50.00 100.0 表 2 标准工作曲线的回归方程和相关系数
Table 2. Regression equations and correlation coefficientsofthestandard curve
出峰顺序Peak occurrence sequence 离子名称Cations 线性方程Linear equations 相关系数Related coefficient 1 Li+ Y=0.9249X+0.0026 0.9999 2 Na+ Y=0.3115X+0.0490 0.9999 3 NH4+ Y=−0.0185X2+0.3390X+0.0173 0.9997 4 K+ Y=0.1899X+0.0553 0.9996 5 Mg2+ Y=0.4900X+0.1890 0.9998 6 Ca2+ Y=0.3768X-0.0918 0.9998 表 3 方法的检出限、测定下限(mg·L−1)
Table 3. Method detection limit and the limit of quantitation(mg·L−1)
离子名称Cations 平均值Average value 标准偏差Standard deviation 方法检出限Method detection limit 测定下限Limit of quantitation Li+ 0.0507 0.0005 0.002 0.008 Na+ 0.0530 0.0021 0.01 0.04 NH4+ 0.0576 0.0031 0.01 0.04 K+ 0.4830 0.0026 0.01 0.04 Mg2+ 0.5195 0.0048 0.01 0.04 Ca2+ 0.4848 0.0027 0.02 0.08 表 4 不同浓度标准溶液的测定平均值和相对标准偏差
Table 4. Measured meanconcentrations and relative standard deviations of standard solutions with different concentrations
离子Cations 低浓度/(mg·L−1)Low concentration 相对标准偏差/%Relative standard deviation 中浓度/(mg·L−1)Medium concentration 相对标准偏差/%Relative standard deviation 高浓度/(mg·L−1)High concentration 相对标准偏差/%Relative standard deviation Li+ 0.05 1.45 0.53 0.40 1.08 0.46 Na+ 0.55 0.52 12.68 0.87 21.47 0.10 NH4+ 0.11 2.98 1.15 1.25 5.77 0.36 K+ 0.26 0.76 7.34 0.64 21.74 0.94 Mg2+ 0.22 1.29 5.64 0.77 22.67 0.19 Ca2+ 0.76 0.82 5.48 0.17 21.16 0.18 表 5 有证标准溶液阳离子浓度测定结果
Table 5. Results of determination of cationic concentration in certified standard solution
离子Cations 平均值/(mg·L−1)Average value 标准样品浓度/(mg·L−1)Standard sample concentration 相对标准偏差/%Relative standard deviation 相对误差/%Relative error Li+ 0.77 0.76±0.03 1.41 0.72 Na+ 12.35 11.90±0.60 0.19 3.82 NH4+ 0.63 0.65±0.03 1.73 −2.50 K+ 6.34 6.36±0.51 0.74 −0.29 Mg2+ 5.68 5.56±0.27 1.45 2.11 Ca2+ 21.29 20.4±2.0 0.33 4.38 表 6 阳离子的加标回收率
Table 6. Therecovery rates of spiked cations
离子Cations 原样浓度/(mg·L−1)Original concentration 加标量/(mg·L−1)Added scalar quantity 加标回收率/%Recovery rate Li+ 0.0167 0.05 90.7 0.50 103.0 5.00 97.4 Na+ 109.8143 0.50 98.1 5.00 99.5 50.00 95.9 NH4+ ND 0.05 92.6 0.50 96.2 5.00 97.9 K+ 12.2641 1.00 93.0 20.00 107.5 50.00 103.7 Mg2+ 41.7051 1.00 92.8 20.00 106.7 50.00 104.5 Ca2+ 93.1263 1.00 98.1 20.00 105.8 50.00 99.3 表 7 3个区域水体水化学特征值
Table 7. Hydrochemical characteristic values of water bodies in thethreeareas
区域Region 项目Item pH 离子/(mg·L−1) Cations K+ Na+ Ca2+ Mg2+ NH4+ Li+ 城乡结合部 最大值 9.45 29.07 112.13 94.56 31.72 1.47 0.031 最小值 7.45 1.63 6.09 26.52 6.93 0.00 0.001 平均值 8.31 12.34 58.39 59.61 19.59 0.11 0.013 标准差 0.36 7.15 30.79 18.52 6.52 0.28 0.006 变异系数CV/% 4.33 57.94 52.73 31.07 33.28 254.6 46.15 城区 最大值 9.69 20.31 109.16 131.59 49.17 0.23 0.044 最小值 7.73 1.53 4.85 19.92 6.65 0.00 0.00 平均值 8.74 6.63 41.04 52.49 19.48 0.06 0.010 标准差 0.36 4.71 32.14 21.76 10.47 0.07 0.01 变异系数CV/% 4.12 71.04 78.31 41.46 53.75 116.7 100.0 郊区 最大值 8.49 18.19 35.48 64.82 11.71 0.20 0.004 最小值 6.94 2.30 9.59 36.04 7.06 0.00 0.001 平均值 7.55 3.69 23.84 54.90 9.27 0.05 0.003 标准差 0.35 2.75 6.80 7.55 1.53 0.06 0.001 变异系数CV/% 4.64 74.53 28.52 13.75 16.50 120.0 33.33 表 8 3个区域水体阳离子相关性矩阵
Table 8. Correlation matrices of cation concentrations of water bodies in the three areas
郊区 Suburb K+ Na+ Ca2+ Mg2+ NH4+ Li+ K+ 1 −0.042 0.089 0.076 −0.110 0.105 Na+ 1 −0.889*** −0.778*** −0.354 0.500* Ca2+ 1 0.932*** 0.160 −0.227 Mg2+ 1 −0.004 −0.110 NH4+ 1 −0.641*** Li+ 1 城乡结合部 Urban fringe area K+ Na+ Ca2+ Mg2+ NH4+ Li+ K+ 1 0.906*** 0.684*** 0.651*** −0.037 0.648*** Na+ 1 0.755*** 0.793*** −0.043 0.614*** Ca2+ 1 0.862*** −0.028 0.401 Mg2+ 1 −0.019 0.383 NH4+ 1 −0.044 Li+ 1 城区 Urban area K+ Na+ Ca2+ Mg2+ NH4+ Li+ K+ 1 0.841*** 0.478*** 0.551*** −0.146 0.658*** Na+ 1 0.470*** 0.834*** −0.202 0.797*** Ca2+ 1 0.639*** −0.208 0.289* Mg2+ 1 −0.214 0.663*** NH4+ 1 −0.172 Li+ 1 注:***表示在 0.001 置信度下显著相关,**表示在 0.01 置信度下显著相关,* 表示在 0.05 置信度下显著相关. Note:*** indicated a significant correlation between the 0.001 confidence level,** indicated a significant correlation between the 0.01 confidence level, * indicated a significant correlation between the 0.05confidence level. -
[1] 陈伟华, 张艳芳, 鲍峰伟, 等. 超声波提取-离子色谱法同时测定卷烟纸中的钾、钠、钙、镁 [J]. 中国测试, 2012, 38(6): 41-43. CHEN W H, ZHANG Y F, BAO F W, et al. Simultaneous determination of K+, Na+, Ca2+and Mg2+ contents in cigarette paper by ultrasonic extraction-ion chromatography [J]. China Measurement & Test, 2012, 38(6): 41-43(in Chinese).
[2] 殷丽, 张飞, 唐溢湉, 等. 大气降水中钾钠钙镁测定方法的比对 [J]. 环境监测管理与技术, 2013, 25(5): 60-62. doi: 10.3969/j.issn.1006-2009.2013.05.017 YIN L, ZHANG F, TANG Y T, et al. Method comparison of the determination of K+, Na+, Ca2+, Mg2+ in atmospheric precipitation [J]. The Administration and Technique of Environmental Monitoring, 2013, 25(5): 60-62(in Chinese). doi: 10.3969/j.issn.1006-2009.2013.05.017
[3] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. The State Environmental Protection Administration. Water and wastewater monitoring and analysis method[M]. Fourth Edition. Beijing: China Environment Science Press, 2002(in Chinese).
[4] 赵云. 离子色谱同时检测水中4种阳离子的快速测定方法研究 [J]. 水利技术监督, 2018, 26(6): 181-183. doi: 10.3969/j.issn.1008-1305.2018.06.055 ZHAO Y. Study on rapid method of simultaneous determination of 4 cations in water by ion chromatography [J]. Technical Supervision in Water Resources, 2018, 26(6): 181-183(in Chinese). doi: 10.3969/j.issn.1008-1305.2018.06.055
[5] 马丽萍, 杨磊. 离子色谱法同时测定黄河水中5种可溶性阳离子 [J]. 化学分析计量, 2021, 30(5): 22-27. doi: 10.3969/j.issn.1008-6145.2021.05.006 MA L P, YANG L. Simultaneous determination of five soluble cations in Yellow River water by ion chromatography [J]. Chemical Analysis and Meterage, 2021, 30(5): 22-27(in Chinese). doi: 10.3969/j.issn.1008-6145.2021.05.006
[6] 王晓梅. 离子色谱法测定降水中的五种阳离子 [J]. 中国资源综合利用, 2022, 40(6): 24-26. doi: 10.3969/j.issn.1008-9500.2022.06.007 WANG X M. Determination of five cations in precipitation by ion chromatography [J]. China Resources Comprehensive Utilization, 2022, 40(6): 24-26(in Chinese). doi: 10.3969/j.issn.1008-9500.2022.06.007
[7] 中华人民共和国水利部. 水环境监测规范: SL 219—2013[S]. 北京: 中国水利水电出版社, 2014. Ministry of Water Resources of the People's Republic of China. Regulation for water environmental monitoring: SL 219—2013[S]. Beijing: China Water Power Press, 2014(in Chinese).
[8] 朱世丹, 张飞, 张海威. 艾比湖流域河流水化学季节特征及空间格局研究 [J]. 环境科学学报, 2018, 38(3): 892-899. doi: 10.13671/j.hjkxxb.2017.0448 ZHU S D, ZHANG F, ZHANG H W. The seasonal and spatial variations of water chemistry of rivers in Ebinur Lake Basin [J]. Acta Scientiae Circumstantiae, 2018, 38(3): 892-899(in Chinese). doi: 10.13671/j.hjkxxb.2017.0448
[9] 赵胜男, 史小红, 崔英, 等. 内蒙古达里诺尔湖湖泊水体与入湖河水水化学特征及控制因素 [J]. 环境化学, 2016, 35(9): 1865-1875. doi: 10.7524/j.issn.0254-6108.2016.09.2016012001 ZHAO S N, SHI X H, CUI Y, et al. Hydrochemical properties and controlling factors of the Dali Lake and its inflow river water in Inner Mongolia [J]. Environmental Chemistry, 2016, 35(9): 1865-1875(in Chinese). doi: 10.7524/j.issn.0254-6108.2016.09.2016012001
[10] 冯泽波, 史正涛, 苏斌, 等. 滇池主要入湖河流水化学特征及其环境意义 [J]. 水生态学杂志, 2019, 40(3): 18-24. doi: 10.15928/j.1674-3075.2019.03.003 FENG Z B, SHI Z T, SU B, et al. Water chemistry in the primary tributaries of Dianchi Lake and effect on the water environment of Dianchi Lake [J]. Journal of Hydroecology, 2019, 40(3): 18-24(in Chinese). doi: 10.15928/j.1674-3075.2019.03.003
[11] 陈荣彦, 叶许春, 张世涛, 等. 人类活动影响盘龙江下游浅层地下水水质的变化 [J]. 水资源与水工程学报, 2007, 18(5): 47-51. doi: 10.3969/j.issn.1672-643X.2007.05.012 CHEN R Y, YE X C, ZHANG S T, et al. Change of the shallow groundwater quality by human activities influence in lower reaches of Panlongjiang River [J]. Journal of Water Resources and Water Engineering, 2007, 18(5): 47-51(in Chinese). doi: 10.3969/j.issn.1672-643X.2007.05.012
[12] 尹新雅, 陶发祥. 寻找人类活动影响南明河的水化学指纹: Ⅰ. 空间变化 [J]. 地球与环境, 2012, 40(4): 517-523. YIN XY, TAO F X. Searching for hydrochemical imprints indicating human impacts on the Nanming River: Ⅰ. Spatial variations [J]. Earth and Environment, 2012, 40(4): 517-523(in Chinese).
[13] 闻欣然, 王天阳, 李凤全, 等. 金华江城区段河流水化学变化及其控制因素 [J]. 地球与环境, 2018, 46(2): 146-155. doi: 10.14050/j.cnki.1672-9250.2018.46.019 WEN X R, WANG T Y, LI F Q, et al. Changes in river water chemistry of the urban section of Jinhua river and its' controlling factors [J]. Earth and Environment, 2018, 46(2): 146-155(in Chinese). doi: 10.14050/j.cnki.1672-9250.2018.46.019
[14] 陈洲, 王兮之, 李保生, 等. 粤北岩溶区星子河流域水化学离子特征及其时空变化分析 [J]. 地球与环境, 2014, 42(2): 145-156. doi: 10.14050/j.cnki.1672-9250.2014.02.010 CHEN Z, WANG X Z, LI B S, et al. Analysis of hydrochemical ion characteristics and their temporal and spatial variations in the Karst Basin of the Xingzi River, north Guangdong Province [J]. Earth and Environment, 2014, 42(2): 145-156(in Chinese). doi: 10.14050/j.cnki.1672-9250.2014.02.010
-




 下载:
下载: