-
PFASs是分子中与碳原子连接的氢原子全部被氟原子取代的一类持久性有机污染物,被广泛应用于织物、地毯、纸张、泡沫灭火剂、不粘锅、包装材料等生产制造领域,被大量地排放到环境中[1]. 同时由于其难降解,可远距离传输,并通过食物链在动物和人体中累积等特点,造成该类化合物在全球范围内广泛存在[2-3]. 研究表明,该类物质具有致畸、致癌、神经毒性和内分泌干扰等特性,其对人体健康存在潜在危害[4-5]. 此外,由于大部分PFASs具有较低的饱和蒸气压、较高的水溶性和很强的表面活性,使其在各种表层水体中累积,因此水环境是PFASs重要的汇和污染传输途径,了解PFASs在水环境中的分布特征极为重要[6-7].
随着发达国家逐步加强对PFASs的管控[8],氟化工产业逐渐由欧美等发达国家向发展中国家转移[9],我国氟化工产业主要集中在中部和东部地区,其中长三角地区是主要生产地[10-11],而氟化工产业的大规模发展会带来潜在的污染风险. 因此长三角地区的PFASs污染一直是学术界研究热点,但大部分长三角地区PFASs研究都集中在上海地区或少数城市,且部分研究主要集中在全氟辛烷磺酸(PFOS)和PFOA的研究,对长三角地区PFASs的整体污染研究不全面. 如Sun等[12]对上海水体中的PFASs的污染水平研究和Chen等[13]对常熟、淮安、盐城等城市的PFASs污染特征研究等.
本研究利用快速液相色谱-三重四极杆串联质谱联用检测技术,以长三角地区11个城市作为研究区域,选取了29个采样点,对该地区11种PFASs在水环境中的污染水平、污染特征、污染来源开展研究,并对该地区PFASs生态环境潜在风险进行评估,以期为该类化合物的全面、深入研究以及该区域水环境综合管理提供科学依据.
-
于2019年6月在长三角地区采集了29份河水,采样点(参照省级控制断面)位于长三角地区主要河流及支流,河流宽约20—50 cm,涉及11个城市覆盖长三角核心区域,具体点位见图1.
采样方法参考国家标准GB/T 26411—2010和HJ 805—2016,使用预清洁的聚丙烯塑料瓶采集2 L表层水(0—30 cm),避光冷藏送回实验室并在-4 ℃的冰箱中保存,在7 d内完成水样的前处理.
-
仪器:快速液相色谱-三重四极杆串联质谱仪(Agilent 1260/ABSIEX 4000Q)、24位固相萃取装置(visiprep-24TMPL)、氮吹仪(ETEL4 MG-2200)和涡旋仪(SI Vortex-2)等.
试剂:甲醇(色谱纯、Honeywell)、乙腈(色谱纯、Honeywell)、醋酸铵(色谱纯、广州化学试剂厂)和氨水(色谱纯、广州化学试剂厂)等.
标准品:全氟己烷磺酸盐(PFHxS)、全氟己酸(PFHxA)、全氟庚酸(PFHpA)、全氟辛酸(PFOA)、全氟辛烷磺酸盐(PFOS)、全氟壬酸(PFNA)、全氟癸酸(PFDA)、全氟十一酸(PFUnA)、全氟十二酸(PFDoA)、全氟十三酸(PFTrDA)和全氟十四酸(PFTeDA)、13C4-全氟辛酸(MPFOA)、13C4-全氟辛烷磺酸(MPFOS)和13C2-全氟正癸酸(MPFDA)(Wellington,纯度≥98%).
其它材料:WAX固相萃取柱(Agela,6 mL/500 mg)、针头过滤器(疏水性聚丙烯材质,0.22 μm)、1.5 mL旋盖平底瓶等.
-
量取经0.22 μm滤膜过滤后的水样1.0 L,加入4.0 ng内标物质(MPFOA、MPFOS和MPFDA),水样以每秒1—2 滴过WAX固相萃取柱萃取,WAX小柱预先用4.0 mL含0.5%氨的甲醇溶液、4.0 mL甲醇和4.0 mL超纯水活化,上样完成后的小柱抽真空干燥,干燥后依次用4.0 mL 0.5%氨的甲醇溶液、4.0 mL甲醇洗脱,洗脱液收集于10 mL试管中,氮吹至1 mL,用0.22 μm滤膜过滤后转移至1.5 mL进样瓶中,待上机检测.
-
液相色谱条件:流动相为5 mmol·L−1醋酸铵水溶液和乙腈,进样体积为10 μL,柱温为40 ℃. 质谱测定条件:离子源为电喷雾离子源,负离子模式(ESI-),雾化器为N2,干燥器气为N2,喷雾电压为4500 V,质谱扫描方式为多反应离子监测(MRM),入口电压EP为10.00 V,碰撞室出口电压CXP=-15.00 V. 各化合物优化的保留时间,MRM离子对,碎裂电压,碰撞能量见表1.
-
实验室空白 为控制样品前处理过程可能带来的外源性污染,实验过程避免使用聚四氟乙烯材质的器皿. 实验过程采用10%实验室空白,仅PFOA单体有检出,质量浓度为0.04—0.06 ng·L−1,所有实验结果均为扣除空白后的数据.
实验室平行 实验过程采用10%实验室平行,平行样的相对标准偏差为2.4%—13.1%. 基质加标:实验过程采用10%基质加标,加标回收率范围为75.4%—108.6%.
检出限 11种PFASs的检出限为0.015—0.47 ng·L−1. 方法满足检测要求,数据真实可信.
-
在数据分析过程中采用ArcGIS进行采样点位图绘制;采用Origin9.1进行相关数据图件绘制;采用Spass20.1进行主成分分析.
-
风险熵值(RQ)定义为测量的环境浓度(MEC)与预测的无影响浓度(PNEC)的比值,见式(1).
式中,RQ为风险熵,无量纲;MEC为实测环境质量浓度,ng·L−1;PCNC为预测无效浓度,ng·L−1. 当RQ≥1.0时,认为存在高风险,当0.1≤RQ<1.0时,认为存在中风险,RQ<0.1时认为存在低风险[14].
健康风险值(HR)定义为每日平均摄入量(ADI)与参考剂量(RfD)的比值,见式(2)和(3). 式中,ρ为PFASs的质量浓度,ng·L−1;V为日均饮水摄入量,L·d−1;m为人体质量kg;ADI为每日平均摄入质量分数,ng·kg−1;RfD为日摄入质量分数的参考值,ng·kg−1·d−1. 当风险值HR≥1.0时,认为存在高风险;当风险值为0.1≤HR<1.0,认为存在中风险;当HR<0.1时,认为无风险[14].
-
对长三角地区水体中的11种PFASs进行检测分析,其中PFDoA、PFTrDA和PFTeDA未检出,其它PFASs的检出浓度见表2. PFDA和PFUnA的检出率分别为89.7%和48.3%,其它PFASs单体的检出率均为100%,说明PFASs在长三角地区广泛存在. 各采样点PFHxS、PFHxA、PFHpA、PFOA、PFOS、PFNA、PFDA和PFUnA的浓度分别为0.51—260 ng·L−1、0.92—688 ng·L−1、0.59—19.60 ng·L−1、4.49—517 ng·L−1、0.38—20.1 ng·L−1、0.04—3.50 ng·L−1、ND—1.73 ng·L−1和ND—0.64 ng·L−1,各PFASs单体之间浓度差异较大.
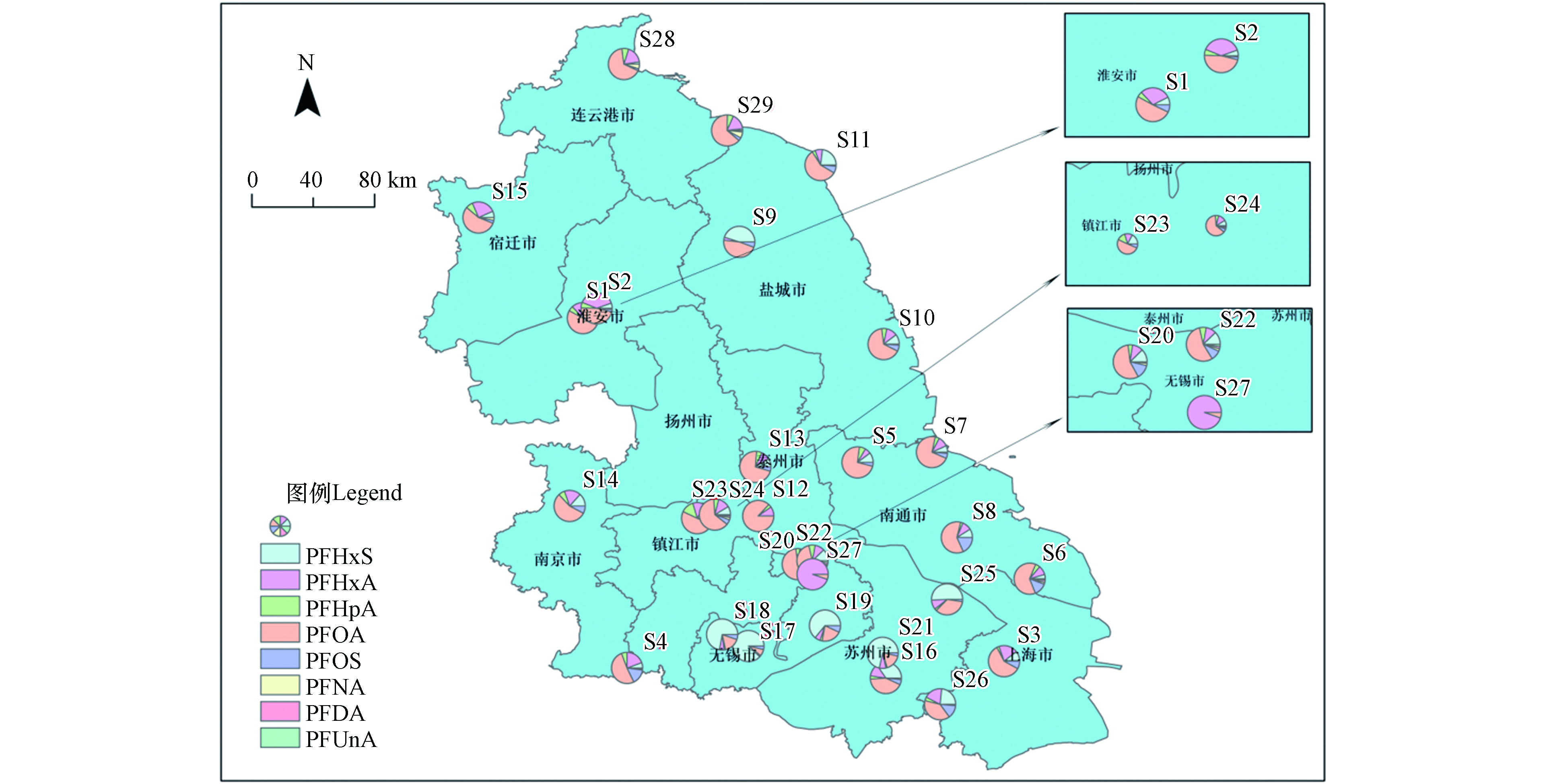
各采样点位Σ8PFASs浓度见表2,Σ8PFASs的浓度为8.64—736.74 ng·L−1,浓度最高的3个点位分别为S27(无锡市)、S12(泰州市)和S25(苏州市),浓度分别为736.74 ng·L−1、598.02 ng·L−1和381.38 ng·L−1,此3个点位Σ8PFASs浓度显著高于其它点位,调查发现此3个采样点周边均存在大型氟化工企业,较高的Σ8PFASs浓度可能是受到周边氟化工企业的影响.
各采样点位Σ8PFASs组成特征见图2,除无锡市的4个点位和苏州市的2个点位主要污染物为PFHxA、PFHxS以外,其它点位的主要污染物均为PFOA,占研究区域Σ8PFASs的58.40%±11.06%,说明长三角地区PFASs污染主要污染物为PFOA,这与Sun [12]等的研究结果一致,其中氟化工企业是PFOA的主要的潜在污染源[15],而长三角地区存在的大量的氟化工企业对PFOA高浓度污染具有重要贡献.
无锡市和苏州市部分采样点位主要污染物为PFHxA和PFHxS,说明采样点位附近可能存在PFHxA和PFHxS的污染源,近些年类似PFHxA和PFHxS的短链PFASs由于其较小的生物毒性和生物积累效应,被大量生产用于代替中长链PFASs,导致类似PFHxA和PFHxS的短链PFASs的污染浓度及所占的比例逐年升高[4].
与国内外其它地区PFASs污染的比较见表3,本研究区域PFOA污染处在较高的污染水平,而PFOS的污染水平较低. PFOA的高浓度污染可能主要与研究区域存在大量工业源有关,而PFOS污染浓度较低可能是由于近几年我国对PFOS实行了严格管控政策,使其生产、使用和排放量大大减少.
-
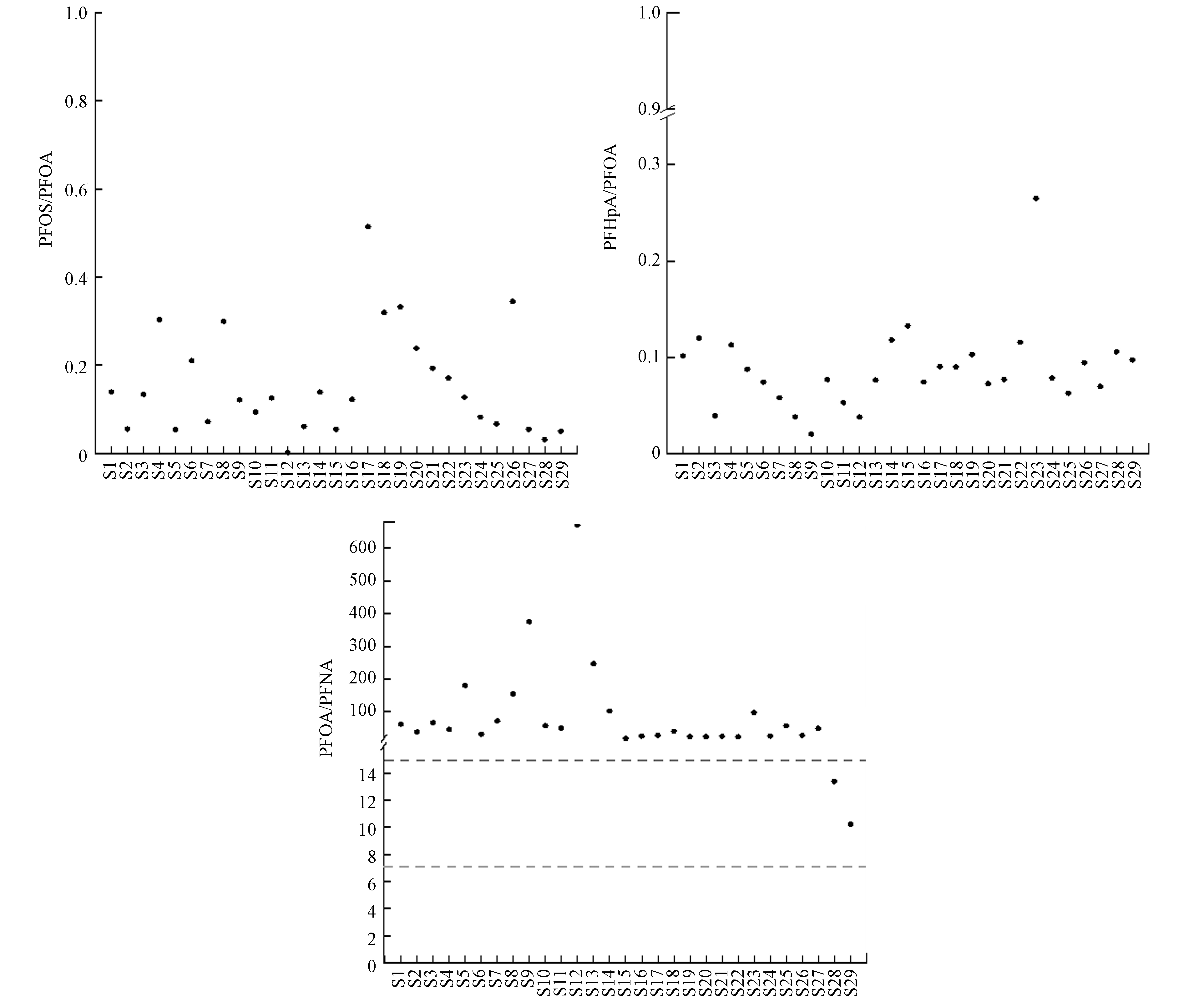
PFASs的组成可以在一定程度上反映污染源的信息,其中PFOS/PFOA、PFOA/PFNA和PFHpA/PFOA常被用于确定PFASs的潜在污染源,比值见图3. 当PFOS/PFOA>1认为该地区存在PFASs点源污染[27],研究区域PFOS/PFOA为0.03—0.51,表明研究区域存在面源污染. 当PFOA/PFNA<7时认为该地区PFASs污染主要来源于间接来源,7≤PFOA/PFNA≤15时认为该地区PFASs污染主要来源于工业直接排放,PFOA/PFNA≥15时认为PFASs污染主要来源于前驱体降解[28],其中S1—S27的PFOA/PFNA比值为18.30—670.55,表明S1—S27的PFASs污染主要来自前驱体降解;S28—S29的PFOA/PFNA比值为10.22—13.94,表明S28-S29的PFASs污染主要来源于工业排放. 当PFHpA/PFOA>1时,说明该地区主要受到大气沉降的影响[29],研究区域PFHpA/PFOA的比值为0.038—0.265,所有点位均远远小于1,表明研究区域PFASs分布受大气沉降影响较小.
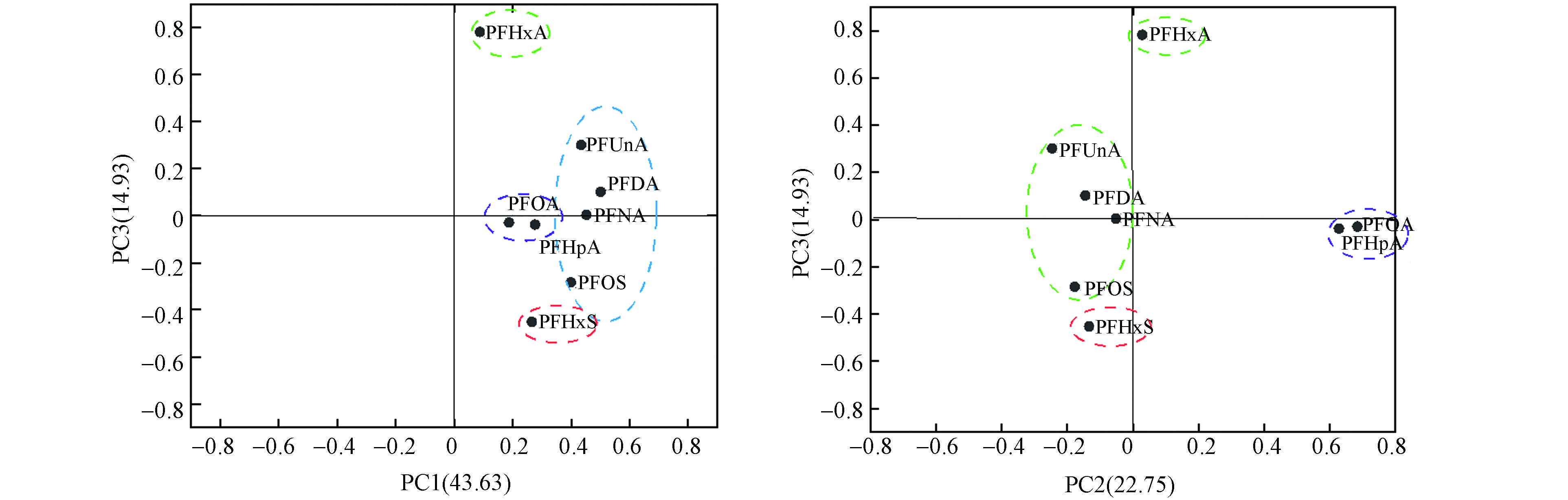
利用主成分分析法(PCA)进一步量化长三角地区PFASs污染的潜在来源及其贡献,本研究对29个点位检出PFASs含量数据进行PCA分析,结果如图4所示. 结果表明3个主成分可解释了长三角地区水环境中83.31%的PFASs污染来源,说明长三角地区PFASs主要来源于3种不同类型的污染来源. 其中PC1可解释长三角地区水环境中41.19%的PFASs来源,该成分中PFNA、PFUnA和PFOS具有较高的载荷;PC2可解释长三角地区25.15%的PFASs来源,该成分中PFOA和PFHpA具有较高的载荷;PC3可解释长三角地区14.96%的PFASs来源,其中PFHxA具有较高的载荷. PFASs的相关性分析结果见表4,PFDA、PFNA、PFUnA、PFOS之间和PFOA、PFHpA之间存在较好的相关性,相关系数分别为(R2=0.50—0.88,P≤0.01)和(R2=0.96,P≤0.01),也正说明了PFDA、PFNA、PFUnA、PFOS之间和PFOA、PFHpA之间可能具有一致的污染来源,而PFHxS和PFHxA与其它PFASs单体之间不存在相关性,说明PFHxS和PFHxA可能具有独立的污染来源. 根据PFASs不同来源的典型标志物可将解析因子与实际排放源结合起来,PFDA和PFNA是氟调醇(PTOH)降解的产物之一[30],同时PFDA污染的主要来源也为前体化合物降解[31],而PFOS曾经被广泛应用于纺织、电镀、石化和半导体工业,同时也是全氟辛基磺酰胺(EtFOS)的降解产物之一[32],由于近些年国家对PFOS实行了大力管控政策,禁止其生产、流通、使用和进出口,因此推测PFOS主要来源于前体化合物降解,由此PC1可解释长三角地区前体化合物的降解来源,所示特征并非点源污染,而为PFASs前体化合物生产使用后排放环境中又发生降解所形成的面源污染. PFHpA与PFOA常于表面活性剂、纺织和皮革等行业 [12],因此PC2可解释长三角地区上述行业的直接排放来源. PFHxA被广泛应用于皮革行业和食品包装行业,且在污水处理厂的进出水中也广泛存在[33],鉴于PFHxA与其它PFASs之间并不存在相关性,推测PFHxA主要污染来源可能为污水处理厂出水,因此PC3可解释长三角地区污水处理厂排放来源. 总体而言,长三角大部分地区水环境PFASs污染来源于前体化合物降解所形成的面污染源,少部分地区水环境PFASs污染来源于部分行业接排放形成的点污染源.
-
由于目前PFASs风险评价和健康风险评价参数的匮乏,仅对PFOA、PFOS、PFHxA、PFNA、PFDA进行生态风险评估,对PFOA、PFOS进行健康风险评估. PFASs的预测无影响浓度、日均饮水量、平均人体质量和日摄入质量分数等参数均参考文献报道. 其中PFOA、PFOS、PFHxA、PFNA和PFDA的预测无影响浓度分别为570000、1000、97000、100000、11000 ng·L−1[34],平均日均饮水量和平均人体质量分别为1.875 L·d−1和60.6 kg,PFOA和PFOS日摄入质量分数的参考值分别为200 ng·kg−1·d−1和80 ng·kg−1·d-1[34],PFASs的RQ值和HQ值见图5.
由图5可知,PFOS的RQ值略高于PFHxA、PFOA、PFNA和PFDA,但所有点位PFASs的RQ值均小于0.1,表明长三角地区PFASs污染浓度尚未达到对生态环境具有风险的水平. PFOA的HQ值略高于PFOS,但所有点位PFASs的HQ值均小于0.1,表明长三角地区水环境PFASs的污染浓度尚未达到对人体健康具有风险的水平. 该生态风险评价和健康风险评价采用的方法较为粗略,并且由于数据匮乏其余指标并未参评,也未考虑多种污染可能带来的复合风险. 此外PFASs难降解且具有较高的生物富集性,容易在人体内富集,因此PFASs对环境的潜在风险和人体健康风险仍不容忽视.
-
(1)研究区域水环境中除PFDoA、PFTrDA和PFTeDA以外的PFASs均有检出,检出率为48.3%—100%;ΣPFASs的浓度为8.64—736.74 ng·L−1,其中主要污染物为PFOA、PFHxA和PFHxS,其浓度范围分别为4.49—517 ng·L−1、0.92—688 ng·L−1和0.51—260 ng·L−1;对相比国内外其它研究,本研究区域水环境中PFOA的污染浓度处在较高的水平,而PFOS污染浓度处在较低的水平.
(2)对研究区域PFASs的污染进行了源解析研究,结果表明长三角大部分地区水环境中PFASs污染来源于前体化合物降解所形成的面污染源,少部分地区水环境PFASs污染来源于部分行业直接排放形成的点污染源.
(3)长三角地区水环境中PFASs的生态风险评价结果表明,PFOA、PFOS、PFHxA、PFNA和PFDA的生态风险熵值均低于参考值,健康风险评价结果表明PFOA和PFOS的健康风险熵值均低于参考值,表明长三角地区水环境PFASs的生态环境和人体健康的风险水平较低.
长三角地区水体中全氟化合物的污染特征及风险评价
Pollution characteristics and risk assessment of perfluoroalkyl substances in surface water from Yangtze River Delta
-
摘要: 为探究长三角地区水环境中全氟化合物(PFASs)的污染分布特征及风险水平,对长三角地区水环境中11种PFASs进行了研究. 通过固相萃取结合液相色谱-三重四极杆串联质谱的方法对该地区水环境中PFASs污染水平进行分析,并运用环境风险熵值法对该地区水环境中PFASs污染进行了风险评估. 结果表明PFASs在长三角地区广泛存在,Σ8PFASs浓度为8.64—736.74 ng·L−1,其中主要污染物为全氟辛酸(PFOA)、全氟己酸(PFHxA)和全氟己烷磺酸盐(PFHxS),其浓度范围分别为4.49—517 ng·L−1、0.92—688 ng·L−1和0.51—260 ng·L−1. 源解析结果表明长三角大部分地区水环境中PFASs污染来源于前体化合物降解所形成的面污染源,少部分地区水环境PFASs污染来源于部分行业直接排放形成的点污染源. 风险评估结果显示该地区水环境中PFASs的生态风险值和健康风险熵值均低于参考值,对生态环境和人体健康的风险水平较低.Abstract: In order to investigate the pollution characteristics of the perfluoroalkyl substances (PFASs) in Yangtze River Delta region, 11 PFASs were systematically investigated in the water of Yangtze River Delta region. The concentrations of PFASs in study region were analyzed by high performance liquid chromatography-triple quadrupole tandem mass spectrometry and the risk level in water of PFASs in study region was evaluated by risk quotient method. The results suggested that PFASs are widespread in the Yangtze River Delta region and total concentration of PFASs ranged from 8.64 ng·L−1 to 736.74 ng·L−1. Pentadecafluorooctanoic acid (PFOA), Perfluorohexanoic acid (PFHxA) and sodium perfluorohexanesulfonate (PFHxS)were dominant pollutants, with their concentrations of 4.49—517 ng·L−1, 0.92—688 ng·L−1 and 0.51—260 ng·L−1, respectively. In most areas of the Yangtze River Delta, PFASs pollution comes from no-point pollution sources formed by degradation of precursor compounds, while in a few areas of the Yangtze River Delta, PFASs pollution comes from point pollution sources formed by direct discharge of some industries. The preliminary risk assessment suggested that PFASs have lower environmental risk to local aquatic ecosystem and no health risk to human health.
-
醛酮类羰基化合物是环境中一类重要污染物[1-4],是我国及世界许多国家和地区重点监测的环境污染物之一。环境中醛酮类化合物一次污染源主要来源于工业排放、植被释放、香烟烟雾、烹饪油烟以及化石燃料和植物燃烧[5-9] 等。大气中VOCs的光氧化反应是醛酮类羰基化合物二次排放的主要来源[10]。在水[11-12]、土壤和沉积物[13-14],尤其是大气[15-16]等介质中均有不同程度的检出。
测定醛酮类羰基化合物主要有GC法[17]、GC/MS(/MS)法[7-18],毛细管电泳-紫外法[19]、HPLC法[13-15, 20]以及HPLC/MS法[12, 21]等。空气样品醛酮类化合物中最常用的方法是用涂敷2,4-二硝基苯肼(DNPH)的硅胶管采集,使目标物与DNPH在酸性介质中发生衍生化反应生成醛酮-DNPH腙衍生物,用反相液相色谱法分离,紫外检测器检测。
LC对比GC和GC/MS法的缺点是分辨率低、分析时间长、溶剂用量大,但GC或GC/MS只能分析样品在进样系统不发生分解且能产生较高不受干扰色谱或质谱峰的羰基化合物或羰基化合物衍生物,而大部分高沸点羰基化合物衍生物容易分解,使得GC或GC/MS分析的目标物种类受到很大限制。LC-MS(/MS)对比LC-UV主要优势在于其选择性和灵敏度,但LC法仪器成本低、方法稳定性好也是其不可被替代的优势。Ochs等[22-23] 建立了RRLC-APCI(-)-MS/MS法测定31种羰基化合物,并与RRLC-UV法的线性、相关系数、检测限和灵敏度进行了比较,RRLC-UV法灵敏度更高;RRLC-APCI(-)-MS/MS检测限为0.71—10.3 µg·L−1,略低于RRLC-UV法,但方法定性准确更高。Zurek等[24]对比了APCI和ESI正离子模式下测定羰基化合物与4-二甲氨基-6-(4-甲氧基-1-萘基)-1,3,5-三嗪-2-肼(DMNTH) 的Hantzsch衍生反应产物。随着高分辨质谱技术的发展,化合物定性准确性又有了大幅提高。孟志娟等[25] 将Orbitrap GC-MS用于农产品中70种农药残留的快速筛查分析,陈溪等[26]用UPLC-Q-Orbitrap MS对水中112种药品及个人护理品进行了筛查和定量测定,112 种PPCPs 的定量限可达 0.002—0. 8 µg·L−1,准确性和灵敏度大大提高。目前还未发现使用液相色谱/高分辨质谱分析醛酮类化合物的报道。
本论文深入研究了25种羰基化合物-DNPH衍生物的HPLC-UV、UPLC-ESI-MS/MS和UPLC-ESI-Q- Orbitrap MS的最佳分析条件,建立了各自对应分析方法,并对分析结果的分离度、分辨率、检出限、线性范围和定性准确性等分析特征进行了比较评价。使用3种方法分别对加标模拟样及天津市大气实际样品进行了分析测定,明确3种方法各自特点和适用范围,Orbitrap MS还可对样品中非靶标污染物进行准确识别,并可通过理化性质相似的已知浓度化合物响应因子比较,提供半定量结果,为复杂环境样品污染物精准识别和准确检测提供了有力技术支持。
1. 实验部分(Experimental section)
1.1 仪器、试剂与材料
高效液相色谱仪,带二极管阵列检测器(Agilent1260,美国Agilent公司);超高效液相色谱-串联质谱仪,带电喷雾离子源(Agilent 1290/6460,美国Agilent公司);超高效液相色谱-电喷雾离子源-四极杆/静电场轨道阱高分辨质谱仪(Ultimate 3000-Q Exactive Focuse,美国Thermo Fisher公司);N-EVAP111氮吹仪(Organomation公司);Milli-Q超纯水系统(美国Millipore公司);色谱柱1:Agilent ZORBAX Extend-C18,4.6 mm×250 mm,5 µm;色谱柱2 Agilent ZORBAX Eclipse Plus C18,2.1 mm×100 mm,1.8 μm (美国Agilent公司);色谱柱3:Thermo Accucore RP-MS,2.1 mm×100 mm,2.6 µm(美国Thermo公司);Cleanert DNPH-Silica醛酮气体采样管 (200 mg·3mL−1)及臭氧去除管(240 mg·3mL−1)(天津艾杰尔飞诺美公司);0.22 µm尼龙水相针式滤膜(美国Supelco公司)。
25种醛酮-DNPH标准溶液,15 mg·L−1(美国ChemTek公司),分别为甲醛、乙醛、丙烯醛、丙酮、糠醛、丙醛、巴豆醛/丁烯醛、丁酮、甲基丙烯醛、丁醛、苯甲醛、异戊醛、环己酮、戊二醛、戊醛、对,间,邻-甲基苯甲醛、甲基异丁基酮、己醛、2,5-二甲基苯甲醛、庚醛、辛醛、壬醛和癸醛的DNPH衍生物;16种醛酮类标准液1000 mg·L−1(包括甲醛、乙醛、丙烯醛、丙酮、丙醛、丁烯醛、丁酮、丁醛、苯甲醛、异戊醛、戊醛、对,间,邻-甲基苯甲醛、己醛、2,5-二甲基苯甲醛,CHEM SERVICE公司),其余9种醛酮为标准品,均为色谱纯 (DIKMA公司);2,4-二硝基苯肼(DNPH) (99.5%,百灵威公司);甲醇、乙腈(液相色谱纯,MERCK公司);超纯水,经Milli-Q超纯水器纯化得到。
1.2 标准溶液配制
分别取9种醛酮类标准品用乙腈配制成质量浓度为1000 mg·L−1的混合储备溶液,与16种醛酮类标准溶液一起,各取100 µL于10 mL容量瓶中,用乙腈定容,配制成10 mg·L−1的25种醛酮类混合标准工作溶液,低于4 ℃冰箱保存。
1.3 样品采集和保存
环境空气按照HJ 683—2014和EPA TO-11的规定采集样品,在真空泵的作用下,气体样品经除臭氧小柱去除臭氧后,用 DNPH柱吸附,样品中醛酮类化合物与DNPH发生衍生化反应。采样流量0.5 L·min−1,采气体积100 L。采样管用密封帽将两端管口封闭,放入避光密封袋中,低于4 ℃保存,时间不超过7 d。
1.4 样品制备
用乙腈洗脱采样管,洗脱方向与采样时气流方向相反,将洗脱液收集于5 mL容量瓶中,用氮吹仪浓缩至≤0.5 mL(液相色谱法浓缩至≤1.0 mL),若存在未溶解的橘红色颗粒物,用少量乙腈溶解,乙腈含量应≤0.5 mL,用纯水定容至1.0 mL,混匀,经针头过滤器过滤,滤液收集于2 mL棕色样品瓶中,待测。
1.5 仪器条件和参数
1.5.1 HPLC-UV分析条件
(1)色谱柱1;柱温:40 ℃;流动相:A相为纯水,B相为乙腈;检测波长:360 nm;进样量:10 μL。流速:1.0 mL·min−1。
(2)梯度洗脱程序:0—15 min,60%B; 15—23 min,60%—100%B;23—34 min,100%B;34—34.1 min,100%—60%B;34—36 min,60%B。
1.5.2 UPLC-ESI-MS/MS分析条件
(1)色谱柱2;柱温:40 ℃;流动相 A:1 mmol·mol−1乙酸铵/水溶液;流动相B:乙腈;流速:0. 3 mL·min−1;进样量:10 µL。
(2)梯度洗脱程序:0—18 min,60%—70%B;18—23 min,70%—90%B;23—26 min,90%B;26—26.1 min,95%—60%B;26.1—30 min,60%B。
(3)质谱条件:离子源:ESI,负离子模式;干燥气流量:10 L·min−1,温度:300 ℃;毛细管电压:4000 V;监测方式:MRM(多反应监测)。优化后得到25种醛酮腙的MRM条件见表1。
表 1 目标化合物的多反应监测条件Table 1. MRM parameters for target compounds序号No. 化合物缩写Compound abbreviation 化合物Compound 分子式Molecular formula 母离子Precursor ions(m/z) 子离子Product ions(m/z) 碎裂电压/VFragmenter 碰撞能/eVCE 1 DNPH 2,4-二硝基苯肼2,4-dinitrophenylhydrazine C6H6N4O4 197 137 60 8 167.1 4 2 FA 甲醛-DNPHFormaldehyde-DNPH C7H6N4O4 209 163.1 100 0 151.1 0 3 AA 乙醛-DNPHAcetaldehyde-DNPH C8H8N4O4 223 46.1 100 16 163.1 0 4 ACR 丙烯醛-DNPHAcrolein-DNPH C9H8N4O4 235 158.2 100 4 163.1 28 5 PA 丙醛-DNPHPropionaldehyde-DNPH C9H10N4O4 237.1 46.1 100 20 163.1 16 6 AK 丙酮-DNPHActone-DNPH C9H10N4O4 237.1 46.1 100 20 122.0 0 7 CA 巴豆醛/丁烯醛-DNPHCrotonaldehyde-DNPH C10H10N4O4 249.1 172.1 100 4 46.2 12 8 MA 甲基丙烯醛-DNPHMethacrolein-DNPH C10H10N4O4 249.1 46.2 100 12 172.1 4 9 BK 丁酮-DNPHButanone-DNPH C10H12N4O4 251.1 152.1 100 8 122.0 16 10 BA 丁醛-DNPHButylaldehyde-DNPH C10H12N4O4 251.1 152.1 100 8 122.0 16 11 IVA 异戊醛-DNPHIsovaleraldehyde-DNPH C11H14N4O4 265.1 152.1 100 12 163.1 4 12 VA 戊醛-DNPHValeraldehyde-DNPH C11H14N4O4 265.1 152.1 100 12 163.1 4 13 2-FA 糠醛-DNPH2-Furaldehyde-DNPH C11H8N4O5 275 46.1 100 12 228.0 4 14 CHK 环己酮-DNPHCyclohexanone-DNPH C12H14N4O4 277.1 247.2 100 4 231.1 12 15 HEXA 己醛-DNPHHexaldehyde-DNPH C12H16N4O4 279.1 152.0 100 12 122.0 28 16 MIBK 甲基异丁基酮-DNPHMethyl Isobutyl Ketone-DNPH C12H16N4O4 279.1 152.0 100 12 122.0 28 17 BZA 苯甲醛-DNPHBenzaldehyde-DNPH C13H10N4O4 285.1 46.2 100 20 163.1 20 18 HEPA 庚醛-DNPHHeptaldehyde-DNPH C13H18N4O4 293.1 152.1 100 12 163.2 4 19 o-TA 邻-甲基苯甲醛-DNPHo-Tolualdehyde-DNPH C14H12N4O4 299.1 162.9 100 8 252.1 8 20,21 p,m-TA 对,间-甲基苯甲醛-DNPHp,m-Tolualdehyde-DNPH C14H12N4O4 299.1 162.9 100 8 252.1 8 22 OA 辛醛-DNPHOctanal-DNPH C14H20N4O4 307.1 152.1 100 20 163.0 8 23 DMBA 2,5-二甲基苯甲醛2,5-Dimethylbenzaldehyde-DNPH C15H14N4O4 313.1 181.0 140 20 163.0 20 24 NA 壬醛-DNPHNonanal-DNPH C15H22N4O4 321.1 152.0 140 20 46.1 56 25 DA 癸醛-DNPHDecanal-DNPH C16H24N4O4 335.2 152.1 140 20 163.0 8 26 GA 戊二醛-DNPHGlutaraldehyde-DNPH C17H16N8O8 459.1 182.1 140 12 179.0 8 1.5.3 UPLC-ESI-Q-Orbitrap MS分析条件
(1)色谱柱3;柱温:40 ℃;流动相A:1 mmol·mol−1乙酸铵/水溶液;流动相B:乙腈;流速:0.3 mL·min−1;进样量:10 µL。
(2)梯度洗脱:0—5 min, 50% B; 5—15 min, 50%—60% B; 15—20 min, 60%—70% B; 20—24 min, 70%—80% B; 24—25 min, 80%—95% B; 25—28 min, 95% B; 28—28.1 min, 95%—50% B; 28.1—30 min, 50% B。
(3)离子化模式:HESI电离源;扫描模式:负离子模式;毛细管温度: 325 ℃;加热温度: 350 ℃;鞘气: N2,流速 40 arb;辅助气: N2,流速10 arb;喷雾电压:2800 V; 透镜电压:60 V。
(4)扫描模式:全扫描/数据依赖二级(Full MS/dd-MS2)用于筛查、定性和定量,Full MS参数:分辨率 70000,自动增益控制目标(AGC target) 1×106,最大驻留时间(maximum IT) 100 ms,扫描范围 m/z50—600;dd-MS2参数:分辨率17500,AGC target2×105,最大驻留时间60 ms,动态排除8.0 s;NCE/Stepped NCE 25、45、65,Loop count 3,Isolation window 1.0 m/z。
2. 结果与讨论(Results and discussion)
2.1 色谱条件优化
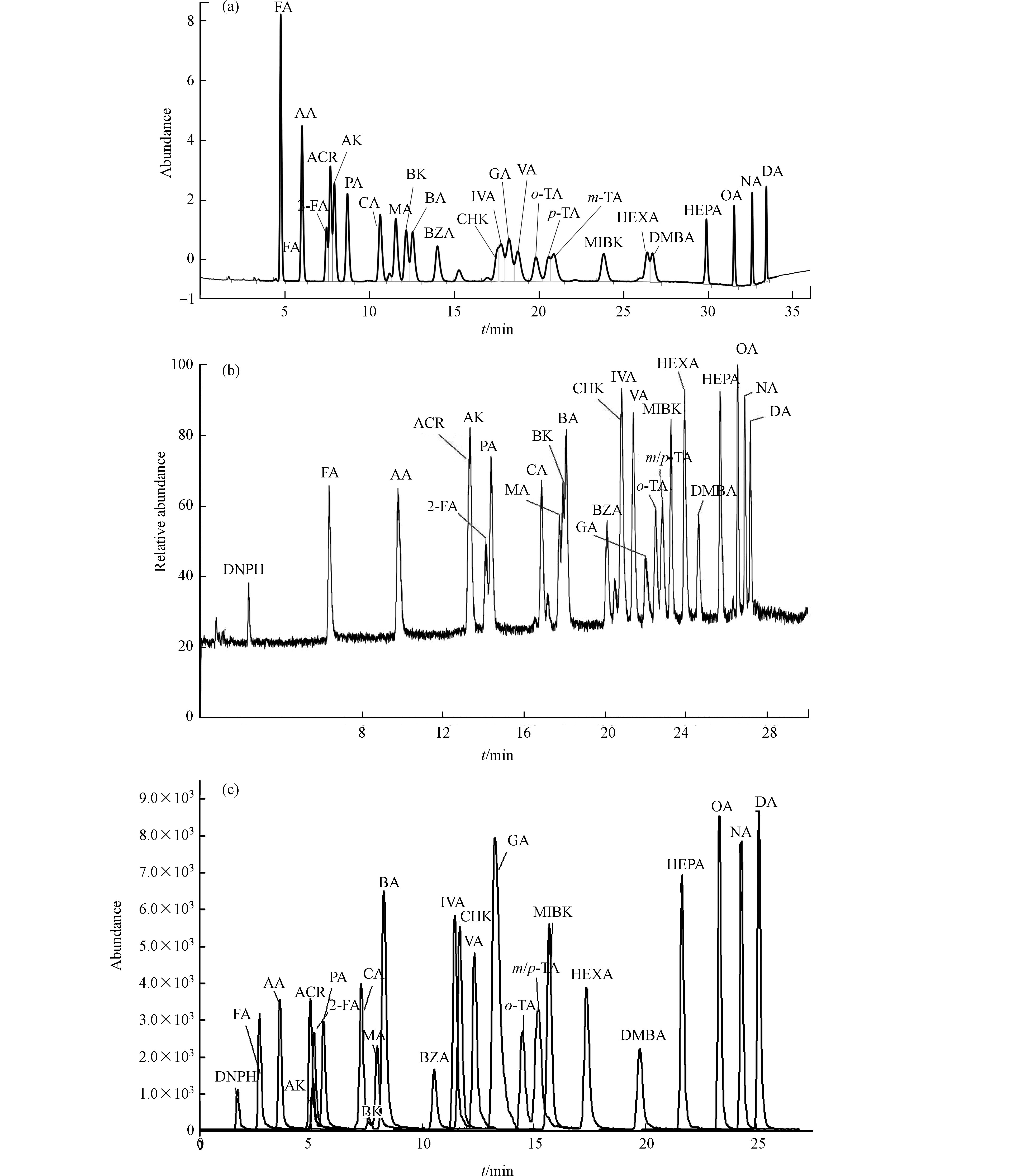
对25种浓度为150 µg·L−1羰基化合物-DNPH混合标准溶液用3种分析仪器在优化的质谱条件下分别进行分离测定,通过优化各自的最佳流动相梯度,各自分别考察了柱1:Agilent ZORBAX Extend-C18、柱2:Agilent ZORBAX Eclipse Plus C18和柱3:Thermo Accucore RP-MS的分离效果。25种目标物中含丙烯醛、丙酮、糠醛;环己酮、戊二醛、异戊醛、戊醛;邻,间,对-甲基苯甲醛等3组难分离物质。
UV法用化合物的特征紫外吸收波长以及其保留时间定性,大部分化合物最佳吸收波长均为360 nm,难分离物质需要单标辅助定性,否则容易造成目标峰识别错误,这对化合物分离的要求更高。通过调整流动相梯度,只有柱1能够实现所有化合物识别(对,间-甲基苯甲醛能够在峰顶分离,环己酮和戊二醛分离最差,仅能分辨出是两种物质接近共流出),其他两根色谱柱均完全不能实现这两组难分离物质对的识别,因此UV法选择柱1进行分析测定。
质谱法均为串联超高效液相色谱,色谱柱容量比常压液相色谱小,溶剂效应影响较大,因此待分析物质溶剂中有机相比例不能高于流动相的初始比例,否则容易出现色谱峰变形,使分离变差。柱2和柱3均为超高压液相色谱柱,适用于质谱的分析。通过优化各自最佳的分离条件,两根色谱柱在各自质谱仪上分辨率相差不大,最终MS/MS法选择柱2,Orbitrap MS法以柱3为分析柱。柱2和柱3除对,间-甲基苯甲醛不能实现分离外,其余化合物在30 min之内均可获得良好的分离度和尖锐对称的色谱峰形.
由于MS/MS法是以特征离子对和保留时间定性、特征子离子定量,Orbitrap MS法以保留时间和具有精确质量数的二级特征碎片离子定性、母离子定量,因此对,间-甲基苯甲醛合并定量外,其他保留时间接近化合物均可不受对方干扰,即可准确定性定量。具体色谱分析条件优化结果见1.5节,本研究3根色谱柱25种目标物出峰顺序略有不同,具体见图1—(a),(b),(c)。
2.2 质谱条件优化
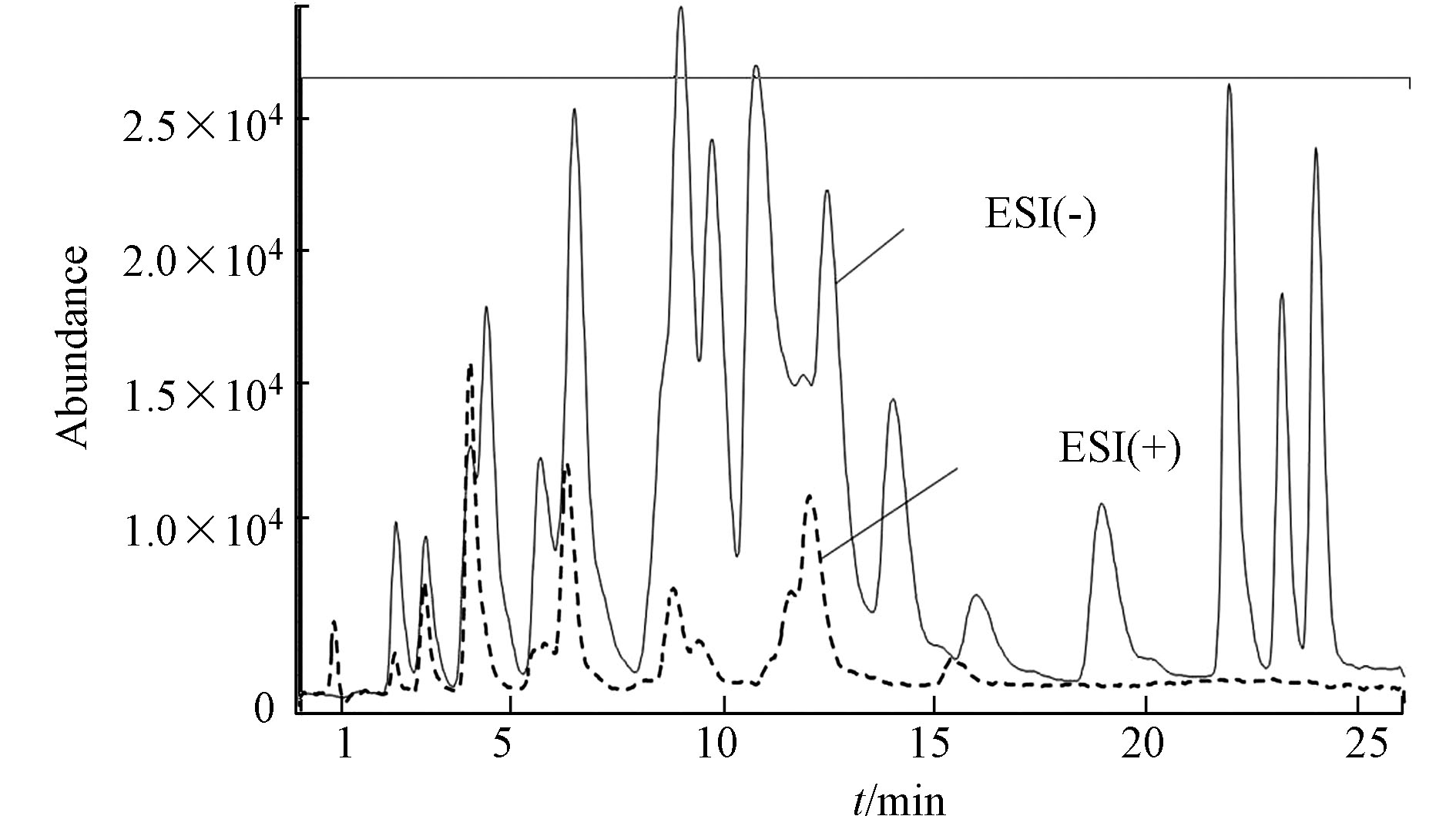
羰基化合物-DNPH结构使得ESI离子源采用正/负离子模式都有可能,通过负离子模式以甲醇−1 mmol/mol乙酸铵/水溶液为流动相,正离子模式以甲醇−0.1%甲酸/水溶液为流动相,在MS/MS法分别优化最佳子离子及最佳离子响应、最佳framgenger和CE值,Orbitrap MS优化了最佳NCE值条件下,测定各自ESI(+/−)模式下的分离度和响应值,结果发现在相同的分离情况下,负离子模式对大多数目标物具有更高的响应值。图2即为MS/MS法ESI(+/−)总离子流图的比较。Orbitrap MS ESI(+/−)母离子提取质谱图对比发现同样是ESI(−)比ESI(+)具有更高的响应值,更适合分析25种醛酮类羰基化合物。具体质谱分析优化条件结果见1.5节。
2.3 方法评价
2.3.1 方法线性关系及检出限
分别量取一定量的羰基化合物-DNPH标准溶液于1.0 mL棕色进样瓶中,用纯水定容,混匀。配制成质量浓度分别为0.45、0.75、1.50、3.00、4.50、7.50、15.0、30.0、45.0、75.0、150、300、450、750、1500 µg·L−1的标准系列,在各自优化的色谱和质谱条件下,UV以目标物色谱峰面积、MS/MS法以母离子对应的定量子离子峰面积、Orbitrap MS以母离子的提取色谱峰面积为纵坐标,以目标物的质量浓度为横坐标,绘制标准曲线,具体线性范围、相关系数测定结果见表2。由测定结果可见,3组曲线相关系数r均大于 0.990,UV法比MS/MS法线性范围更宽,UV法所有目标物在15—1500 µg·L−1内线性关系良好,而MS/MS法线性最高点仅为300 µg·L−1。Orbitrap MS法测定浓度最低,约为0.45—300 µg·L−1。方法检出限测定按照HJ168—2010规定的方法,采用向空白醛酮采样管中加标的方式(不同检测方法加标量分别为各化合物线性最低点对应的量,按采样量为100 L,定容体积为1.0 mL计算),测定7组模拟样品,按照样品测定方法进行测定,并计算标准偏差,以3.14倍标准偏差计算方法检出限,测定结果见表2。由表2可见,各目标物检出限 UV法略高于MS/MS法,分别在0.12—0.40 µg·m−3和0.08—0.60 µg·m−3之间,Orbitrap MS法最低,在1.1—13 ng·m−3之间,更适用于环境低浓度样品的测定。
表 2 不同方法测定25种醛酮类化合物线性方程、相关系数、方法检出限比较Table 2. Comparison of linear equations, correlation Coefficients, method detection limits of 25 carbonyl derivatives by different methods化合物compound HPLC-UV法 HPLC-ESI-MS/MS法 HPLC-ESI-Q-Orbitrap MS法 线性方程Linear equations 线性范围/ (µg·L−1)Linear range 相关系数r 检出限/ (µg·m−3)MDL 线性方程Linear equations 线性范围/(µg·L−1)Linear range 相关系数r 检出限/ (µg·m−3)MDL 线性方程Linear equations 线性范围/(µg·L−1)Linear range 相关系数r 检出限/ (ng·m−3)MDL FA y=0.362x+0.807 3.0—1500 0.999 0.12 y=226x+55.6 15—300 0.999 0.15 y=7.43e6x+2.026e6 0.75—300 0.999 7.5 AA y=0.267x+0.670 7.5—1500 0.999 0.15 y=259x+130 7.5—300 0.997 0.08 y=1.0917x−3.0536 0.75—300 0.999 4.6 2-FA y=0.0981x+0.256 15—1500 0.999 0.25 y=143x+181 7.5—300 0.996 0.08 y=1.06e7x−6.78e6 0.75—300 0.999 6.5 ACR y=0.231x+0.679 15—1500 0.999 0.15 y=213x+80.2 7.5—300 0.994 0.08 y=1.47e6x−1.57e6 0.75—300 0.999 4.5 AK y=0.209x+0.486 15—1500 1.000 0.16 y=121x+176 7.5—300 0.995 0.08 y=6.87e6x−1.16e6 1.50—300 0.999 15 PA y=0.207x+0.524 15—1500 0.999 0.16 y=430x+545 7.5—300 0.997 0.08 y=1.16e7x−5.58e6 0.75—300 0.999 8.5 CA y=0.182x+0.365 15—1500 0.999 0.20 y=342x+396 7.5—300 0.997 0.08 y=1.53e7x−5.54e6 0.75—150 0.999 9.1 MA y=0.184x+0.722 15—1500 0.999 0.20 y=352x+290 7.5—300 0.999 0.08 y=1.51e7x−6.12e5 0.45—300 0.999 5.1 BK y=0.153x+0.338 15—1500 0.999 0.21 y=764x−10.6 7.5—300 0.994 0.08 y=7.04e6x−3.74e6 1.50—300 0.999 15 BA y=0.160x+0.388 15—1500 0.999 0.21 y=889x+109 7.5—300 0.998 0.08 y=1.47e7x−9.78e4 0.75—300 0.999 7.5 BZA y=0.125x+0.255 15—1500 0.999 0.25 y=165x+70.3 15—300 0.998 0.15 y=1.58e7x-4.47e6 0.45—75.0 0.999 4.5 CHK y=0.0911x+0.310 30—1500 0.999 0.28 y=191x+172 30—300 0.998 0.30 y=7.20e6x-2.61e6 0.45—150 0.999 3.8 IVA y=0.113x+1.16 30—1500 0.999 0.30 y=538x+109 7.5—300 0.998 0.08 y=3.14e7x−9.02e6 0.45—300 0.999 4.1 GA y=0.191x+1.10 30—1500 0.999 0.30 y=1939x1549 7.5—300 0.998 0.08 y=1.69e7x−2.16e6 1.50—75.0 0.999 15 VA y=0.119x+1.33 30—1500 0.999 0.35 y=798x+29.3 7.5—300 0.999 0.08 y=1.50e7x+1.90e6 0.45—300 0.999 4.5 o−TA y=0.105x+1.50 30—1500 0.999 0.38 y=325x+276 30—300 0.995 0.30 y=1.63e7x−6.86e6 0.75—75.0 0.999 5.5 p−TA y=0.0879x+0.496 30—1500 0.999 0.38 y=567x+283 60—600 0.997 0.60 y=2.66e7x+4.00e6 1.5—150 0.999 5.5 m−TA y=0.121x−0.0047 30—1500 0.999 0.38 MIBK y=0.120x+0.258 30—1500 0.999 0.38 y=838x+346 7.5—300 0.998 0.08 y=1.09e7x−6.70e6 0.45—300 0.999 4.5 DMBA y=0.102x+0.927 30—1500 0.999 0.40 y=278x+266 30—300 0.998 0.30 y=1.48e7x−4.44e6 0.45—75.0 0.999 3.5 HEXA y=0.0951x+0.241 30—1500 0.999 0.40 y=521x+266 15—300 0.993 0.15 y=1.58e7x+6.15e6 0.45—300 0.999 3.8 HEPA y=0.108x+0.378 15—1500 0.999 0.20 y=509x+111 7.5—300 0.997 0.08 y=1.53e7x+2.39e6 0.45—300 0.999 2.5 OA y=0.0954x+0.192 15—1500 0.999 0.20 y=553x+738 7.5—300 0.996 0.08 y=1.74e7x−4.66e6 0.45—75.0 0.999 1.1 NA y=0.0897x+0.117 15—1500 1.000 0.21 y=638x+116 7.5—300 0.994 0.08 y=1.81e7x−2.58e6 0.45—75.0 0.999 1.1 DA y=0.0840x+0.709 15—1500 0.999 0.21 y=854x+308 7.5—300 0.997 0.08 y=1.82e7x+2.24e6 0.45—75.0 0.999 1.1 2.3.2 方法精密度和准确度
向3个6组空白醛酮采样管口分别加入25种醛酮标准混合溶液,按照样品采集方法,用高纯氮气代替实际样品,模拟采集环境空气中醛、酮类化合物,连续采样 1 h,制成加标量分别为75 ng的模拟样品,按照样品测定方法进行测定,计算加标回收率平均值和相对标准偏差。具体测定结果见表3。25种目标物的UV法、MS/MS法和Orbitrap MS测得平均回收率范围分别为68.9%—98.8%,67.9%—97.6%和66.5%—107%,相对标准偏差范围分别为4.9%—10%,6.9%—18%和5.6%—11%,精密度和准确度均能够满足测定要求。
表 3 UV法、MS/MS法和Orbitrap法精密度、准确度和实际样品测定结果比较Table 3. Comparison of the accuracy, precision and real sample test results by UV, MS/MS and Orbitrap methods respectively化合物Compound 加标样/% Spiked sample(n=6) 样品1/(µg·m−3) Sample 1 样品2/(µg·m−3) Sample 2 UV MS/MS Orbitrap MS UV MS/MS Orbitrap MS UV MS/MS Orbitrap MS 回收率Recovery RSD 回收率Recovery RSD 回收率Recovery RSD FA 94.7 10.4 90.3 12 97.9 7.1 2.31 2.06 2.25 2.45 2.70 2.56 AA 98.8 7.3 90.7 8.1 107 8.9 2.05 1.78 1.96 1.80 1.76 1.92 2-FA 83.6 7.1 86.1 7.9 88.5 5.6 ND ND 0.052 ND ND 0.017 ACR 75.8 7.5 67.9 6.9 74.1 6.2 ND 0.146 0.136 ND ND 0.049 AK 81.3 7.4 70.3 12 74.5 11 3.27 3.13 3.80 2.78 2.67 2.84 PA 90.9 5.6 89.5 13 94.5 7.1 0.33 0.25 0.300 0.25 0.22 0.229 CA 84.1 5.9 78.7 8.8 81.5 8.9 ND ND 0.10 ND ND 0.013 MA 85.3 6.6 80.2 9.1 83.3 7.8 ND ND 0.033 ND ND 0.016 BK 77.4 9.7 78.6 15 66.5 6.7 0.64 0.702 0.656 0.35 0.41 0.364 BA 68.9 5.5 75.6 8.2 85.3 7.9 0.41 0.468 0.477 0.22 0.26 0.235 BZA 91.1 5.6 92.5 9.6 97.4 9.7 ND ND 0.114 ND ND 0.043 CHK 75.6 8.8 70.7 14 86.7 8.2 ND 0.46 0.048 ND ND 0.040 IVA 80.9 7.4 78.9 17 94.8 9.9 ND 0.12 0.108 ND ND 0.027 GA 71.7 9.8 72.5 18 77.1 11 ND ND ND ND ND ND VA 79.3 5.8 75.1 12 99.4 7.5 ND 0.33 0.274 ND 0.12 0.117 o−TA 79.3 4.9 80.1 11 98.4 8.1 ND ND 0.015 ND ND ND p−TA 92.9 7.6 97.6 12 101 8.7 ND ND 0.009 ND ND ND m−TA 90.5 6.7 ND ND MIBK 82.2 5.4 78.4 8.8 77.7 6.2 ND ND 0.040 ND ND 0.015 DMBA 90.8 7.1 91.2 16 93.2 8.6 ND ND 0.024 ND ND 0.007 HEXA 84.8 7.6 83.4 8.8 79.4 9.2 ND 0.40 0.334 0.50 0.63 0.536 HEPA 86.5 7.3 78.3 11 81.0 7.8 ND 0.16 0.192 0.31 0.29 0.322 OA 93.2 8.4 87.8 9.3 90.9 5.7 0.47 0.54 0.518 0.83 0.78 0.895 NA 90.9 6.7 88.7 10 86.4 9.1 2.29 2.12 2.40 4.45 4.37 4.84 DA 93.4 7.9 92.2 15 90.4 7.7 0.43 0.31 0.336 0.77 0.71 0.820 注:ND., 未检出. ND., not detected. 2.4 实际样品分析
将所建立的方法应用于来自天津市区某采样点于2020年3月9日(样品1)和3月27日(样品2)采集的环境空气样品,采用相同的前处理方法,制备好的试样分别分成3份,使用不同分析仪器针对25种羰基化合物分别进行了定性和定量测定。
测定结果见根据测定结果可知,2个样品中除戊二醛未检出、样品2苯甲醛未检出外,Orbitrap法24种目标物均有检出,且其保留时间及一级母离子精确质量数测定值与理论值相差均<5×10−6,二级质谱5个碎片与筛查谱库离子碎片一致,测得24种目标物平均浓度在0.007—4.84 µg·m−3之间,其中浓度最高分别为丙酮、甲醛、乙醛、壬醛和己醛,浓度均高于1.00 µg·m−3;浓度最低依次是甲基苯甲醛、甲基丙烯醛、糠醛、丁烯醛和甲基异丁基酮。3种方法UV法和MS/MS法检出的化合物均远少于Orbitrap法,UV法检出最少。3种方法均能检出的目标物相对偏差均小于20%。
3. 结论(Conclusion)
本研究通过优化流动相梯度、最佳离子化模式和离子对、最佳碰撞能量等色谱质谱条件,建立了分别用HPLC-UV、UPLC-ESI-MS/MS和UPLC-ESI-Q-Orbitrap MS法同时测定空气中25种醛酮类羰基化合物的分析方法并进行了比较。研究结果表明3种检测方法线性相关系数、精密度和准确度均良好,MS方法定性准确性高,检出限较UV法低,而Orbitrap MS法最低,可达ng·m−3水平。UV法适用于检测相对高浓度样品,线性范围最宽;MS/MS法适用于测定中等浓度样品;而Orbitrap MS法适用于环境中低浓度样品检测,同时通过分析碎片离子,根据裂解规律、母离子和子离子精确质量,还可扩展筛查其他可能存在的非靶标羰基化合物。3种方法应用于实际样品测定发现Orbitrap MS法能够准确定性定量测定的化合物种类最多,UV法最少,但3种法均能检出的目标物相对偏差均小于20%。3种方法各有侧重,相互补充,为环境醛酮类羰基化合物准确定性定量提供了完善的技术手段,同时为其他适用于液相色谱和液相色谱质谱测定的化合物方法建立提供了可靠的例证。
-
表 1 PFASs检测的质谱条件
Table 1. MS conditions for the detection of PFASs
化合物Compounds 母离子Precursor ions 定性离子Qualitative ion 定量离子Quantitative ion 去簇电压/VDeclustering potential 碰撞能/V Collision energy PFHxA 312.9 269.0 118.9 −40.00 −13.00/−30.00 PFHpA 362.8 318.8 168.9 −49.00 −15.00/−26.00 PFOA 412.8 369.0 168.8 −45.00 −15.00/−26.00 PFNA 462.9 418.8 218.7 −38.00 −16.00/−25.00 PFDA 513.0 469.0 269.0 −50.00 −17.00/−26.00 PFUnA 563.0 519.1 269.1 −45.00 −17.00/−28.00 PFDoA 613.1 569.0 268.8 −50.00 −19.00/−29.00 PFHxS 398.8 79.9 98.8 −80.00 −75.00/−60.00 PFOS 498.9 79.9 98.9 −70.00 −85.00/75.00 PFTeDA 713.0 669.1 319.0 −55.00 −23.00/−35.00 PFTrDA 663.0 619.0 269.0 −55.00 −20.00/−35.00 表 2 长三角地区地表水中PFASs的污染浓度(ng·L−1)
Table 2. Concentration of PFASs in the waters from Yangtze River Delta(ng·L−1)
PFHxS PFHxA PFHpA PFOA PFOS PFNA PFDA PFUnA Σ8PFASs 检出率 100% 100% 100% 100% 100% 100% 89.7% 48.3% 11.60 S1 0.85 3.40 0.59 5.85 0.82 0.09 ND ND 14.73 S2 0.79 5.67 0.83 6.88 0.38 0.18 ND ND 185.21 S3 19.2 35.8 4.23 108 14.5 1.64 1.22 0.62 22.99 S4 1.27 4.48 1.33 11.8 3.58 0.26 0.27 ND 14.57 S5 1.49 0.92 0.93 10.6 0.58 0.06 ND ND 37.93 S6 1.67 3.60 1.76 23.7 4.99 0.77 0.89 0.55 22.44 S7 1.49 2.37 0.93 16.0 1.15 0.22 0.28 ND 26.65 S8 2.36 2.59 0.61 16.0 4.80 0.10 0.19 ND 128.30 S9 57.3 3.96 1.17 58.5 7.13 0.16 0.08 ND 26.38 S10 2.70 3.05 1.33 17.3 1.63 0.31 0.07 ND 33.60 S11 7.74 2.57 1.02 19.3 2.43 0.39 0.16 ND 598.02 S12 1.25 58.0 19.60 517 1.07 0.77 0.33 ND 14.56 S13 1.28 1.36 0.79 10.4 0.64 0.04 0.05 ND 20.23 S14 2.68 3.44 1.31 11.1 1.55 0.11 0.04 ND 22.45 S15 1.46 5.59 1.63 12.3 0.68 0.67 0.12 ND 194.88 S16 66.7 25.4 6.03 81.3 9.97 3.22 1.73 0.53 299.40 S17 260 4.66 1.84 20.4 10.5 0.74 0.80 0.45 99.36 S18 71.1 4.70 1.45 16.1 5.15 0.40 0.29 0.17 166.44 S19 105 9.45 3.53 34.3 11.4 1.44 0.82 0.50 62.39 S20 7.69 6.47 2.52 34.8 8.30 1.45 0.79 0.37 217.67 S21 154 14.7 2.81 36.6 7.07 1.51 0.71 0.27 25.71 S22 3.13 2.59 1.64 14.2 2.43 0.61 0.56 0.55 8.94 S23 1.53 1.09 1.19 4.49 0.57 0.05 0.02 ND 56.07 S24 4.80 7.06 2.78 35.4 2.93 1.41 1.05 0.64 381.38 S25 192 36.8 8.29 132 8.88 2.33 0.79 0.29 150.77 S26 35.0 28.4 5.50 58.3 20.1 2.11 0.99 0.38 736.74 S27 3.00 688 2.70 38.8 2.12 0.78 0.73 0.61 22.35 S28 0.51 3.94 1.54 14.6 0.46 1.09 0.21 ND 56.32 S29 0.98 9.33 3.48 35.8 1.80 3.50 0.92 0.52 8.94 注:“ND”表示低于检出限,统计时浓度以0计. Note: “ND” means lower than the detection limit, and the concentration is counted as 0 during statistics. 表 3 国内外其它地区水体中PFOA和PFOS浓度
Table 3. PFOA and PFOS concentrations in surface water from China and other countries.
地区Location 点位数Sites number 时间Year 全氟辛酸/(ng·L−1)PFOA 全氟辛烷磺酸盐/ (ng·L−1)PFOS 参考文献 References 中国阜新 7 2009 27.2—668 0.28—0.54 [16] 中国聊城 3 2014—2015 3.9—5.4 0.5—1.3 [13] 中国东北地区 32 2014 1.52—18.0 ND—13.0 [17] 中国北京 34 2015 4.21—98.52 2.24—121.62 [18] 中国杭州 32 2013—2014 34.66—197.8 ND [19] 中国武汉 23 2010 ND—256 ND—88.9 [20] 日本 79 2003 0.10—456.41 0.24—37.32 [21] 越南 47 2013—2015 ND—53.5 ND—40.2 [22] 法国 315 2012 0.08—36 0.01—197 [23] 荷兰 21 2007 6.5—43 4.7—32 [24] 北欧 40 2013 0.21—4.2 0.040—6.9 [25] 意大利 19 2007 1—1270 0—25 [26] 中国长三角地区 29 2019 4.49—517 0.38—20.10 本研究 表 4 长三角地区地表水中PFASs的相关性
Table 4. Correlation of PFASs in the waters from Yangtze River Delta
PFHxS PFHxA PFHpA PFOA PFOS PFNA PFDA PFUnA PFHxS 1.00 −0.07 0.14 0.04 0.50** 0.29 0.35 0.27 PFHxA 1.00 0.09 0.07 0.06 0.03 0.15 0.32 PFHpA 1.00 0.96** 0.20 0.38 0.31 0.13 PFOA 1.00 0.07 0.18 0.15 −0.01 PFOS 1.00 0.52** 0.67** 0.52** PFNA 1.00 0.83** 0.65** PFDA 1.00 0.88** PFUnA 1.00 注:**,P≤0.01 -
[1] ZHANG M, WANG P, LU Y L, et al. Bioaccumulation and human exposure of perfluoroalkyl acids (PFAAs) in vegetables from the largest vegetable production base of China [J]. Environment International, 2020, 135: 105347. doi: 10.1016/j.envint.2019.105347 [2] RYU H, LI B K, de GUISE S, et al. Recent progress in the detection of emerging contaminants PFASs [J]. Journal of Hazardous Materials, 2021, 408: 124437. doi: 10.1016/j.jhazmat.2020.124437 [3] YANG L, WANG T Y, ZHOU Y Q, et al. Contamination, source and potential risks of pharmaceuticals and personal products (PPCPs) in Baiyangdian Basin, an intensive human intervention area, China [J]. Science of the Total Environment, 2021, 760: 144080. doi: 10.1016/j.scitotenv.2020.144080 [4] LI Y, ZHANG L Y, DING J, et al. Prioritization of pharmaceuticals in water environment in China based on environmental criteria and risk analysis of top-priority pharmaceuticals [J]. Journal of Environmental Management, 2020, 253: 109732. doi: 10.1016/j.jenvman.2019.109732 [5] ZHOU J, LI Z, GUO X T, et al. Evidences for replacing legacy per- and polyfluoroalkyl substances with emerging ones in Fen and Wei River Basins in central and Western China [J]. Journal of Hazardous Materials, 2019, 377: 78-87. doi: 10.1016/j.jhazmat.2019.05.050 [6] 陈静, 王琳玲, 朱湖地, 等. 东湖表层水体中全氟辛酸和全氟辛磺酸空间分布特征 [J]. 环境科学, 2012, 33(8): 2586-2591. doi: 10.13227/j.hjkx.2012.08.035 CHEN J, WANG L L, ZHU H D, et al. Spatial distribution of perfluorooctanoic acids and perfluorinate sulphonates in surface water of east lake [J]. Environmental Science, 2012, 33(8): 2586-2591(in Chinese). doi: 10.13227/j.hjkx.2012.08.035
[7] 张大文, 王冬根, 张莉, 等. 太湖梅梁湾全氟化合物污染现状研究 [J]. 环境科学学报, 2012, 32(12): 2978-2985. doi: 10.13671/j.hjkxxb.2012.12.016 ZHANG D W, WANG D G, ZHANG L, et al. A study on the perfluorinated compounds pollution in Meiliang Bay, Taihu Lake [J]. Acta Scientiae Circumstantiae, 2012, 32(12): 2978-2985(in Chinese). doi: 10.13671/j.hjkxxb.2012.12.016
[8] GAO J, DONG S H, YU H F, et al. Source apportionment for online dataset at a megacity in China using a new PTT-PMF model [J]. Atmospheric Environment, 2020, 229: 117457. doi: 10.1016/j.atmosenv.2020.117457 [9] ZHAO Y G, WONG C K C, WONG M H. Environmental contamination, human exposure and body loadings of perfluorooctane sulfonate (PFOS), focusing on Asian countries [J]. Chemosphere, 2012, 89(4): 355-368. doi: 10.1016/j.chemosphere.2012.05.043 [10] PAN C G, YING G G, ZHAO J L, et al. Spatial distribution of perfluoroalkyl substances in surface sediments of five major rivers in China [J]. Archives of Environmental Contamination and Toxicology, 2015, 68(3): 566-576. doi: 10.1007/s00244-014-0113-8 [11] SUN R, WU M H, TANG L, et al. Perfluorinated compounds in surface waters of Shanghai, China: Source analysis and risk assessment [J]. Ecotoxicology and Environmental Safety, 2018, 149: 88-95. doi: 10.1016/j.ecoenv.2017.11.012 [12] SUN Z Y, ZHANG C J, YAN H, et al. Spatiotemporal distribution and potential sources of perfluoroalkyl acids in Huangpu River, Shanghai, China [J]. Chemosphere, 2017, 174: 127-135. doi: 10.1016/j.chemosphere.2017.01.122 [13] CHEN S, JIAO X C, GAI N, et al. Perfluorinated compounds in soil, surface water, and groundwater from rural areas in Eastern China [J]. Environmental Pollution, 2016, 211: 124-131. doi: 10.1016/j.envpol.2015.12.024 [14] YAN C X, YANG Y, ZHOU J L, et al. Antibiotics in the surface water of the Yangtze Estuary: Occurrence, distribution and risk assessment [J]. Environmental Pollution, 2013, 175: 22-29. doi: 10.1016/j.envpol.2012.12.008 [15] CHEN C L, LU Y L, ZHANG X, et al. A review of spatial and temporal assessment of PFOS and PFOA contamination in China [J]. Chemistry and Ecology, 2009, 25(3): 163-177. doi: 10.1080/02757540902918321 [16] BAO J, LIU W, LIU L, et al. Perfluorinated compounds in the environment and the blood of residents living near fluorochemical plants in Fuxin, China [J]. Environmental Science & Technology, 2011, 45(19): 8075-8080. [17] GONG X X, LIU R X, LI B, et al. Perfluoroalkyl acids in Daliao River system of northeast China: Determination, distribution and ecological risk [J]. Environmental Earth Sciences, 2016, 75(6): 469. doi: 10.1007/s12665-016-5345-7 [18] ZHANG Y Z, WANG B, WANG W, et al. Occurrence and source apportionment of Per- and poly-fluorinated compounds (PFCs) in North Canal Basin, Beijing [J]. Scientific Reports, 2016, 6: 36683. doi: 10.1038/srep36683 [19] XU H Y, ZHU J Q, LEI C, et al. The investigation of perfluorinated compounds in surface waters of the Xixi wetland, Hangzhou, China [J]. Bulletin of Environmental Contamination and Toxicology, 2016, 97(6): 770-775. doi: 10.1007/s00128-016-1954-9 [20] TONG L, LIAO X, CHEN J S, et al. Pollution characteristics of ambient volatile organic compounds (VOCs) in the southeast coastal cities of China [J]. Environmental Science and Pollution Research, 2013, 20(4): 2603-2615. doi: 10.1007/s11356-012-1187-3 [21] SAITO N, HARADA K, INOUE K, et al. Perfluorooctanoate and perfluorooctane sulfonate concentrations in surface water in Japan [J]. Journal of Occupational Health, 2004, 46(1): 49-59. doi: 10.1539/joh.46.49 [22] LAM N H, CHO C R, KANNAN K, et al. A nationwide survey of perfluorinated alkyl substances in waters, sediment and biota collected from aquatic environment in Vietnam: Distributions and bioconcentration profiles [J]. Journal of Hazardous Materials, 2017, 323: 116-127. doi: 10.1016/j.jhazmat.2016.04.010 [23] MUNOZ G, GIRAUDEL J L, BOTTA F, et al. Spatial distribution and partitioning behavior of selected poly- and perfluoroalkyl substances in freshwater ecosystems: A French nationwide survey [J]. Science of the Total Environment, 2015, 517: 48-56. doi: 10.1016/j.scitotenv.2015.02.043 [24] KWADIJK C J A F, KORYTÁR P, KOELMANS A A. Distribution of perfluorinated compounds in aquatic systems in the Netherlands [J]. Environmental Science & Technology, 2010, 44(10): 3746-3751. [25] NGUYEN M A, WIBERG K, RIBELI E, et al. Spatial distribution and source tracing of per- and polyfluoroalkyl substances (PFASs) in surface water in Northern Europe [J]. Environmental Pollution, 2017, 220: 1438-1446. doi: 10.1016/j.envpol.2016.10.089 [26] LOOS R, LOCORO G, HUBER T, et al. Analysis of perfluorooctanoate (PFOA) and other perfluorinated compounds (PFCs) in the River Po watershed in N-Italy [J]. Chemosphere, 2008, 71(2): 306-313. doi: 10.1016/j.chemosphere.2007.09.022 [27] GUO C S, ZHANG Y, ZHAO X, et al. Distribution, source characterization and inventory of perfluoroalkyl substances in Taihu Lake, China [J]. Chemosphere, 2015, 127: 201-207. doi: 10.1016/j.chemosphere.2015.01.053 [28] PAN C G, YING G G, LIU Y S, et al. Contamination profiles of perfluoroalkyl substances in five typical rivers of the Pearl River Delta region, South China [J]. Chemosphere, 2014, 114: 16-25. doi: 10.1016/j.chemosphere.2014.04.005 [29] YOUNG C J, FURDUI V I, FRANKLIN J, et al. Perfluorinated acids in Arctic snow: New evidence for atmospheric formation [J]. Environmental Science & Technology, 2007, 41(10): 3455-3461. [30] FASANO W J, CARPENTER S C, GANNON S A, et al. Absorption, distribution, metabolism, and elimination of 8-2 fluorotelomer alcohol in the rat [J]. Toxicological Sciences, 2006, 91(2): 341-355. doi: 10.1093/toxsci/kfj160 [31] 齐彦杰. 中国湖泊沉积物中全氟化合物的空间分布、历史沉积行为及源解析[D]. 杨凌: 西北农林科技大学, 2016. QI Y J. Spatial distribution, historical deposition behaviors and source apportionment of perfluoroalkyl substances in sediments from the lakes of China[D]. Yangling: Northwest A & F University, 2016(in Chinese).
[32] TOMY G T, TITTLEMIER S A, PALACE V P, et al. Biotransformation of N-ethyl perfluorooctanesulfonamide by rainbow trout (Onchorhynchus mykiss) liver microsomes [J]. Environmental Science & Technology, 2004, 38(3): 758-762. [33] HOKE R A, BOUCHELLE L D, FERRELL B D, et al. Comparative acute freshwater hazard assessment and preliminary PNEC development for eight fluorinated acids [J]. Chemosphere, 2012, 87(7): 725-733. doi: 10.1016/j.chemosphere.2011.12.066 [34] XIAO F, HALBACH T R, SIMCIK M F, et al. Input characterization of perfluoroalkyl substances in wastewater treatment plants: Source discrimination by exploratory data analysis [J]. Water Research, 2012, 46(9): 3101-3109. doi: 10.1016/j.watres.2012.03.027 -






 DownLoad:
DownLoad: