-
全氟及多氟代烷基化合物 (per- and polyfluoroalkyl substances, PFASs) 是一类人工合成的高氟化学品,被应用于不同的工业和商业产品中,如纺织品、地毯和消防泡沫[1-2]。2001年,全氟辛烷磺酸 (perfluorooctane sulfonate, PFOS) 首次在野生动物中被检测到,此后其在许多野生动物(比如,北极狐、北极熊和海洋生物)和人体中被广泛检出[3-7]。啮齿动物的实验室研究表明,PFAS暴露会降低实验动物体重,增加肝脏重量,引发癌症,改变脂质代谢的路径,且在高剂量暴露时导致机体死亡[8-9]。2009年,PFOS及其盐类和全氟辛基磺酰氟被列入《斯德哥尔摩公约》的持久性有机污染物名单附件B[10]。随着PFOS被逐步淘汰,PFOS替代品开始被大规模使用,如氯化多氟醚磺酸盐 (chlorinated polyfluorinated ether sulfonic acids, 商品名F-53B)。F-53B的主要成分是6:2 氯化多氟醚磺酸盐 (6:2 chlorinated polyfluorinated ether sulfonic acid, 6:2 Cl-PFESA),其中还包括两个同系物杂质 (8:2 Cl-PFESA和10:2 Cl-PFESA)[11]。F-53B主要用途是作为铬电镀行业中的铬雾抑制剂,在中国的年产量约为20—30 t[12]。2013年,Wang等在中国温州市的镀铬电镀行业的废水首次检测到高浓度的F-53B (43—122 μg·L−1)[13],此后,其在野生动物和人体中被检测到[11-12]。F-53B已被证实具有和PFOS类似的生物持久性,生物积累性以及生物毒性。Wang等发现,F-53B对斑马鱼有中度的急性毒性且难以生物降解[13];Cui等研究表明,在黑斑蛙中6:2 Cl-PFESA (平均生物积累因子:1304 L·kg−1) 的生物累积因子高于PFOS (1050 L·kg−1)[12]。越来越多的研究表明F-53B暴露存在潜在生态和健康风险[12]。然而,目前很少的研究对F-53B进行系统的毒理学评价,关于F-53B引起的生物代谢紊乱方面的研究仍存在局限。
本研究采用代谢组学技术和多元统计分析评估新型氟化物 (F-53B) 生物扰动情况,旨在通过1H-NMR代谢组学技术和多元统计分析评估由F-53B暴露引起的大鼠血清代谢紊乱情况。研究结果有助于了解F-53B对哺乳动物的毒性和代谢扰动效应,揭示F-53B潜在代谢机制和健康风险,并为综合评价F-53B的毒理风险提供数据支持。
-
分析级NaH2PO4.2H2O 和K2HPO4·3H2O (Sinopharm, China);F-53B (J&K, China);BRUKER 600 MHz AVANCE III HD (Bruker, Germany);离心机 (Eppendorf, Germany);−80℃ MDF-U32V冰箱 (SANYO, Japan);Milli-Q 超纯水仪 (Millipore, America)。
-
雄性SD大鼠 (3周) 10只,从上海斯莱克实验动物有限责任公司购买,饲养于浙江中医药大学 (中国,杭州) 的SPF实验室动物研究中心。实验环境保持相对稳定,温度为20—25°C,相对湿度为45%—55%,光周期12 h光/12 h暗。适应性饲养1周后,将大鼠随机分为对照组 (超纯水,n = 5) 和F-53B暴露组 (50 μg·kg−1·d−1 F-53B, n = 5),采用灌胃方式进行暴露。暴露28 d后,收集大鼠血液并处死大鼠。待血液完全凝固后,离心 (10000 r·min−1, 4 ℃, 10 min) 分离血清,最后将血清放置于-80℃冰箱中以进行后续实验。本研究开始前,先进行预实验确定相关暴露浓度。预实验结果表明,当大鼠灌胃浓度为50 μg·kg−1·d−1时,其血清中F-53B浓度与普通人群(非职业暴露人群)血清中F-53B浓度相似 (1.5—6 ng·mL−1) [11, 14].
-
按照之前Gu等所报道的方法进行预处理与NMR分析[15]。血清充分解冻后,取血清 (300 μL) 与PBS (210 μL, pH 7.4, 50 mmol·L−1) 混合,并离心 (12000 r·min−1, 4℃, 15 min) 以除去沉淀物。随后,取500 μL清液转移至NMR管 (5 mm)中,在298 K条件下,通过有三共振反向 TXI 探头的BRUKER 600 MHz AVANCE III HD进行分析检测。自旋-自旋弛豫延迟总时间设置为80 ms,以过滤大分子信号,保留Carr-Purcell-Meiboom-Gill (CPMG) 脉冲序列 [RD-90°-(τ-180°-τ)n-acq] 中小分子信号。谱宽为12 kHz,采集点数为64 K,采集时间为2.73 s。在傅里叶变换前,所有样品谱图均乘以增宽因子为0.3 Hz的指数窗函数,并手动对谱图进行相位及基线校正,在乳酸 δ 1.33 ppm处定标。通过Chenomx NMR Suite (Chenomx Inc., Canada, Version 7.0) 识别代谢物的NMR信号。
-
使用MestReNova (Mestrelab Research S.L., Espain, Version 9.0) 对NMR图谱数据进行预处理,每段积分区域的宽度为0.001 ppm,积分有效范围为δ 0.20—9.00,而δ 4.68—5.02的积分值设为0,以消除水峰压制所造成的影响。最后,将所有积分值进行概率商归一化处理。
将商归一化的的积分值导入SIMCA14.1 (Umetrics AB, Umea, Sweden) 进行多元统计分析:主成分分析 (PCA)、偏最小二乘判别分析 (PLS-DA) 和正交偏最小二乘判别分析 (OPLS-DA)。
-
采用响应排序实验(RPT)验证OPLS-DA模型的鲁棒性。使用变量权重重要性排序(VIP)和载荷权重的相关系数 (Pcorr,用 |r| 表示) 识别差异代谢物。在MATLAB中重构OPLS-DA载荷图中,将VIP > 1且 |r| > 0.765的峰顶标为红色,视为变量统计学差异极其显著;将VIP > 1且0.632 < |r| < 0.765之间的峰顶标为橘红色,视为变量统计学差异显著;将VIP < 1或 |r| < 0.632 的峰顶标为蓝色,视为变量无统计学显著差异。根据筛选出的差异性变量对应的化学位移 (ppm),利用HMDB数据库和Chenomx NMR Suite 8.0 (Chenomx, Canada)确定差异性代谢物。
-
基于代谢物的相对浓度,使用Metabo Analyst 5.0 在线网站中的 Pathway Analysis 模块分析代谢通路的变化。代谢通路分析包括代谢通路富集分析(Metabolite Set Enrichment Analysis, MESA)和通路拓扑分析(Pathway Topology Analysis, PTA)。作为揭示代谢物水平变化中具有生物学意义和类型的新工具,MESA 通过计算统计 |r| 值来评估一组功能相关的代谢物是否显着富集。此外,在代谢网络中,重要节点的代谢变化可能比发生在相对孤立或边界节点中的代谢变化对通路产生的影响更为重要。本研究进行了路径拓扑分析,使用相对介数中心性算法计算通路影响值 (Pathway Impact Values, PIV), 根据 |r| 值和 PIV 值定义显著代谢紊乱的途径。
-
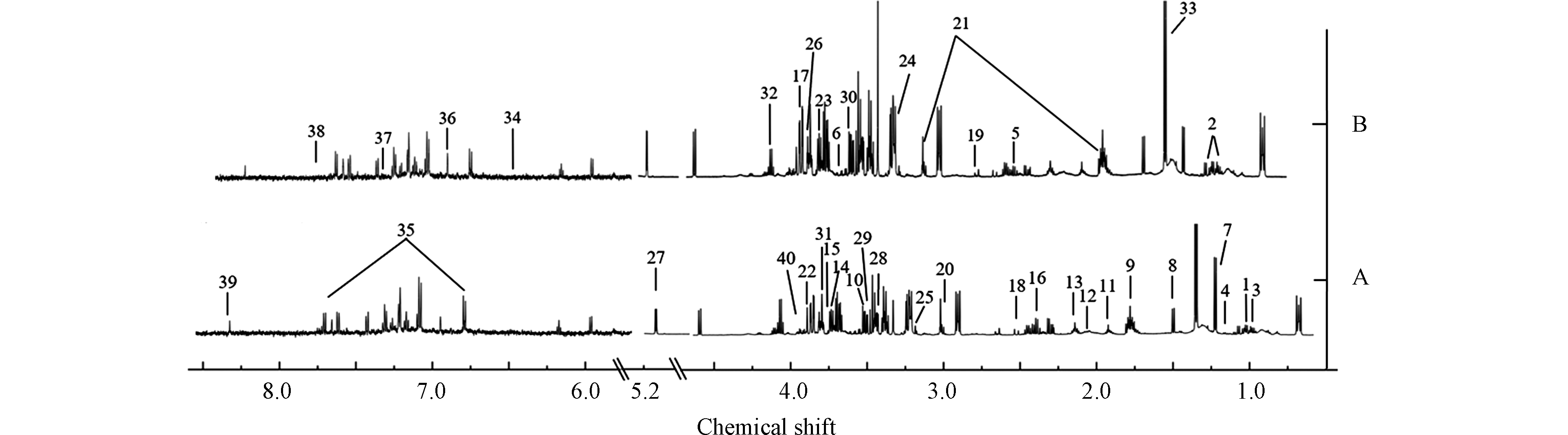
大鼠血清样品的 1H-NMR 典型谱如图1所示。
根据HMDB数据库 (Human Metabolome Database, http://www.hmdb.ca) 和 Chenomx NMR Suite 8.0 (Chenomx, Canada),对代谢产物的 NMR 信号进行指认,结果如表1所示。代谢物的NMR信号通过TOCSY谱图验证。
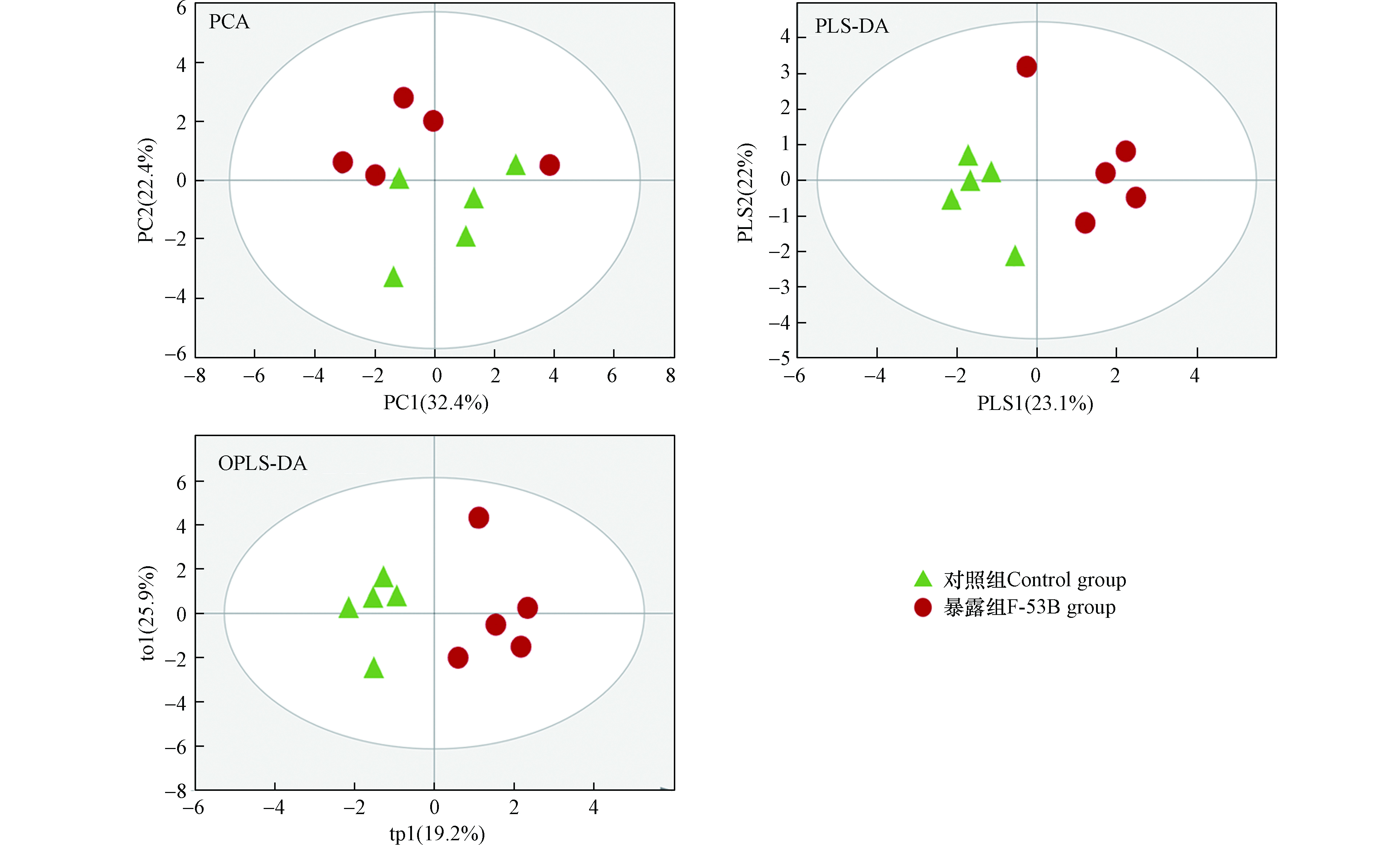
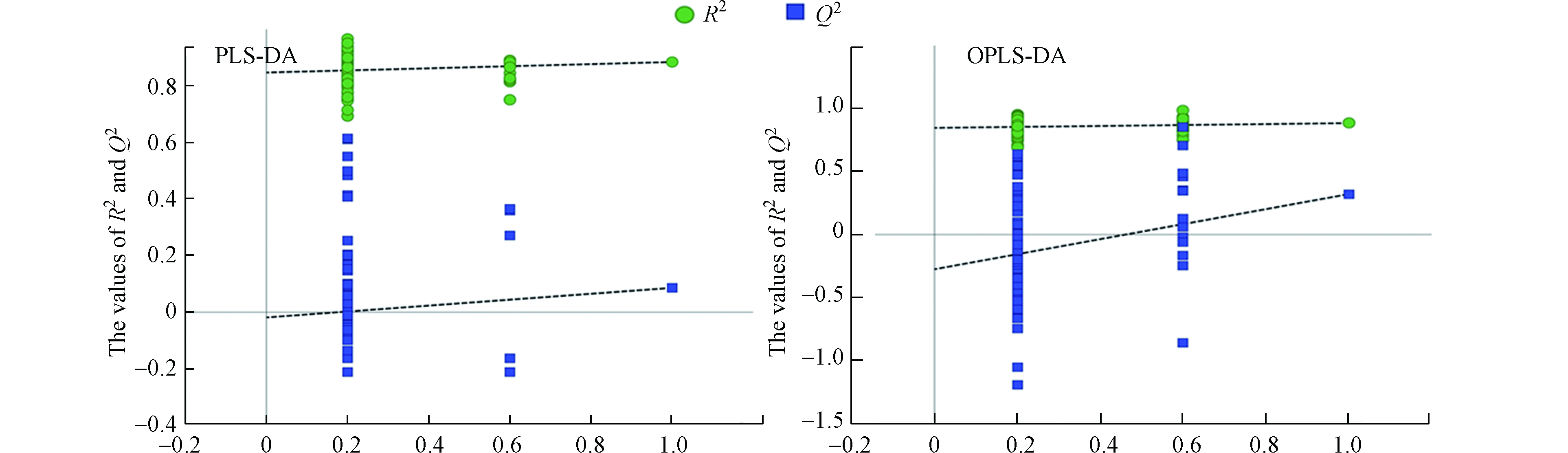
运用多元统计方法进行差异代谢物的筛选和后续分析。首先采用PCA评估F-53B暴露后大鼠代谢表型和代谢产物的变化。PCA得分结果显示 (图2),对照组和暴露组并不能完全区分。进一步用PLS-DA 分析,PLS-DA得分的结果显示 (图2),对照组和暴露组在第一主成分(PC1)区分明显,但其中一个F-53B暴露大鼠血清样本被误判为对照组。不同的代谢表型揭示了两组中产生的代谢物的差异较大,为了进一步确认两组的差异代谢物,本研究基于NMR数据集构建了OPLS-DA模型(图2),将差异性变量集中于第一主成分上(tp1)。OPLS-DA的得分图表明暴露组和对照组能够完全区分,两组能够完全聚集在不同区域从而显示差异。PLS-DA和OPLS-DA模型均使用100次响应排序实验 (RPT)来验证相应模型的鲁棒性,各模型验证得到的R2 > Q2并且Q2回归线与Y轴截距 < 0,表明模型未过拟合。RPT的结果表明,PLS-DA和OPLS-DA模型所分类结果合理可靠 (图3)。
-
采用OPLS-DA模型第一主成分的VIP值以及 |r| 值筛选出差异性代谢物。F-53B暴露后,大鼠血清中存在17个差异代谢物 (图4,表2),主要是氨基酸代谢物和碳水化合物代谢物,其中7个代谢物浓度显著上升和10个代谢物浓度显著下降。浓度上升的代谢物包括鸟氨酸(ornithine),天冬酰胺 (asparagine),苏氨酸 (threonine),组氨酸 (histidine),葡萄糖 (glucose),甘油磷酰胆碱 (GPC),脂质 (lipid)。浓度下降的代谢物包括丙氨酸 (alanine),异丁酸 (isobutyrate),天冬氨酸 (aspartate),酪氨酸 (tyrosine),乳酸 (lactate),柠檬酸盐 (citrate),甘油 (glycerol), 3-羟基丁酸 (3-Hydroxybutyrate),α-乙酰糖蛋白 (NAc1),胆碱 (choline).
-
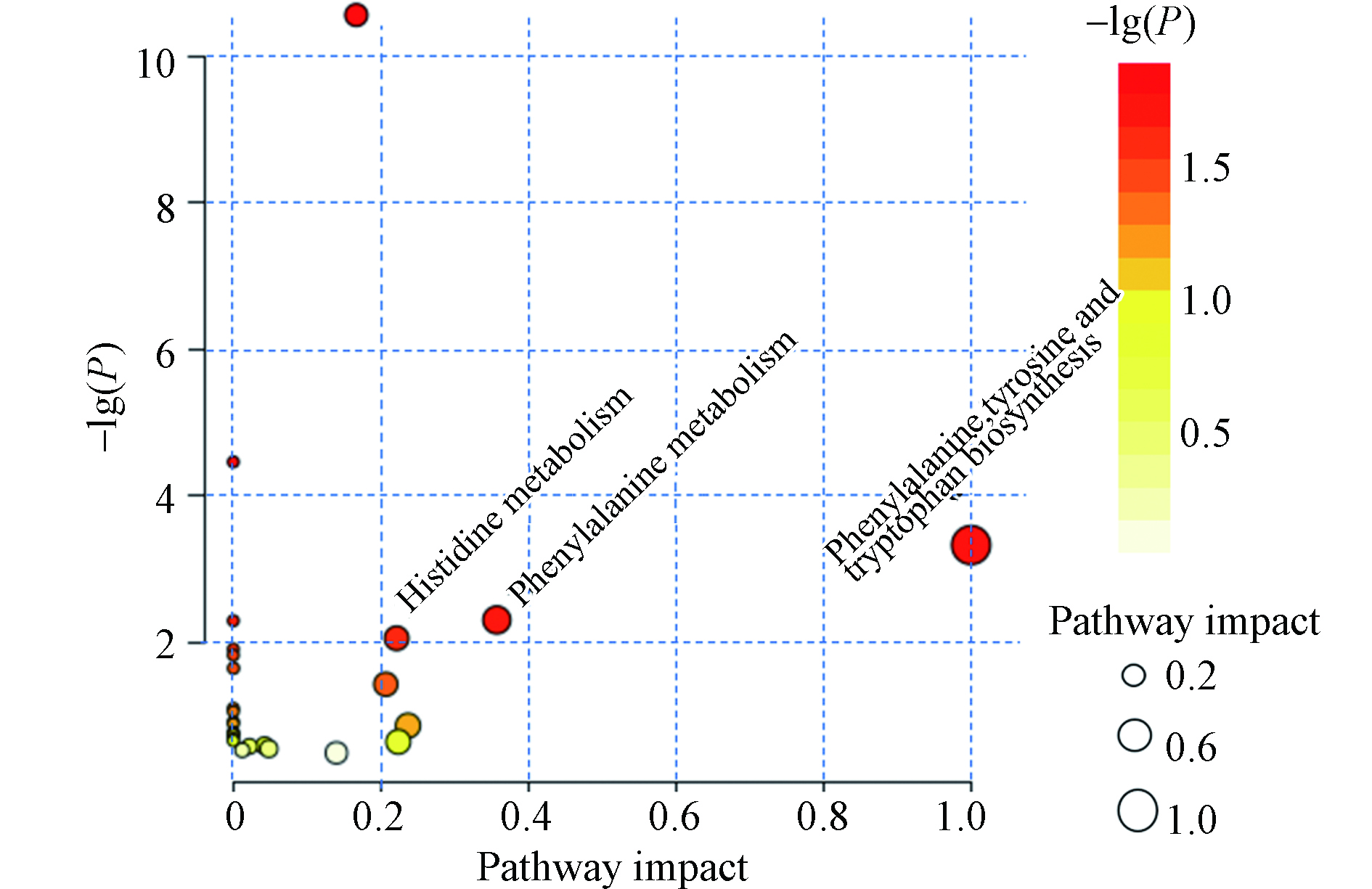
将具有显著性差异的代谢物进一步分析,探究F-53B暴露对大鼠代谢通路的扰动,将PIV > 0.2 且 P < 0.05的通路,视为是潜在扰动通路。结果显示,当暴露于F-53B时,大鼠体内的3条氨基酸代谢通路受到显著影响 (图5),包括丙氨酸、天冬氨酸和谷氨酸代谢,组氨酸代谢,苯丙氨酸,酪氨酸和色氨酸生物合成。
丙氨酸、天冬氨酸和谷氨酸代谢和组氨酸代谢与生物体 (如SD大鼠和人体) 的氧化应激反应和炎症密切相关[16-17]。活性氧 (reactive oxygen species, ROS) 的生成和清除之间的不平衡会导致机体产生氧化应激和炎症[18]。ROS还能够与多个细胞组分 (脂质,蛋白质和DNA) 反应,与DNA损伤和细胞凋亡等有关[18]。许多研究证明生物体氧化应激反应发生,ROS生成以及DNA损伤与PFAS暴露相关[19-20]。Chen等将妊娠期大鼠暴露于PFOS (0、0.1、2.0 mg·kg−1·d−1, 孕期1—21 d给药),发现母体暴露于2.0 mg·kg−1·d−1 PFOS时会引起母体严重的组织病变以及后代肺部明显氧化损伤和细胞凋亡[21]。Wu等将斑马鱼幼体暴露于F-53B (10、100 μg·L−1) 48 h后,发现F-53B的毒性效应类似于PFOS,在斑马鱼幼体表现出生物累积和持久性,进一步诱导氧化应激反应[22]。Ryu等将妊娠期小鼠用4 mg·kg−1 PFOA 饲料饲养12周,表明PFOA暴露会引起小鼠气管炎症发生[23]。本研究表明,F-53B会对大鼠血清中丙氨酸、天冬氨酸和谷氨酸代谢通路和组氨酸代谢通路产生扰动,这可能是大鼠血清氧化应激效应变化,炎症发生的原因。
苯丙氨酸,酪氨酸和色氨酸是神经递质生物合成的重要前体分子,与精神疾病相关,影响神经系统发育[24]。此前大量的研究证明了PFASs具有神经发育毒性,包括对神经递质水平的影响[25]。Johansson等将雄性新生小鼠暴露于PFOA, PFOS (1.4 μmol·kg−1或21 μmol·kg−1,灌胃),连续暴露10 d,2个月和4个月后进行观察与进一步实验,结果表明PFOS和PFOA导致成年小鼠脑中产生不可逆的变化,影响了大脑发育和胆碱能系统[26]。Cui等将大鼠暴露于PFOS (20 mg·kg−1·d−1) 28 d,结果显示大鼠大脑中脑中的髓鞘减少,表明PFOS具有神经毒性[27]。胆碱是神经元和神经胶质细胞中含有磷脂的胆碱以及胆碱能神经元中乙酰胆碱的重要前体,在大脑发育过程中起着十分重要的作用[28]。F-53B暴露后大鼠血清中胆碱浓度显著下调,也进一步证实F-53B能够抑制大鼠大脑发育,具有神经毒性。
Birru等研究发现人体血液妊娠期葡萄糖的浓度与PFAS浓度呈正相关[29]。葡萄糖在无氧条件下生成乳酸并产生能量,这是糖代谢主要的途径[30];甘油则是葡萄糖的重要前体物质[31]。F-53B暴露后大鼠血清中葡萄糖浓度显著上调,乳酸和甘油浓度显著下调,表明大鼠体内糖代谢受到扰动。霍丽丽等的研究表明人体血清中丙氨酸转氨酶水平的升高与糖代谢异常相关[32]。F-53B暴露后,大鼠体内糖代谢紊乱可能导致了血清中丙氨酸转氨酶的活性增强,加快了丙氨酸转化为丙酮酸,使大鼠血清中丙氨酸浓度下降。丙酮酸是糖代谢,脂质代谢和氨基酸代谢之间的重要的枢纽[33]。脂质浓度显著上调,表明大鼠体内脂质代谢紊乱。脂肪酸 β-氧化作用能够通过3-羟基丁酸水平反映[34]。暴露组大鼠血清中 3-羟基丁酸浓度显著下调,进一步表明F-53B暴露会影响大鼠体内的脂质代谢。糖代谢和脂质代谢紊乱是引发心血管疾病、糖尿病和高血压的重要原因之一[35]。一项关于青少年血清中PFAS浓度和血压之间的关联研究表明PFOS浓度与线性回归模型中的青少年的抗舒张压(DBP)呈显著正相关[36]。Min等发现人体血压升高和高血压患病风险增加与血清 PFAS浓度增加相关,每增加一单位lg 6:2 Cl-PFESA (ng·mL−1) ,舒张压 (DBP) 升高 1.31 mmHg[37]。Han等检测了中国山东人体血清中PFASs,发现每增加一单位lg 6:2 Cl-PFESA,总胆固醇升高17.49%[38]。
-
本研究基于1H-NMR的代谢组学和多元统计分析,检测分析F-53B (50 μg·kg−1·d−1) 暴露28 d后大鼠血清代谢紊乱状况。结果显示,F-53B暴露后产生17个差异代谢物,主要包括氨基酸代谢物和碳水化合物代谢物。3条氨基酸代谢通路受到显著影响,包括丙氨酸、天冬氨酸和谷氨酸代谢,组氨酸代谢,苯丙氨酸,酪氨酸和色氨酸生物合成。糖代谢和脂质代谢受到影响。本次研究提供了F-53B暴露的基础毒理数据,有助于了解F-53B对大鼠的毒性作用和揭示F-53B潜在的代谢机制,为评估F-53B的健康风险提供科学依据。然而,在后续研究中应考虑使用更大的样本量和一些相关其他因素,包括年龄,性别,暴露周期等,以便进一步了解F-53B对大鼠的代谢扰动是否存在性别和年龄等差异。
基于1H NMR的代谢组学方法研究F-53B暴露对大鼠血清代谢表型的影响
Elucidation of F-53B exposure on serum metabolic phenotype in SD rat by NMR-based metabonomic analysis
-
摘要: 氯化多氟醚磺酸盐 (chlorinated polyfluorinated ether sulfonic acids, F-53B) 是全氟烷基磺酸 (perfluorooctane sulfonate, PFOS) 的替代品。大量毒理学实验证明F-53B具有类似PFOS的生物持久性及毒性,但目前国内外尚未报道过关于F-53B的生物代谢扰动机制研究。本研究基于1H-NMR分析了F-53B (50 μg·kg-1·d-1) 暴露28 d后的大鼠血清代谢扰动情况,结合多元统计分析,分析相关差异代谢物和代谢通路变化。暴露组检测到17个差异代谢物,主要包括氨基酸代谢物和碳水化合物代谢物。3条氨基酸代谢通路受到显著影响,包括丙氨酸、天冬氨酸和谷氨酸代谢,组氨酸代谢,苯丙氨酸,酪氨酸和色氨酸生物合成。糖代谢和脂质代谢受到影响。研究结果表明大鼠暴露于F-53B后可能会影响血清的氧化应激反应,引发炎症,心血管疾病,糖尿病和高血压,引起神经毒性且抑制大脑发育。本研究对F-53B暴露产生的代谢扰动进行深入且全面的探究,为评估F-53B的健康风险提供了科学依据。Abstract: Chlorinated polyfluorinated ether sulfonic acid (trade name, F-53B) is an alternative to perfluorooctane sulfonate (PFOS). A large number of toxicological experiments have proved that F-53B has biological persistence and toxicity similar to PFOS, but there is no study on the biological metabolic disturbance mechanism research of F-53B. In this study, SD rats were orally exposed to 50 μg·kg-1·d-1 F-53B for 28 days to evaluate the serum metabolic disturbances of F-53B by 1H-NMR serum metabolomics and then combined with multivariate statistical analysis, the relevant differential metabolites and metabolic pathway changes were analyzed. Results showed that 17 metabolites (mainly including amino acid metabolites and carbohydrate metabolites) and 3 metabolic pathways (alanine, aspartic acid, and glutamate metabolism; histidine metabolism; phenylalanine, tyrosine, and tryptophan biosynthesis) were disturbed by F-53B exposure. Sugar metabolism and lipid metabolism were affected. The results of the study indicated that exposure to F-53B may affect the oxidative stress response of the serum, cause inflammation, cardiovascular disease, diabetes, and hypertension, cause neurotoxicity and inhibit brain development. This study provides an in-depth and comprehensive exploration of the metabolic disturbances caused by F-53B exposure, and a scientific basis for assessing the health risks of F-53B.
-
Key words:
- metabolomics /
- 1H-NMR /
- F-53B /
- SD rats /
- serum
-

-
表 1 大鼠血清代谢物1H-NMR谱的信号指认
Table 1. Identify the metabolites in the 1H-NMR spectra of the rat serum
No. 代谢产物
Metabolites化学位移(ppm)及多重性δ
1H and Multiplicity1 Leucine 0.95(dd), 1.70(m), 3.72(m) 2 Isoleucine 0.93(t), 1.02(d), 1.25(m), 1.46(m), 1.95(m), 3.66(d) 3 Valine 0.97(d), 1.05(d), 2.26(m), 3.61(d) 4 Lipid 0.82—0.90(bar), 1.24—1.31(bar) 5 Isobutyrate 1.06(d), 2.37(m) 6 Ethanol 1.17(t), 3.65(dd) 7 3-Hydroxybutyrate 1.19(d), 2.30(dd), 2.39(dd), 4.15(m) 8 Alanine 1.47(d), 3.78(dd) 9 Arginine 1.65(m), 1.73(m), 3.23(t), 3.76(t) 10 Lysine 1.43(m), 1.49(m), 1.70(m), 1.91(m), 3.02(t), 3.75(t) 11 Acetate 1.92(s) 12 NAc1* 2.02—2.06(bar) 13 NAc2* 2.12—2.17(bar) 14 Glutamate 2.05(m), 2.12(m), 3.75(dd) 15 Glutamine 2.12(m), 2.44(m), 3.77(t) 16 Succinate 2.39(s) 17 Aspartate 2.67(dd), 2.81(dd), 3.89(dd) 18 Citrate 2.51(d), 2.68(d) 19 PUFA 2.72—2.84(bar) 20 Asparagine 2.85(dd), 2.94(dd), 4.01(dd) 21 Ornithine 1.73(m), 1.82(m), 1.93(m), 3.05(t), 3.78(t) 22 Creatine 3.02(s), 3.93(s) 23 Citrulline 1.53(m), 1.59(m), 3.13(m), 3.74(dd), 6.34(bar) 24 Choline 3.19(s), 3.51(m), 4.05(m) 25 PC* 3.20(s), 3.58(m), 4.16(m) 27 Glucose 3.23(m), 3.40(m), 3.47(m), 3.53(dd), 3.83(m), 3.89(dd), 4.64(d),5.23(d) 28 Taurine 3.25(t), 3.42(t) 29 Glycerol 3.55(dd), 3.64(dd), 3.77(m) 30 Glycine 3.56(s) 31 Serine 3.84(m), 3.94(dd), 3.98(dd) 32 Lactate 1.33(d), 4.12(dd) 33 Threonine 1.33(d), 3.58(d), 4.25(m) 34 Fumarate 6.51(s) 35 Tyrosine 6.88(d), 7.18(d) 36 Histidine 7.06(s), 7.85(s) 37 Phenylalanine 7.33(m), 7.35(m), 7.42(m) 38 Xanthine 7.91(s) 39 Formate 8.46(s) 40 GPC* 3.22(s), 3.60(m), 3.67(m), 3.86(m), 3.93(m), 4.32(m) *NAc1 and NAc2 为乙酰基信号(α-acid glycoprotein); PC 为磷酸胆碱(phosphocholine)信号; GPC 为甘油磷酰胆 (glycerophosphocholine) 信号. 表 2 差异性代谢物对比
Table 2. Differential metabolites comparison of the two groups
类别
Classification代谢产物
Metabolites对照组 vs 暴露组
Control vs. F-53BAmino acid metabolism Aspartate ** Tyrosine * Histidine ## Isobutyrate ** Alanine ** Ornithine ## Threonine # Asparagine ## Carbohydrate metabolism Lactate ** Glucose # Citrate ** Fatty acid metabolism Glycerol ** 3-Hydroxybutyrate ** Residual metabolism GPC # NAc1 ** Lipid # Choline ** “*”和“#”表示P < 0.05,“**”和“##”表示P < 0.01; “#”表示上调,“*”表示下调. -
[1] 郭萌萌, 崔文杰, 刘晓玉, 等. 黄渤海区域水产品中全氟烷基物质的分布特征 [J]. 中国环境科学, 2020, 40(8): 3424-3432. doi: 10.3969/j.issn.1000-6923.2020.08.021 GUO M M, CUI W J, LIU X Y, et al. Distribution of perfluoroalkyl substances in aquatic products in coastal and adjacent areas of the Yellow Sea and Bohai Sea, China [J]. China Environmental Science, 2020, 40(8): 3424-3432(in Chinese). doi: 10.3969/j.issn.1000-6923.2020.08.021
[2] KOTTHOFF M, MÜLLER J, JÜRLING H, et al. Perfluoroalkyl and polyfluoroalkyl substances in consumer products [J]. Environmental Science and Pollution Research, 2015, 22(19): 14546-14559. doi: 10.1007/s11356-015-4202-7 [3] AAS C B, FUGLEI E, HERZKE D, et al. Effect of body condition on tissue distribution of perfluoroalkyl substances (PFASs) in arctic fox (Vulpes lagopus) [J]. Environmental Science & Technology, 2014, 48(19): 11654-11661. [4] CHEN H, HAN J B, CHENG J Y, et al. Distribution, bioaccumulation and trophic transfer of chlorinated polyfluoroalkyl ether sulfonic acids in the marine food web of Bohai, China [J]. Environmental Pollution, 2018, 241: 504-510. doi: 10.1016/j.envpol.2018.05.087 [5] ROUTTI H, ATWOOD T C, BECHSHOFT T, et al. State of knowledge on current exposure, fate and potential health effects of contaminants in polar bears from the circumpolar Arctic [J]. Science of the Total Environment, 2019, 664: 1063-1083. doi: 10.1016/j.scitotenv.2019.02.030 [6] PÉREZ F, NADAL M, NAVARRO-ORTEGA A, et al. Accumulation of perfluoroalkyl substances in human tissues [J]. Environment International, 2013, 59: 354-362. doi: 10.1016/j.envint.2013.06.004 [7] GIESY J P, KANNAN K. Global distribution of perfluorooctane sulfonate in wildlife [J]. Environmental Science & Technology, 2001, 35(7): 1339-1342. [8] LINDSTROM A B, STRYNAR M J, LIBELO E L. Polyfluorinated compounds: Past, present, and future [J]. Environmental Science & Technology, 2011, 45(19): 7954-7961. [9] SEACAT A M, THOMFORD P J, HANSEN K J, et al. Sub-chronic dietary toxicity of potassium perfluorooctanesulfonate in rats [J]. Toxicology, 2003, 183(1/2/3): 117-131. [10] 王亚韡, 蔡亚岐, 江桂斌. 斯德哥尔摩公约新增持久性有机污染物的一些研究进展 [J]. 中国科学:化学, 2010, 40(2): 99-123. doi: 10.1360/zb2010-40-2-99 WANG Y W, CAI Y Q, JIANG G B. Research processes of persistent organic pollutants (POPs) newly listed and candidate POPs in Stockholm Convention [J]. Scientia Sinica (Chimica), 2010, 40(2): 99-123(in Chinese). doi: 10.1360/zb2010-40-2-99
[11] JIN Q, MA J H, SHI Y L, et al. Biomonitoring of chlorinated polyfluoroalkyl ether sulfonic acid in the general population in central and Eastern China: Occurrence and associations with age/sex [J]. Environment International, 2020, 144: 106043. doi: 10.1016/j.envint.2020.106043 [12] CUI Q Q, PAN Y T, ZHANG H X, et al. Occurrence and tissue distribution of novel perfluoroether carboxylic and sulfonic acids and legacy per/polyfluoroalkyl substances in black-spotted frog (Pelophylax nigromaculatus) [J]. Environmental Science & Technology, 2018, 52(3): 982-990. [13] WANG S W, HUANG J, YANG Y, et al. First report of a Chinese PFOS alternative overlooked for 30 years: Its toxicity, persistence, and presence in the environment [J]. Environmental Science & Technology, 2013, 47(18): 10163-10170. [14] JIN H B, LIN S, DAI W, et al. Exposure sources of perfluoroalkyl acids and influence of age and gender on concentrations of chlorinated polyfluorinated ether sulfonates in human serum from China [J]. Environment International, 2020, 138: 105651. doi: 10.1016/j.envint.2020.105651 [15] GU J P, JI C Y, YUE S Q, et al. Enantioselective effects of metalaxyl enantiomers in adolescent rat metabolic profiles using NMR-based metabolomics [J]. Environmental Science & Technology, 2018, 52(9): 5438-5447. [16] 顾金苹. 用基于NMR的代谢组学方法研究胃炎癌化过程的代谢网络和分子机制[D]. 厦门: 厦门大学, 2016: 89-91. GU J P. Elucidation of metabolic networks and molecular mechanisms of gastric carcinogenesis by NMR-based metabonomic analysis[D]. Xiamen: Xiamen University, 2016: 89-91(in Chinese).
[17] FENG R N, NIU Y C, SUN X W, et al. Histidine supplementation improves insulin resistance through suppressed inflammation in obese women with the metabolic syndrome: A randomised controlled trial [J]. Diabetologia, 2013, 56(5): 985-994. doi: 10.1007/s00125-013-2839-7 [18] ZHANG Z W, ZHANG X W, MENG L, et al. Pioglitazone inhibits diabetes-induced atrial mitochondrial oxidative stress and improves mitochondrial biogenesis, dynamics, and function through the PPAR-γ/PGC-1α signaling pathway [J]. Frontiers in Pharmacology, 2021, 12: 658362. doi: 10.3389/fphar.2021.658362 [19] BONATO M, CORRÀ F, BELLIO M, et al. PFAS environmental pollution and antioxidant responses: An overview of the impact on human field [J]. International Journal of Environmental Research and Public Health, 2020, 17(21): 8020. doi: 10.3390/ijerph17218020 [20] WIELSØE M, LONG M H, GHISARI M, et al. Perfluoroalkylated substances (PFAS) affect oxidative stress biomarkers in vitro [J]. Chemosphere, 2015, 129: 239-245. doi: 10.1016/j.chemosphere.2014.10.014 [21] CHEN T, ZHANG L, YUE J Q, et al. Prenatal PFOS exposure induces oxidative stress and apoptosis in the lung of rat off-spring [J]. Reproductive Toxicology, 2012, 33(4): 538-545. doi: 10.1016/j.reprotox.2011.03.003 [22] WU Y M, DENG M, JIN Y X, et al. Uptake and elimination of emerging polyfluoroalkyl substance F-53B in zebrafish larvae: Response of oxidative stress biomarkers [J]. Chemosphere, 2019, 215: 182-188. doi: 10.1016/j.chemosphere.2018.10.025 [23] RYU M H, JHA A, OJO O O, et al. Chronic exposure to perfluorinated compounds: Impact on airway hyperresponsiveness and inflammation [J]. American Journal of Physiology-Lung Cellular and Molecular Physiology, 2014, 307(10): L765-L774. doi: 10.1152/ajplung.00100.2014 [24] GOSTNER J M, BECKER K, KURZ K, et al. Disturbed amino acid metabolism in HIV: Association with neuropsychiatric symptoms [J]. Frontiers in Psychiatry, 2015, 6: 97. [25] FOGUTH R, SEPÚLVEDA M S, CANNON J. Per- and polyfluoroalkyl substances (PFAS) neurotoxicity in sentinel and non-traditional laboratory model systems: Potential utility in predicting adverse outcomes in human health [J]. Toxics, 2020, 8(2): 42. doi: 10.3390/toxics8020042 [26] JOHANSSON N, FREDRIKSSON A, ERIKSSON P. Neonatal exposure to perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) causes neurobehavioural defects in adult mice [J]. NeuroToxicology, 2008, 29(1): 160-169. doi: 10.1016/j.neuro.2007.10.008 [27] CUI L, ZHOU Q F, LIAO C Y, et al. Studies on the toxicological effects of PFOA and PFOS on rats using histological observation and chemical analysis [J]. Archives of Environmental Contamination and Toxicology, 2008, 56(2): 338-349. [28] KLEIN J, KÖPPEN A, LÖFFELHOLZ K. Regulation of free choline in rat brain: Dietary and pharmacological manipulations [J]. Neurochemistry International, 1998, 32(5/6): 479-485. [29] BIRRU R L, LIANG H W, FAROOQ F, et al. A pathway level analysis of PFAS exposure and risk of gestational diabetes mellitus [J]. Environmental Health, 2021, 20(1): 63. doi: 10.1186/s12940-021-00740-z [30] SCHURR A. Lactate: the ultimate cerebral oxidative energy substrate? [J]. Journal of Cerebral Blood Flow and Metabolism, 2006, 26(1): 142-152. doi: 10.1038/sj.jcbfm.9600174 [31] NIKKILAE E A, OJALA K. Glycerol as an endogenous precursor of body glucose in the rat [J]. Annales Medicinae Experimentalis et Biologiae Fenniae, 1963, 41: 478-484. [32] 霍丽丽, 纪立农. 血清丙氨酸转氨酶与糖代谢状况关系的研究 [J]. 中国糖尿病杂志, 2012, 20(2): 91-94. doi: 10.3969/j.issn.1006-6187.2012.02.001 HUO L L, JI L N. Study of relationship between serum alanine aminotransferase level and the different states of glucose metabolism [J]. Chinese Journal of Diabetes, 2012, 20(2): 91-94(in Chinese). doi: 10.3969/j.issn.1006-6187.2012.02.001
[33] CHAMPE P C, HARVEY R A. Lippincott's Illustrated Reviews: Biochemistry[M]. Second Edition. Philadelphia: Lippencott Williams & Wilkins, 2007: 163-205. [34] 张王宁, 李爱平, 刘少博, 等. 基于代谢组学的阿霉素肾病大鼠模型损伤程度评价 [J]. 中草药, 2018, 49(2): 360-367. doi: 10.7501/j.issn.0253-2670.2018.02.015 ZHANG W N, LI A P, LIU S B, et al. Evaluation of injury degree of rat nephropathy model induced by doxorubicin based on metabolomics [J]. Chinese Traditional and Herbal Drugs, 2018, 49(2): 360-367(in Chinese). doi: 10.7501/j.issn.0253-2670.2018.02.015
[35] DU H Z, ZHAO Y R, YIN Z W, et al. The role of miR-320 in glucose and lipid metabolism disorder-associated diseases [J]. International Journal of Biological Sciences, 2021, 17(2): 402-416. doi: 10.7150/ijbs.53419 [36] MA S Y, XU C, MA J, et al. Association between perfluoroalkyl substance concentrations and blood pressure in adolescents [J]. Environmental Pollution, 2019, 254: 112971. doi: 10.1016/j.envpol.2019.112971 [37] MI X, YANG Y Q, ZEESHAN M, et al. Serum levels of per- and polyfluoroalkyl substances alternatives and blood pressure by sex status: Isomers of C8 health project in China [J]. Chemosphere, 2020, 261: 127691. doi: 10.1016/j.chemosphere.2020.127691 [38] HAN X, MENG L L, ZHANG G X, et al. Exposure to novel and legacy per- and polyfluoroalkyl substances (PFASs) and associations with type 2 diabetes: A case-control study in East China [J]. Environment International, 2021, 156: 106637. doi: 10.1016/j.envint.2021.106637 -



 下载:
下载: