-
塑料因重量轻、化学性质稳定、耐磨损且成本低而被广泛应用于个人护理产品、服装、医药和化学纤维制造等工业中. 据报道,2019年全球塑料产量几乎达到3. 7亿吨[1]. 但塑料使用废弃后回收率只有9%—20%,相当一部分塑料废弃后直接被排放到环境中[2]. 加上其难降解的特点,使得环境中的塑料垃圾不断堆积. 联合国环境规划署已将海洋塑料垃圾污染列为“十大新兴环境问题之一”. 随着时间的推移,塑料会经生物降解、长时间光照或物理磨损等碎裂成微塑料(Microplastics, MPs),即粒径小于5 mm的塑料碎屑. 这一概念是2004年Thompson等[3]在《Science》上首次提出的. MPs按其来源可分为两类:初生MPs,即直接按这一尺寸范围生产的塑料微粒,如个人护理产品或面部清洁剂中的MPs;次生MPs,即通过粉碎较大的塑料或其他高分子聚合物(如人造纤维或汽车轮胎)等产生的微粒[4].
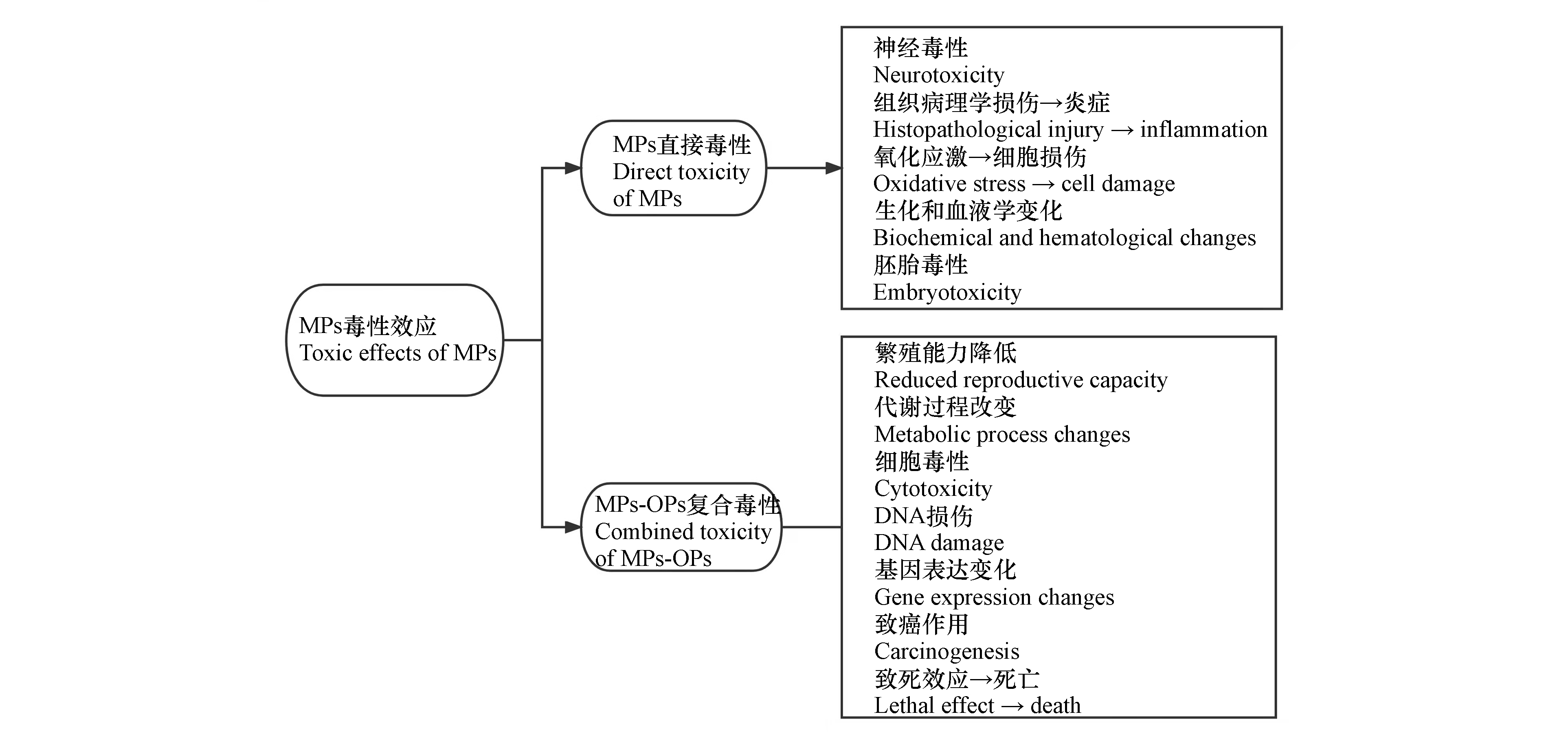
MPs在全球水环境中几乎无处不在[5-7] ,甚至包括深海[8]和极地[9-10]. MPs、生物、环境三者之间相互作用,并具有生态风险[4]. 在水环境中,MPs因被生物体摄入后产生生物累积等效应对生物体产生负面影响,例如对于淡水和海洋生物而言,由于某些MPs的颜色、形状和大小与天然猎物相似[11-12],且其表面的生物膜会对生物体获取的嗅觉信息产生干扰[13],所以增加了水环境中生物体误食MPs的概率. 此外,生物通过鳃呼吸、生物的非选择性过滤[14]以及直接穿透裸露细胞膜等方式摄入MPs[4, 7, 15-18]. 据统计,已在323种海洋鱼类[19]、80种海鸟[20]、6种海龟[21]体内检出了MPs,在其它海洋生物体中MPs也广泛存在,如无脊椎动物[22-23]、海洋哺乳动物等[24-25]. 摄入MPs会对鱼类造成严重的健康影响,包括摄食强度降低、生殖障碍、免疫抑制、生理紊乱以及对鳃、肝脏、肌肉、肾脏、心脏和中枢神经系统的损伤等[26]. MPs还为某些微生物群落的生长提供了基质,使其表面形成生物膜[27],摄入这些颗粒会影响生物体的肠道微生物群,增加被病原微生物的感染的风险. 此外,许多研究者都从水环境中的MPs中检测出了有机污染物(OPs)[28-29]. 诸如多环芳烃(PAHs)、多氯联苯(PCBs)和多溴联苯醚(PBDEs)等. MPs的大比表面积和疏水性促进了其对OPs的吸附[28]. 作为污染物的载体和释放者,MPs可能影响OPs的迁移转化、生物累积和毒性,影响大小取决于这些化合物在MPs上的吸附/解吸动力学和热力学平衡[30]. MPs对生态环境、动物及人体都存在潜在威胁[31]. 图1总结了MPs对生物的毒性效应.
本文综述了MPs与OPs相互作用对OPs在水环境中迁移转化、生物累积性及毒性的影响,并重点讨论了MPs吸附OPs之后形成的复合污染物MPs-OPs的复合毒性.
-
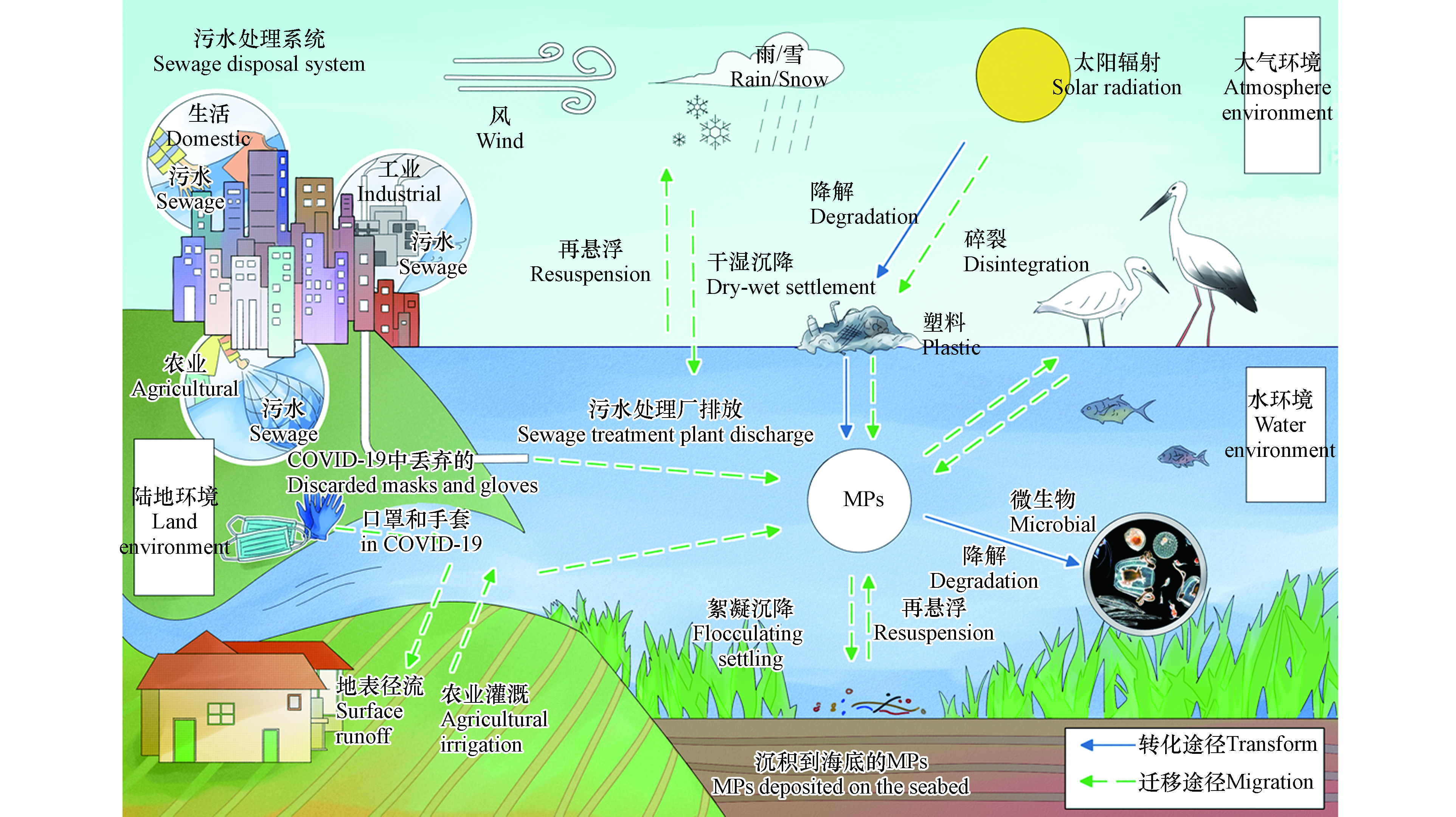
水环境中的MPs一般来自地表径流、污水处理系统、渔业、造船业、旅游业和大气沉降等[32]. 此外,COVID-19的流行也大大增加了MPs释放到水环境中的风险[33]. 水环境中MPs的主要来源及迁移途径见图2所示.
大多数来自污水处理系统的MPs直接排放到河流和湖泊中,而陆地环境中的MPs多经地表径流进入水体[34]. 一般,小而轻的塑料颗粒悬浮在水面,大而重的塑料颗粒则沉积在水底. 然而,MPs会与自然环境中存在的大量天然无机/有机颗粒和微生物聚集(非均相聚集)或自身聚集(均相聚集),从而改变MPs的原始密度,进而影响MPs的沉降和停留时间[32]. 此外,地表径流,降雨事件[35],气流,洪水以及河流或湖泊的水文特征[4]如水位、流速、总流量和地理位置等都可导致河流中MPs的迁移[32].
淡水中的MPs最终会聚集在海洋中,并再次迁移. 洋流运动作为海洋中MPs水平输送的主要输送方式,对MPs在公海中的迁移、分布和聚集起着重要的作用[36]. MPs进入深海后,重力将引导其继续沉入更深的海洋领域,但各种洋流使塑料的运输和分布更加复杂[4]. 底部洋流可以很容易地提供剪切力,以输送表层沉积物中的MPs. 漂流沉积物中存在强烈的生物干扰,迫使MPs转移到更深的沉积物中. 与海底洋流相反,温盐层结和内部潮汐将抑制MPs的沉降,并使其重新悬浮在海水中,随后可能迁移到其它地区. 同时,生物体的摄食和排便促使了MPs再悬浮. 因此,沿海水域中MPs的浓度高于深海水域,即MPs的行为与大多数其它沉积颗粒物相似,主要沉积在靠近陆源的地方[37]. 此外,人类活动也是影响MPs运输的关键因素[8, 32]. 例如,高强度的农业、工业和渔业活动使得渤海海域辽东湾水体中的MPs丰度偏高[8];海洋中高浓度MPs主要集中在靠近工业化城市的海域[38].
-
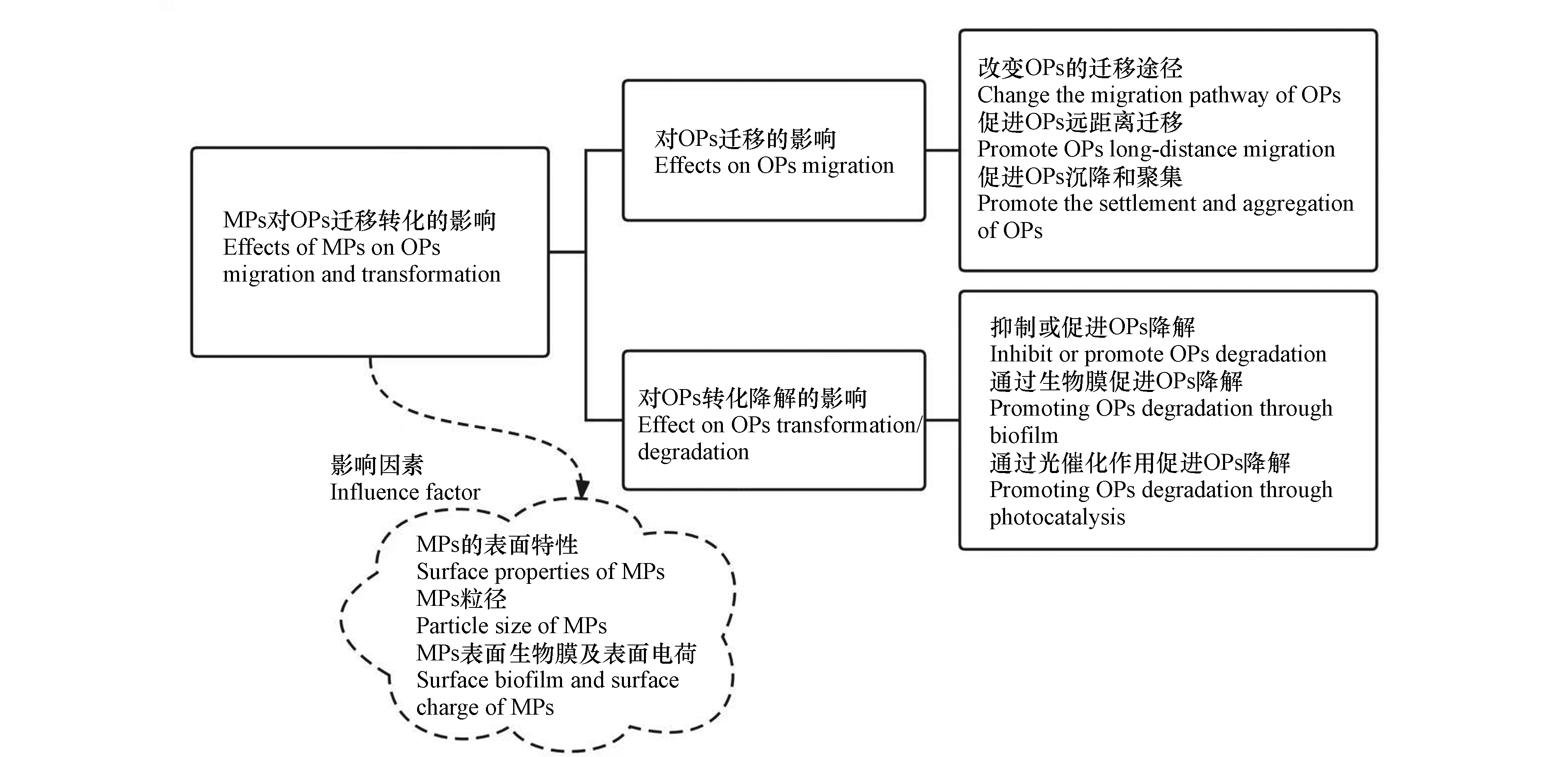
水环境中的MPs可作为载体,加速OPs的迁移和重新分布,或使OPs随其发生共沉降. 它还可通过吸附OPs来改变水环境中OPs的转化或降解. 图3描述了水环境中MPs对OPs迁移转化的影响.
-
作为OPs的载体,MPs能加速OPs在水环境中的迁移,并使得OPs迁移的更远. 虽然OPs在水环境(特别是在公海)中的浓度可能比在陆地环境中低得多,但通过在MPs上积累,OPs,特别是持久性有机污染物(POPs),能以更高的浓度与MPs共同迁移[39]. 复合物MPs-OPs在水环境中迁移,最终进入公海,水流往往决定了它们的迁移途径,MPs的表面特性和周围环境条件决定了MPs-OPs在水环境中的归宿[40]. MPs的粒径也会对复合物的迁移途径产生影响,且会影响OPs在MPs上的吸附/解吸动力学和热力学平衡. 此外,MPs的表面生物膜、表面电荷及其与天然有机物的相互作用促进了MPs以及所吸附OPs的聚集和沉降,从而影响相关OPs在水环境中的归趋[41-42].
-
OPs在MPs上的强吸附导致污染物在环境基质中的重新分布,并可能影响其在水环境中的降解. 影响因素有MPs的粒径,MPs表面生物膜和MPs降解产生的自由基等.
MPs粒径是影响OPs降解的重要因素之一,例如,50 nm聚苯乙烯(PS)颗粒改变了水环境中菲的分布状况并显著抑制了菲的降解. 而10 μm PS颗粒没有显著抑制菲的降解. 这是因为较小颗粒具有更强吸附能力[43].
MPs表面的生物膜也会影响所吸附OPs的降解. MPs一旦进入水环境,其表面会形成生物膜. MPs表面生物膜上的细菌和真菌群落在结构和功能多样性上与周围环境中形成的群落不同,这些微生物群落的结构和代谢过程会影响吸附在MPs上的OPs的降解和转化[44]. 例如,在低密度聚乙烯(LDPE)上形成的生物膜中,微生物群落使滴滴涕和PAHs的降解率和生物转化率升高[45]. 膜的形成因季节、地理位置和环境营养状况而异[46],取决于MPs的特性,包括塑料类型、表面疏水性和粗糙度等[47]. 另外,MPs中添加剂的释放会改变MPs表面微生物群落的结构和功能,进而影响微生物介导的OPs降解[45].
紫外光照射下聚合物的光氧化降解常伴随着自由基的产生[48]. 研究证实在受到紫外线照射的PS和酚醛树脂上检测到超氧自由基(·O2−)和羟基自由基 (·OH)[49]. 这些自由基会促使OPs的降解;另一方面,水环境中的塑料经光氧化降解产生具有光活性的亲水亲脂性聚合物,它们充当单线态氧发生器或提供电子转移位点从而促使OPs降解[50]. 例如,通过将光活性苯并噻二唑单体引入尼龙(PA)主链,开发出一种光活性聚合物,可促进废水中两种污染物(双酚A和西咪替丁)的降解[50]. 此外,塑料中的抗氧化剂和光稳定剂也会影响被吸附OPs的光氧化作用,从而影响其降解.
-
MPs是否可作为OPs的有效性载体仍存在争论. 目前,多数研究结果表明MPs能够作为OPs的载体. 在一定条件下,当携带污染物或添加剂的MPs进入环境或生物体时,被吸附的添加剂或污染物可能会再次释放,此时MPs发挥了载体的作用. 且一些OPs可以在低浓度下与MPs结合产生生物效应[51-54]. 由于MPs表面电荷、高比表面积和疏水性,它可以当作载体来运输不同类型的OPs,包括PCBs[55]、PAHs[56](菲、芘、荧蒽)等. 此外,周围环境的污染程度直接影响MPs上OPs的含量,塑料聚合物的类型、疏水性、结晶度、尺寸和风化程度以及污染物的pH值、盐度、离子强度和化学性质也是重要影响因素.
然而,也有研究者持不同观点,他们认为与自然暴露途径相比,MPs对生物体内OPs的积累是微不足道的. 因为MPs上OPs的占比极小[57],尽管MPs可将水体中的OPs浓缩106倍[58],但是海洋水体总量却大约比塑料大1013倍[57] ,因此MPs不能作为有效载体. 其次,MPs虽然可以吸附生物体或水环境中的OPs,进而降低化学物质的生物利用度[59-62]. 但由于肠道中MPs的化学转移是双向且可逆的,所以当生物体肠道中OPs的化学逸度大于摄入的MPs时,MPs将发挥“清除”作用[63]. 最后,还有一些研究者认为MPs的存在对有些OPs的蓄积无明显影响[64-67].
由于MPs和OPs之间特定的吸附/解吸机制,加之环境条件和生物物种的不同,不同的实验可能得出不同的结果,但它们之间的吸附/解吸机制可总结为:不同OPs在同种MPs上的吸附强度与污染物的吸附/分配系数(Kd)呈正相关;而有机物的疏水性,即辛醇-水分配系数(Kow)与Kd存在正相关关系,进一步说明OPs的疏水性是影响其吸附强弱的关键因素,疏水性强的OPs更容易被吸附在MPs表面,使MPs作其有效性载体. 此外,MPs的表面极性也决定了其作为OPs载体的有效程度,具有相似极性的MPs和OPs更容易吸附在一起. 由于不同类型的MPs具有不同的表面特性和结晶度,因此,不同MPs对同种OPs的吸附效果也不同[68].
-
研究表明,生物体中的MPs可将其从海水中吸附的OPs或添加剂等内源污染物转移到生物体中. 在北太平洋北部采集的短尾海鸥的腹部脂肪和胃中MPs上同时检测出了两种PBDEs,而在海鸥的天然猎物体内则未检出,表明海鸥体内的PBDEs来自MPs[69]. 通过实验也证明了MPs可以把OPs转移到生物体中[70],例如,将蠕虫暴露在含有5%MPs(聚氯乙烯(PVC))的沙子中,这些MPs上预先吸附了污染物(壬基酚和菲)和添加剂(三氯生(TCS)和PBDE-47),实验结果表明MPs将化学物质转移到了蠕虫的肠道组织中[71],即MPs上吸附的OPs可以直接经胃肠道释放到动物体内. 此外,MPs上吸附的OPs还可能释放到水环境中间接造成生物蓄积,例如,在韩国海域的PS泡沫浮标上采集的贻贝中分析了六溴环十二烷(HBCDs)的含量及与浮标的同源性,证明了HBCDs通过水环境从浮标向贻贝的转移[72]. 除了直接摄入MPs-OPs,较高营养级生物还可以通过食物链生物放大效应将MPs-OPs蓄积到体内. 在PS(700 nm)和对外消旋甲基苯丙胺生物放大效应的研究中,MPs和手性药物外消旋甲基苯丙胺的共存会增加人工淡水食物链中较高营养级生物——蜗牛体内甲基苯丙胺的蓄积,这是因为食物链中藻类的存在提高了甲基苯丙胺在蜗牛体内的生物利用度. 这种生物放大效应会对整个水生食物链产生潜在的影响[73-74].
-
一方面MPs可以吸附OPs,另一方面,有些OPs也是塑料添加剂或未合成完全的原材料单体,例如,邻苯二甲酸酯和双酚A[75]. 由于这些添加剂和游离的单体与MPs基质之间没有键合在一起,所以容易被释放出来. 因此,MPs自身也有一定的毒性. 复合污染物MPs-OPs的复合毒性效应也受多种因素影响,而动物体内MPs-OPs生物代谢使其潜在毒性更为复杂[76]. 如表1所示, MPs-OPs在生物体内的复合作用有促进作用、拮抗作用和无影响. 由表1可知,一些研究表明,MPs-OPs会对生物体造成急性毒性,降低胚胎存活率,使毒性增强;另一些研究有相反的结果. MPs-OPs不会增加毒性,并能吸收生物体内的污染物,使污染物浓度显著降低.
复合污染物的毒性效应主要取决于MPs的浓度. 当MPs处于低浓度范围时,拮抗作用与MPs浓度成正相关,而当 MPs浓度突破某一临界值处于较高浓度范围时则拮抗作用减弱,甚至会转变为促进作用. 例如, 20、200 μg·L−1 MPs不会改变菲的毒性,而2 μg·L−1 MPs和菲复合暴露可将孵化率提高25.8%, 降低畸形率和死亡率, 恢复菲引起的心脏发育相关基因的异常表达[77]. 在PE与菲的复合毒性研究中,当PE浓度在0—5%范围内时,小麦根系抗氧化酶活性随PE浓度的增加而增加;但菲和高浓度(8%)的PE结合时会破坏小麦根系的抗氧化系统[78].
此外,MPs的理化性质也会影响其在复合毒性中发挥的作用. 首先,MPs不同的表面官能团会造成的其吸附能力的差异,这种差异使得不同MPs在相同条件下发挥不同作用. 例如,PVC与TCS组合的复合毒性比PE和PS与TCS的复合毒性低得多. TCS在PVC上的高吸附量是其复合毒性降低的一个可能原因,即OPs在MPs上的吸附量越大,其复合毒性越有可能表现为拮抗作用[79]. 其次,MPs老化也会对复合毒性产生影响,这主要归因于老化过程中形成了生物膜以及MPs和OPs之间相互作用的改变. 老化MPs可对复合毒性发挥促进作用,如老化MPs能将PVC-四溴双酚A对藻的生长的抑制率由22.0%提高到46.7%[80],相反地,MPs老化也可能表现出拮抗作用,如随着聚碳酸酯(PC)老化时间的延长,PC-双酚A的复合毒性逐渐减弱[81]. 总的来说,目前有限的研究还不能确定老化过程对MPs和OPs复合毒性的增强或抑制作用. 促进作用可以解释为老化MPs的高吸收量,而拮抗作用可能是由于老化MPs的低释放量. 再者,MPs粒径和表面电荷也会影响复合毒性效应. 粒径越小的MPs与OPs结合所产生的复合毒性越显著[79]. 且MPs会对带异种电荷的OPs表现出拮抗作用. 例如,在培养基和河水中,带负电荷的MPs对阳离子污染物的细胞毒性的拮抗作用明显强于阴离子污染物[82]. 因此通过改变MPs的粒径和表面电荷,可以改变复合毒性.
最后,OPs的理化性质也是一重要影响因素.例如,在蛋白核小球藻生物体内,聚苯乙烯(PS)暴露使藻细胞结构的破坏,导致绿藻加速吸收三苯基氯化锡(TPTCl),从而提高TPTCl的毒性[83],但PS却能降低邻苯二甲酸二丁酯的生物利用度[84].
总之,因MPs-OPs复合毒性受多种因素的影响:MPs的浓度、单体类型、表面生物膜、表面电荷、粒径、形状、添加剂类型、OPs的理化性质和环境条件等,所以关于MPs-OPs复合毒性的问题十分复杂. 一般认为,复合毒性主要受控于MPs和OPs的理化性质,其次受环境条件影响[70].
-
人类可以通过食物链暴露于MPs. 目前,许多研究者在不同的生物体内检测到了MPs的存在,例如,在牡蛎、贻贝、扇贝和蛤蜊等双壳类动物体内检测出了较高浓度的MPs[91],在渤海、黄海的浮游动物样体内也检测出了MPs[92]. 而人类作为食物链的顶端,通过食物链和生物放大作用直接或间接接触这些摄入了MPs的生物体,最终会导致MPs在人体内的蓄积,且胃肠道往往是MPs在人体内蓄积的靶点[93]. 进入人体的MPs可能通过循环系统转移到全身各处组织. 据报道,循环系统中的MPs可能会引起全身炎症反应、增加产生细胞毒性、血管炎症、和肺动脉高压的风险. 体外实验还证实了MPs对人体新陈代谢、能量平衡、免疫功能、生殖功能等有不利影响[75]. 而且,进入人体的MPs可以释放其表面微生物和从环境中吸附的多种化学物质[75]. 例如,MPs可以作为病菌微生物的载体,将病原体带入到人体内[94]. 除了通过食物链和生物放大作用,人类还可能通过空气吸入以及皮肤接触等途径使人体暴露于MPs. 例如,空气中的高浓度的MPs会引起粉尘过载反应,并强烈释放趋化因子,增加血管通透性,阻止巨噬细胞迁移,从而导致慢性炎症. 肺部的MPs有促炎症作用,并具有高氧化活性. 人体长期吸入高浓度MPs可导致哮喘等呼吸道疾病和慢性肺病等发生恶化[75, 95]. 小于100 nm的MPs可能会经皮肤接触引起人体上皮细胞氧化应激而产生细胞毒性,且MPs中的添加剂,如表面活性剂、润滑剂、芳香剂、颜料等,也有可能通过皮肤接触诱发毒性[96].
-
MPs与OPs之间的吸附/解吸作用主要受其各自性质的影响——MPs的大小、类型和老化过程;OPs的疏水性、官能团和空间结构等. 它们之间的相互作用影响着OPs在生物体内或环境中的迁移转化、生物累积和毒性. MPs能够通过不同途径改变OPs对水生生物的毒性,并选择性发挥“载体”、“释放剂”、“稀释”或“净化”作用来增加或减少OPs的生物累积或代谢. MPs能够改变OPs在环境中的迁移转化及其在生物体中的代谢,即MPs可影响OPs的环境归趋和生态风险. 因此,它们的毒性效应需从形成复合污染物的角度综合评价.
未来关于MPs与OPs相互作用的环境影响和风险的研究应考虑以下几个方面:(1)规范MPs的取样、分析和表征方法. MPs的采集、分析和鉴定是MPs研究的第一步,但目前对MPs的取样和分类分析鉴定方法还没有统一的标准. 研究过程中采用的方法不同,大大降低了不同研究之间的可比性. 在进一步的研究中,应根据MPs的形状、粒径和化学成分,建立统一的取样和分析方法,规范环境中丰富的MPs的表示方法. 统一的标准有助于在全球范围内定量研究MPs污染的分布和特征,应开发新的方法应用于MPs的分析. (2)目前,MPs的毒性实验大多是在实验室条件下,在细胞、组织和器官水平上进行的. 存在试验暴露时间短、剂量远高于环境浓度的问题. 目前对MPs在食物链中的传递效应研究较少,无法准确评价其对人体健康的危害. 今后的研究应结合实际环境特点,建立从细胞到种群的不同层次的评价机制,为生态环境基准和人类健康风险评价提供依据. (3)加强MPs复合污染效应的研究. MPs在迁移过程中会吸附环境中的有毒有害物质,MPs携带的有毒污染物与MPs的结合释放机理尚不清楚. 根据不同的环境特征,探索污染物附着在MPs表面的特性,阐明污染物吸附在MPs表面的环境归趋. 此外,MPs添加剂与表面附着污染物之间的复合效应还需进一步探讨.
水环境中微塑料的迁移及其与有机污染物的复合毒性效应研究进展
Migration of microplastics and their combined toxic effects with organic pollutants in water environment: A review
-
摘要: 水环境中的微塑料(MPs)通过吸附和解吸与共存的有机污染物(OPs)相互作用,影响污染物的迁移转化、生物积累、毒性效应等环境行为. 因此,MPs和OPs的生态效应需从它们之间的相互作用角度综合考虑. 本文在查阅近几年相关文献的基础上,重点阐述了水环境中MPs的环境行为及其对OPs迁移转化的影响,讨论了MPs的生态风险及其与OPs的复合毒性效应的影响因素,并得出如下规律:MPs和OPs的特性,如MPs的表面极性和OPs的疏水性决定了MPs作为OPs载体的有效性;MPs的粒径、表面特性、表面生物膜等理化性质影响了水环境中OPs的迁移转化途径和复合物MPs-OPs的毒性效应. 本文以期为进一步评估MPs的环境行为和生态风险提供有益的参考,并为准确评估MPs及其相关OPs的环境风险提出了建议.Abstract: The environmental behaviors of organic pollutants(OPs) such as migration, transformation, bioaccumulation and toxic effects, are affected by microplastics (MPs), which interact with coexisting OPs through adsorption and desorption in water environment. Therefore, the ecological effects of MPs and OPs should be comprehensively considered from the perspective of their interaction. On the basis of consulting the relevant literatures in recent years, the ecological risk of MPs and the influencing factors of the combined toxic effects of MPs and OPs were discussed. And we obtain the following laws: The effectiveness of MPs as OPs’ carrier was determined by the characteristics of MPs and OPs, such as the surface polarity of MPs and the hydrophobicity of OPs; the migration and transformation of OPs and the combined toxicity of MPs-OPs in water environment were affected by the physical and chemical properties of MPs,such as particle size, surface characteristics and surface biofilms. A useful reference for the further assessment of the environmental behavior and ecological risk of MPs was provided by this paper. And some suggestions were put forward for the accurate assessment of the environmental risk of MPs and its related OPs.
-
Key words:
- microplastics /
- migration and transformation /
- ecotoxicology /
- combined toxicity
-

-
表 1 MPs-OPs复合物在生物体内的复合作用
Table 1. Combined action of MPs-OPs complexes in organism
作用类型
Type of action生物介质
Biological media有机污染物
Organic pollutants微塑料
MPs详情
Details参考文献
References粒径/μm
Particle size类型
Type促进 绿藻类、田螺 外消旋甲基苯丙胺 0.7 PS MPs与外消旋甲基苯丙胺共存时,急性毒性显著增加. [74] 平菇 氧苯酮(BP-3) 11—13 LDPE 复合物暴露7 d后,诱导了氧化应激和损伤, 暴露14 d后还出现了神经毒性效应,即暴露时间越长,遗传毒性越强. [85] 成人血液 石油烃 30 PS PS与石油烃的共存可显著加重石油烃的免疫毒性. [86] 海洋微型藻类 盐酸多西环素、盐酸普鲁卡因胺 1—5 红色荧光聚合物微球* 混合条件下,微藻的平均生长率和叶绿素含量显著下降. [53] 心脏 氯蜱硫磷(CPF) 1.4—42 PE CPF-PE复合物的半数致死浓度(LC50 = 0.26 μg·L−1)低于CPF的半数致死浓度(LC50 = 1.34 μg·L−1). [87] 海洋桡足类 TCS 10—90 PE 添加500 个 mL−1 MPs到TCS中,其LC50明显低于单独TCS的LC50. [88] 海洋青鳉胚胎和幼虫 BaP、全氟辛烷磺酸(PFOS)和二苯甲酮-3 (BP3) 4—6 PE 暴露于MPs-PFOS会降低胚胎存活率并阻止孵化.暴露于MPs-BaP或MPs-BP3的幼虫表现出生长减少、发育异常增加和行为异常.MPs上的BaP和PFOS似乎比单独在海水中更具胚胎毒性. [88] 蛋白核小球藻 TPTCl 0.55、5 PS PS暴露会导致绿藻加速吸收TPTCl,从而提高TPTCl的毒性. [83] 蚯蚓 杜福林农药 40—50 * MPs可以显著增加杜福林在蚯蚓体内的生物累积. [89] 拮抗 大型水蚤 PCB 209 1—5 FMG-1.3* MPs的加入将生物体内的PCB 209含量降低了4倍. [59] 海洋微型藻类 TCS 74、74、74、1 PE、PS、PVC PVC与TCS的复合毒性比PE和PS降低更多. [79] 海洋微型藻类 三苯基锡(TPT) 0.1、5 PS 当添加20 mg·L−1 0.1 μm PS和5 μm PS时,TPT的LC50值分别从
0.56 μg·L−1提高到0.85 μg·L−1和0.71 μg·L−1.[61] 尼罗罗非鱼 罗红霉素 0.1 PS 暴露于混合物14 d后,鱼肝脏的超氧化物歧化酶活性显著升高,丙二醛含量降低,表明肝脏氧化损伤减轻. [56] 斑马鱼仔鱼 6:2氯化聚氟醚磺酸盐(F-53B) 5 PS PS显著促进了F-53B的吸附,降低了F-53B在斑马鱼仔鱼体内的生物利用度和生物蓄积量. [62] G. roeseli PAHs 40—63 PA 含有PA的PAHs的暴露情景显示,在最高浓度下,水样中的菲减少了100%;在最低浓度下,减少了83%. [90] 蛋白核小球藻 邻苯二甲酸二丁酯 0.1、0.55、5 PE 20 mg·L−1 PS可使邻苯二甲酸二丁酯的生物利用度降低20%以上. [84] 受精卵 菲 10 PS 2 μg·L−1MPs和菲复合暴露可将孵化率提高25.8%, 降低畸形率和死亡率, 恢复菲引起的心脏发育相关基因的异常表达. [77] 无影响 受精卵 菲 10 PS 20、200 μg·L−1 MPs不会改变菲的毒性. [77] 蓝贻贝 荧蒽 1 PE 共暴露处理中, MPs的存在没有显著影响鳃和消化腺对荧蒽的吸收. [65] 挪威龙虾 PCB 28, 52, 101, 118, 138, 153, 180, 500—600 PE、PS 复合物不会导致微生物中化学物质的显著生物积累. [67] 注:*为未确定的MPs类型 -
[1] Plastics-the facts[EB/OL]. [2020-6-21]. https://www.plasticseurope.org/en/resources/publications/4312-plastics-facts-2020. [2] 栾晓玉. 基于物质流分析的中国塑料资源代谢研究[D]. 济南: 山东大学, 2020. LUAN X Y. The research of plastics metabolic process based on material flow analysis in China[D]. Jinan: Shandong University, 2020(in Chinese).
[3] THOMPSON R C, OLSEN Y, MITCHELL R P, et al. Lost at sea: Where is all the plastic? [J]. Science, 2004, 304(5672): 838. doi: 10.1126/science.1094559 [4] HUANG D L, TAO J X, CHENG M, et al. Microplastics and nanoplastics in the environment: Macroscopic transport and effects on creatures [J]. Journal of Hazardous Materials, 2021, 407: 124399. doi: 10.1016/j.jhazmat.2020.124399 [5] PAN Z, SUN Y, LIU Q L, et al. Riverine microplastic pollution matters: A case study in the Zhangjiang River of Southeastern China [J]. Marine Pollution Bulletin, 2020, 159: 111516. doi: 10.1016/j.marpolbul.2020.111516 [6] SCHERER C, WEBER A, STOCK F, et al. Comparative assessment of microplastics in water and sediment of a large European river [J]. Science of the Total Environment, 2020, 738: 139866. doi: 10.1016/j.scitotenv.2020.139866 [7] EARN A, BUCCI K, ROCHMAN C M. A systematic review of the literature on plastic pollution in the Laurentian Great Lakes and its effects on freshwater biota [J]. Journal of Great Lakes Research, 2021, 47(1): 120-133. doi: 10.1016/j.jglr.2020.11.001 [8] XU L L, CAO L, HUANG W, et al. Assessment of plastic pollution in the Bohai Sea: Abundance, distribution, morphological characteristics and chemical components [J]. Environmental Pollution, 2021, 278: 116874. doi: 10.1016/j.envpol.2021.116874 [9] KANHAI L D K, GARDFELDT K, KRUMPEN T, et al. Microplastics in sea ice and seawater beneath ice floes from the Arctic Ocean [J]. Scientific Reports, 2020, 10: 5004. doi: 10.1038/s41598-020-61948-6 [10] SUARIA G, PEROLD V, LEE J R, et al. Floating macro- and microplastics around the southern ocean: Results from the Antarctic circumnavigation expedition [J]. Environment International, 2020, 136: 105494. doi: 10.1016/j.envint.2020.105494 [11] BARBOZA L G A, LOPES C, OLIVEIRA P, et al. Microplastics in wild fish from North East Atlantic Ocean and its potential for causing neurotoxic effects, lipid oxidative damage, and human health risks associated with ingestion exposure [J]. Science of the Total Environment, 2020, 717: 134625. doi: 10.1016/j.scitotenv.2019.134625 [12] ORY N C, SOBRAL P, FERREIRA J L, et al. Amberstripe scad Decapterus muroadsi (Carangidae) fish ingest blue microplastics resembling their copepod prey along the Coast of Rapa Nui (Easter Island) in the South Pacific subtropical gyre [J]. Science of the Total Environment, 2017, 586: 430-437. doi: 10.1016/j.scitotenv.2017.01.175 [13] SAVOCA M S, WOHLFEIL M E, EBELER S E, et al. Marine plastic debris emits a keystone infochemical for olfactory foraging seabirds [J]. Science Advances, 2016, 2(11): 1600395. doi: 10.1126/sciadv.1600395 [14] COLE M, LINDEQUE P, FILEMAN E, et al. Microplastic ingestion by zooplankton [J]. Environmental Science & Technology, 2013, 47(12): 6646-6655. [15] PETERSEN F, HUBBART J A. The occurrence and transport of microplastics: The state of the science [J]. Science of the Total Environment, 2021, 758: 143936. doi: 10.1016/j.scitotenv.2020.143936 [16] WANG C H, ZHAO J, XING B S. Environmental source, fate, and toxicity of microplastics [J]. Journal of Hazardous Materials, 2021, 407: 124357. doi: 10.1016/j.jhazmat.2020.124357 [17] CHEN G L, LI Y Z, WANG J. Occurrence and ecological impact of microplastics in aquaculture ecosystems [J]. Chemosphere, 2021, 274: 129989. doi: 10.1016/j.chemosphere.2021.129989 [18] SIGNA G, MAZZOLA A, VIZZINI S. Seabird influence on ecological processes in coastal marine ecosystems: An overlooked role?A critical review [J]. Estuarine, Coastal and Shelf Science, 2021, 250: 107164. doi: 10.1016/j.ecss.2020.107164 [19] MARKIC A, GAERTNER J C, GAERTNER-MAZOUNI N, et al. Plastic ingestion by marine fish in the wild [J]. Critical Reviews in Environmental Science and Technology, 2020, 50(7): 657-697. doi: 10.1080/10643389.2019.1631990 [20] WILCOX C, van SEBILLE E, HARDESTY B D. Threat of plastic pollution to seabirds is global, pervasive, and increasing [J]. PNAS, 2015, 112(38): 11899-11904. doi: 10.1073/pnas.1502108112 [21] SCHUYLER Q, HARDESTY B D, WILCOX C, et al. Global analysis of anthropogenic debris ingestion by sea turtles [J]. Conservation Biology, 2014, 28(1): 129-139. doi: 10.1111/cobi.12126 [22] SPARKS C. Microplastics in mussels along the Coast of cape town, south Africa [J]. Bulletin of Environmental Contamination and Toxicology, 2020, 104(4): 423-431. doi: 10.1007/s00128-020-02809-w [23] XU X Y, WONG C Y, TAM N F Y, et al. Microplastics in invertebrates on soft Shores in Hong Kong: Influence of habitat, taxa and feeding mode [J]. Science of the Total Environment, 2020, 715: 136999. doi: 10.1016/j.scitotenv.2020.136999 [24] MOORE R C, LOSETO L, NOEL M, et al. Microplastics in beluga whales (Delphinapterus leucas) from the Eastern Beaufort Sea [J]. Marine Pollution Bulletin, 2020, 150: 110723. doi: 10.1016/j.marpolbul.2019.110723 [25] HERNANDEZ-GONZALEZ A, SAAVEDRA C, GAGO J, et al. Microplastics in the stomach contents of common dolphin (Delphinus delphis) stranded on the Galician coasts (NW Spain, 2005-2010) [J]. Marine Pollution Bulletin, 2018, 137: 526-532. doi: 10.1016/j.marpolbul.2018.10.026 [26] VÁZQUEZ-ROWE I, ITA-NAGY D, KAHHAT R. Microplastics in fisheries and aquaculture: Implications to food sustainability and safety [J]. Current Opinion in Green and Sustainable Chemistry, 2021, 29: 100464. doi: 10.1016/j.cogsc.2021.100464 [27] CHEN Y L, LI T C, HU H J, et al. Transport and fate of microplastics in constructed wetlands: A microcosm study [J]. Journal of Hazardous Materials, 2021, 415: 125615. doi: 10.1016/j.jhazmat.2021.125615 [28] ALIMI O S, FARNER BUDARZ J, HERNANDEZ L M, et al. Microplastics and nanoplastics in aquatic environments: Aggregation, deposition, and enhanced contaminant transport [J]. Environmental Science & Technology, 2018, 52(4): 1704-1724. [29] BARLETTA M, LIMA A R A, COSTA M F. Distribution, sources and consequences of nutrients, persistent organic pollutants, metals and microplastics in South American estuaries [J]. Science of the Total Environment, 2019, 651: 1199-1218. doi: 10.1016/j.scitotenv.2018.09.276 [30] KOELMANS A A, BESSELING E, WEGNER A, et al. Plastic as a carrier of POPs to aquatic organisms: A model analysis [J]. Environmental Science & Technology, 2013, 47(14): 7812-7820. [31] 刘沙沙, 付建平, 郭楚玲, 等. 微塑料的环境行为及其生态毒性研究进展 [J]. 农业环境科学学报, 2019, 38(5): 957-969. LIU S S, FU J P, GUO C L, et al. Research progress on environmental behavior and ecological toxicity of microplastics [J]. Journal of Agro-Environment Science, 2019, 38(5): 957-969(in Chinese).
[32] KUMAR R, SHARMA P, MANNA C, et al. Abundance, interaction, ingestion, ecological concerns, and mitigation policies of microplastic pollution in riverine ecosystem: A review [J]. Science of the Total Environment, 2021, 782: 146695. doi: 10.1016/j.scitotenv.2021.146695 [33] JĘDRUCHNIEWICZ K, OK Y S, OLESZCZUK P. COVID-19 discarded disposable gloves as a source and a vector of pollutants in the environment [J]. Journal of Hazardous Materials, 2021, 417: 125938. doi: 10.1016/j.jhazmat.2021.125938 [34] GIANICO A, BRAGUGLIA C, GALLIPOLI A, et al. Land application of biosolids in Europe: Possibilities, con-straints and future perspectives [J]. Water, 2021, 13(1): 103. doi: 10.3390/w13010103 [35] XIA W L, RAO Q Y, DENG X W, et al. Rainfall is a significant environmental factor of microplastic pollution in inland waters [J]. Science of the Total Environment, 2020, 732: 139065. doi: 10.1016/j.scitotenv.2020.139065 [36] de LEO A, CUTRONEO L, SOUS D, et al. Settling velocity of microplastics exposed to wave action [J]. Journal of Marine Science and Engineering, 2021, 9(2): 142. doi: 10.3390/jmse9020142 [37] HARRIS P T. The fate of microplastic in marine sedimentary environments: A review and synthesis [J]. Marine Pollution Bulletin, 2020, 158: 111398. doi: 10.1016/j.marpolbul.2020.111398 [38] DU S, ZHU R W, CAI Y J, et al. Environmental fate and impacts of microplastics in aquatic ecosystems: A review [J]. RSC Advances, 2021, 11(26): 15762-15784. doi: 10.1039/D1RA00880C [39] RIOS MENDOZA L M, JONES P R. Characterisation of microplastics and toxic chemicals extracted from microplastic samples from the North Pacific Gyre [J]. Environmental Chemistry, 2015, 12(5): 611. doi: 10.1071/EN14236 [40] TALLEC K, BLARD O, GONZÁLEZ-FERNÁNDEZ C, et al. Surface functionalization determines behavior of nanoplastic solutions in model aquatic environments [J]. Chemosphere, 2019, 225: 639-646. doi: 10.1016/j.chemosphere.2019.03.077 [41] HÜFFER T, PRAETORIUS A, WAGNER S, et al. Microplastic exposure assessment in aquatic environments: Learning from similarities and differences to engineered nanoparticles [J]. Environmental Science & Technology, 2017, 51(5): 2499-2507. [42] LI S C, LIU H, GAO R, et al. Aggregation kinetics of microplastics in aquatic environment: Complex roles of electrolytes, pH, and natural organic matter [J]. Environmental Pollution, 2018, 237: 126-132. doi: 10.1016/j.envpol.2018.02.042 [43] MA Y N, HUANG A N, CAO S Q, et al. Effects of nanoplastics and microplastics on toxicity, bioaccumulation, and environmental fate of phenanthrene in fresh water [J]. Environmental Pollution, 2016, 219: 166-173. doi: 10.1016/j.envpol.2016.10.061 [44] BRYANT J A, CLEMENTE T M, VIVIANI D A, et al. Diversity and activity of communities inhabiting plastic debris in the north Pacific gyre [J]. mSystems, 2016, 1(3): e00024-16. doi: 10.1128/msystems.00024-16 [45] OBERBECKMANN S, KREIKEMEYER B, LABRENZ M. Environmental factors support the formation of specific bacterial assemblages on microplastics [J]. Frontiers in Microbiology, 2017, 8: 2709. [46] OBERBECKMANN S, LOEDER M G J, GERDTS G, et al. Spatial and seasonal variation in diversity and structure of microbial biofilms on marine plastics in Northern European waters [J]. FEMS Microbiology Ecology, 2014, 90(2): 478-492. doi: 10.1111/1574-6941.12409 [47] MERCIER A, GRAVOUIL K, AUCHER W, et al. Fate of eight different polymers under uncontrolled composting conditions: Relationships between deterioration, biofilm formation, and the material surface properties [J]. Environmental Science & Technology, 2017, 51(4): 1988-1997. [48] YOUSIF E, HADDAD R. Photodegradation and photostabilization of polymers, especially polystyrene: Review [J]. SpringerPlus, 2013, 2(1): 1-32. doi: 10.1186/2193-1801-2-1 [49] ZHU K C, JIA H Z, ZHAO S, et al. Formation of environmentally persistent free radicals on microplastics under light irradiation [J]. Environmental Science & Technology, 2019, 53(14): 8177-8186. [50] SHEN J J, STEINBACH R, TOBIN J M, et al. Photoactive and metal-free polyamide-based polymers for water and wastewater treatment under visible light irradiation [J]. Applied Catalysis B:Environmental, 2016, 193: 226-233. doi: 10.1016/j.apcatb.2016.04.015 [51] PRATA J C, LAVORANTE B R B O, B S M MONTENEGRO M D C, et al. Influence of microplastics on the toxicity of the pharmaceuticals procainamide and doxycycline on the marine microalgae Tetraselmis chuii [J]. Aquatic Toxicology, 2018, 197: 143-152. doi: 10.1016/j.aquatox.2018.02.015 [52] OEHLMANN J, SCHULTE-OEHLMANN U, KLOAS W, et al. A critical analysis of the biological impacts of plasticizers on wildlife [J]. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 2009, 364(1526): 2047-2062. doi: 10.1098/rstb.2008.0242 [53] YU Y J, MA R X, QU H, et al. Enhanced adsorption of tetrabromobisphenol a (TBBPA) on cosmetic-derived plastic microbeads and combined effects on zebrafish [J]. Chemosphere, 2020, 248: 126067. doi: 10.1016/j.chemosphere.2020.126067 [54] ZHANG S S, DING J N, RAZANAJATOVO R M, et al. Interactive effects of polystyrene microplastics and roxithromycin on bioaccumulation and biochemical status in the freshwater fish red tilapia (Oreochromis niloticus) [J]. Science of the Total Environment, 2019, 648: 1431-1439. doi: 10.1016/j.scitotenv.2018.08.266 [55] BOUHROUM R, BOULKAMH A, ASIA L, et al. Concentrations and fingerprints of PAHs and PCBs adsorbed onto marine plastic debris from the Indonesian Cilacap Coast and theNorth Atlantic gyre [J]. Regional Studies in Marine Science, 2019, 29: 100611. doi: 10.1016/j.rsma.2019.100611 [56] TAN X L, YU X B, CAI L Q, et al. Microplastics and associated PAHs in surface water from the Feilaixia Reservoir in the Beijiang River, China [J]. Chemosphere, 2019, 221: 834-840. doi: 10.1016/j.chemosphere.2019.01.022 [57] KOELMANS A A, BAKIR A, BURTON G A, et al. Microplastic as a vector for chemicals in the aquatic environment: Critical review and model-supported reinterpretation of empirical studies [J]. Environmental Science & Technology, 2016, 50(7): 3315-3326. [58] MATO Y, ISOBE T, TAKADA H, et al. Plastic resin pellets as a transport medium for toxic chemicals in the marine environment [J]. Environmental Science & Technology, 2001, 35(2): 318-324. [59] GERDES Z, OGONOWSKI M, NYBOM I, et al. Microplastic-mediated transport of PCBs?A depuration study with Daphnia magna [J]. PLoS One, 2019, 14(2): e0205378. doi: 10.1371/journal.pone.0205378 [60] GUO Y H, MA W, LI J J, et al. Effects of microplastics on growth, phenanthrene stress, and lipid accumulation in a diatom, Phaeodactylum tricornutum [J]. Environmental Pollution, 2020, 257: 113628. doi: 10.1016/j.envpol.2019.113628 [61] YI X L, WANG J F, LI Z C, et al. The effect of polystyrene plastics on the toxicity of triphenyltin to the marine diatom Skeletonema costatum—influence of plastic particle size [J]. Environmental Science and Pollution Research, 2019, 26(25): 25445-25451. doi: 10.1007/s11356-019-05826-3 [62] YANG H L, LAI H, HUANG J, et al. Polystyrene microplastics decrease F-53B bioaccumulation but induce inflammatory stress in larval zebrafish [J]. Chemosphere, 2020, 255: 127040. doi: 10.1016/j.chemosphere.2020.127040 [63] MOHAMED NOR N H, KOELMANS A A. Transfer of PCBs from microplastics under simulated gut fluid conditions is biphasic and reversible [J]. Environmental Science & Technology, 2019, 53(4): 1874-1883. [64] SØRENSEN L, ROGERS E, ALTIN D, et al. Sorption of PAHs to microplastic and their bioavailability and toxicity to marine copepods under co-exposure conditions [J]. Environmental Pollution, 2020, 258: 113844. doi: 10.1016/j.envpol.2019.113844 [65] MAGARA G, ELIA A C, SYBERG K, et al. Single contaminant and combined exposures of polyethylene microplastics and fluoranthene: Accumulation and oxidative stress response in the blue mussel, Mytilus edulis [J]. Journal of Toxicology and Environmental Health, Part A, 2018, 81(16): 761-773. doi: 10.1080/15287394.2018.1488639 [66] BEIRAS R, MUNIATEGUI-LORENZO S, RODIL R, et al. Polyethylene microplastics do not increase bioaccumulation or toxicity of nonylphenol and 4-MBC to marine zooplankton [J]. Science of the Total Environment, 2019, 692: 1-9. doi: 10.1016/j.scitotenv.2019.07.106 [67] DEVRIESE L I, de WITTE B, VETHAAK A D, et al. Bioaccumulation of PCBs from microplastics in Norway lobster (Nephrops norvegicus): An experimental study [J]. Chemosphere, 2017, 186: 10-16. doi: 10.1016/j.chemosphere.2017.07.121 [68] 刘芃岩, 孙启智, 刘璐, 等. 微塑料环境赋存及其与有机污染物的作用机理研究进展 [J]. 中国科学:化学, 2021, 51(9): 1206-1216. doi: 10.1360/SSC-2021-0139 LIU P Y, SUN Q Z, LIU L, et al. Research progress on environmental occurrence of microplastics and their interaction mechanism with organic pollutants [J]. Scientia Sinica (Chimica), 2021, 51(9): 1206-1216(in Chinese). doi: 10.1360/SSC-2021-0139
[69] TANAKA K, TAKADA H, YAMASHITA R, et al. Accumulation of plastic-derived chemicals in tissues of seabirds ingesting marine plastics [J]. Marine Pollution Bulletin, 2013, 69(1/2): 219-222. [70] ZHANG Y, PU S Y, LV X, et al. Global trends and prospects in microplastics research: A bibliometric analysis [J]. Journal of Hazardous Materials, 2020, 400: 123110. doi: 10.1016/j.jhazmat.2020.123110 [71] BROWNE M A, NIVEN S J, GALLOWAY T S, et al. Microplastic moves pollutants and additives to worms, reducing functions linked to health and biodiversity [J]. Current Biology, 2013, 23(23): 2388-2392. doi: 10.1016/j.cub.2013.10.012 [72] JANG M, SHIM W J, HAN G M, et al. Styrofoam debris as a source of hazardous additives for marine organisms [J]. Environmental Science & Technology, 2016, 50(10): 4951-4960. [73] BATEL A, BORCHERT F, REINWALD H, et al. Microplastic accumulation patterns and transfer of benzo[a]Pyrene to adult zebrafish (Danio rerio) gills and zebrafish embryos [J]. Environmental Pollution, 2018, 235: 918-930. doi: 10.1016/j.envpol.2018.01.028 [74] QU H, MA R X, BARRETT H, et al. How microplastics affect chiral illicit drug methamphetamine in aquatic food chain?From green alga (Chlorella pyrenoidosa) to freshwater snail (Cipangopaludian cathayensis) [J]. Environment International, 2020, 136: 105480. doi: 10.1016/j.envint.2020.105480 [75] RAHMAN A, SARKAR A, YADAV O P, et al. Potential human health risks due to environmental exposure to nano- and microplastics and knowledge gaps: A scoping review [J]. Science of the Total Environment, 2021, 757: 143872. doi: 10.1016/j.scitotenv.2020.143872 [76] PAUL-PONT I, LACROIX C, GONZÁLEZ FERNÁNDEZ C, et al. Exposure of marine mussels Mytilus spp. to polystyrene microplastics: Toxicity and influence on fluoranthene bioaccumulation [J]. Environmental Pollution, 2016, 216: 724-737. doi: 10.1016/j.envpol.2016.06.039 [77] LI Y J, WANG J, YANG G X, et al. Low level of polystyrene microplastics decreases early developmental toxicity of phenanthrene on marine medaka (Oryzias melastigma) [J]. Journal of Hazardous Materials, 2020, 385: 121586. doi: 10.1016/j.jhazmat.2019.121586 [78] LIU S Q, WANG J W, ZHU J H, et al. The joint toxicity of polyethylene microplastic and phenanthrene to wheat seedlings [J]. Chemosphere, 2021, 282: 130967. doi: 10.1016/j.chemosphere.2021.130967 [79] ZHU Z L, WANG S C, ZHAO F F, et al. Joint toxicity of microplastics with triclosan to marine microalgae Skeletonema costatum [J]. Environmental Pollution, 2019, 246: 509-517. doi: 10.1016/j.envpol.2018.12.044 [80] ZHOU L L, WANG T C, QU G Z, et al. Probing the aging processes and mechanisms of microplastic under simulated multiple actions generated by discharge plasma [J]. Journal of Hazardous Materials, 2020, 398: 122956. doi: 10.1016/j.jhazmat.2020.122956 [81] PFLUGMACHER S, TALLINEN S, KIM Y J, et al. Ageing affects microplastic toxicity over time: Effects of aged polycarbonate on germination, growth, and oxidative stress of Lepidium sativum [J]. Science of the Total Environment, 2021, 790: 148166. doi: 10.1016/j.scitotenv.2021.148166 [82] LI C, LIU J, WANG D J, et al. Electrostatic attraction of cationic pollutants by microplastics reduces their joint cytotoxicity [J]. Chemosphere, 2021, 282: 131121. doi: 10.1016/j.chemosphere.2021.131121 [83] le BIHANIC F, CLÉRANDEAU C, CORMIER B, et al. Organic contaminants sorbed to microplastics affect marine medaka fish early life stages development [J]. Marine Pollution Bulletin, 2020, 154: 111059. doi: 10.1016/j.marpolbul.2020.111059 [84] LI Z C, YI X L, ZHOU H, et al. Combined effect of polystyrene microplastics and dibutyl phthalate on the microalgae Chlorella pyrenoidosa [J]. Environmental Pollution, 2020, 257: 113604. doi: 10.1016/j.envpol.2019.113604 [85] O'DONOVAN S, MESTRE N C, ABEL S, et al. Effects of the UV filter, oxybenzone, adsorbed to microplastics in the clam Scrobicularia plana [J]. Science of the Total Environment, 2020, 733: 139102. doi: 10.1016/j.scitotenv.2020.139102 [86] SUN S G, SHI W, TANG Y, et al. Immunotoxicity of petroleum hydrocarbons and microplastics alone or in combination to a bivalve species: Synergic impacts and potential toxication mechanisms [J]. Science of the Total Environment, 2020, 728: 138852. doi: 10.1016/j.scitotenv.2020.138852 [87] BELLAS J, GIL I. Polyethylene microplastics increase the toxicity of chlorpyrifos to the marine copepod Acartia tonsa [J]. Environmental Pollution, 2020, 260: 114059. doi: 10.1016/j.envpol.2020.114059 [88] SYBERG K, NIELSEN A, KHAN F R, et al. Microplastic potentiates triclosan toxicity to the marine copepod Acartia tonsa (Dana) [J]. Journal of Toxicology and Environmental Health, Part A, 2017, 80(23/24): 1369-1371. [89] SUN W, MENG Z Y, LI R S, et al. Joint effects of microplastic and dufulin on bioaccumulation, oxidative stress and metabolic profile of the earthworm (Eisenia fetida) [J]. Chemosphere, 2021, 263: 128171. doi: 10.1016/j.chemosphere.2020.128171 [90] BARTONITZ A, ANYANWU I N, GEIST J, et al. Modulation of PAH toxicity on the freshwater organism G. roeseli by microparticles [J]. Environmental Pollution, 2020, 260: 113999. doi: 10.1016/j.envpol.2020.113999 [91] CARBERY M, O'CONNOR W, PALANISAMI T. Trophic transfer of microplastics and mixed contaminants in the marine food web and implications for human health [J]. Environment International, 2018, 115: 400-409. doi: 10.1016/j.envint.2018.03.007 [92] 刘全斌. 微塑料在我国渤、黄海浮游动物体内的分布特征及其生物富集和排出过程研究[D]. 大连: 大连海事大学, 2020. LIU Q B. Distribution of microplastics and their uptake and elimination in zooplankton in the bo sea and the Yellow Sea[D]. Dalian, China: Dalian Maritime University, 2020(in Chinese).
[93] VÁZQUEZ O A, RAHMAN M S. An ecotoxicological approach to microplastics on terrestrial and aquatic organisms: A systematic review in assessment, monitoring and biological impact [J]. Environmental Toxicology and Pharmacology, 2021, 84: 103615. doi: 10.1016/j.etap.2021.103615 [94] KIRSTEIN I V, KIRMIZI S, WICHELS A, et al. Dangerous hitchhikers?Evidence for potentially pathogenic Vibrio spp. on microplastic particles [J]. Marine Environmental Research, 2016, 120: 1-8. doi: 10.1016/j.marenvres.2016.07.004 [95] ZARUS G M, MUIANGA C, HUNTER C M, et al. A review of data for quantifying human exposures to micro and nanoplastics and potential health risks [J]. Science of the Total Environment, 2021, 756: 144010. doi: 10.1016/j.scitotenv.2020.144010 [96] REVEL M, CHÂTEL A, MOUNEYRAC C. Micro(nano)plastics: A threat to human health? [J]. Current Opinion in Environmental Science & Health, 2018, 1: 17-23. -



 下载:
下载: