-
氯化石蜡(chlorinated paraffins, CPs)是一类工业合成的正构烷烃氯代衍生物,化学通式为CmH2m+2-nCln,氯含量(质量分数)通常在30%—72%之间。根据碳链长度,CPs 可以分为短链氯化石蜡(C10-13, short chain chlorinated paraffins, SCCPs)、中链氯化石蜡(C14-17, medium chain chlorinated paraffins, MCCPs)和长链氯化石蜡(C18-30, long chain chlorinated paraffins, LCCPs)。由于具有挥发性低、阻燃性和电绝缘性好、稳定性高等优点,氯化石蜡被广泛应用于金属加工润滑剂、聚氯乙烯(PVC)的增塑剂、油漆、涂料和橡胶等高分子材料中的阻燃剂等[1-2]。由于具有持久性、长距离迁移性、生物累积性和潜在的生物毒性等持久性有机污染物(persistent organic pollutants, POPs)特性,以质量计算氯化程度超过48%的SCCPs已于2017年5月列入到《关于持久性有机污染物的斯德哥尔摩公约》附件A的受控名单中。我国是世界上最大的CPs生产国、消费国和出口国,2013年的产量为105万t,占到全球产量的15%,并且产量还在逐年增加[3]。由于全球对SCCPs的限制和禁令,CPs工业品的生产已经从SCCPs转向MCCPs [4],而我国也逐渐限制了CPs工业品中SCCPs的含量。与中长链的CPs相比,SCCPs的毒性效应相对较大,但是研究发现氯含量超过46%的MCCPs同样具有环境持久性和潜在的生物毒性[5],可见MCCPs的环境问题同样需要关注。
目前,SCCPs和MCCPs在多种环境介质和生物体内被频繁检出[6-8],但对于昆虫这种低等级无脊椎动物的研究还未见报道。昆虫是生态系统中的重要组成部分,是连接生产者和消费者的重要纽带,在水生和陆生生态系统中具有重要的生态地位。而水生昆虫作为环境污染的生物指示性物种早就受到关注和重视,如Evenset等[9]在北极圈两个湖泊中摇蚊幼虫体内监测到多种持久性有机污染物;Van Praet等[10]通过蜻蜓(细蟌科)幼虫监测了比利时不同土地利用方式下16个池塘水体中POPs的污染状况。但是对于SCCPs和MCCPs这类新型持久性有机污染物在昆虫中的富集特征还并不清楚。另外,有研究表明昆虫在迁移和转运污染物中起到关键作用,认为水生昆虫(如蜻蜓、蚊和蜉蝣)是污染物重要的携带者和中间载体,它们能跨越水生生态系统边界,将污染物传递到陆生生态系统中[11]。
本研究以广东清远龙塘镇一个受电子垃圾严重污染的池塘为研究区域,采集不同种类的水生昆虫和环境介质(水体)样品。前期的研究表明,这个池塘的沉积物和电子垃圾残渣中含有高浓度的SCCPs(1.6—47 μg·g−1)和MCCPs(7.3—215 μg·g−1)[12]。本文通过气相色谱质谱联用仪(GC/MS)分析水生昆虫和水体中SCCPs和MCCPs的浓度水平和组成模式,研究水生昆虫体内SCCPs和MCCPs的生物富集规律及其影响机制,进一步理解电子垃圾回收区氯化石蜡的环境行为和归趋。
-
2016年6月在广州清远电子垃圾回收区的池塘中采集了3个目的4种水生昆虫,样品采用水网的方法采集,分别为蜻蜓目幼虫(蜻科和蟌科,Libellulidae和Coenagrionoidea)、半翅目(负子蝽,Belostomatidae)和鞘翅目(水龟虫,Hydrophilidae)。昆虫样品采集后立即带回实验,用去离子水清洗晾干后,于电子天平称取湿重,用锡箔纸包装保存于−20 ℃冰箱内待测。由于昆虫个体较小,不适合解剖分析,所以昆虫样品均作整样处理,且多个个体混合成1个混合样,具体样本量见表1。同时还采集了水生昆虫栖息池塘的水样,装于4 L棕色玻璃瓶中保存。
样品的前处理方法详述见参考文献[12-13]。昆虫样品经过冷冻干燥后,充分研磨至粉末状。然后称取1 g干重样品,添加回收率指示物(13C10-trans-chlordane),在60 ℃水浴锅中,用200 mL二氯甲烷/正己烷(1∶1,V/V)溶剂进行索式抽提48 h。提取液加入10 mL浓硫酸除脂肪后,过弗罗里硅胶复合层析柱(自下而上:20∶2∶5 cm,弗罗里硅土:中性硅胶:酸性硅胶)进一步净化,先用 80 mL正己烷淋洗(弃去),后用50 mL二氯甲烷洗脱,收集目标物(SCCPs和MCCPs)。旋转蒸发浓缩后氮吹至近干,加入内标指示物(ε-HCH)后用异辛烷定容至100 μL。水样通过0.7 μm玻璃纤维滤膜(GF/F, Whatman)过滤,将水样分为溶解相和颗粒相。过滤后的水样(溶解相)通过液液萃取的方法提取,净化及后续处理同昆虫样品处理方法。滤膜(颗粒相)经过冷冻干燥后,其前处理过程同昆虫样品。
-
SCCPs和MCCPs的含量分析采用安捷伦气相色谱-质谱联用仪(Agilent 6890GC- 5975MS)负化学离子源(NCI),选择离子检测(SIM)模式检测,色谱柱为DB-5HT(15 m×0.25 mm×0.10 μm),载气为高纯氦气。不分流进样,进样体积1 μL,进样口温度为250 ℃,接口温度为280 ℃,离子源温度为200 ℃,柱流速1.5 mL·min−1。升温程序为80 ℃保持3 min,以25 ℃·min−1升温到160 ℃,保持6 min,再以20 ℃·min−1升温到300 ℃,保持15 min。为增加仪器灵敏度和较少SCCPs和MCCPs之间的干扰,每个样品分4次进样,分组分别为C10和C15,C11和C16,C12和C17,C13和C14,具体仪器和数据分析方法见参考文献[13]。
整个实验过程所用玻璃器皿在450 ℃下灼烧后依次用色谱纯溶剂丙酮,二氯甲烷和正己烷清洗。质量控制与保证包括方法空白及每个样品添加回收率替代物等措施。方法空白中有痕量的CP单体检出,其含量低于样品中相应化合物含量的1%,报道的数据都经过空白校正。生物样品计算浓度以湿重(ww)表示,水样浓度以体积(L)表示。方法检出限定义为3倍信噪比时实际样品的浓度,SCCPs和MCCPs的方法检出限分别为5.6、4.2 ng·g−1 ww。13C10-trans-chlordane的回收率为81% — 116%。
-
两组数据间的比较采用独立样本t检验法,两组以上数据进行比较用单因素方差分析。采用Pearson检验法对正态分布的数据进行相关分析,非正态分布的数据在分析前进行对数转化。主成分分析(Principal component analysis, PCA)取前两个因子进行分析,因子得分与因子载荷结果分别讨论。以上统计分析均由于Origin 8.5和SPSS 19.0软件完成,P < 0.05认为具有统计学意义。
-
4种水生昆虫中SCCPs和MCCPs的氯含量范围分别为61.3%—62.1%和55.9%—57.9%,∑SCCPs的浓度为52—410 ng·g−1 ww,∑MCCPs的浓度为40—740 ng·g−1 ww,如表1所示。其中,蜻蜓目蟌科幼虫∑SCCPs的浓度最高,其中值为280 ng·g−1 ww,负子蝽的浓度最低(98 ng·g−1 ww)。对于MCCPs,水龟虫具有最高的浓度(300 ng·g−1 ww),最低值(51 ng·g−1 ww)出现在蟌科幼虫中。不同种类昆虫中SCCPs和MCCPs的浓度差异较大,造成这种差异的原因可能是食性及摄食习性的不同,蜻蜓目幼虫为肉食性昆虫,捕食小型水生生物;水龟虫取食藻类和浮游生物,一般为植食性;负子蝽的口器为刺吸式,以猎物的组织液为食。与前期的研究相比,蜻科幼虫体内∑SCCPs(97—410 ng·g−1 ww)和∑MCCPs(40—340 ng·g−1 ww)的浓度与多氯联苯(∑PCBs,170—270 ng·g−1 ww)和多溴联苯醚(∑PBDEs,79—490 ng·g−1 ww)相当[14],说明CPs也是电子垃圾污染区重要的POPs。目前,还未见到有关水生昆虫体内SCCPs和MCCPs的报道,因此只能与其生境相似的底栖动物进行比较。该电子垃圾回收区水生昆虫体内∑SCCPs和∑MCCPs的浓度,与同一研究区域[15]和辽东湾[16]采集的底栖动物(虾和螃蟹)中SCCPs的浓度相当(分别为230—610 ng·g−1 ww和240—500 ng·g−1 ww);高于香港海域软体动物和甲壳纲动物(SCCPs和MCCPs:11—52 ng·g−1 ww和 19—88 ng·g−1 dw)[17]和加拿大安大略湖和密歇根湖中糠虾(SCCPs和MCCPs:2.4—7.5 ng·g−1 ww和未检出)[18];但低于另一电子垃圾区(石角镇)采集的贝类和虾类(SCCPs和 MCCPs:37—120 μg·g−1 lw和36—130 μg·g−1 lw),广东省市场采集的水产品(包括鱼类,虾和牡蛎;SCCPs和MCCPs:1400 ng·g−1 ww和590 ng·g−1 ww)[19]和辽河口海域软体动物(螺和贝类;SCCPs:6100 ng·g−1 dw)[20]中的污染水平。
水体(溶解相和颗粒相)中∑SCCPs和∑MCCPs的中值浓度分别为2800 ng·L−1和5600 ng·L−1。其中,颗粒相的浓度贡献占97%以上(∑SCCPs:2700 ng·L−1和∑MCCPs:5500 ng·L−1),这主要是由于有机质对CPs具有很强的吸附能力,在水体中CPs更易于吸附在悬浮颗粒物上,而不是自由溶解态[21]。水体(溶解相和颗粒相)中∑SCCPs和∑MCCPs的浓度明显高于∑PCBs(90 ng·L−1)和∑PBDEs(1100 ng·L−1)[14],表明SCCPs和MCCPs在受电子垃圾污染的水体中广泛存在,其浓度甚至超过传统的POPs。本研究水体(溶解相)中SCCPs和MCCPs的浓度,低于北京地区河水和湖水(SCCPs:120、460 ng·L−1)[22],高碑店湖中表层水体(SCCPs:160—180 ng·L−1)[23]和英国受工业污染的河流水体(SCCPs:200—1700 ng·L−1)[24]中的浓度;但高于加拿大安大略湖水体(SCCPs和MCCPs:1.2 ng·L−1和0.9 pg·L−1)[18],辽东湾海水(SCCPs:4.1—13 ng·L−1)[16]和日本河流水体(SCCPs:7.6—31 ng·L−1)[25]中的浓度。目前,对环境水体(颗粒相)中SCCPs和MCCPs的相关研究较少,仅有Li等[26]报道黄河流域水体(颗粒相)中SCCPs和MCCPs的均值浓度分别为17 μg·g−1 dw和2.6 μg·g−1 dw,明显低于本研究水体(颗粒相)中SCCPs和MCCPs的浓度(500、1400 μg·g−1 dw)。水体(溶解相和颗粒相)中SCCPs和MCCPs的浓度高于预测的最低无影响浓度(SCCPs和MCCPs:500、1000 ng·L−1)[27],说明粗犷的电子垃圾拆解回收活动已经给当地水生生态系统造成了严重的污染。
-
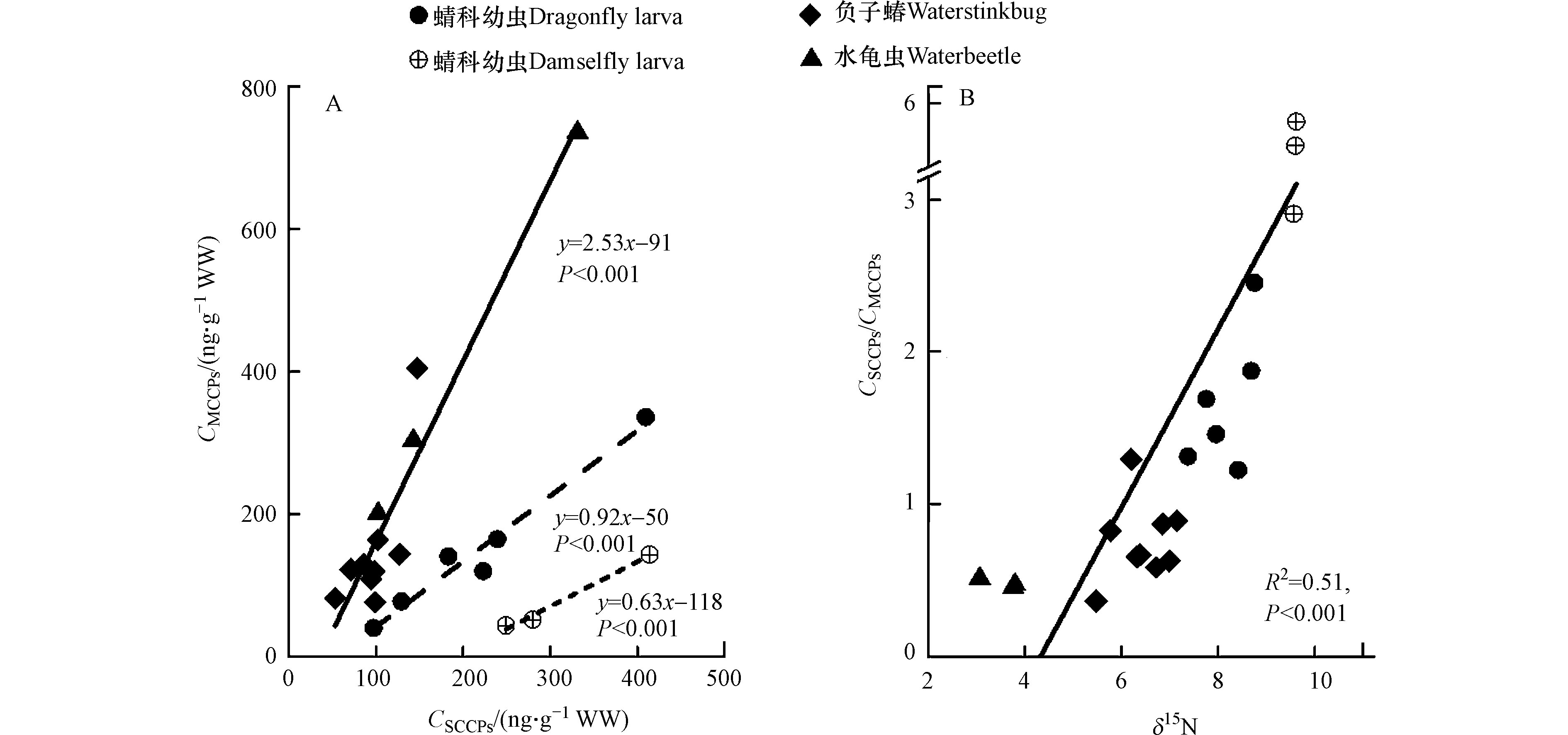
4种水生昆虫中SCCPs与MCCPs的浓度比值为0.47—5.50,如表1所示。其中,蟌科幼虫(5.50)和蜻科幼虫(1.57)中SCCPs与MCCPs的比值均大于1,明显高于水体中的比值(0.37—0.50),表明SCCPs比MCCPs更易于在它们体内富集。而负子蝽和水龟虫中SCCPs与MCCPs的比值分别为0.66和0.47,略高于水体中的比值,说明不同种类昆虫对SCCPs和MCCPs的富集能力有明显差异。通过对SCCPs与MCCPs浓度的相关分析也发现,不同种类昆虫中SCCPs与MCCPs线性拟合方程的斜率差异明显,结果如图1A所示。其中,负子蝽和水龟虫的斜率为2.53,明显高于蜻科幼虫(0.92)和蟌科幼虫(0.63),造成这种差异的原因可能是不同种类昆虫的食性、摄食习性和生境不同。另外发现,水生昆虫体内SCCPs与MCCPs的浓度比值与其氮稳定同位素值(δ15N)呈显著的正相关关系(图1B,P < 0.001),说明SCCPs比MCCPs更易于通过生物放大过程(食物链)累积到生物体内。这与Houde等[18]研究发现水生食物链上SCCPs比MCCPs具有更高的营养级放大潜力的结果一致,但也有研究表明MCCPs在水生食物链上具有更高的营养级放大潜力[17],这可能与高等级生物(如哺乳动物、鸟类等)对SCCPs具有较强的代谢能力有关[28]。
-
水生昆虫和水体(溶解相和颗粒相)中SCCPs和MCCPs同系物的组成模式如图2所示。蜻蜓幼虫(蜻科和蟌科)和负子蝽中SCCPs同系物的组成以C10-11(64%—86%)和Cl6-8(77%—85%)为主,与淀山湖底栖动物[29]、大连市海产品[30]、渤海湾软体动物[31]、辽东湾海洋生物[16]和香港海域软体动物和甲壳纲动物[17]中SCCPs的组成模式一致。水龟虫中SCCPs的组成特征是以C12-13(61%)和Cl6-8(76%)为主,这与我们前期在同一区域所研究的鱼体(鲮鱼)内SCCPs组成模式相似[15],这可能是由于水龟虫和鲮鱼均是植食性生物,取食的藻类和浮游生物,它们具有相似的污染来源。水体中SCCPs不同碳数同系物的占比较为平均(均为20%左右),与同一区域所研究的沉积物的组成模式相似[12],但是水体中低氯代同系物的丰度更高(75%),这主要是由化合物的理化性质决定的,低氯代单体具有更高的溶解度。
对于MCCPs而言,其同系物在水生昆虫和水体中均以C14(34%—53%)和Cl7-9(64%—75%)为主(图2),与法国河流中淡水鱼[32]和黄河水体(颗粒相)[26]中MCCPs的组成特征相似。但本研究的水生昆虫中C14的丰度要低于来自加拿大湖泊和河流[33]、辽东湾[34]、波罗的海[35]和挪威北极圈海域[36]的鱼类中C14的丰度(贡献60%以上)。Zeng等[17, 37]对中国香港海域水生生物的研究发现,脂肪含量越高和营养级越高的水生生物中C14的丰度越高,认为C14更倾向于累积在高脂肪含量的捕食者中。如表1所示,本研究的水生昆虫具有较低的脂肪含量(1.8%—3.2%),也是低营养级生物,同时它们具有较低的C14丰度。这可能是由化合物的理化性质决定,MCCPs的中长碳链组分具有更高的辛醇/水分配系数(KOW)和更大的分子量,因而生物富集和生物放大潜力较低,但是这还需要进一步研究。
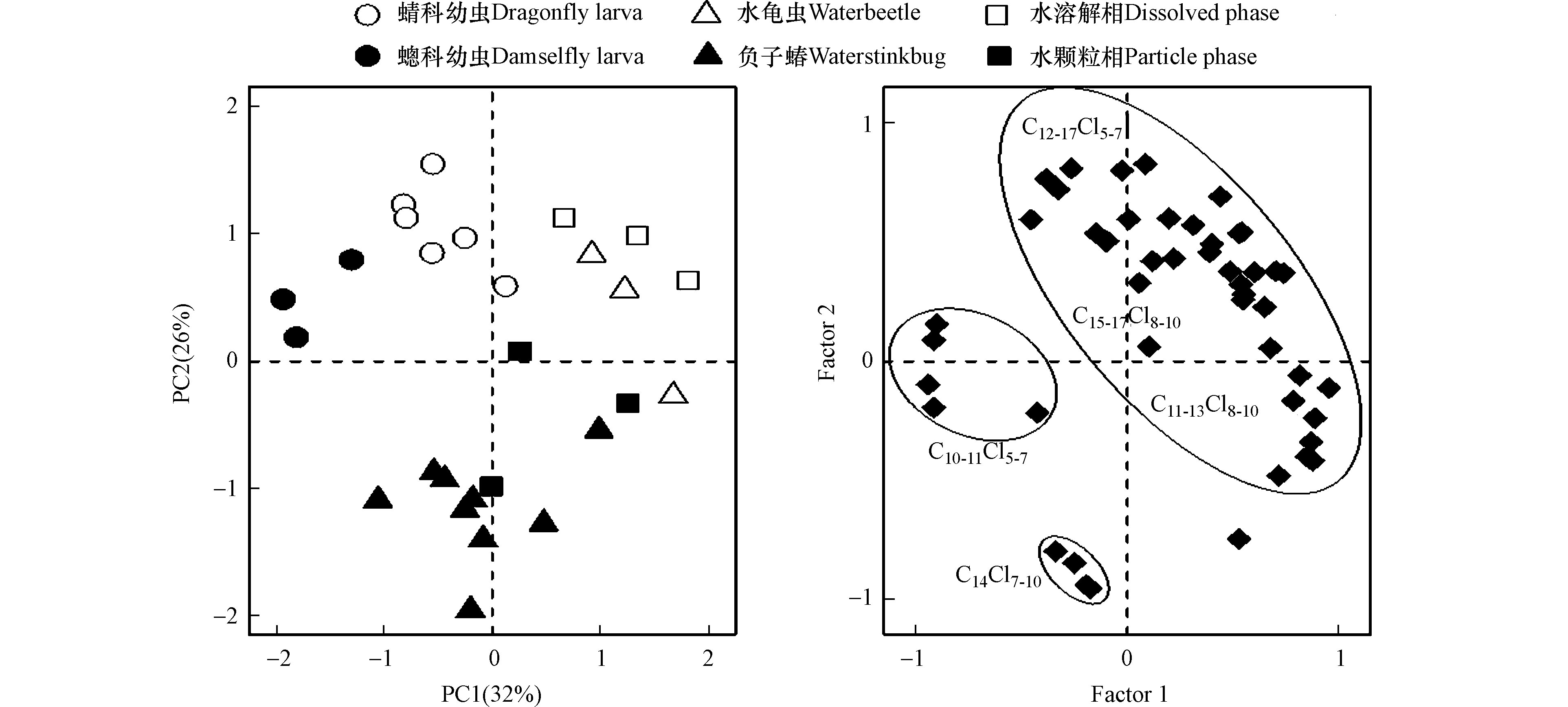
利用主成分分析(PCA)对4种水生昆虫和水体中SCCPs和MCCPs同系物的丰度进行了特征分类,提取占总变量58% 的前两个变量作为第一主成分(PC1:32%)和第二主成分(PC2:26%),结果如图3所示。蜻蜓幼虫(蜻科和蟌科)聚集在得分图的左上方,以低碳低氯代(C10-11Cl5-7)单体为主;水龟虫和水体(溶解相和颗粒相)聚集在得分图右上方,以高碳高氯代(C13-17Cl8-10)单体为主;负子蝽则聚集在得分图下方,以C14Cl7-10单体为主。结果表明,水生昆虫中SCCPs和MCCPs的组成特征表现出种间特异性,与前期发现不同种类昆虫体内HOPs的组成模式不同的研究结果一致[14],这主要是由于食性、摄食习性或者富集能力的不同,从而造成它们体内污染物组成模式的差异。
-
水生昆虫中SCCPs和MCCPs的生物富集因子(Bioaccumulation factor, BAF)采用以下公式计算[18]:
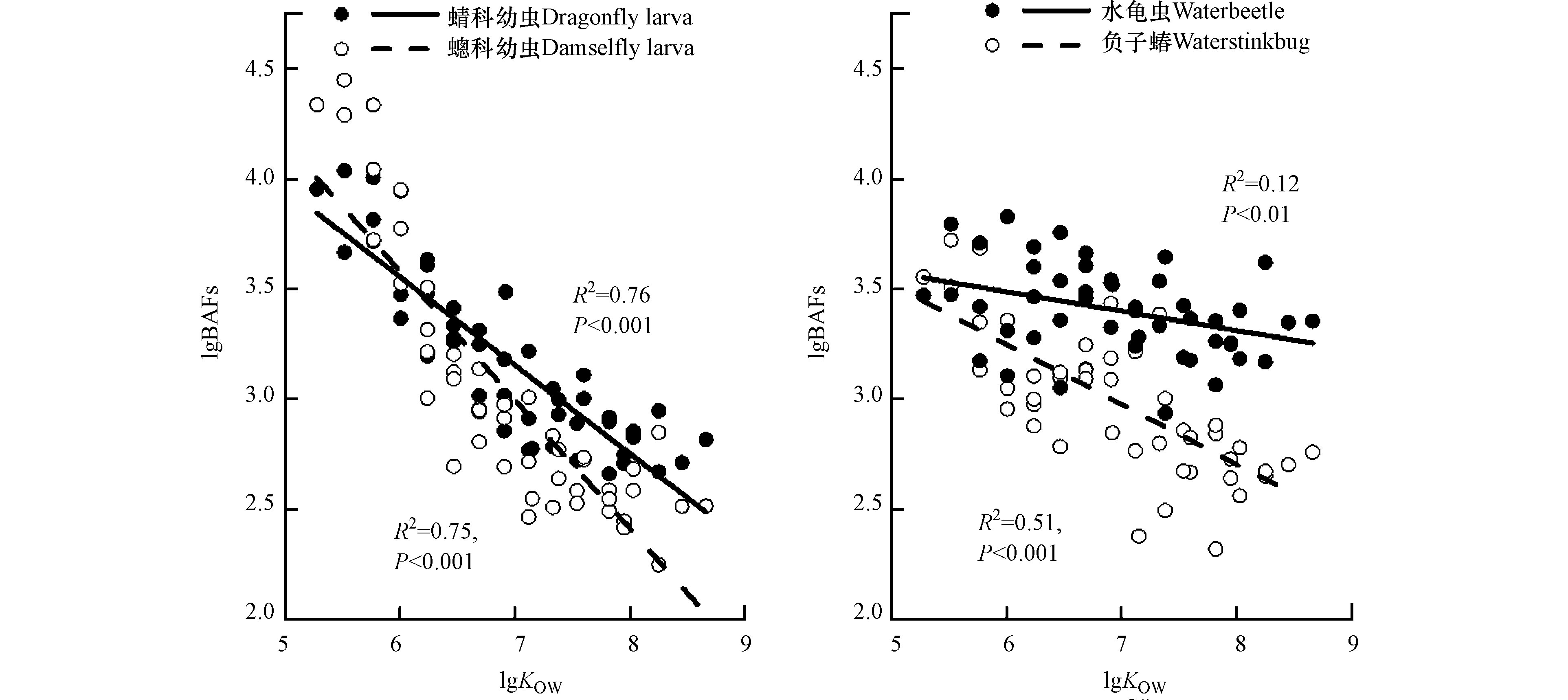
式中,Ci为水生昆虫体内SCCPs或MCCPs的湿重浓度(ng·g−1 ww),Cw为水体(溶解相)中SCCPs或MCCPs的体积浓度(ng·L−1)。如图4所示,四种水生昆虫中SCCP和MCCP同系物的lg BAF值范围分别为2.70—4.45和2.25—3.64。∑SCCPs的lg BAF值最大的是蟌科幼虫(3.79),最小值是负子蝽(3.27),而∑MCCPs的lg BAF值最大的是水龟虫(3.34),最小值是蟌科幼虫(2.62)。与前期的研究相比,蜻科幼虫中∑SCCPs和∑MCCPs的lg BAF值(3.59和2.86)均小于∑PCBs(4.87)和∑PBDEs(4.65),说明在水生昆虫中SCCPs和MCCPs的生物富集潜力低于PCBs和PBDEs。本研究中SCCPs的lg BAF值与同一区域所研究的鱼类的BAF值(2.46—3.45)[15]相近,高于珠江口鱼类和底栖动物(螃蟹、虾和牡蛎)的BAF值(1.6—3.0)[38],但是低于辽东湾底栖动物(螃蟹、虾、螺和贝类,4.5—5.5)[16]和鱼类(4.69—6.05)[34],加拿大安大略湖鱼类(6.0—6.6)[18]和北京高碑店湖鱼类的 BAF值(4.75—5.45)[23]。目前对于水生生物中MCCPs的BAF值的研究较少,仅有Houde等[18]报道了安大略湖鱼类中MCCPs的lg BAF值为6.6—7.3,明显高于本研究中水生昆虫的BAF值(2.62—3.34)。但是在辽东湾、安大略湖和高碑店湖鱼类中SCCPs和MCCPs的lg BAF值的计算方法是以污染物的脂肪归一化浓度为基础,而本研究中BAF值的计算是以湿重浓度为基础,从而造成计算结果的不同。
对于SCCPs和MCCPs,分析了4种水生昆虫的lg BAF值与化合物理化性质的关系。如表2和图4所示,4种水生昆虫中SCCP和MCCP同系物的BAF值与其辛醇/水分配系数(KOW)和碳原子数(C10-17)均呈显著负相关(P < 0.05)。对于氯代程度,蜻蜓幼虫(蜻科和蟌科)的BAF值与氯原子取代数(Cl5-10)呈显著负相关(P < 0.05),但是负子蝽和水龟虫的BAF值与氯原子取代数没有明显的相关性。这些结果表明化合物的理化性质影响了水生昆虫对SCCPs和MCCPs的积累,低KOW和低碳链长度的同系物更容易被生物富集。Sun等[15]和Huang等[38]也报道底栖动物(螃蟹和虾类)中SCCPs的BAF值与其KOW值呈显著负相关,但与鱼类的研究结果不同的是,在鱼类中SCCPs的BAF值与其KOW值和氯原子取代数呈显著正相关[23-34]。可能的原因是,对于底栖动物(包括昆虫、螃蟹和虾类)而言,水体并不是污染物富集的主要途径,它们更容易从沉积物中累积污染物。另一种可能的解释是,与鱼类不同,昆虫、螃蟹和虾的生长发育过程中都需要多次蜕壳(外骨骼),而高KOW值或长碳链的同系物累积在外骨骼中被清除,但是这一过程对污染物生物富集的影响还需深入研究。
-
(1)在受电子垃圾污染的池塘水体和水生昆虫中均检测到较高浓度的SCCPs和MCCPs,说明电子垃圾回收活动已经给当地水生生态系统造成了CPs的严重污染。
(2)不同种类水生昆虫中SCCPs和MCCPs的浓度和组成均表现出明显的种间差异,这可能是食性、摄食习性或富集能力不同造成的。
(3)SCCPs和MCCPs的理化性质(KOW值、碳原子数和氯原子取代数)影响污染物的生物富集效应,低KOW和低碳链长度的同系物更倾向在水生昆虫体内累积。
电子垃圾回收区水生昆虫体内氯化石蜡的污染水平和富集特征
Bioaccumulation of short- and medium-chain chlorinated paraffins in aquatic insects from an e-waste recycling site
-
摘要: 通过GC/MS法测定了广东清远龙塘镇电子垃圾回收区水生昆虫和水体中短链氯化石蜡(SCCPs)和中链氯化石蜡(MCCPs)的浓度水平。结果显示,4种水生昆虫体内∑SCCPs和∑MCCPs的浓度范围分别为52—410 ng·g−1 ww(湿重)和40—740 ng·g−1 ww(湿重),其中,蟌科幼虫的∑SCCPs浓度最高,水龟虫的∑MCCPs浓度最高。主成分分析表明,不同种类水生昆虫中SCCP和MCCP同系物的组成特征表现出种间特异性,可能是由于食性、摄食习性或富集能力的不同。水生昆虫中∑SCCPs和∑MCCPs的生物富集因子(lg BAFs值)的范围分别为3.27—3.79和2.62—3.34。蜻科幼虫中∑SCCPs和∑MCCPs的lg BAFs值均小于多氯联苯(∑PCBs,4.87)和多溴联苯醚(∑PBDEs,4.65),说明在水生昆虫中SCCPs和MCCPs的生物富集潜力低于PCBs和PBDEs。SCCPs和MCCPs同系物的BAFs值与辛醇/水分配系数(KOW)和碳链长度(C10-17)均呈显著负相关(P < 0.05),表明化合物的理化性质影响了水生昆虫对SCCPs和MCCPs的积累,低KOW和低碳链长度的同系物更容易被生物富集。
-
关键词:
- 短链氯化石蜡(SCCPs) /
- 中链氯化石蜡(MCCPs) /
- 水生昆虫 /
- 生物富集因子 /
- 电子垃圾
Abstract: The concentrations of short-chain chlorinated paraffins (SCCPs) and medium-chain chlorinated paraffins (MCCPs) in aquatic insects and water from an electronic waste recycling site in Longtang Town, Qingyuan County of Guangdong Province were determined using gas chromatographic-mass spectrometric (GC/MS). The results showed that ∑SCCPs and ∑MCCPs concentrations in aquatic insects were range from 52 ng·g−1 to 410 ng·g−1 and 40 ng·g−1 to 740 ng·g−1 wet weight (ww), respectively. Damselfly larvae have the highest level of ∑SCCPs and the highest level of ∑MCCPs was found in waterbeetles. Principal component analysis was conducted, and species-specific different composition patterns of SCCP and MCCP congeners were seen among aquatic insects. This may be due to differences in diet, feeding habits and bioaccumulation ability among different species. Bioaccumulation factor (BAF) values of ∑SCCPs and ∑MCCPs in aquatic insects were range from 3.27 to 3.79 and 2.62 to 3.34, respectively. BAFs of ∑SCCPs and ∑MCCPs in dragonfly larvae were lower than that of ∑PCBs (4.87) and ∑PBDEs (4.65), suggesting the bioaccumulation potential of SCCPs and MCCPs was below that of PCBs and PBDEs in aquatic insects. Significant negatively correlations (P < 0.05) were observed between BAF values and octanol-water partition coefficient (KOW) and carbon-chain length (C10-17) of SCCPs and MCCPs. Those results indicated that the physicochemical properties of compounds affected the bioaccumulation of SCCPs and MCCPs by aquatic insects, and homologues with low KOW and low carbon chain length were preferred to bioaccumulation. -
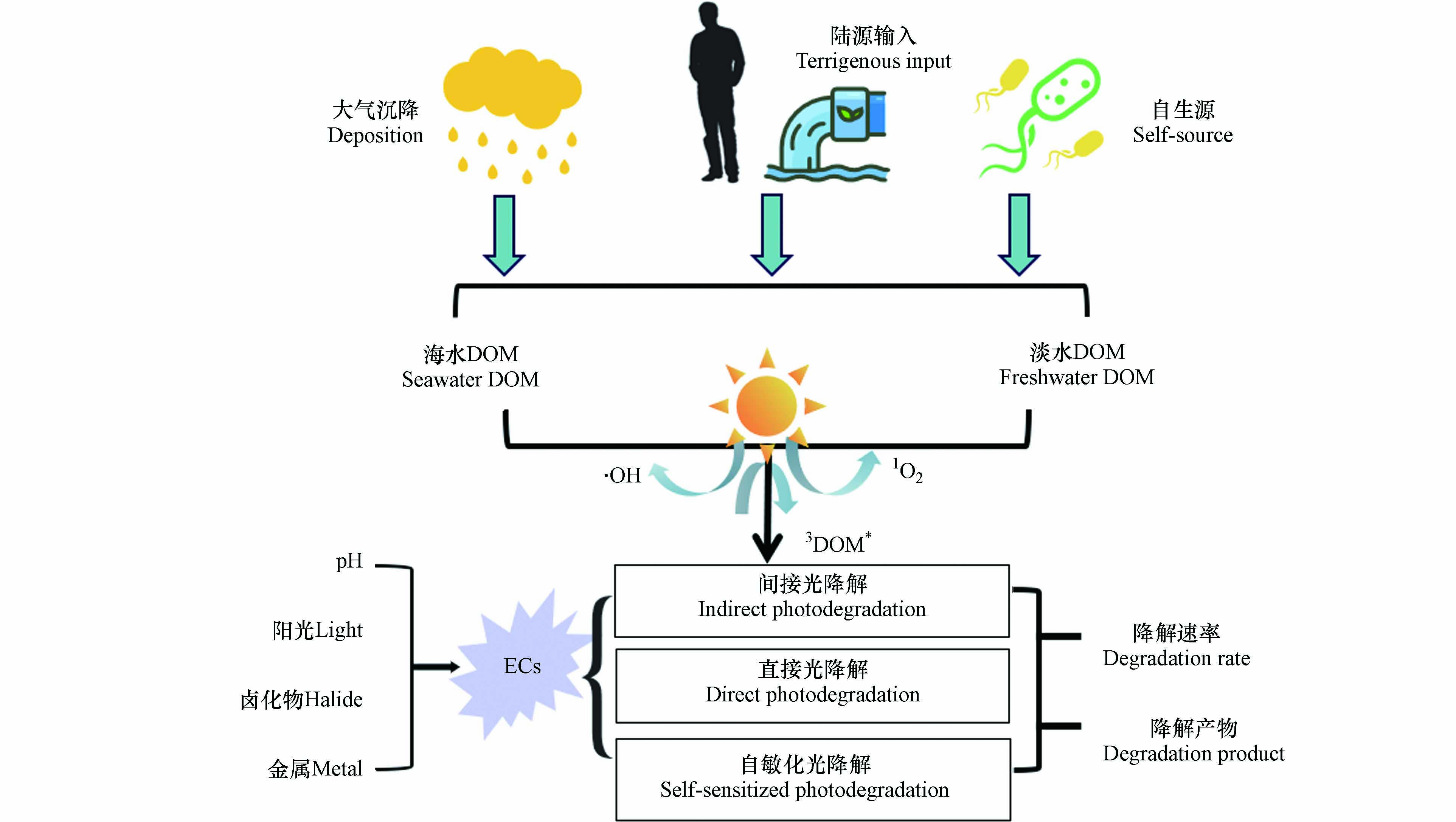
新污染物(emerging contaminants, ECs)是指新近发现或被关注,对生态环境或人体健康存在风险,尚未纳入管理或者现有管理措施不足以有效防控其风险的污染物[1]. 主要包括但不限于药物及个人护理品、抗生素抗性基因、内分泌干扰物、消毒副产物、纳米材料以及包括多氯联苯、有机氯农药、多环芳烃和全氟化合物在内的持久性有机污染物. 这类化学物质稳定性高、亲水性强,它们可以在地下水、饮用水、地表水,甚至是污水处理厂的废水中检测到,其中大部分物质最终会进入并滞留在沿海水域,影响水产品的质量和安全,因其对水质环境的长期不良影响而受到科学界和公众的广泛关注[2 − 3]. 因此,迫切需要研究ECs在水生环境中的迁移转化过程机制. 为了调查和探究ECs在沿海水域的迁移转化并评估其生态环境风险,有必要提高对其降解过程的认识.
研究表明光化学降解是水体中有机污染物的主要转化途径[4 − 6],ECs的光化学降解包括直接、间接和自敏化光解3种方式[7]. 在直接光降解过程中,目标化合物对光子的吸收导致键断裂或重排以形成新的稳定产物;在自敏化光降解过程中,ECs吸收光子跃迁至激发态,同时将能量转移给基态3O2或H2O,产生活性氧自由基,进而引发自身降解;在间接光降解中,具有光活性的化合物吸收阳光,产生活性反应中间体(reactive intermediates,RIs),这些物质在ECs的光降解过程中起着重要作用[8 − 9]. 溶解有机物(dissolved organic matter, DOM)是一种具有优异光化学活性的天然光敏剂,在ECs的间接光解过程中发挥着重要作用:一方面DOM可以通过屏蔽阳光、清除RIs和淬灭目标污染物的激发态来减弱有机污染物的光降解;另一方面主要通过产生RIs促进光降解[10]. DOM在特定有机污染物光降解中的具体作用主要取决于DOM的类型、来源和组成[11 − 12]. 另外,环境因素如pH、光照强度等也会影响DOM的微观形态和光化学性质. 不同DOM的分子结构和特征性质存在内在差异,进而对ECs光降解表现出不同的作用.
然而,不同ECs在自然水体中的光降解行为并不一致,环境条件的动态变化也在影响该行为. 因此,研究DOM组分及环境因素对ECs在自然水体中的间接光降解作用,对预测其光化学命运至关重要,也将有助于更好地了解其他ECs的环境命运. 本文介绍了DOM诱导ECs间接光降解的降解途径和作用,讨论了DOM来源、类型、组分和其他环境条件对光降解效率的影响,以全面了解该行为机制.
1. DOM的性质和来源及光化学过程(Properties, sources and photochemical processes of DOM)
1.1 DOM的性质和来源
DOM是一类由多种活性有机物(如多糖、蛋白质和木质素)组成的复杂且不均匀的混合物[13]. 它由各种官能团组成,包括醛、氨基、羧基、酯、羟基、酮、苯酚和其他官能团. DOM中的芳香酮类结构具有较强的得电子能力;酚类结构具有较强的给电子能力. 这两种结构可使DOM作为电子传递体,通过电子转移与水体中的其他物质发生氧化还原反应[14]. 研究表明,芳香酮和酚类结构在DOM中的比例对其光敏化过程起决定作用[15]. 按荧光结构划分,DOM分为类腐殖质和类蛋白质[16]. 在水生环境中主要存在两种腐殖酸组分:腐殖酸和富里酸. 腐殖酸和富里酸在分子量、化学成分、化学性质、芳香性和光学性质方面各有差异[17]. 由于有机物种的多样性和丰富的化学结构,DOM被认为是地球上最具有化学活性的有机物质之一[18].
DOM中能够吸收光的基团称为生色团,在DOM的光化学活性中起主导作用. 由于这部分结构的光吸收随着可见光(VIS)和紫外(UV)光谱中波长的降低而呈指数增长,其光吸收在UV区域最高,在光谱的红色区域下降到接近零的水平[19]. DOM在受到光辐照后通常会发生两个过程,即光漂白和光矿化. 光漂白是指DOM吸收光后发色基团吸光能力及芳香性降低的现象;而光矿化则是指随着光化学反应的发生,DOM中连接到芳香结构上的羧基发生脱羧,分解为简单矿物质后形成无机小分子化合物(如CO和CO2)的过程[20]. 由于DOM具有特殊的荧光特性,在受到光激发时会发射出荧光,通常采用三维荧光光谱与平行因子相结合的方式来分析其组成、来源和性质[21].
水体环境中的DOM可通过两个主要来源引入:内源或外源[22]. 内源主要是指水生生物,包括藻类、浮游生物和大型植物[23]. 在海洋中,浮游植物是DOM的主要来源[22];而在淡水湖泊中,植物凋谢物的分解被视为水生DOM的重要来源. 外源是指从外部水体环境中引入的外来DOM,引入途径主要包括土壤、雨水径流、大气(如雨水、沙尘暴)、地下水和人类活动等[24]. 由于营养状况、周围环境和水力特性等因素的不确定性,水体环境中DOM的来源及其比例变化很大,从而导致了其复杂性和异质性[25 − 26].
鉴于DOM在水生环境中的整体作用,深入了解其性质、反应性和环境影响在环境和生态化学领域具有重要意义.
1.2 DOM光致生成自由基的过程
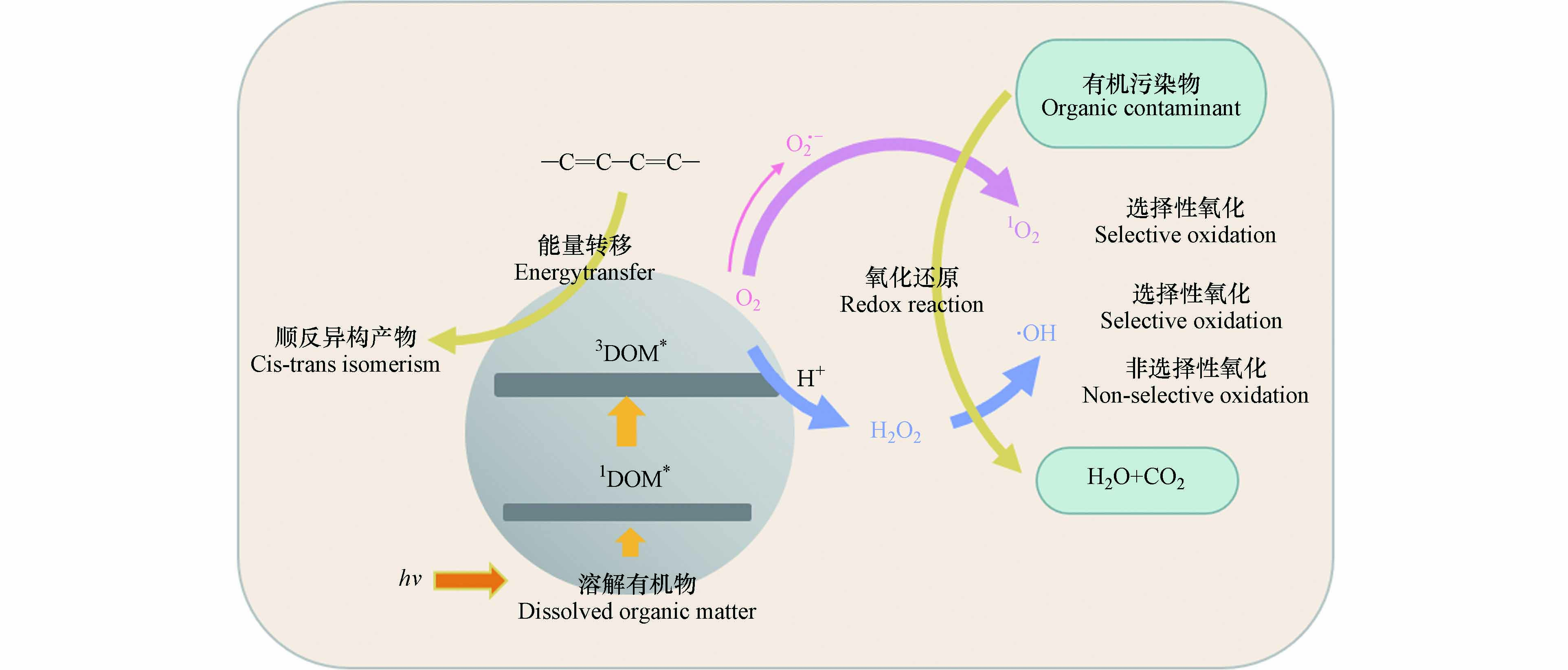
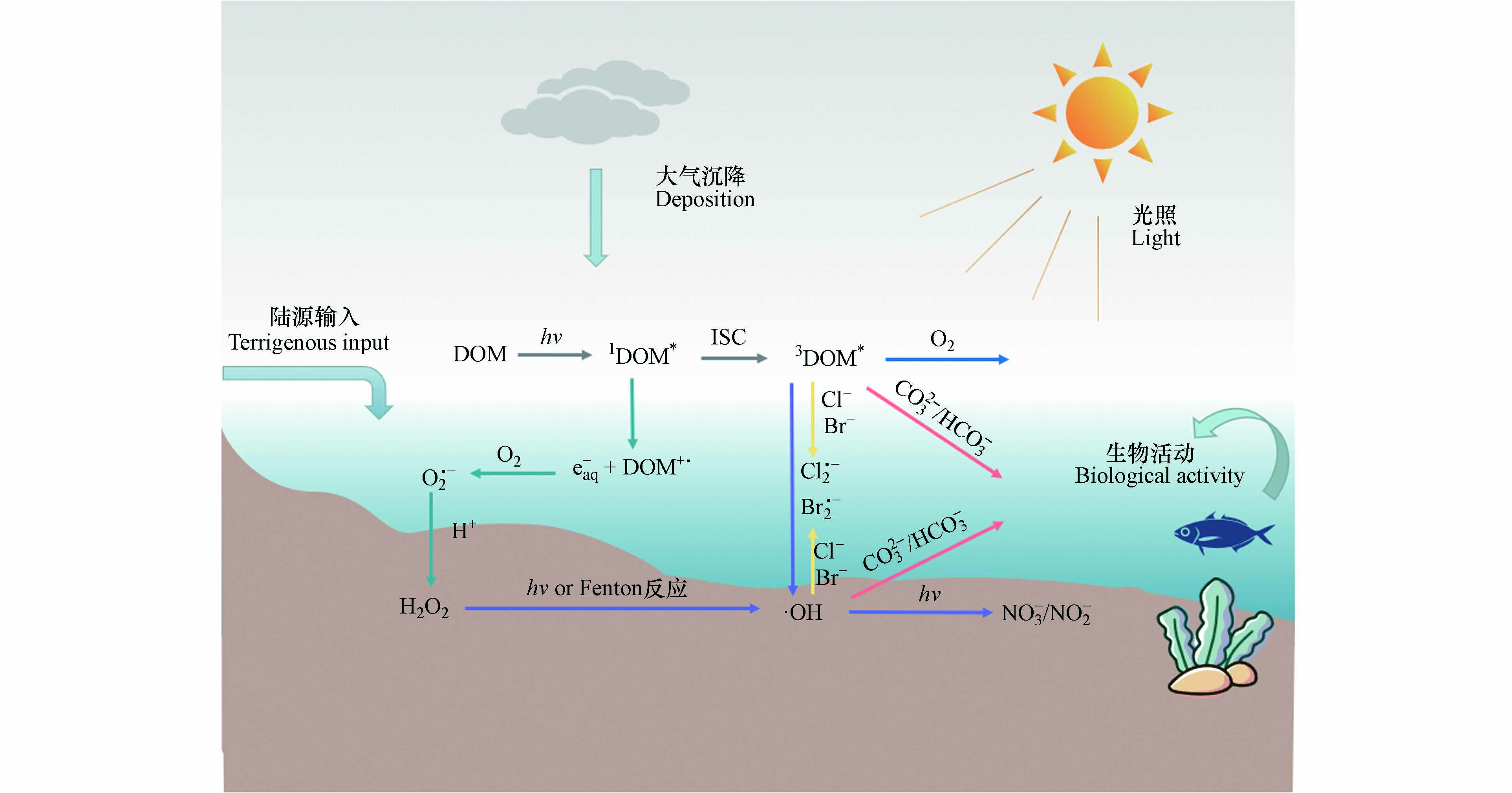
DOM是连接生命形态碳和无机碳的关键纽带,参与各种生物地球化学循环过程[27]. 尤其是DOM中的高分子量成分作为“太阳屏障”,对水生生态环境非常重要[18]. 吸光反应是DOM在水体中的重要光化学过程[28]. 由于DOM分子具有很强的光反应性,尤其是含有苯环、羧基、羟基等发色团,使其能够在水生环境中吸收光后诱导形成RIs,如羟基自由基(·OH)、单线态氧(1O2)、DOM的激发三重态(3DOM*)、过氧化氢(H2O2)等[29]. 这些光生反应物种由于其高度不稳定性和化学反应性而具有瞬态性质,可以对ECs的光降解产生不同程度的影响. 其主要反应途径如图1所示.
DOM通过辐射吸收,从电子基态(S0)光化学激发到激发单线态(1DOM*),通过荧光发射和无辐射跃迁释放能量回到基态,或在有利条件下通过系统间交叉(ISC,Intersystem Crossing)进化到三线态,从而形成3DOM*[30]. 3DOM*是水体中重要的过渡物种,可以通过能量、电子或氢转移与ECs反应,在后两种情况下,三重态通常表现为氧化剂. 在含氧水环境中,3DOM*可以将能量转移到基态分子氧以产生1O2[31]. 1O2在有机微污染物的转化中起着重要作用[32]. 3DOM*还能够通过水的氧化产生羟基化物种·OH[33]. 另外,1DOM*存在时间非常短,它会向水中释放电子形成水合电子(e-),从而在含氧水环境中产生超氧自由基(O2·-),与H+结合后转化为H2O2[34]. H2O2作为·OH的前驱体,通过直接光解或与过渡金属离子发生芬顿反应(Fenton)生成·OH[35]. ·OH还可以通过水体中NO3-/NO2-的光解产生,这也是·OH的重要来源[36]. ·OH是地表水中能产生的反应性最强的瞬态物种,它们对许多持久污染物都有很高的二阶动力学常数,因此涉及·OH的反应速率往往受到传质(扩散)现象的限制,但是它们通常可以与许多难降解的污染物反应[35]. 水体中的卤素离子也是有机污染物进行光化学转化的重要参与者. 3DOM*可以氧化卤素离子(如Cl-、Br-),从而生成卤素自由基(Cl·-、Br·-). 有研究表明,卤素自由基在富含卤化物的河口和沿海水域对污染物的光化学降解具有重要影响[37].
2. 水体中ECs的光降解过程(Photodegradation process of ECs in water)
ECs通常水溶性较低,易被有机物质吸附,在水体中主要涉及一系列生物、物理和化学过程,包括吸附、生物降解和光化学降解[38 − 40]. 其中光化学降解是天然水环境中ECs的主要转化过程之一,尤其是在表层水体中[41]. 光化学降解一般分为直接光降解、间接光降解和自敏化光降解. 大多数ECs对光高度敏感,会对光子进行吸收,当光子具有足够的能量时ECs分子断裂进行直接分解;间接光降解是由水中的光敏剂产生RIs引发的;自敏化光降解是指ECs在吸收光子活化至激发态的同时,将能量转移给基态3O2或H2O,导致活性氧自由基的产生,进而引发自身降解[27,42 − 43]. ECs在水体中的光降解途径及影响因素如图2所示.
直接光降解和间接光降解的区别主要在于吸收光子的对象不同. 直接光降解是由ECs自身吸收光子引发的,而在间接光降解中吸收光子的对象则是光敏剂. 当ECs吸光能力较强时,DOM对其光降解的影响较弱. 例如,Zeng等[44]研究发现,相对于直接光降解速率,光敏剂的存在对氟乐灵的光降解速率没有影响. Carena等[45]研究发现,即使将苯达松溶解在含有光敏剂的天然水样中,苯达松的光降解速率与在纯水中相比并无显著差异. 该类物质在太阳光谱中具有很强的吸收作用,因此直接光降解是其在环境相关条件下的主要光降解途径. 对于这类物质来说,光敏剂如DOM的存在可能不会改变其光降解速率.
ECs的光降解过程与其化学结构密切相关. 在间接光降解过程中,光敏剂诱导ECs的光降解效率会受到ECs自身结构的影响. 先前研究发现敌草隆直接光降解速率非常缓慢,当加入DOM时光降解速率变快[46]. 由于敌草隆芳环上存在吸电子取代基,光敏剂DOM在阳光诱导下产生·OH,带有亲电性和非选择性,导致其与富电子的芳香族有机化合物的反应性最强[44]. Bertoldi等[47]研究发现与短波长辐射相比,在长波长辐射下腐殖酸对双酚A的光降解作用更弱. 由于双酚A分子结构中含有不饱和苯环,而不饱和烃、芳烃及其类似化合物对短波紫外光有很强的吸收,对波长大于290 nm的UVA和UVB几乎没有吸收作用[48]. 因此,双酚A在短波长辐射下光降解作用显著,而在长波长辐射下的光降解作用并不明显. Bertoldi等[47]还发现雌三醇(E3)比17β-雌二醇(E2)更易受到腐殖酸的诱导作用. 与E2相比,E3具有更多数量的羟基自由基,而腐殖酸结构中含有大量的羧基,它是由两个平行p轨道的横向重叠形成,有利于π-π相互作用[49]. 由此可见,ECs的自身结构会决定化学性质,从而影响间接光降解行为.
在自然水体中,DOM是有效的光敏剂,可以在辐照下生成RIs从而诱导ECs进行间接光降解[39,50]. 例如Ozaki等[51]将DOM浓度设置为与自然水体相似的浓度,发现TCS的光降解比在纯水中显著增强;Carena等[52]研究发现在DOM存在下,除草剂丙腈的间接光降解速率显著提高;任文华等[53]研究发现不同的DOM对丁吡吗啉降解存在不同程度的促进作用. 光降解效率增强的一个可能原因是在间接光降解过程中,DOM吸收光进行光解反应生成RIs,然后与化合物进行反应一起消耗,提高ECs降解效率并缩短残留ECs的半衰期. 相反,郑晓东等[54]研究三氯生光降解行为时发现DOM的存在降低其光降解速率;刘师宇等[55]向阿特拉津溶液中加入不同浓度的DOM后发现,DOM的存在对阿特拉津的光降解起到抑制作用,且浓度越高,抑制作用越显著. 这归因于DOM的抑制作用:DOM与ECs竞争光吸收进行自身光降解从而对其具有光屏蔽作用,另外DOM可以与RIs直接反应清除部分RIs,这也是抑制ECs光降解的一个重要原因[56]. 上述研究表明光敏化过程是由DOM诱导的. 因此,可以合理假设水体中的DOM是诱导ECs间接光降解的主要驱动因素.
3. DOM诱导ECs间接光降解机制(Indirect photodegradation mechanism of ECs induced by DOM)
DOM诱导的ECs光降解是一种间接光降解,而间接光降解主要取决于氧化剂种类. 例如,DOM在光照下产生的·OH、1O2、H2O2、和3DOM*等[29,57]. DOM通常对ECs光降解过程产生两种影响:促进或抑制作用. DOM的促进作用主要表现在DOM吸光后产生RIs与ECs反应并促进其光降解;抑制作用主要包括两种机制:①DOM吸收阳光进行光降解,从而与有机污染物发生竞争作用;②清除RIs和淬灭目标污染物的激发态减弱有机污染物的光降解. 除影响ECs光降解速率外,DOM还可以改变其光降解产物,如Mansour等[58]研究发现二甲戊灵在没有DOM存在的情况下发生脱烷基化,在DOM存在的情况下发生硝基还原. DOM产生的·OH、1O2及3DOM*均可以作为氧化剂与供电子体发生氧化还原反应. 其中·OH为非选择性氧化剂;1O2为选择性氧化剂,易与烯烃、硫化物及富电子酚类物质发生氧化还原反应. 3DOM*在遇到共轭二烯结构时会发生能量转移,使含有该结构的ECs生成自身顺反异构产物;在遇到芳香胺、富电子酚类等富电子物质时发生氧化还原反应[27]. ECs在DOM水体中降解的大致路径如图3所示. 同时,DOM对ECs光降解的影响机制具有很强的特异性,这种特异性的产生可能有4个原因,即DOM类型不同,来源不同,组分不同,且DOM的性质及功能还会受到环境因素的影响. DOM对不同ECs光降解的影响如表1所示.
表 1 DOM对不同污染物光降解的影响Table 1. Effects of DOM on photodegradation of different pollutants污染物Pollutants CAS号CAS number 主要光降解途径Main photodegradation pathways DOM来源DOM source 促进/抑制作用Promotion/inhibition DOM主要作用机制Main mechanism of DOM 参考文献Reference 氟乐灵 1582-09-8 直接光降解 SRHA/SRFA/SRNOM — — [44] 苯达松 25057-89-0 直接 湖水/稻田 — — [45] 二甲戊灵 40487-42-1 直接 湖水 — — [58] 敌草隆 330-54-1 间接 SRFA 促进 光致产生·OH [46] 雌三醇 50-27-1 间接 SRFA/SRNOM 促进 π-π相互作用 [47] 17-β雌二醇 50-28-2 间接 滇池底泥 促进 光致产生·OH,1O2,3DOM* [59] 三氯生 3380-34-5 间接 腐殖酸(购自日本) 促进 光致产生·OH,1O2,3DOM* [51] NLHA/NLFA 抑制 光屏蔽;动态猝灭 [54] 丙腈 107-12-0 间接 蒽醌-2-磺酸钠 促进 光致产生3DOM* [52] 丁吡吗啉 868390-90-3 间接 腐殖酸(购自中国天津) 促进 氢键、离子交换等作用力 [53] 阿特拉津 1912-24-9 间接 腐殖酸(购自中国上海) 抑制 竞争光吸收 [55] 17α-乙炔基雌二醇 57-63-6 间接 河水腐殖酸 促进 光致产生·OH [60] 河水富里酸 促进 光致产生3DOM* [60] 二苯甲酮-1 131-56-6 间接 海水DOM/SRFA/SRNOM 促进 光致产生·OH,1O2,3DOM* [61] 二苯甲酮-3 131-57-7 间接 淡水DOM/海水DOM 促进 光致产生·OH,1O2,3DOM* [4] 2-(2-羟基-5-苯甲基)苯并三唑 2440-22-4 间接 海水DOM 促进 光致产生3DOM* [12] 磺胺嘧啶 68-35-9 间接 SRHA/SRFA/SRNOM/JKHA 促进 光致产生3DOM* [3] 布洛芬 15687-27-1 间接 SRHA/SRFA/SRNOM/JKHA 促进 光致产生·OH,1O2 [62] 对乙酰氨基酚 103-90-2 间接 SRHA/SRFA/SRNOM/JKHA 促进 光致产生·OH,1O2,3DOM* [63] 注:蒽醌-2-磺酸钠为DOM替代物,SRHA为苏万尼河腐殖酸,SRFA为苏万尼河富里酸,SRNOM为苏万尼河天然有机物,NLHA为Nordic湖腐植酸,NLFA为Nordic湖富里酸,JKHA为J&K科技有限公司腐殖酸,上述均为商品化DOM. Note:anthraquinone-2-sulfonate is a DOM substitute, SRHA is Suwannee River humic acid, SRFA is Suwannee River fulvic acid, SRNOM is Suwannee River natural organic matter, NLHA is Nordic Lake humic acid, NLFA is Nordic Lake fulvic acid, JKHA is humic acid from J&K Scientific Ltd. All of the above are commercial DOM. 3.1 不同类型DOM对光降解的影响
一般来说,DOM主要分为腐殖酸和富里酸[64]. 腐殖酸(humic acid,HA)又称胡敏酸,是一种天然有机高分子化合物,也是腐殖质的主要组成部分. 富里酸(fulvic acid,FA)又称黄腐酸,既溶于酸也溶于碱,是土壤腐殖质的组成成分之一[65]. HA和FA都是腐殖质中易溶于水的部分,主要由碳、氢、氧、氮、硫等元素构成[66]. 与HA相比,FA碳氢比值较低,分子结构方面芳香核的聚合度较小,官能团中酚羟基和甲氧基的数目比较多,含有更多含氧官能团和脂肪结构,且腐殖化程度更深[67]. 此外,FA的酸性官能团(—COOH)含量也高于HA,因此其在水溶液中具有较强的酸性[68]. HA和FA分子结构和特征性质的内在差异往往导致其对ECs的间接光降解作用表现不一致.
研究表明,DOM结构对光活性有重要影响[69 − 70]. 任东等[57]在研究E2光降解时发现,与HA相比FA的促进作用更强. 这主要与HA和FA的含氧官能团含量和分子极性大小有关. 含氧官能团如酚、醌、酮等组分结构与·OH、1O2等活性氧物种的产生密切相关. 杜超等[71]研究发现,含氧官能团含量会影响3DOM*的电子转移和能量传递过程,且含量高的组分在光照下产生RIs的能力更高. Fang等[72]研究发现,醌类结构在DOM生成·OH和1O2过程中起主要作用. 含氧官能团的含量制约着腐殖酸的可溶性、亲疏水性等,是光诱导DOM生成RIs的重要影响因素. 大分子作为较小组分的超分子聚集体,其特点是电荷转移相互作用有利于内部转化,而牺牲了光物理(例如荧光)和光化学过程[73 − 74]. 腐殖质的低分子量组分具有更高的形成三重态的能力[75 − 76]. 从这个角度来看,与HA相比,FA具有更高的生成3DOM*的能力. Ren等[60]研究发现,与HA相比,FA表现出较弱的光吸收,但在促进17α-乙炔基雌二醇(EE2)光降解方面,FA的促进作用比HA更强. 其猝灭实验表明·OH是HA溶液中EE2光降解的主要贡献者,而3DOM*在FA溶液中主导EE2的降解. 这种机制差异主要归因于以下两个原因:①FA中酮羰基和羟基的数量高于HA;②HA中的分子内相互作用可以强烈抑制3DOM*的形成[77 − 79]. 由于HA生成的3DOM*产率受到抑制,导致·OH在ECs光降解过程中起主导作用. 综上来看,与HA相比,FA具有更强的光敏能力、更低的反应物种猝灭效应和较弱的光衰减. 因此FA在ECs光降解中的促进作用强于HA.
3.2 海水和淡水DOM对光降解的影响
目前研究的淡水DOM主要购自腐殖酸协会,如SRHA、SRFA、SRNOM及JKHA等[43,46],而海水DOM主要取自海水水域,通过电渗析/反渗透、固相萃取等方式获得[61,80]. 由于水域不同,海水DOM与淡水DOM在参与ECs间接光降解过程中通常会表现出不同的作用.
Wang等[61]在研究沿海海水DOM和淡水河流DOM对二苯甲酮-1(BP-1)光降解影响时发现,BP-1的光降解在不同DOM水体中出现了不同结果. 研究发现与沿海海水DOM相比,淡水DOM的光吸收率较高,导致吸光后产生的RIs稳态浓度较高,DOM光致产生活性中间体的稳态浓度决定了DOM对有机污染物的反应性[81]. 而且淡水DOM通常具有更高的发色团和荧光团含量,这与稳定状态下的挥发性有机物浓度有关[82]. Li等[4]研究也发现二苯甲酮-3在海水中的光降解速率相对低于在淡水中的光降解速率. 不同的是,在海水中的间接光降解主要归因于3DOM*,而在淡水中,3DOM*和·OH是其间接光降解的主要原因. 对于不同来源的DOM,组成成分不同,相应的3DOM*也具有不同的激发态还原电势[82]. 说明沿海海水和淡水DOM的光反应性对污染物的光降解具有内在差异,且淡水DOM对ECs的光降解促进作用更明显.
由于人为排放,例如海水养殖活动的影响,来自养殖海域的DOM与来自原始海水的DOM对ECs光降解表现出不同程度的行为. 人为投放的营养饵料和高强度动物活动是海水养殖的特定DOM来源[83]. 之前有研究表明,海水DOM对磺胺类抗生素的光降解具有显著的促进作用,且受海水养殖影响较大DOM的促进作用强于其他海域DOM[84 − 85]. Chen等[12]研究也发现,与来自原始海水DOM相比,受海水养殖活动影响较大的DOM表现出更高的吸光度,且对2-(2-羟基-5-苯甲基)苯并三唑的光降解促进作用更显著. 这表明养殖活动会增强DOM的光敏化降解能力. 光漂白是从天然水中去除DOM的主要过程,可以降低海洋中DOM的紫外线吸收率和分子量[86 − 87]. 与来自沿海水域的DOM相比,受海水养殖影响较大海域的DOM光漂白较少,类腐殖质物质比例较高,芳香结构和羰基结构比例较高,通常具有较高的光吸收率、3DOM*的形成量子产率和3DOM*稳态浓度,从而会对ECs的光降解产生更高的光敏效应[84]. 说明养殖区海水DOM具有更强的光敏化降解能力,并且主要是通过3DOM*加速光降解过程.
综上,光漂白过程弱、富含发色团和芳香结构的DOM光敏化降解能力更强. 由于来源不同,DOM经历的光漂白过程及所含的发色团和芳香结构含量不同,其产生RIs的能力不同,从而导致来自淡水、海水及特殊海水水域的DOM在诱导ECs间接光降解过程中表现出不同的作用.
3.3 不同荧光组分DOM对光降解的影响
激发发射矩阵光谱(EEM)与平行因子分析(PARAFAC)相结合是表征DOM的常用分析技术[88 − 89]. 该方法可以根据不同的光源、特性以及迁移和转换方式,将DOM划分为具有特殊光学性质的不同组分[90]:首先利用PARAFAC得到荧光组分图,根据最大激发发射波长得到荧光峰的位置,通过与前人所研究的荧光峰位置对比及荧光参数分析,从而得到DOM组分性质及来源的相关信息[91]. DOM组分一般分为类色氨酸、类络氨酸、类腐殖质等荧光组分[92]. 由于DOM组分千差万别,ECs与不同组分的DOM发生相互作用时,效果也不一致.
白莹等[62]研究发现,布洛芬主要进行间接光降解且光降解速率与DOM的组成成分密切相关. Bai等[63]在研究DOM各组分对对乙酰氨基酚光降解影响时发现,对乙酰氨基酚与所有组分的间接光降解速率常数均呈显著正相关,且外源DOM的相关性强于自源DOM. 为进一步分析探究,Bai等[3]在研究DOM组分对磺胺类抗生素光降解影响时,将DOM分为4个组分C1、C2、C3和C4,通过与前人研究结果对照发现C1、C2、C3为外源DOM,C4为自源DOM,且各组分的分子量和芳香度顺序为C3>C1>C2>C4,与组分荧光强度的衰减和光降解速率的相关系数一致. 说明这4种组分在光降解过程中起重要作用,且外源性荧光组分起主要作用. 与源自微生物合成的自源DOM相比,外源DOM可能具有更多芳香环和电供体基团,因此往往具有更高的芳香性[93 − 95]. DOM中含羰基和芳香结构的部分为主要发色团,RIs的稳态浓度与DOM的芳香性呈显著正相关[96]. 这是由于高分子量DOM的量子产率下降,而DOM的高芳香性超过了其量子产率,能够产生RIs或表现出较低的猝灭速率[97]. 与上述研究相符,Batista等[96]报道了芳香性与·OH稳态浓度及·OH生成速率之间的密切关系. Timko等[11]观察到芳香性与1O2和3DOM*的形成速率呈正相关. Zhou等[98]的研究表明,DOM(E2/E3)的吸光度比与1O2的表观量子产率之间存在正相关,并且DOM的芳香结构是产生3DOM*和1O2的主要部分. RIs的稳态浓度随DOM的分子量、光学性质和组成而变化. 由于DOM组分不同,其产生的RIs活性效率不同. 芳香度更高的组分对RIs的生成贡献更大,从而对ECs间接光降解过程促进作用更明显. 因此,我们应该了解DOM组分的变化,以评估DOM对ECs间接光降解的影响.
3.4 环境因素的影响
除了DOM的类型、来源及组分差异外,DOM诱导的ECs光降解还受到环境因素的影响,例如pH大小、光照强度、离子强度及金属元素等.
3.4.1 光源及光照强度
吸光是光化学反应的前提条件,DOM中的发色团可以吸收290—500 nm的太阳光,且光吸收强度随着波长增长呈现近似指数的下降趋势[81,99]. 当光源强度不同,产生的光子能量自然不同,从而会影响DOM对ECs的光降解效率. Peng等[100]研究发现,在UV-vis辐照下(λ>200 nm),DOM抑制了普萘洛尔的光降解,然而在模拟太阳辐照下(λ>290 nm),DOM促进其光降解. 研究表明在不同光源照射下,DOM对普萘洛尔光降解的双重作用十分典型. 一方面由于DOM具有很强的光敏性,能进行光解产生大量的RIs;另一方面当DOM自身发生光解时,会与污染物竞争光吸收从而产生光屏蔽作用. 在波长较小的UV-vis辐照下,DOM吸光强度变大,此时可能以竞争光吸收的抑制作用为主. 另外,光源强度还会影响DOM产生活性物种的能力. 如刘砚弘等[101]研究发现,汞灯照射下DOM产生活性物种的能力显著高于氙灯照射条件下,说明光源强度越大,DOM产生的活性物种越多.
3.4.2 卤化物浓度
上述研究中提到DOM可以产生RIs,其中3DOM*能够氧化卤化物离子(如Cl-,Br-),从而生成卤素自由基(Reactive halogen species,RHs),如Cl·、Br·、Cl·-、Br·-等. 这些自由基可以促进海水中许多ECs的光解. 例如,Zhao等[102]研究发现,磺胺嘧啶的光解随着上游至下游河口水域卤化物浓度的增加而增强. Pinto等[103]研究表明,在低浓度的DOM溶液和盐水中,毒死蜱主要进行直接光降解;而在高浓度的DOM溶液和盐水中,其主要进行间接光降解. 由于3DOM*的寿命变化和3DOM*与其他卤化物离子生成RHs,从而增强ECs的间接光降解速率.
但是,3DOM*与卤化物离子反应产生的RHs也可能导致3DOM*的猝灭. Hou等[104]研究发现,向DOM溶液中添加卤化物,卡马西平光解速率明显降低. 因此,即使在RHs主导的河口水域中有些污染物出现了光降解增强的现象,可能也会有部分污染物光降解受到抑制. 3DOM*诱导产生的RHS反应无法补偿3DOM*因猝灭效应对降解产生抑制,这可能会减缓ECs在卤化物浓度相对较高的河口水域中的光降解. 此外,卤化物离子的离子强度效应也会影响3DOM*衰变,从而影响3DOM*的稳态浓度[105].
3.4.3 pH
pH值的变化会严重影响ECs的电离形式并改变其光化学反应性[69],pH值在污染物的光降解中起着重要作用. 例如Bai等[63]研究发现,在碱性条件下APAP的光降解速率显著增强. 在pH为碱性时,APAP中的羟基转变为酚阴离子,由于酚阴离子在芳香环上的电子密度较高,因此其与3DOM*的反应比酚羟基更容易[106]. Jin等[107]研究发现,氧四环素直接光解速率常数随pH的增加而增加. Ge等[69]研究发现,沙拉沙星和加替沙星的光解速率常数随着pH值的增加先增大后减小. pH决定了ECs的离子存在形式. 可电离污染物最佳离子形式占主导地位,光吸收率也随之增加;而当污染物以最稳定形式存在时,光化学活性降低. 因此,ECs的不同解离状态具有不同的光化学反应性,光降解速率随pH的变化与其在给定pH值下的解离状态密切相关.
另外,pH还会改变DOM的性质和微观形态,从而影响DOM产生RIs的浓度[108]. 于莉莉等[109]研究发现,DOM吸光系数随pH值的增大而增大. 由于在碱性条件下DOM结构发生膨胀,导致显色基团暴露增多,从而其吸光系数变大[110]. Zhang等[111]研究发现,氧四环素的光解速率常数与含DOM水溶液的酸碱度呈正相关. DOM中含有较多的含氧官能团和芳香官能团,活性氧在光照下介导形成苯氧自由基,含氧官能团和芳香物质与四环素络合. 在碱性条件下,四环素更容易受到活性氧的攻击,提高DOM与四环素在光照下的反应效率从而加速四环素的光降解[112]. Gao等[113]研究发现,随着离子强度的增加,DOM吸光度始终在较高pH下增加更明显. 离子强度可以影响DOM的光化学特性,增强DOM诱导的间接光降解作用,而这种增强效应主要依赖于酸碱度[111,113].
3.4.4 金属离子
在水环境中,DOM能够与痕量金属(如Cu2+、Fe3+、Mn2+和Zn2+)结合后产生不同络合强度的稳定配合物[114 − 115]. 据研究称,光激发的金属DOM络合物可以进行配体到金属的电荷转移,从而产生·HO2和O2·-,进一步反应生成·OH[116 − 117]. 这一过程可能会显著影响金属离子和DOM共存体系ECs的间接光降解. Wang等[118]研究发现,Fe3+和丙酮酸形成的络合物是·OH的来源. Liu等[119]研究发现,Fe(Ⅲ)黄腐酸络合物通过在盐水中产生更多·OH,促进了双酚A的光氯化. 庄晓虹等[120]研究发现与只含有DOM的体系相比,DOM和铁(Ⅲ)的络合体系对壬基酚的光降解表现出更显著的促进作用. 在辐照下Fe(Ⅲ)产生自由基时更具有光活性[121]. Fe(Ⅲ)-DOM络合物很容易被光解,引入的氧气促进了这一过程. Fe3+首先被还原为Fe2+,同时生成H2O2,这两种产物进行类芬顿反应,从而生成·OH促进有机物的光降解[122 − 123].
除生成·OH外,向DOM溶液中添加金属离子还会导致DOM的荧光猝灭[115,124]. Wan等[125]研究发现,金属离子和DOM的络合能力与3DOM*的猝灭呈正相关. Liu等[126]研究发现,对于具有较强给电子基团的ECs,Cu(Ⅱ)-DOM络合物显著抑制了3DOM*诱导的有机污染物光降解. 这可能因为Cu2+的络合作用降低了3DOM*形成速率,导致3DOM*稳态浓度的降低. 通过金属离子的静态猝灭效应,1DOM*的形成受到抑制,从而形成3DOM*以及水生环境中其他RIs的进一步减少. 同时,金属离子还可以通过形成偶合络合物直接淬灭ECs的激发三重态,然后进行电子转移和能量转移或无辐射跃迁到基态,产生动态猝灭[127]. 因此,共存的金属离子对DOM诱导的ECs光降解有明显的影响. 研究这一因素对于系统地了解金属离子配位在DOM中如何影响ECs光降解的机制是必要的.
综上,DOM的光敏化降解能力会受到光源、卤化物、pH及金属离子等因素的影响:(1)光源会影响DOM诱导ECS的间接光降解过程. 在短波长辐射下,DOM的光吸收强度更强,在ECs光降解过程中产生的光屏蔽作用更明显. 在强光源辐射下,DOM产生的光活性物种更多,从而对ECs光降解的促进作用更明显. (2)卤化物离子通常在DOM诱导ECs间接光降解过程中表现出双重作用. 3DOM*可以诱导卤素离子产生卤素自由基促进ECs的光降解,但在该过程中3DOM*也可能发生猝灭从而抑制ECs光降解. (3)pH可以改变DOM的性质和微观形态,影响DOM产生的RIs浓度,从而影响DOM诱导ECs的间接光降解过程. (4)金属离子能够与DOM络合,在电荷转移过程中,DOM能够产生·HO2和O2·-,同时又会发生荧光猝灭,对诱导ECs的间接光降解过程起到双重作用.
4. 结论与展望(Conclusion and prospects)
DOM介导的光化学过程对水生系统的生物地球化学有着深远的影响. 目前对ECs在DOM水体中的光转化行为研究常在实验室开展,且选取的DOM溶液大多为实验室配制. 虽然研究的目标物质化学性质各有不同,但大多研究的结论也不尽相同. 另外,许多环境因素包括盐度、pH、离子强度、硝酸盐和碳酸氢盐等也被列入研究范围. 随着分析技术和手段不断进步,对ECs在水环境中光解动力学和机理的研究也逐渐深入.
目前的研究多集中于DOM对单种ECs光降解过程的影响,但是水体环境所含成分较为复杂,且DOM成分复杂、功能多样,同时自然水体中往往是多种DOM与多种ECs共存的情况;另外,部分ECs的代谢物比母体化合物具有更高的活性. 基于此,今后可重点关注以下几个方面:
(1)探究DOM的化学成分与ECs相互作用的机制. 注意与实际相结合,对多种DOM-ECs混合体系中的相互作用规律进行探究,明晰其作用过程和机理,建立相应数据库.
(2)探究ECs在间接光降解后可能形成的降解产物及产物转化途径. 应特别关注母体化合物及其代谢物的环境归宿,分析DOM作用后ECs性质的变化及毒性,为预测ECs的环境行为及评估其生态环境风险作出理论支持.
(3)探究水质因素和环境因素等可变因素综合作用对ECs光降解过程的影响. 河口是受海洋和陆地共同影响的动态系统,在环境条件(如pH、离子强度和卤化物浓度)是动态的河口地区,阐明ECs的光化学转化行为具有重要意义.
-
表 1 水生昆虫和水体中脂肪含量、氯含量及SCCPs和MCCPs的浓度水平
Table 1. Lipid content, chlorine content, and concentrations of SCCPs and MCCPs in aquatic insects and water
化合物Compounds 蜻蜓目 Odonata/(ng g−1 ww) 半翅目Hemiptera/(ng·g−1 ww) 鞘翅目 Coleoptera/(ng·g−1 ww) 水体 Water/(ng·L−1) 蜻科幼虫Dragonfly larva 蟌科幼虫Damselfly larva 负子蝽Waterstinkbug 水龟虫Waterbeetle 溶解相Dissolved phase 颗粒相Particle phase Nc 6 (75) 3 (40) 9 (130) 3 (45) 3 3 Lipid /% 1.8 ± 0.11d 2.0 ± 0.05 3.2 ± 0.08 3.0 ± 0.60 NDe ND 短链氯含量/% 61.3 ± 0.21 61.3 ± 0.06 62.1 ± 0.16 61.4 ± 0.30 62.5 ± 0.48 61.7 ± 0.33 ∑C10 75 (45—130)f 150 (140—220) 37 (19—48) 25 (18—28) 12 (11—13) 710 (490—1200) ∑C11 50 (20—110) 89 (78—110) 25 (13—28) 33 (21—68) 14 (13—22) 710 (500—1600) ∑C12 44 (19—97) 25 (23—54) 18 (12—35) 40 (28—100) 12 (11—21) 670 (390—1800) ∑C13 33 (13—69) 11 (7.5—31) 14 (8.9—41) 44 (35—130) 13 (12—17) 650 (340—1600) ∑SCCPs 200 (97—410) 280 (250—410) 98 (52—150) 140 (100—330) 50 (49—72) 2700 (1700—6200) 中链氯含量 /% 55.9 ± 0.40 56.1 ± 0.23 57.9 ± 0.30 56.6 ± 0.43 56.1 ± 0.15 57.4 ± 0.19 ∑C14 50 (12—140) 23 (18—55) 69 (43—160) 120 (78—290) 53 (45—65) 3100 (1200—11000) ∑C15 39 (14—97) 14 (11—42) 27 (16—110) 81 (57—230) 52 (42—57) 1100 (690—6800) ∑C16 24 (8.2—60) 6.5 (6.4—28) 18 (10—76) 55 (36—110) 34 (30—39) 750 (530—5000) ∑C17 16 (5.3—41) 7.2 (6.9—17) 9.0 (6.4—62) 48 (29—98) 24 (17—24) 540 (360—3200) ∑MCCPs 130 (40—340) 51 (43—140) 120 (76—400) 300 (200—740) 160 (130—190) 5500 (2700—26000) ∑SCCPs/∑MCCPs 1.57 ± 0.41 5.50 ± 1.29 0.66 ± 0.25 0.47 ± 0.02 0.37 ± 0.04 0.50 ± 0.16 c N为混合后的样品数量,括号内为采集的样品数量;d平均值 ± 标准偏差;e 未检测;f 中值(范围). a Unit (ng g−1 ww); b Unit (ng L−1); c N means number of composite samples analyzed and figures in brackets indicate the number of individuals collected; d Mean ± standard deviation; e Not detected; f Median (range). 表 2 水生昆虫中SCCP和MCCP同系物的BAFs值与其辛醇水分配系数(KOW)、碳链长度(C10-17)和氯代程度(Cl5-10)的相关性
Table 2. Correlation between the lg BAFs and octanol-water partition coefficient (KOW), carbon chain length (C10-17) and chlorinated degree (Cl5-10) for SCCPs and MCCPs in aquatic insects
种类Species 辛醇水分配系数(KOW)Octanol-water partition coefficient 碳链长度(C10-17)Carbon chain length 氯代程度(Cl5-10)Chlorinated degree 蜻蜓目 蜻科幼虫 −0.873 (< 0.001)** −0.807 (< 0.001)** −0.337 (0.019)* 蟌科幼虫 −0.869 (< 0.001)** −0.781 (< 0.001)** −0.349 (0.015)* 半翅目 负子蝽 −0.725 (< 0.001)** −0.708 (< 0.001)** 0.052 (0.727) 鞘翅目 水龟虫 −0.370 (0.010)** −0.313 (0.030)* −0.057 (0.701) ** 在0.01水平(双侧)上显著相关;* 在0.05水平(双侧)上显著相关. ** Correlation was significant at P < 0.01; * Correlation was significant at P < 0.05. -
[1] TOMY G T, STEM G A, LOCKHART W L, et al. Occurrence of C10-C13 polychlorinated n-alkanes in Canadian midlatitude and arctic lake sediments [J]. Environmental Science & Technology, 1999, 33(17): 2858-2863. [2] 王亚韡, 王莹, 江桂斌. 短链氯化石蜡的分析方法、污染现状与毒性效应 [J]. 化学进展, 2017, 29(9): 919-929. doi: 10.7536/PC170504 WANG Y W, WANG Y, JIANG G B. Analytical methods, environmental pollutions and toxicity of short chain chlorinated paraffins [J]. Progress in Chemistry, 2017, 29(9): 919-929(in Chinese). doi: 10.7536/PC170504
[3] VAN MOURIK L M, GAUS C, LEONARDS P E G, et al. Chlorinated paraffins in the environment: A review on their production, fate, levels and trends between 2010 and 2015 [J]. Chemosphere, 2016, 155: 415-428. doi: 10.1016/j.chemosphere.2016.04.037 [4] KRATSCHMER K, SCHACHTELE A, MALISCH R, et al. Chlorinated paraffins (CPs) in salmon sold in southern Germany: Concentrations, homologue patterns and relation to other persistent organic pollutants [J]. Chemosphere, 2019, 227: 630-637. doi: 10.1016/j.chemosphere.2019.04.016 [5] TOMY G T, FISK A T, WESTMORE J B, et al. Environmental chemistry and toxicology of polychlorinated n-alkanes [J]. Reviews of Environmental Contamination and Toxicology, 1998, 158: 53-128. [6] GLUGE J, SCHINKEL L, HUNGERBUHLER K, et al. Environmental risks of medium-chain chlorinated paraffins (MCCPs): A review [J]. Environmental Science & Technology, 2018, 52(12): 6743-6760. [7] WEI G L, LIANG X L, LI D Q, et al. Occurrence, fate and ecological risk of chlorinated paraffins in Asia: A review [J]. Environment International, 2016, 92-93: 373-387. doi: 10.1016/j.envint.2016.04.002 [8] BAYEN S, OBBARD J P, THOMAS G O. Chlorinated paraffins: a review of analysis and environmental occurrence [J]. Environment International, 2006, 32(7): 915-929. doi: 10.1016/j.envint.2006.05.009 [9] EVENSET A, CHRISTENSEN G N, KALLENBORN R. Selected chlorobornanes, polychlorinated naphthalenes and brominated flame retardants in Bjornoya (Bear Island) freshwater biota [J]. Environmental Pollution, 2005, 136(3): 419-430. doi: 10.1016/j.envpol.2005.01.018 [10] VAN PRAET N, COVACI A, TEUCHIES J, et al. Levels of persistent organic pollutants in larvae of the damselfly Ischnura elegans (Odonata, Coenagrionidae) from different ponds in Flanders, Belgium [J]. Science of the Total Environment, 2012, 423: 162-167. doi: 10.1016/j.scitotenv.2012.02.045 [11] KRAUS J M, WALTERS D M, WESNER J S, et al. Metamorphosis alters contaminants and chemical tracers in insects: implications for food webs [J]. Environmental Science & Technology, 2014, 48(18): 10957-10965. [12] 路风辉, 陈满英, 陈燕舞, 等. 电子垃圾拆解区氯化石蜡和多氯联苯的分布特征——以广东清远龙塘镇为例 [J]. 环境化学, 2015, 34(7): 1297-1303. doi: 10.7524/j.issn.0254-6108.2015.07.2014111103 LU F H, CHEN M Y, CHEN Y W, et al. Distribution of chlorinated paraffins and polychlorinated biphenyls in e-waste, residues and sediment from e-waste areas of Qingyuan [J]. Environmental Chemistry, 2015, 34(7): 1297-1303(in Chinese). doi: 10.7524/j.issn.0254-6108.2015.07.2014111103
[13] CHEM M Y, LUO X J, ZHANG X L, et al. Chlorinated paraffins in sediments from the Pearl River Delta, South China: spatial and temporal distributions and implication for processes [J]. Environmental Science & Technology, 2011, 45(23): 9936-9943. [14] LIU Y, LUO X J, HUANG L Q, et al. Bioaccumulation of persistent halogenated organic pollutants in insects: Common alterations to the pollutant pattern for different insects during metamorphosis [J]. Environmental Science & Technology, 2018, 52(9): 5145-5153. [15] SUN R X, LUO X J, TANG B, et al. Bioaccumulation of short chain chlorinated paraffins in a typical freshwater food web contaminated by e-waste in south china: Bioaccumulation factors, tissue distribution, and trophic transfer [J]. Environmental Pollution, 2017, 222: 165-174. doi: 10.1016/j.envpol.2016.12.060 [16] MA X D, ZHANG H J, WANG Z, et al. Bioaccumulation and trophic transfer of short chain chlorinated paraffins in a marine food web from Liaodong Bay, North China [J]. Environmental Science & Technology, 2014, 48(10): 5964-5971. [17] ZENG L X, LAM J C W, CHEN H, et al. Tracking dietary sources of short- and medium-chain chlorinated paraffins in marine mammals through a subtropical marine food web [J]. Environmental Science & Technology, 2017, 51(17): 9543-9552. [18] HOUDE M, MUIR D C, TOMY G T, et al. Bioaccumulation and trophic magnification of short-and medium-chain chlorinated paraffins in food webs from Lake Ontario and Lake Michigan [J]. Environmental Science & Technology, 2008, 42(10): 3893-3899. [19] WANG R H, GAO L R, ZHENG M H, et al. Short- and medium-chain chlorinated paraffins in aquatic foods from 18 Chinese provinces: Occurrence, spatial distributions, and risk assessment [J]. Science of The Total Environment, 2018, 615: 1199-1206. doi: 10.1016/j.scitotenv.2017.09.327 [20] CHEN C, MA X D, GUO W, et al. Congener specific distribution and bioaccumulation of short-chain chlorinated paraffins in Liao estuary [J]. Chinese Science Bulletin (Chinese Version), 2014, 59(7): 578-585. doi: 10.1360/972013-801 [21] XU C, ZHANG Q, GAO L R, et al. Spatial distributions and transport implications of short- and medium-chain chlorinated paraffins in soils and sediments from an e-waste dismantling area in China [J]. Science of The Total Environment, 2019, 649: 821-828. doi: 10.1016/j.scitotenv.2018.08.355 [22] 王迎军, 王亚韡, 江桂斌. 固相萃取法测定水中短链氯化石蜡 [J]. 分析化学, 2018, 46(7): 1102-1108. doi: 10.11895/j.issn.0253-3820.181008 WANG Y J, WANG Y W, JIANG G B. Determination of short chain chlorinated paraffins in water by solid-phase extraction [J]. Chinese Journal of Analytical Chemistry, 2018, 46(7): 1102-1108(in Chinese). doi: 10.11895/j.issn.0253-3820.181008
[23] ZENG L X, WANG T, WANG P, et al. Distribution and trophic transfer of short-chain chlorinated paraffins in an aquatic ecosystem receiving effluents from a sewage treatment plant [J]. Environmental Science & Technology, 2011, 45(13): 5529-5535. [24] NICHOLLS C R, ALLCHIN C R, and LAW R J. Levels of short and medium chain length polychlorinated n-alkanes in environmental samples from selected industrial areas in England and Wales [J]. Environmental Pollution, 2001, 114(3): 415-430. doi: 10.1016/S0269-7491(00)00230-X [25] IINO F, TAKASUGA T, SENTHILKUMAR K, et al. Risk assessment of short-chain chlorinated paraffins in Japan based on the first market basket study and species sensitivity distributions [J]. Environmental Science & Technology, 2005, 39(3): 859-866. [26] LI Q L, CHENG X H, CUI Y R, et al. Short- and medium-chain chlorinated paraffins in the Henan section of the Yellow River: Occurrences, fates, and fluxes [J]. Science of The Total Environment, 2018, 640-641: 1312-1319. doi: 10.1016/j.scitotenv.2018.05.344 [27] KOBETICOVA K and CEMY R. Ecotoxicity assessment of short- and medium-chain chlorinated paraffins used in polyvinyl-chloride products for construction industry [J]. Science of the Total Environment, 2018, 640-641: 523-528. doi: 10.1016/j.scitotenv.2018.05.300 [28] LI H J, BU D, Fu J J, et al. Trophic dilution of short-chain chlorinated paraffins in a plant-plateau pika-eagle food chain from the Tibetan Plateau [J]. Environmental Science & Technology, 2019, 53(16): 9472-9480. [29] ZHOU Y H, YIN G, DU X Y, et al. Short-chain chlorinated paraffins (SCCPs) in a freshwater food web from Dianshan Lake: Occurrence level, congener pattern and trophic transfer [J]. Science of The Total Environment, 2018, 615: 1010-1018. doi: 10.1016/j.scitotenv.2017.10.026 [30] 虞俊超, 王宝盛, 王亚韡, 等. 大连市海产品中短链氯化石蜡的含量与分布研究 [J]. 环境科学, 2014, 35(5): 1955-1961. YU J C, WANG B S, WANG Y W, et al. Levels and distribution of short chain chlorinated paraffins in seafood from Dalian, China [J]. Environmental Science, 2014, 35(5): 1955-1961(in Chinese).
[31] YUAN B, WANG T, ZHU N L, et al. Short chain chlorinated paraffins in mollusks from coastal waters in the Chinese Bohai Sea [J]. Environmental Science & Technology, 2012, 46(12): 6489-6496. [32] LABADIE P, BLASI C, LE MENACH K, et al. Evidence for the widespread occurrence of short- and medium-chain chlorinated paraffins in fish collected from the Rhone River basin (France) [J]. Chemosphere, 2019, 223: 232-239. doi: 10.1016/j.chemosphere.2019.02.069 [33] SABORIDO BASCONCILLO L, BACKUS S M, MCGOLDRICK D J, et al. Current status of short- and medium chain polychlorinated n-alkanes in top predatory fish across Canada [J]. Chemosphere, 2015, 127: 93-100. doi: 10.1016/j.chemosphere.2015.01.016 [34] HUANG H T, GAO L R, XIA D, et al. Bioaccumulation and biomagnification of short and medium chain polychlorinated paraffins in different species of fish from Liaodong Bay, North China [J]. Scientific Reports, 2017, 7(1): 10749. doi: 10.1038/s41598-017-06148-5 [35] RETH M, ZENCAK Z, and OEHME M. First study of congener group patterns and concentrations of short- and medium-chain chlorinated paraffins in fish from the North and Baltic Sea [J]. Chemosphere, 2005, 58(7): 847-854. doi: 10.1016/j.chemosphere.2004.09.036 [36] RETH M, CIRIC A, CHRISTENSEN G N, et al. Short- and medium-chain chlorinated paraffins in biota from the European Arctic - differences in homologue group patterns [J]. Science of the Total Environment, 2006, 367(1): 252-260. doi: 10.1016/j.scitotenv.2005.12.014 [37] ZENG L X, LAM J C, WANG Y W, et al. Temporal rrends and pattern changes of short- and medium-chain chlorinated paraffins in marine mammals from the South China sea over the past decade [J]. Environmental Science & Technology, 2015, 49(19): 11348-11355. [38] HUANG Y M, CHEN L G, JIANG G, et al. Bioaccumulation and biomagnification of short-chain chlorinated paraffins in marine organisms from the Pearl River Estuary, South China [J]. Science of the Total Environment, 2019, 671: 262-269. doi: 10.1016/j.scitotenv.2019.03.346 -




 下载:
下载: