从组分和性质角度谈污染地块中石油烃的人体健康风险评估
Human Health Risk Assessment of Petroleum Hydrocarbons in Contaminated Sites from the Perspective of Components and Properties
-
摘要: 石油烃的人体健康风险评估是污染地块土壤污染风险评估过程中的最常见的问题之一,其远比单一污染物的评估复杂和困难。但我国缺乏针对性的评估方法,实际操作中存在较多误区。因此,对于石油烃概念、性质的归纳总结以及对其健康风险评估方法的研究和探索,具有重要的意义。本文介绍了石油烃的基本概念,分析了不同馏分性质间的关系,回顾并分析了其分析测试方法及人体健康风险评估方法的适用要求及优缺点,提出了指示剂法与分馏法相结合采用典型样品馏分占比进行总体评估的工作方法,进而针对我国当前面临的问题,提出了后续的研究和发展建议。Abstract: Human health risk assessment of petroleum hydrocarbons is a common problem in the process of risk assessment of contaminated sites, and it is far more complicated and challenging than the assessment of single pollutants. Currently in China, specific assessment methods for petroleum hydrocarbons have not been established, and misunderstandings in the practice of risk assessment concerning this group of contaminants are common. Therefore, it is important to summarize the concepts and properties of petroleum hydrocarbons, and to study and explore their health risk assessment methods. This paper introduces the basic concepts of petroleum hydrocarbons, analyzes the relationship between the properties of different fractions, reviews and analyzes the applicable requirements, advantages and disadvantages of their analytical methods and human health risk assessment methods, proposes the working method of overall assessment by combining indicator method and fractionation method using typical sample fraction percentages, and puts forward suggestions for further research and development based on the current challenges.
-
Key words:
- petroleum hydrocarbons /
- soil /
- chronic toxicity /
- human health risk /
- risk assessment methods
-
制革废水经生化处理后尾水中通常含有0.3~1.0 mg·L−1的总铬[1],在制革废水生化剩余污泥中含有1~10 g·kg−1的总铬。活性污泥中微生物的胞外聚合物(extracellular polymeric substance, EPS)主要组分包括多糖(PS)、蛋白质(PN)和核酸等多聚物[2],因其含有大量的羧基、羟基、氨基、磷酸酯等吸附位点,能够通过离子交换、络合、电中和等作用对重金属进行有效固定 [3-4]。有关EPS对铬的吸附已有大量报道,普遍认为,EPS的不同结构层、EPS含量及组分比例和外界环境均会影响重金属在EPS上的吸附[5]。有研究[6]发现,EPS对Cr3+吸附的主要作用位点是羧基和磷酸基,并形成EPS-Cr3+配位物。
EPS一般可分为松散附着型(loosely bound EPS,LB-EPS)、紧密黏附型(tightly bound EPS,TB-EPS)和溶解型EPS(S-EPS)[7]。LASPIDOU等[7]认为,S-EPS与溶解性微生物代谢产物(soluble microbial product,SMP)属同源物质,也是由微生物的内源呼吸过程(BAP)和基质分解过程(UAP)中产生的[8]。许多研究表明,进水基质及污泥种类均影响EPS的组成,不同层EPS上存在不同的金属吸附位点[9],不同结构层中蛋白质和多糖含量的动态变化会影响污泥的吸附速率[10]。可溶性EPS具有比结合态EPS更大的质子离子交换能力[11],高度可溶性EPS-Cr3+配位化合物可导致铬在环境中的迁移和蓄积[6]。
随着我国对制革废水总铬排放总量限制指标的日益严格,探索制革生化尾水中残留铬与EPS的相互关系,特别是S-EPS对出水中总铬的影响很有必要。目前,有关制革废水生物处理过程中EPS各结构层的组分变化及金属铬离子在EPS各结构层和SMP中分布情况的研究鲜有报道。本研究在对制革废水各处理阶段的不同层EPS组分定量分析的基础上,重点围绕EPS组分变化与铬的分布规律进行了研究,为制革废水铬排放总量控制和深度处理提供参考。
1. 材料与方法
1.1 活性污泥取样及预处理
实验所用活性污泥及废水取自河北某制革废水处理站的主要生化处理段(水解酸化-两级好氧处理工艺),共5个采样点,分别为初沉池出水、水解酸化池污泥、一级好氧池污泥、二级好氧池污泥及二沉池出水,污泥基本性质如表1所示,水解酸化池、一级好氧池、二级好氧池的污泥沉降比(SV30)分别为30%、76%、81%。所取样品经固液分离和EPS分步提取后,储存在4 ℃冰箱中备用。
表 1 实验所用活性污泥基本性质Table 1. Basic properties of activated sludge in experiments污泥来源 MLSS/(g·L−1) MLVSS/(g·L−1) pH 水解酸化污泥 6.225 2.641 8.8 一级好氧污泥 14.092 6.668 8.0 二级好氧污泥 2.55 1.282 7.9 1.2 EPS与SMP的提取方法
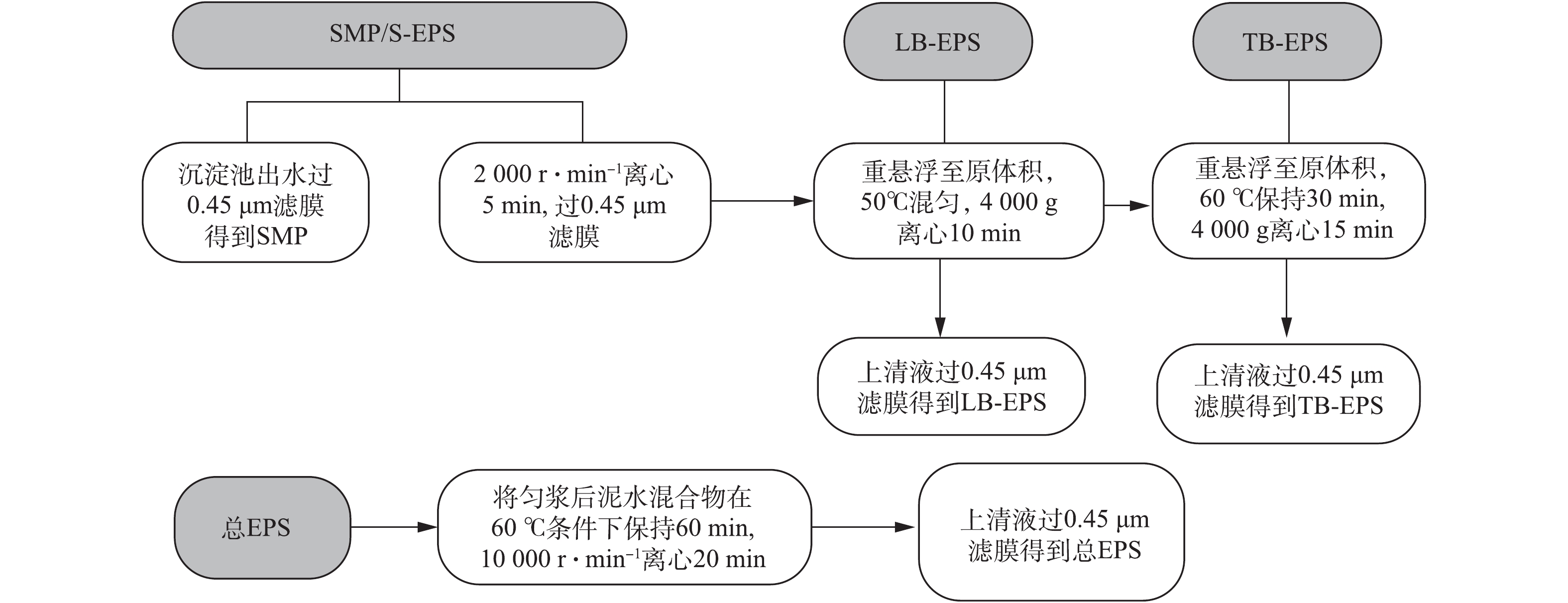
EPS 提取方法有物理法和化学法[12-13]。因化学法易造成铬离子的流失和形态改变,为保证EPS的结构完整性、物理化学性质的稳定及铬离子分布在EPS各结构层分布的相对准确性,本实验采取改良热提取法从制革生化活性污泥中提取EPS溶液[14-15],控制温度≤80 ℃,并使加热时间≤60 min。本方法对铬离子在EPS各结构层的分布造成的影响较小,同时能更好地反映EPS各结构层蛋白质和多糖的相对组成[16-19]。EPS和SMP的提取方法如图1所示。
取均匀混合的泥水混合物50 mL,在2 000 r·min−1的离心机中离心5 min 后,取上清液,然后过0.45 μm 滤膜,得到S-EPS[20]、沉淀池出水过0.45 μm滤膜得到SMP。
1.3 分析方法
溶解性有机碳(DOC)的测定使用德国元素分析系统公司liqui Ⅱ TOC测定仪,水样过0.45 μm滤膜,采用DOC表征SMP浓度;总铬的测定采用二苯碳酰二肼分光光度法(GB/T 7466-1987),每个样品平行测量3次,取平均值;挥发性悬浮物固体浓度(VSS)和悬浮固体浓度(SS)采用重量法测定。
多糖(PS)采用蒽酮-硫酸法测定,以葡萄糖作为标准品;蛋白质(PN)采用考马斯亮蓝法测定,以牛血清白蛋白(BSA)作为标准品,进行标准曲线的绘制[21];UV254采用紫外分光光度计测定。采用蛋白质与多糖之和表征SMP及EPS总量,每个样品平行测量3次,测定结果取平均值。
2. 结果与分析
2.1 制革生物处理过程SMP组分特征
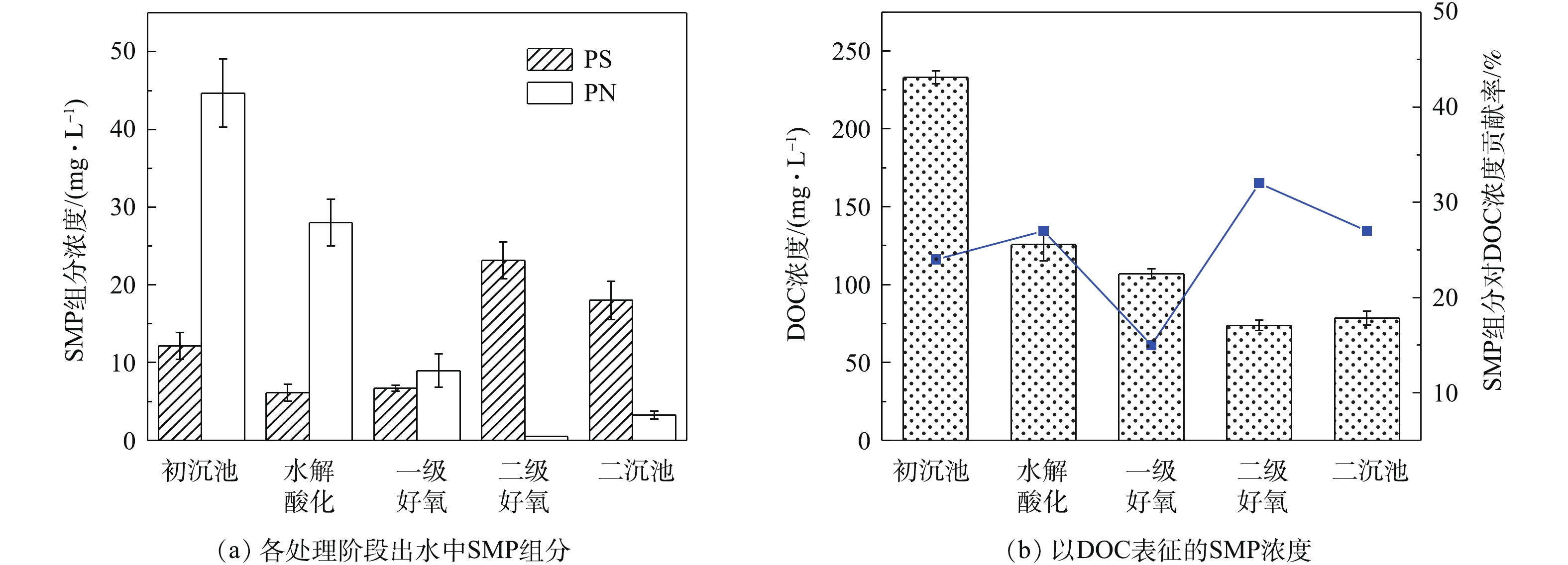
有机物在出水SMP中的分布呈下降趋势,SMP中有机碳含量逐渐降低,各处理工段出水SMP中溶解性有机物及各组分浓度见图2。SMP中有机碳浓度用DOC表征,各水样DOC浓度与组分浓度变化趋势一致,SMP中组分对有机碳的贡献率为15%~32%。初沉池出水DOC浓度为233.1 mg·L−1时经水解酸化-好氧生物处理,使二沉池出水DOC降低至78.54 mg·L−1,DOC去除率为66.4%,有机碳浓度变化受进水基质影响较大。在制革废水生物处理系统中,SMP中多糖变化呈先降低后升高的趋势,一级生化SMP中蛋白质和多糖的变化趋势一致,二级生化多糖含量大幅增加,二沉池出水SMP中多糖含量与二级好氧池出水SMP相似。初沉池SMP多糖含量为12.13 mg·L−1,二沉池出水中多糖含量为18.02 mg·L−1,初沉池出水SMP蛋白质含量高达44.69 mg·L−1。通过水解酸化预处理及好氧生物处理后,二沉池出水蛋白质含量削减至3.23 mg·L−1,削减92.8%,与出水DOC的削减规律相呼应。SMP组分含量呈先降低后升高的趋势,这可能是因为二级好氧池中TB-EPS外排使SMP的组分含量升高,EPS与SMP之间相互转化。杨丹等[15]研究表明,好氧颗粒污泥中SMP随底物基质消耗而缓慢增加,当底物浓度降低时,SMP来源于微生物内源呼吸及EPS水解,这验证了SMP的产生会影响出水水质。
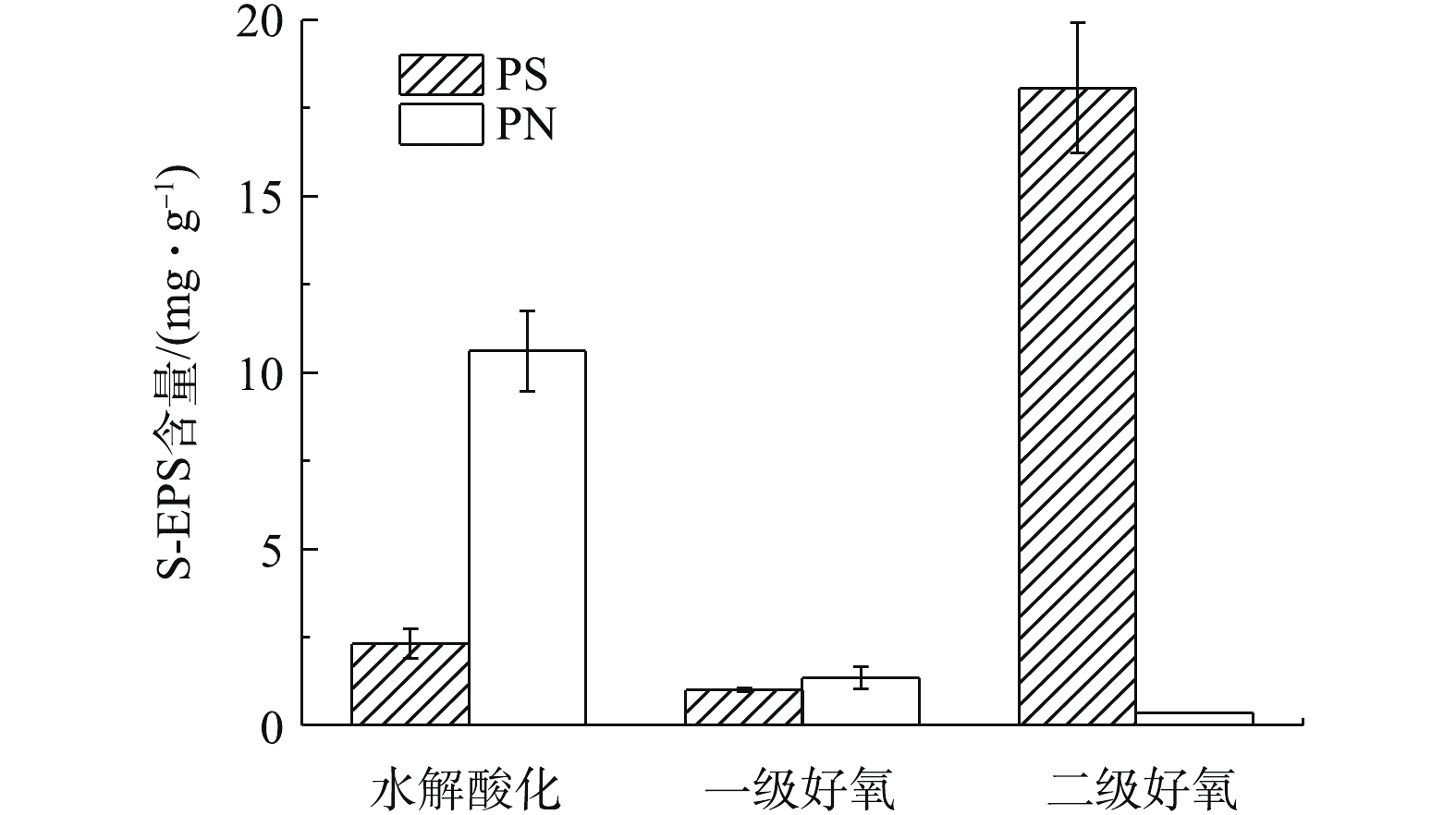
由图3可知,水解酸化池S-EPS蛋白质含量为10.61 mg·g−1(以VSS计),一级好氧池中蛋白质含量为1.347 mg·g−1,削减87.3%,二级好氧池SMP蛋白质含量未检出;一级生化后端S-EPS多糖含量为1.003 mg·g−1,二级生化多糖含量增加至18.07 mg·g−1。初沉池SMP取自初沉池后端出水,初沉池没有明显的生物处理作用,水解酸化使大分子难生物降解物质转变为易生物降解的物质。在缺氧条件下,细菌利用外源有机物合成自身细胞,导致水解酸化池中S-EPS蛋白质组分削减幅度较大,削减部分可能主要作为微生物的营养物质被消耗掉,蛋白质可为生物处理提供氮源,进而促进微生物生长。有研究[22]发现,重金属冲击浓度增加,SMP中蛋白质产生量下降。相比市政污水生物处理过程中多糖含量随着生物处理不断削减[17],制革污水的生物处理过程则存在多糖含量增加的趋势,这可能是微生物通过增加EPS的产量来对抗微量重金属铬(Cr3+<1.5 mg·L−1)的胁迫作用。AQUINO等的[23]研究表明,在铬的存在下,细胞裂解作用增强,细胞裂解产物对SMP的积累有重要贡献。康福星[24]的研究表明,在一定浓度重金属的污染水体中,微生物能分泌大量的EPS,来提高净化水体的能力。
2.2 制革生物处理过程EPS组分特征
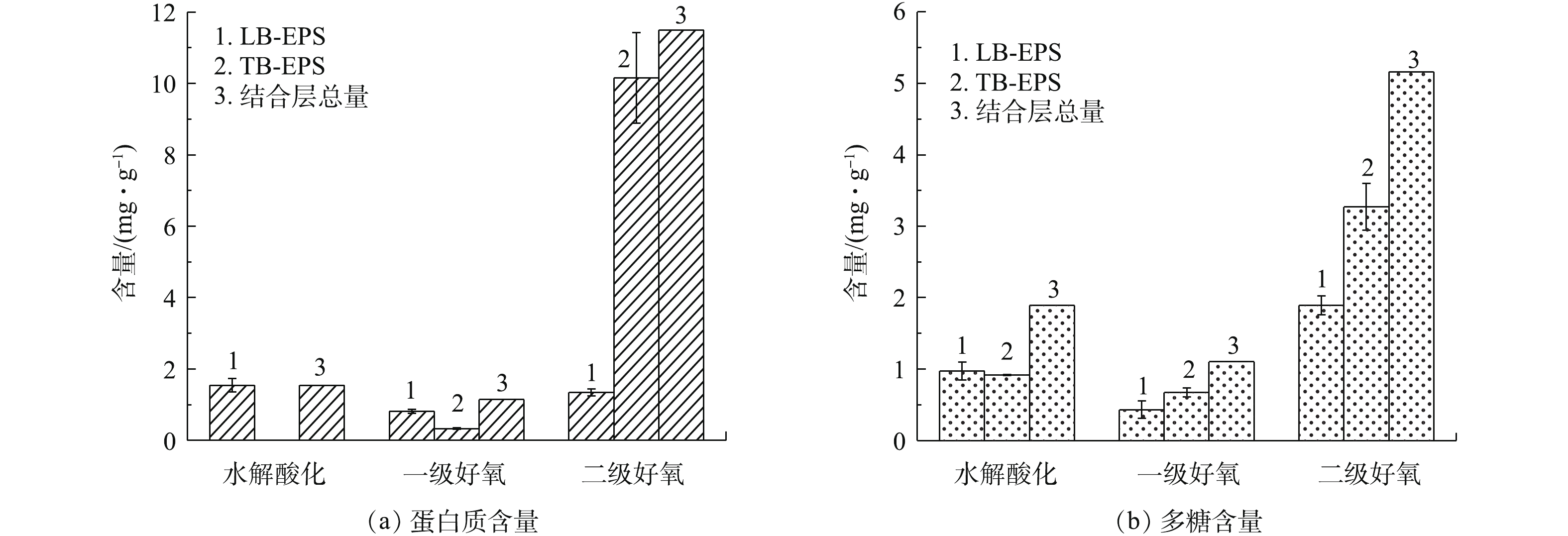
由图4可知,不同污泥样品的EPS含量变化较大。结合层EPS组分含量为2.248~16.66 mg·g−1,蛋白质占比约44.9%~69.0%,多糖占比约31.0%~55.1%。水解酸化池及一级好氧池LB-EPS主要组分为蛋白质,TB-EPS中主要组分为多糖,二级好氧池LB-EPS主要组分为多糖,TB-EPS主要由蛋白质组成。由此可见,LB-EPS层随生物处理过程的推进,蛋白质随之降低、多糖含量随之升高。LB-EPS中多糖含量从高到低依次为二级好氧>水解酸化池>一级好氧,含量依次为1.893、0.975、0.430 mg·g−1;LB-EPS中蛋白质含量从高到低依次为水解酸化池>二级好氧池 >一级好氧池,含量依次为1.544、1.346、0.817 mg·g−1;TB-EPS中多糖含量依次为0.919、0.673、3.269 mg·g−1,蛋白质含量依次为0、0.328、10.16 mg·g−1。TB-EPS与细胞表面结合紧密,稳定地附着于细胞壁外,组分变化主要是由微生物细胞自身的变化而产生的,较少受外界水体的影响;LB-EPS结构松散,是微生物细胞与液相间物质交换的场所,易受微生物活性及外界水体的影响。
樊鹏超等[9]对采用A2O工艺的城市污水处理厂研究发现,EPS中蛋白质含量高于多糖,蛋白质为6.17~43.18 mg·g−1,多糖为0.970~6.76 mg·g−1。张安龙等[25]对采用氧化沟工艺的造纸厂废水处理厂研究发现,EPS中蛋白质为47.8~124 mg·g−1,多糖为13.3~25.2 mg·g−1 。SPONZA [26]发现,皮革、染料、化学3种工业废水活性污泥EPS中蛋白质含量为24~48 mg·g−1 。生物处理前端,进水中有机物浓度较高,污染负荷大,从而抑制EPS分泌,EPS总量为5.68 mg·g−1。SPONZA[26]研究发现,化学品、染料和皮革工业EPS中蛋白质含量低的原因是蛋白质与进水中高COD含量物质的复杂作用。生物处理末端,结合层EPS总量大幅度增加,TB-EPS含量增幅为93%,LB-EPS增幅为22.2%。由于二级好氧处理阶段污泥负荷小,底物基质浓度较低,微生物可利用基质减少,微生物进入内源呼吸阶段,细胞的分泌及自溶使污泥中EPS含量增大[15]。胡小兵等[10]采用加热法分层提取污水厂好氧池的活性污泥EPS,发现内层EPS的PN/PS含量高于外层EPS。周健等[27]发现,EPS及多糖含量与污泥负荷呈负相关,这与本研究中的结果相一致。
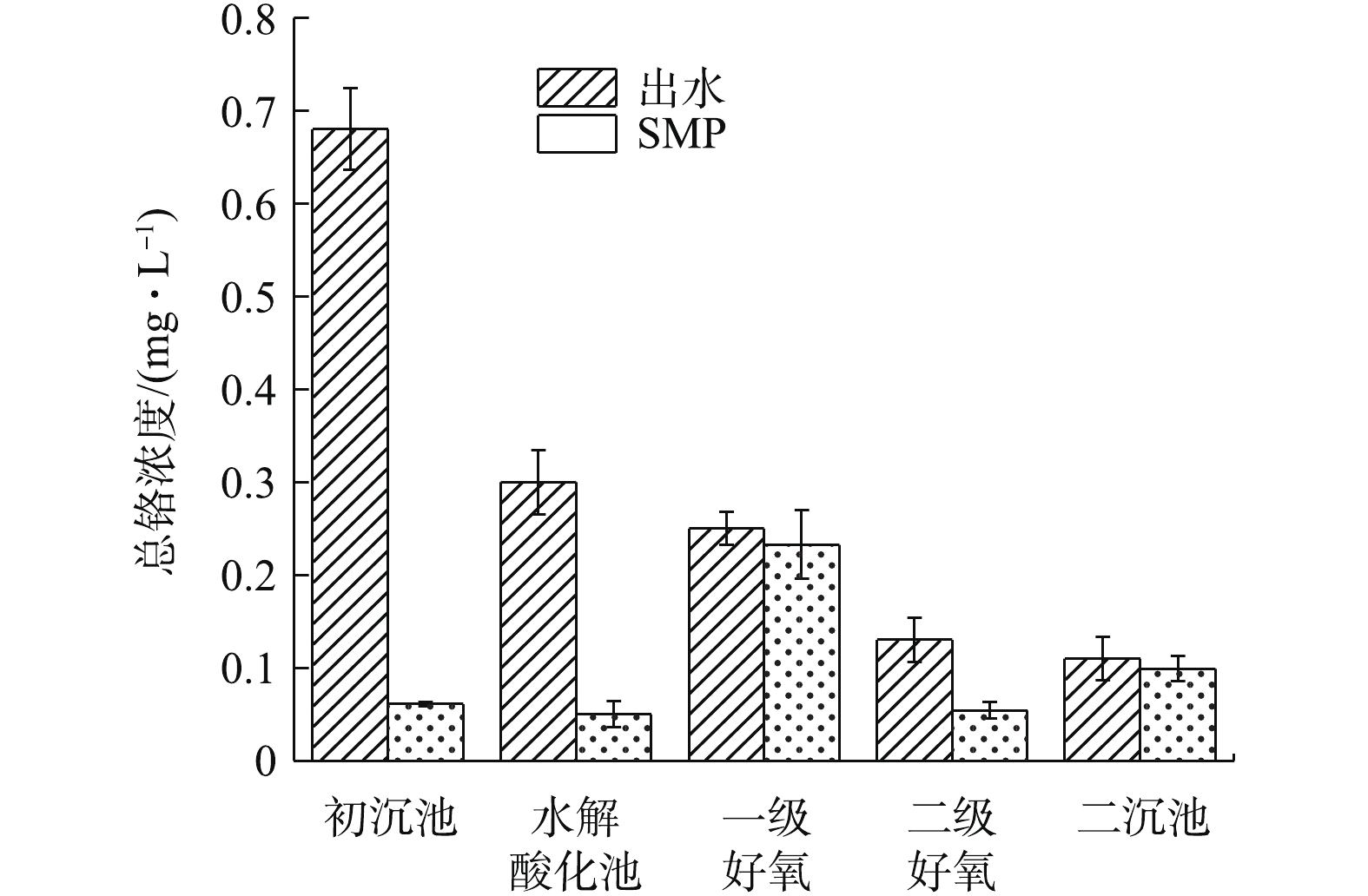
2.3 总铬在EPS、SMP组分中的分布
由图5可知,各处理单元的铬含量存在一定差异。以初沉池出水中铬含量为初始参照值,初沉池及水解酸化池出水经0.45 μm过滤,铬含量大幅度下降。这说明生化处理前,铬主要吸附在固体悬浮物上,大尺寸悬浮物经自然沉降附着于EPS表层,Cr3+沉淀分布在细胞表面或与EPS络合存在于微生物表面,少部分Cr3+进入细胞内部[28]。初沉池出水SMP中铬浓度为0.061 mg·L−1,经生物处理,二沉池出水SMP中铬浓度为0.099 mg·L−1,出水端中铬浓度略高于进水端。每个样品平行测定3次,基本排除了测量误差,故出水中增加的铬浓度可能是污泥中吸附累积的铬重新被释放,络合态EPS-Cr随EPS水解进入液相。这与王金翠等[29]的研究结果相似,即EPS与SMP之间存在相互转化,吸附与被吸附的关系。
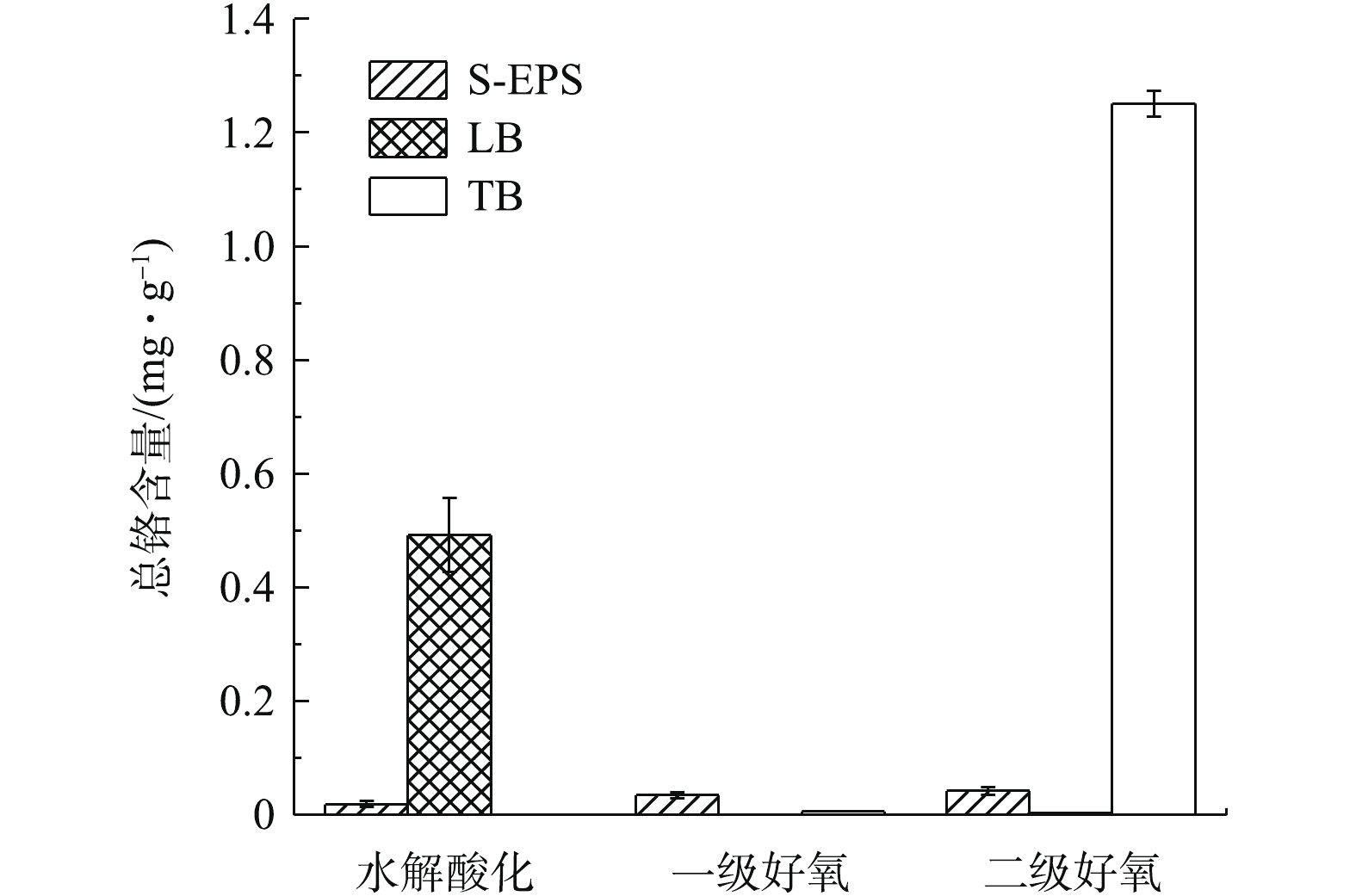
如图6所示,水解酸化池LB-EPS、二级好氧池TB-EPS中铬含量分布较多,分别为0.491 9、1.251 mg·g−1,这可能与各处理单元的污泥负荷、溶解氧含量、EPS含量等因素有关。一级好氧池中铬含量分布均很低,主要是由于该池活性污泥浓度较高造成的,MLVSS高达6.668 g·L−1,如表1所示。二级好氧池TB-EPS中铬含量高,主要是由于胞外聚合物结合层对Cr3+的络合能力较强。这与胡小兵等[10] 的研究结果一致,即各层EPS对污泥吸附污染物的作用机制是:有机污染物通过S-EPS的吸附,经LB-EPS传输渗透到TB-EPS中储存,多糖含量的增加有利于SMP和TB-EPS对污染物的吸附。重金属铬在各池S-EPS中分布较少,主要是由于S-EPS表面结构较为光滑,结构松散,对重金属铬具有一定的吸附作用,但固定作用较弱。
利用SPSS软件,对EPS各组分的蛋白质多糖含量与DOC、总铬分布情况和多糖蛋白质比进行Pearson相关性分析,结果如表2所示。从Pearson相关系数及相伴概率可知,总铬的分布与胞外聚合物中PS/PN (r=0.787, P=0.036)、与PS呈显著正相关(r=0.890,P=0.003);DOC与PN的含量呈显著正相关(r=0.941,P=0);EPS总含量对污泥中总铬的分布影响不显著。
表 2 胞外聚合物成分含量与Cr分布的相关性Table 2. Correlation matrix among EPS content and Cr distribution项目 总Cr DOC PS/PN PS PN EPS总量 Pearson P Pearson P Pearson P Pearson P Pearson P Pearson P 总Cr 1 0.459 0.252 0.787** 0.036 0.890** 0.003 0.266 0.564 0.407 0.148 DOC 1 0.004 0.991 0.589* 0.027 0.941** 0 0.952** 0 PS/PN 1 0.656* 0.028 −0.290 0.386 −0.098 0.740 PS 1 0.463 0.152 0.645** 0.003 PN 1 0.949** 0 EPS总量 1 注:** 在 0.01水平下(双尾)显著相关;* 在 0.05 水平下(双尾)显著相关。 已有研究[30-32]表明,EPS中多糖比蛋白质更容易吸附金属离子,这与多糖和蛋白质中对金属离子的活性吸附点数量和吸附点位活性大小有关。EPS中多糖是络合Cr离子主要的组分,金属离子可能首先占据多糖中的活性吸附点,待饱和后再与蛋白质中的活性吸附点位结合。刘轶等[33]认为,对活性污泥脱水性能起决定作用的不是 EPS 总量而是其各组分间的比例,EPS各组分比例可影响污泥絮体表面的离子化多聚物含量和EPS亲疏水性质。PS/PN越大,污泥EPS的Zeta电位越小,对重金属阳离子的络合作用就越强,这与本研究结果一致。朱经贺[34]发现,海藻酸钠(多糖)的加入会使重金属离子(Pb2+、Cd2+)从人血清白蛋白(HSA)上脱离,并与海藻酸钠形成络合物。这可能是由于EPS中蛋白质与多糖发生静电相互作用及反应基团间的相互干扰所致[5],说明蛋白质和多糖在EPS各组分中所占比重是影响金属铬分布的重要因素。
3. 结论
1)在制革污水生物处理过程中,EPS各组分中主要成分存在蛋白质与多糖的交替变化,结合层EPS组分含量为2.248~16.66 mg·g−1。在一级生物处理中,多糖及蛋白质含量均降低;在二级生物处理中,污泥负荷小,EPS含量显著升高,主要表现在蛋白质含量增长,SMP中多糖含量大幅升高。这一结果表明生物处理中胞外聚合物存在由内向外排的过程。
2)在制革废水生物处理中,S-EPS吸附废水中Cr3+,经LB-EPS传输渗透到TB-EPS中储存,吸附饱和或外界条件变动会引起附着于细胞表面的铬重新被释放,EPS-Cr络合物也可能由于胞外聚合物外排过程进入液相,从而影响出水水质。
3)根据Pearson相关性分析结果,总铬的分布与胞外聚合物中PS/PN呈显著正相关(P<0.05)、总铬与PS呈显著正相关(P<0.01);DOC与PN的含量呈显著正相关(P<0.01)。这说明EPS中的不同组分含量对Cr的结合能力不同,证实了PS/PN对铬的络合起关键作用。
-
刘丹青. 我国污染场地土壤石油烃环境质量标准体系的现状与趋势[J]. 中国环境监测, 2020, 36(1):138-146 Liu D Q. Current situation and trend of petroleum hydrocarbon related standard system in contaminated site soils of China[J]. Environmental Monitoring in China, 2020, 36(1):138-146(in Chinese)
黄雪洋. 污染场地地下水中石油烃的生物强化降解及风险管控研究[D]. 北京:中国地质大学(北京), 2020:1-2 Huang X Y. Research on biodegradation and risk control of petroleum hydrocarbon in groundwater at a contaminated site[D]. Beijing:China University of Geosciences, 2020:1-2(in Chinese) 中华人民共和国生态环境部. 建设用地土壤污染风险评估技术导则:HJ 25.3-2019[S]. 北京:中国环境出版集团, 2020 Ministry of Ecology and Environment of the People's Republic of China. Technical guidelines for risk assessment of soil contamination of land for construction:HJ 25.3-2019 [S]. Beijing:China Environmental Science Press, 2020(in Chinese)
中华人民共和国生态环境部. 土壤环境质量建设用地土壤污染风险管控标准:GB36600-2018[S]. 北京:中国环境出版集团, 2019 Ministry of Ecology and Environment of the People's Republic of China. Soil environmental quality risk control standard for soil contamination of development land:GB36600-2018[S]. Beijing:China Environmental Science Press, 2019 (in Chinese)
中华人民共和国生态环境部. 工业企业场地环境调查评估与修复工作指南(试行)[S]. 北京:中华人民共和国生态环境部, 2014 中华人民共和国生态环境部. 建设用地土壤环境调查评估技术指南[S]. 北京:中华人民共和国生态环境部, 2017 上海市生态环境局. 沪环土[2020] 62号上海市建设用地土壤污染状况调查、风险评估、风险管控与修复方案编制、风险管控与修复效果评估工作的补充规定(试行)[S]. 上海:上海市生态环境局, 2020 陈捷. 石油烃组分在土壤和地下水环境中的分布规律与迁移特征研究[D]. 广州:华南理工大学, 2018:3-5 Chen J. Distribution and migration characteristics of petroleum hydrocarbon components in soil and groundwater environment[D]. Guangzhou:South China University of Technology, 2018:3 -5(in Chinese)
Adeniji A O, Okoh O O, Okoh A I. Analytical methods for the determination of the distribution of total petroleum hydrocarbons in the water and sediment of aquatic systems:A review[J]. Journal of Chemistry, 2017, 2017:1-13 Weisman W, Vorhees D. Human Health Risk-Based Evaluation of Petroleum Contaminated Site:Implementation of the Working Group Approach[M]. Amherst:Amherst Scientific Publishers, 1998:27-28 Potter T L, Simmons K E. Total petroleum hydrocarbon criteria working group series:Volume 2:Composition of petroleum mixtures[R]. Amherst:Total Petroleum Hydrocarbon Criteria Working Group Series, 1998 Rojo F. Degradation of alkanes by bacteria[J]. Environmental Microbiology, 2009, 11(10):2477-2490 吴慧君, 宋权威, 郑瑾, 等. 微生物降解石油烃的功能基因研究进展[J]. 微生物学通报, 2020, 47(10):3355-3368 Wu H J, Song Q W, Zheng J, et al. Function genes in microorganisms capable of degrading petroleum hydrocarbon[J]. Microbiology China, 2020, 47(10):3355-3368(in Chinese)
Varjani S J. Microbial degradation of petroleum hydrocarbons[J]. Bioresource Technology, 2017, 223:277-286 Edwards D A, Andriot M D, Amoruso M A, et al. Total Petroleum Hydrocarbon Criteria Working Group Series:Volume 4:Development of fraction specific reference doses (RfDs) and reference concentration (RfCs) for total petroleum hydrocarbons (TPH)[R]. Amherst:Total Petroleum Hydrocarbon Criteria Working Group Series, 1997 中华人民共和国国家卫生健康委员会. 生活饮用水卫生标准:GB 5749-2006[S]. 北京:中国标准出版社, 2007 National Health Commission of the People's Republic of China. Standards for drinking water quality:GB 5749-2006[S]. Beijing:Standards Press of China, 2007 (in Chinese)
万云洋, 朱迎佳, 费佳佳, 等. 环境中的多环芳烃结构及其危害[J]. 油气田环境保护, 2017, 27(6):23-26 ,56 Wan Y Y, Zhu Y J, Fei J J, et al. The structure of polycyclic aromatic hydrocarbons and its danger in the environment[J]. Environmental Protection of Oil & Gas Fields, 2017, 27(6):23-26,56(in Chinese)
陆凤翔, 杨玉. 临床实用药物手册[M]. 2版. 南京:江苏科学技术出版社, 2002:292 古文革, 杜丹, 王桂菊. 油田采出水中含油量和外排水中石油类、石油烃的差异分析[J]. 油气田地面工程, 2018, 37(3):89-92 Gu W G, Du D, Wang G J. Differential analysis between oil content in oilfield produced water and petroleum and petroleum hydrocarbons in effluent[J]. Oil-Gas Field Surface Engineering, 2018, 37(3):89-92(in Chinese)
杨慧娟. 土壤中石油烃分段测定方法及根际促生菌强化植物修复研究[D]. 南京:南京师范大学, 2013:3-5 United States Environmental Protection Agency (US EPA). SW-846 Test Method 8015C:Nonhalogenated Organics by Gas Chromatography[S]. Washington DC:US EPA, 2007 United States Environmental Protection Agency (US EPA). SW-846 Test Method 8260D:Volatile Organic Compounds by Gas Chromatography/Mass Spectrometry (GC/MS)[S]. Washington DC:US EPA, 2018 United States Environmental Protection Agency (US EPA). SW-846 Test Method 8270E:Semivolatile Organic Compounds by Gas Chromatography/Mass Spectrometry (GC/MS)[S]. Washington DC:US EPA, 2018 Texas Commission on Environmental Quality (TCEQ). Total Petroleum Hydrocarbons TNRCC Method 1005[S]. Austin:TCEQ, 2001 Texas Commission on Environmental Quality (TCEQ). Draft TNRCC Method 1006[S]. Austin:TCEQ, 2000 Washington State Department of Ecology. Analytical Methods for Petroleum Hydrocarbons. Publication No. ECY 97-602:137.[S]. Lacey:Washington State Department of Ecology, 1997 Massachusetts Department of Environmental Protection (MassDEP). Method for the Determination of Extractable Petroleum Hydrocarbons (EPH)[S]. Boston:MassDEP, 2004 Massachusetts Department of Environmental Protection (MassDEP). Method for the Determination of Volatile Petroleum Hydrocarbons (VPH) by Gas Chromatography/Mass Spectrometry[S]. Boston:MassDEP, 2004 Massachusetts Department of Environmental Protection (MassDEP). Method for the Determination of Volatile Petroleum Hydrocarbons (VPH) by Gas Chromatography/Photoionization Detector/Flame Ionization Detector[S]. Boston:MassDEP, 2004 United States Environmental Protection Agency (US EPA). SW-846 Test Method 3630C:Silica Gel Cleanup[S]. Washington DC:US EPA, 2018 中华人民共和国生态环境部. 土壤和沉积物石油烃(C6-C9)的测定吹扫捕集/气相色谱法:HJ 1020-2019[S]. 北京:中国环境出版集团, 2020 Ministry of Ecology and Environment of the People's Republic of China. Soil and sediment-Determination of petroleum hydrocarbons(C6-C9)-Purge and trap/gas chromatography:HJ 1020 -2019[S]. Beijing:China Environmental Science Press, 2020(in Chinese)
中华人民共和国生态环境部. 土壤和沉积物石油烃(C10-C40)的测定气相色谱法:HJ 1021-2019[S]. 北京:中国环境出版集团, 2020 Ministry of Ecology and Environment of the People's Republic of China. Soil and sediment-Determination of petroleum hydrocarbons (C10-C40)-Gas chromatography:HJ 1021 -2019[S]. Beijing:China Environmental Science Press, 2020(in Chinese)
李桂香, 高岩, 张青. 环境样品中石油烃的分类/分段检测技术[J]. 实验室研究与探索, 2016, 35(4):30-33 Li G X, Gao Y, Zhang Q. Testing technology of total petroleum hydrocarbon speciation/fractions in the environmental samples[J]. Research and Exploration in Laboratory, 2016, 35(4):30-33(in Chinese)
中华人民共和国生态环境部. 关于征求《土壤石油类的测定红外光度法》等七项国家环境保护标准意见的函. (2018-09-12). http://www.mee.gov.cn/gkml/sthjbgw/stbgth/201809/t20180921_626427.htm. 中华人民共和国生态环境部. 关于征求《水质石油类的测定紫外分光光度法(征求意见稿)》等三项国家环境保护标准意见的函. (2018-05-30). http://www.mee.gov.cn/gkml/sthjbgw/stbgth/201806/t20180601_442260.htm. 谢楠, 徐佼姣. 水质中石油类(红外分光光度法)与石油烃(GC_MS和GC_FID)的检测结果比较[J]. 资源节约与环保, 2015(3):93-94 李晶晶, 白光明, 于瀛鑫. GC-MS法与红外分光光度法测定水中石油类烃含量的方法比对[J]. 黑龙江科技信息, 2017(4):156-157 McMillen S J. Risk-Based Decision-Making for Assessing Petroleum Impacts at Exploration and Production Sites[M]. Washington DC:Department of Energy, 2001 Zemo D A. White paper:Analytical methods for total petroleum hydrocarbons (TPH)[R]. Washington DC:American Petroleum Institute (API), 2016 Interstate Technology and Regulatory Council (ITRC). TPH risk evaluation at petroleum-contaminated sites[R]. Washington DC:ITRC, 2018 にほん環境省. 環境庁告示第46号, 土壌の汚染に係る環境基準[S]. とうきよう:にほん環境省, 1991 Ministry of the Environment of Japan. Environment Agency Notification No. 46, Environmental Standard for Soil Contamination[S]. Tokyo:Ministry of the Environment of Japan, 1991(in Japanese) Bundesregierung. BGBl. I S. 1554, Federal Soil Protection and Contaminated Sites Ordinance(BBodSchV)[S]. Berlin:The Federal Republic of Germany, 1999 Yao Y J, Verginelli I, Suuberg E M. A two-dimensional analytical model of petroleum vapor intrusion[J]. Water Resources Research, 2016, 52(2):1528-1539 Yao Y J, Shen R, Pennell K G, et al. A review of vapor intrusion models[J]. Environmental Science & Technology, 2013, 47(6):2457-2470 Ma J, Lahvis M. Rationale for soil-gas sampling to improve vapor intrusion risk assessment in China[J]. Groundwater Monitoring & Remediation, 2020, 40:12-13 Beckley L, McHugh T. A conceptual model for vapor intrusion from groundwater through sewer lines[J]. Science of the Total Environment, 2020, 698:134283 Yao Y J, Xiao Y T, Luo J, et al. High-frequency fluctuations of indoor pressure:A potential driving force for vapor intrusion in urban areas[J]. Science of the Total Environment, 2020, 710:136309 Idowu O, Kim Anh Tran T, Baker P, et al. Bioavailability of polycyclic aromatic compounds[J]. Science of the Total Environment, 2020, 736:139574 Liu X L, Ji R, Shi Y, et al. Release of polycyclic aromatic hydrocarbons from biochar fine particles in simulated lung fluids:Implications for bioavailability and risks of airborne aromatics[J]. Science of the Total Environment, 2019, 655:1159-1168 Gao P, da Silva E B, Townsend T, et al. Emerging PAHs in urban soils:Concentrations, bioaccessibility, and spatial distribution[J]. Science of the Total Environment, 2019, 670:800-805 Ministry of Infrastructure and Water Management of the Netherlands. Soil Remediation Circular 2013[S]. Bilthoven:Ministry of Infrastructure and Water Management of the Netherlands, 2013 United States Environmental Protection Agency (US EPA). Regional Screening Levels (RSLs) Risk Assessment.. https://www.epa.gov/risk/regional-screening-levels-rsls. National Institute for Public Health and the Environment (RIVM). A proposal for revised intervention values for petroleum hydrocarbons (mineral oil) on base of fractions of petroleum hydrocarbons. RIVM report 711701015[R]. Bilthoven:RIVM, 1999 中国台湾地区环境保护局. 土壤污染管制标准[S]. 台北:中国台湾地区环境保护局, 2011 曹云者, 施烈焰, 李丽和, 等. 石油烃污染场地环境风险评价与风险管理[J]. 生态毒理学报, 2007, 2(3):265-272 Cao Y Z, Shi L Y, Li L H, et al. Petroleum hydrocarbons-contaminated sites and related risk-based management strategy[J]. Asian Journal of Ecotoxicology, 2007, 2(3):265-272(in Chinese)
Ministry for the Environment of New Zealand. Guidelines for assessing and managing petroleum hydrocarbon contaminated sites in New Zealand. ME 1074.[S]. Wellington, New Zealand:Ministry for the Environment of New Zealand, 1997 Environment Agency. Principles for evaluating the human health risks for petroleum hydrocarbons in soils:A consultation paper[J]. R&D Technical Report, 2003:1 Environment Agency of United Kingdom. Review of comments on:Environment Agency public consultation paper-Principles for evaluating the human health risks from petroleum hydrocarbons in soils. Science Report P5-080/TR2[R]. Bristol:Environment Agency of United Kingdom, 2004 Twerdok L E. Development of toxicity criteria for petroleum hydrocarbon fractions in the Petroleum Hydrocarbon Criteria Working Group approach for risk-based management of total petroleum hydrocarbons in soil[J]. Drug and Chemical Toxicology, 1999, 22(1):275-291 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 4371
- HTML全文浏览数: 4371
- PDF下载数: 142
- 施引文献: 0





 DownLoad:
DownLoad: