-
零价镁(zero-valent magnesium, ZVMg)是一种银白色的碱土金属,具有化学性质活泼、低密度 (1.74 g/cm3)、高强度和地壳中高丰度的特点,镁合金已经在航空、育种、自动化和电器工业中有广泛应用[1]。ZVMg的活性较强,在污染物的还原降解方面具有诸多优势[2-3]:ZVMg的氧化还原电位(−2.37 V)是零价铁(ZVI,−0.44 V)的5.4倍,具有更强的还原活性;Mg(OH)2的沉淀平衡常数(Ksp)为7.08×10−12 (25 ℃),显著高于Fe(OH)2 (7.943×10−16)[4],因此ZVMg表面形成的Mg(OH)2氧化膜比ZVI表面形成的Fe(OH)3膜更疏松易溶,有利于ZVMg传递电子;ZVI只适用于厌氧环境,而ZVMg能同时用于有氧和无氧环境[5-6];镁广泛存在于天然环境中,是植物光合作用和人体细胞必需的元素之一,对环境友好。因此,ZVMg作为一种环境友好型高效还原剂,在环境修复领域具有较大应用潜力。
ZVMg应用于污染物去除的研究始于20世纪末期[7],1998~2021年间,Web of Science上可统计的关于ZVMg降解污染物的文章50篇左右,而国内几乎没有相关研究。ZVMg与水之间发生强烈的腐蚀-钝化作用可能是限制其应用的重要因素[8];此外,对于ZVMg进入水环境后的生态影响及较高的使用成本等问题,目前尚缺少详细研究结果以支持ZVMg的环境应用。由于ZVMg具有负电位(<<−1 VSHE),其与水反应将在短时间内生成大量的H2[8],同时pH快速升至10以上,并且Mg2+和OH−生成的Mg(OH)2沉淀层抑制Mg传递电子,导致ZVMg的还原效率降低[9-10],这与ZVI在水中的钝化机制类似。同时,由于ZVMg具有较高的氧化还原电势,很难通过化学还原方法得到纳米级的ZVMg,目前主要集中于微米颗粒的研究[11]。因此,虽然ZVMg在去除环境污染物方面具有较多优势,但目前仍存在较多问题。本文旨在详细介绍ZVMg的制备方法与性质特征,重点评述ZVMg独特的腐蚀特性和近年来ZVMg材料用于处理不同污染物的研究进展,指出现有研究存在问题及未来应用面临的挑战,并展望了ZVMg未来的研究方向,以期为ZVMg在环境修复领域的研究与应用提供关键理论基础。
-
SOLANKI et al[12]提出可以利用NaBH4通过湿化学还原方法得到ZVMg纳米颗粒,但是由于ZVMg自身较强的还原特性,通常认为很难通过湿化学还原方法制备ZVMg。目前多数研究通过机械球磨法获得微纳米尺寸的ZVMg颗粒。该方法利用高速转动的研磨小球与罐体之间的碰撞作用力来改变颗粒表面的微观结构,降低颗粒粒径,增大比表面积,而且机械作用力能破坏金属表面的氧化层,使颗粒表面产生更多缺陷结构,增加活性位点[10, 13-14]。球磨过程中还需要添加过程控制剂,以防止或减弱球磨材料发生冷焊作用[15-16]。导电性能较好的石墨通常被用作球磨镁粉的控制剂[17-19],此外,活性炭(active carbon,AC)是一种较好的控制剂,并且活性炭是良好的多孔碳材料,对疏水性有机污染物具有强烈的吸附性能[19],有利于提高污染物的去除效率。
球磨ZVMg的常见方法:利用Red Devil 5400系列油漆搅拌器,配备传统托盘承载研磨罐体,容器和磨球为不锈钢材质。镁粉(76 g)和石墨(9 g)混合置于研磨罐(内径5.5 cm,高17 cm)内,加研磨球,磨球与粉末的质量比3:1,容器充入氮气或氩气后密封,球磨约30~45 min、球磨转速为670 r/min[10, 18, 20] 。但有学者利用行星式球磨仪(BM40,北京格瑞德曼仪器设备有限公司)制备得到了微米级镁粉颗粒[21]。球磨参数:4.5 g镁粉、0.5 g石墨与100.0 g氧化锆小球混合,置于不锈钢球磨罐(内径7 cm,高10 cm)中密封,设定球磨仪的转速为300 r/min,球磨过程每运行5 min、暂停10 min,共循环9次。
此外,合成ZVMg材料的方法还包括:氢气还原氧化镁(500 ℃以上);碱金属还原镁盐;氢化镁脱氢;在四氢呋喃条件下气化金属镁;超声电化学方法等[6, 22-24]。但这些方法的操作难度较高,实验室条件下较难制备ZVMg的微纳米颗粒,比较而言,机械球磨法制备ZVMg材料更为可行。
-
在Mg表面掺杂其他过渡金属形成具有催化还原作用的双金属,是强化Mg还原效率的常见方法。Mg双金属合成方法与纳米Fe双金属的合成方法类似。一般是将Mg颗粒沉浸在第二相金属盐溶液中,利用Mg自身的强还原性,使催化金属盐在液相中直接被还原并负载到Mg颗粒表面,形成许多具有催化作用的金属“小岛”[11]。这种合成方法具有以下优势:操作过程简单;材料合成重复性好;催化金属均匀负载在Mg颗粒表面;可通过改变溶剂的种类、反应温度或添加不同的稳定剂等方式,合成不同的Mg双金属材料[25]。
-
有研究发现,球磨后ZVMg颗粒的比表面积为3.62 m2/g,是球磨前颗粒比表面积 (0.83 m2/g)的4.36倍[26],比纳米零价铁(nZVI)的比表面积(10~50 m2/g)[27]低一个数量级。但是由于nZVI颗粒自身强烈的磁引力作用,它们进入水溶液后容易形成链状或树枝状的聚集体,导致nZVI颗粒粒径比原来增大几十甚至几百倍[28],而ZVMg颗粒则不存在磁性吸引导致的颗粒团聚问题。
MOGHARBEL et a[19]通过扫描电镜(scanning electron microscopy,SEM)图发现ZVMg和AC球磨后为圆粒状颗粒,见图1(a)和(b)。但魏鹏刚等[21]的研究发现,ZVMg与石墨(C)球磨后由不规则的粒状变为较光滑的片状结构,见图1(c)和(d)。
ZHANG et al[26]利用X-射线衍射(XRD)分析了ZVMg/C表面的晶体结构,发现ZVMg的特征衍射峰包括32.16°、34.40°、36.62°、47.74°、57.26°和63.06°,见图2,这与SICILIANO et al[4]报道的XRD分析结果一致。ZVMg与水溶液反应后,ZVMg的特征衍射峰信号显著减弱,而在2θ 为 18.5°、38.0°、50.8°、58.7°和62.1°处出现了Mg(OH)2的特征衍射峰,并且通过扫描电镜(SEM)谱图,见图3[26],也证明了ZVMg表面形成了花瓣状疏松多孔的Mg(OH)2氧化层结构[29]。
在空气中自然老化6 d后,ZVMg/C的XRD衍射峰与新鲜制备的ZVMg/C几乎没有差异,见图2[26],表明老化时间内空气对ZVMg/C的氧化作用比较微弱。并且通过高分辨率透射电镜(HRTEM)分析并没有发现ZVMg/C颗粒表面形成明显的氧化壳结构,见图4[26],与nZVI的壳-核结构存在明显差异[30],因此,ZVMg在空气中老化速率较慢。
-
当ZVMg颗粒进入水溶液中,将自发与水发生电化学腐蚀反应,生成氢氧化镁[Mg(OH)2] 和氢气 (H2),见式 (1) 。尽管O2/H2O的标准氧化还原电位(+1.23 V)明显高于Mg2+/Mg的标准氧化还原电位 (E0SHE=−2.37 V),但事实证明溶解氧的浓度对ZVMg的溶解程度和反应速率几乎没有影响,因此一般认为溶解氧对ZVMg的氧化作用微乎其微[31-33]。
分解反应式,见式(2 ~ 4):
式中,ZVMg腐蚀产生释放Mg2+,同时水中产生大量OH−,导致pH上升到10.5左右,而Mg(OH)2在pH>10.7将形成饱和沉淀[34]。当Mg与其他过渡金属形成微电解体系,Mg表面的过渡金属作为阴极有助于加速阳极Mg的腐蚀作用;而Mg腐蚀形成的Mg(OH)2中,有一部分用于修复Mg表面的氧化膜。因此水溶液中,Mg表面的腐蚀-氧化作用形成了一套循环调控机制。Mg颗粒表面独特的腐蚀特性具有较大的环境应用潜力,这使得ZVMg可以自然存储在环境中,仍然可以保持其还原活性。LEE et al[31]研究了粒状ZVMg在开放的缓冲溶液中的溶解动力学,结果表明,浓度为10~50 mg/L的ZVMg在200 min内可以完全溶解,主要的氧化剂为水分子而非氧气。
-
ZVMg或Mg的双金属材料已被证明对多种有机和无机污染物具有还原降解功能,并具有较高的去除效率和反应速率,见表1。ZVMg去除有机或重金属污染物的概念模型图,见图5。与ZVI结构类似,ZVMg同样具有核-壳结构,ZVMg单质表面覆盖着一层镁氧化物或氢氧化物氧化层,但氧化层的结构具有分散性和多孔状,有利于内部ZVMg传递电子。理论上,ZVMg与ZVI发生还原作用的机理基本一致,过程主要包括:1)有机污染物,尤其是卤代烷烃或芳香烃污染物主要通过得电子和加氢脱氯作用被还原[10, 35],见式(5);2)重金属阳离子作为电子受体,直接接受ZVMg单质传递的电子,从高价态被还原为低价态,见式(6),如Cr(VI)被ZVMg还原为Cr(III)[2];3)还原后的重金属离子,如Cr(III)可能形成Cr(OH)3沉淀在ZVMg表面或与Mg2+发生共沉淀作用[2];4)一些相对稳定的无机盐离子,如高氯酸盐和硝酸盐也可能被ZVMg还原。如,硝酸盐离子能直接被ZVMg还原为氨根离子[36];5)而某些不易被还原的金属离子也有可能单纯被ZVMg吸附。此外,在ZVMg单质的还原过程中,同时伴随着ZVMg与水的腐蚀反应产生过量H2,尽管H2通常被认为在没有催化的条件下很难具有还原作用,但有研究发现Mg-水反应过程中,H2的逐渐生成会增加阳极ZVMg的电位,这是一个较为特殊的现象[31]。因此有研究者提出ZVMg可能首先生成了Mg+,并且与水分子反应首先产生一个活性中间体:水合氢电子(eaq−),它是生成H2的前体物,同时也是一种良好的还原剂,能够与污染物发生电子传递作用[31]。
-
在已有研究报道中,有机污染物被ZVMg或Mg的双金属降解研究多数在酸性有机溶剂体系中开展,以避免Mg与水分子的剧烈反应导致Mg利用效率下降的问题,有机溶剂主要包括乙醇[45]、1:1乙醇/乳酸乙酯[46]和丙酮[47]等。如,美国中佛罗里达大学YESTREBSKY课题组[10, 46]以冰醋酸 (1% v/v) 作为活化剂,利用球磨后的ZVMg/C分别在1:1乙醇/乳酸乙酯 (v/v) 和无水乙醇溶液体系中降解六氯苯和五氯酚。
与单独ZVMg材料相比,Mg双金属材料能显著提高污染物的降解效率[12]。常见过渡金属包括Pd[11, 18, 45-48]、Ni[41]、Cu[41]和Ag[14]等。Mg的双金属材料已经被证明能有效去除各种高毒性的氯代有机物,如滴滴涕[49]、六氯苯[10]、多氯联苯[5, 11, 42]和氯酚类[12-13, 46]等物质。关于Mg的双金属降解氯代有机污染物的作用机理,加氢脱氯作用普遍被认为是高氯代有机污染物 (氯苯类、多氯联苯) 逐渐被转化为低毒性、易生物降解的低氯代有机物的主要过程[11, 42, 48]。活性氢原子 (H·) 被认为是铁基或镁基双金属体系在活化催化条件下产生的主要还原物质。CWIERTNY et al[50]甚至提出吸附在金属催化剂表面H·的量决定了其还原能力。PATEL et al[38]发现在水溶液中,单独ZVMg难以降解五氯酚,但利用ZVMg在五氯酚溶液中原位还原Ag+生成Mg/Ag (Ag=3.1w%) 双金属后,可以降解约35%的五氯酚;加入醋酸 (6.25%) 后,ZVMg可去除80%以上的五氯酚,而Mg/Ag双金属可以在1 h内降解90%以上的五氯酚。此外,PATEL et al[51]也发现原位还原合成的Mg/Pd双金属比非原位合成的材料对五氯酚降解更有效。而且,单独ZVMg和Mg/Pd双金属对五氯酚的降解效果优于Fe/Pd双金属和单纯ZVI[13]。MORALES[52]研究证实,Mg/Pb双金属在室温和常压条件下可将苯酚氢化成环己醇和环己酮。Mg/Pd也被用于有机氯农药和二噁英的去除研究,结果表明,滴滴涕、滴滴滴和滴滴伊可以被Mg/Pd完全还原脱氯至烃类化合物,且脱氯过程中无有毒中间体生成[49, 53]。THANGADURAI et al[47]利用Mg/Pd实现了对硫丹的完全脱硫和脱氯,最终产物为碳氢化合物。BEGUM et al[54]也证实了Mg/Zn体系可将硫丹和林丹这2种内分泌干扰物完全脱氯成碳氢化合物。
-
虽然ZVMg被证明在有机溶剂体系中能有效去除目标污染物,但是添加有机溶剂容易导致环境次生污染、增加环境修复成本等问题,对环境和经济并不友好,在有机体系中ZVMg很难原位应用于场地地下水的修复技术中。在有限的水溶液体系研究中,ZVMg仍然可以实现对污染物的降解目的,但可能存在反应速率下降、溶液pH显著上升导致Mg钝化等问题。ZHANG et al[26]探索了ZVMg降解地下水典型污染物三氯乙烯 (TCE) 的应用潜力和内在作用机制。结果表明,在未调节pH的水溶液体系中,10 g/L的球磨ZVMg/C能够将初始浓度为38 μmol/L的TCE在24 h降解91%,与其在添加冰醋酸(1 vol.%)的有机溶剂体系中的降解率相当。TCE通过加氢脱氯途径被降解生成甲烷 (62.51%)、正己烷 (11.86%) 和乙烷 (7.40%) 等烯烃和炔烃产物去除,见图6(a)。在添加或未添加冰醋酸 (1 vol.%) 的水溶液中,TCE降解速率常数 (KSA) 分别为1.42×10−1和9.31×10−2 L/(m2·h)。在TCE水溶液中,ZVMg的利用率约为60%,见图6(b)[26],与对照实验(未添加TCE的背景溶液)中ZVMg的利用率相当,表明ZVMg/C在2种体系中具有相似的供电子能力。此外,研究表明,ZVMg与水反应后,由于pH短时间(~10 min)内上升到11左右,导致Mg2+会迅速生成Mg(OH)2沉淀。在未调节溶液pH条件下,投加量为10 g/L的ZVMg反应后溶液中Mg2+的浓度约为1.05 mg/L,远低于白云质石灰岩含水层中Mg2+的背景浓度(22~43 mg/L)[55],同时也远低于我国《地下水质量标准:GB/T 14848—2017》I类水的总硬度指标(≤150 mg/L)[56]。其次,通过老化实验发现,当ZVMg/C在空气中自然暴露2、4和6 d,TCE的KSA分别降至2.52×10−2、2.07×10−2 和1.90×10−2 L/(m2·h),这主要是因为空气氧化使得ZVMg的含量由最初的85.2%下降了5.3%~7.3%,研究结果初步证明了ZVMg/C对工业污染场地地下水氯代烃污染去除的应用潜力。
-
Cr(VI) 作为最常见的无机污染物之一,可以被Fe2+、硫化零价铁、ZVI等还原剂转化为毒性较低、迁移性较差的Cr(III),但在中性、碱性或溶解氧存在条件下,Cr(VI) 的还原效率较低,而LEE et al[31]则发现ZVMg能在中性缓冲溶液中将Cr(VI) 完全还原去除,研究还发现,当质量比ZVMg:Cr(VI) <100时,ZVMg会被水分子快速消耗,并且Cr(VI)被还原生成的Cr(III) 会大量沉淀在ZVMg表面,因而降低了ZVMg的还原速率,但是提高ZVMg的投加量将显著提高还原效率。LEE et al[31]提出,Cr(VI) 并非被ZVMg直接还原,而是被ZVMg-水反应生成的活性中间物质 (eaq− 和/或H·) 还原:1)Mg与水反应生成活性中间物质I:Mg + H2O → Mg2+ + I;2)Cr(VI) 与活性中间物质I反应生成Cr(III):Cr(VI) + I → Cr(III);3)同时活性中间物质I与另一种活性物质S反应可以生成氢气:I + S → H2。
ZVMg也能高效处理水中硝酸盐,MIRABI et al[36]发现用Mg/AC可以完全去除水中硝酸盐,而且在相同实验条件下,Mg/AC体系对硝酸盐的去除效率显著优于Fe/AC。ILERI et al[9]通过超声活化ZVMg还原水中硝酸盐,发现单独超声或单独ZVMg均不能有效降低硝酸盐的浓度,但两者联合可将50 mg/L的NO3-N在60 min内降解90%以上,降解产物主要是亚硝酸盐和氮气,并且可以通过增加超声功率或ZVMg剂量提高亚硝酸盐转化成氮气的比例。
-
溶液中背景电解质对ZVMg腐蚀或溶解的影响主要分为抑制和促进作用[57]。在溶液pH为10~11条件下,Mg在不同电解质溶液中的腐蚀速率为NaCl > Na2SO4 > MgSO4 > NaIO4;并且Mg在Na2SO4溶液中的腐蚀速率要比在MgSO4溶液中低2个数量级,这可能是由于Na2SO4能促进ZVMg表面形成Mg(OH)2氧化膜的缘故[31]。
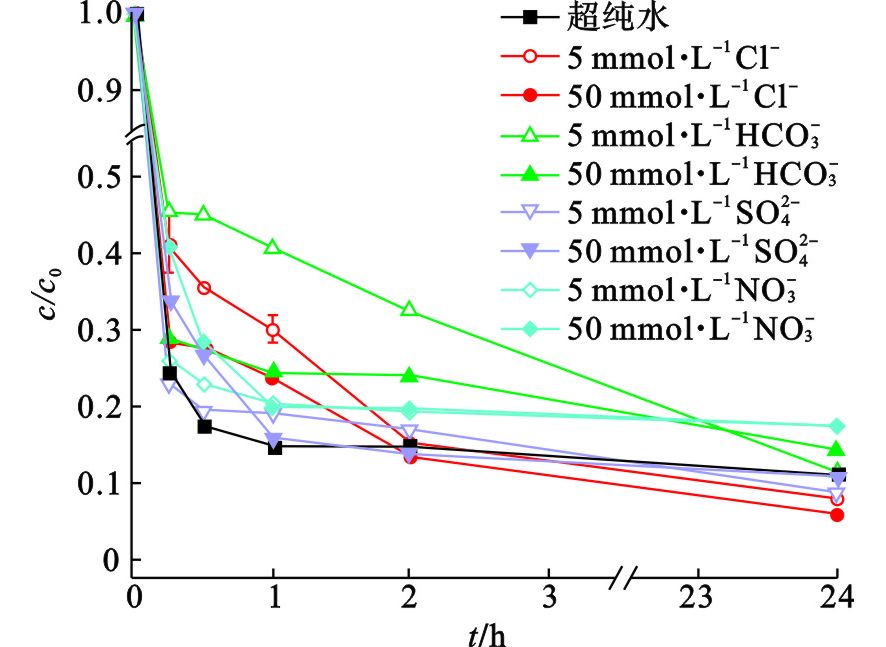
AGARWAL et al[39]利用Mg/Pd降解2-氯联苯时也考察了不同阴离子对降解速率的影响,见图7。在Mg/Pd投加量为4 g/L,2-氯联苯初始浓度为4 mg/L,阴离子浓度为50 mmol/L条件下,研究发现醋酸根 (CH3COO−)、氯离子 (Cl−)、碳酸氢根 (HCO3−)和磷酸一氢根 (HPO32−)均可作为质子供体增强Mg/Pd的腐蚀性;而乙二胺四乙酸 (EDTA)、硫酸根 (SO42−) 和磷酸二氢根 (H2PO3−) 分别与2-氯联苯溶液共存时,则表现为先促进后抑制的作用。这是由于EDTA作为螯合剂容易与Mg2+结合,因而最初能降低Mg(OH)2膜的形成,增强ZVMg的腐蚀性,但是EDTA可能迫使过多ZVMg进入溶液,反而降低了Mg对2-氯联苯的降解速率。SO42−是一种弱腐蚀剂,一般被认为能够加速ZVMg的腐蚀,但该研究中,SO42−可能导致ZVMg表面形成了较厚的氧化膜,正如BARIL et al[33]发现将Mg浸入0.1 mol/L的Na2SO4溶液3.5 h,ZVMg表面形成了较厚的膜,但这层孔隙性较好的膜没有完全抑制ZVMg的腐蚀,因而说明SO42−最初促进了ZVMg腐蚀,但随着膜增厚而逐渐降低腐蚀速率。NO3−的存在也会降低2-氯联苯的脱氯速率,因为NO3−可以与污染物竞争电子,被还原为NH4+。
魏鹏刚等[21]也考察了不同阴离子 (Cl−、HCO3−、SO42−和NO3−) 对ZVMg/C降解TCE的影响,见图8。在高浓度 (50 mmol/L) 或低浓度 (50 mmol/L) 共存阴离子溶液中,ZVMg/C降解TCE的反应速率在前2 h内均受到不同程度的抑制作用,但2 h后又呈现出不同的影响趋势,可分为促进、抑制和无影响3种作用,且同种离子在不同浓度下对TCE降解的影响程度也有差异。具体来说,Cl−具有先抑制后促进作用;而SO42−对ZVMg的腐蚀影响较小;HCO3−和NO3−则具有明显的抑制作用。但是也有研究发现共存Cl−对Mg/Pd降解五氯酚速率有明显的抑制作用[14]。因此,与阴离子对ZVI降解污染物的影响类似,不同阴离子对金属还原剂的腐蚀影响并不完全一致,这可能取决于离子-金属-污染物三者的共同作用。
-
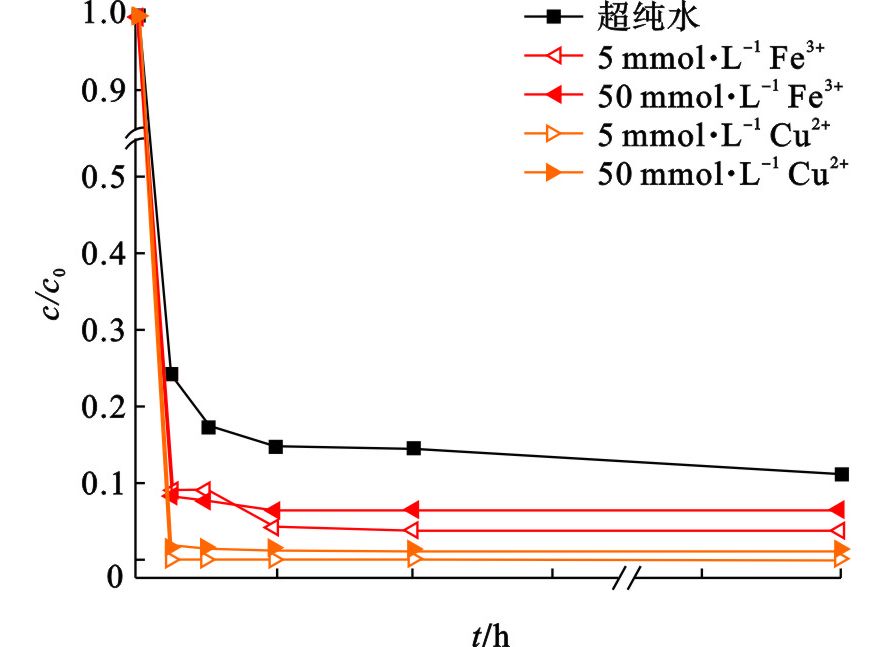
魏鹏刚等[21]研究了水溶液中不同浓度的Fe3+和Cu2+与TCE共存时对其降解的影响,发现两者均可以提高ZVMg的还原活性。相比于对照实验,TCE的降解率从原来的89%分别提升至94%~96%和99%~100%,见图9,说明共存金属阳离子对ZVMg起到了催化活化作用,提高了ZVMg的利用率[11, 48];而且共存Cu2+能够使TCE在15 min内被完全降解,比共存Fe3+的反应速率更快,这主要是由于Mg/Cu的电势差 (2.71 V) 高于Mg/Fe (1.93 V)[3],对Mg的催化效果更显著。并且,双金属形成有利于降低整个反应体系的pH (<10.5),这将抑制Mg(OH)2的沉淀,进而减缓了ZVMg表面的钝化作用。因此,溶液中共存的过渡金属阳离子能优先被ZVMg原位还原并对Mg起到化学催化作用,显著提高ZVMg的还原活性。
-
ZVMg材料虽然在环境修复领域具有较大的应用潜力,对多种难降解污染物具有较高的还原去除效率,但仍有许多关键科学问题亟待解决。
(1)ZVMg与水的腐蚀-钝化作用显著影响ZVMg与污染物的相互作用,但该过程对ZVMg降解污染物的长期作用机制目前尚不十分清楚。
(2)ZVMg与环境持久性难降解污染物的相互作用机理及关键影响因素有待进一步研究,尤其是ZVMg的强还原作用对地下水中高浓度、高异质性和高复合有机污染物的去除效果尚不可知,对相关作用机制的认知还处于空白。
(3)在特定环境条件下,水化学成分与ZVMg的相互作用及其对污染物降解的构-效关系研究目前还很缺乏,关于ZVMg在水环境中的老化作用和对污染物的长效机制及其对生态环境的长期影响尚未见报道。
(4)地下水是一个复杂的环境体系,涉及地下水、地层结构、地球化学和水化学等多种特征的综合作用,因此地下水污染修复不仅仅是修复材料在水溶液中对污染物的处理或降解。ZVMg材料在降解污染物的处理工艺、批量生产、与修复技术和设备上的匹配和工程应用方面还需要大量的基础研究和实践探索。
-
ZVMg作为一种绿色高效的还原材料,相比于ZVI,具有反应活性更高,表面不易钝化、在空气中更稳定和制备工艺简单等特点,已经被证明对多种难降解污染物具有很好的去除效果,在环境污染修复领域中具有重要的应用潜力,但ZVMg在水溶液中的化学稳定性、使用安全性和长效机制还有待于进一步研究,未来实际应用的可能性还需要大量验证工作。ZVMg材料的研发、改性和降解污染物机理研究和工程化应用,以及材料对生态环境的影响研究将成为未来研究的重点。ZVMg材料的研发应用,或将成为ZVI修复材料的替代产品,为地下水污染的绿色可持续修复提供先进理论基础和关键技术储备。
零价镁材料在环境修复领域的研究进展
Research progresses of zero-valent magnesium application in environmental remediation
-
摘要: 零价镁(ZVMg)金属化学活性强,在空气中易稳定保存,是一种环境友好的高效还原型修复材料,对多种有机污染物和重金属具有很好的去除效果,具有较大的环境修复应用潜力。文章综述了近20年来 ZVMg对环境污染物去除的研究进展,重点阐述了ZVMg材料的还原特性、制备方法及其对污染物的去除效率和反应机理,指出了目前ZVMg材料应用于环境修复所面临的问题与挑战,并展望了未来ZVMg在污染场地治理领域的研究方向和应用前景。Abstract: Zero-valent magnesium (ZVMg) is an environment-friendly and efficient reductant with a high reactivity and a good stability in the atomsphere. It has an excellent performance on the removal of numerous organic and heavy metal pollutants, and a great application potential in the environmental remediation. This paper reviews on the research progresses of ZVMg to remove environmental pollutants in the past 20 years, focusing on ZVMg’s reducing characteristics and preparation methods, pollutants removal efficiency and reaction mechanisms. Accordingly, the present difficulties and challenges on the application of ZVMg in the field of the environmental remediation are highlighted. Future research areas and application prospects for the utilization of ZVMg-based materials in the environmental remediation are also prospected.
-
随着长三角地区经济的快速发展,太湖流域水环境污染问题日益严重,引起了国内外的广泛关注[1-2]。由于目前工业点源污染被逐步严格控制,非点源污染已经成为当前水环境污染的最主要来源[3]。
非点源污染的影响因素很多,由于人类活动对土地利用产生较大的影响,使得土地利用成为影响非点源污染的关键因素[4]。土地利用方式及其程度的改变与非点源污染密切相关,其中农业用地及林地与其关系最为密切。研究表明雨季的农田排水是造成水体富营养化的主要原因[5],林地则对非点源污染具有显著的截留作用[6]。对于流域非点源污染控制的计算手段中,目前常采用SWAT模型对流域非点源污染进行模拟。NIRAULA et al[7]应用SWAT模型模拟阿拉巴马州某流域月时间尺度的径流、泥沙和污染物负荷,并识别污染的关键区域。MAANAN et al[8]研究了Oualidia lagoon地区土地利用方式对湖泊污染的影响,认为林地对非点源污染物在一定程度上有很大程度的削减作用。宋林旭等[9]将SWAT模型与GIS平台相结合,对三峡库区香溪河流域径流、营养盐输出模拟,认为径流和营养盐负荷受降雨影响呈正相关关系,且在丰水年和丰水季节较大,支流总氮(TN)、总磷(TP)输出空间差异大。马广文等[10]通过SWAT模型对鄱阳湖流域2003~2012年入湖的径流、泥沙和非点源氮磷污染负荷进行了模拟,并识别了流域氮磷污染削减的关键时期。张婷等[11]基于实测水文水质数据,采用SWAT模型和SUFI2算法,模拟了滦河潘家口水库非点源氮磷流失变化情况并进行相关性分析,结果表明TN、TP负荷量从大到小排序依次为耕地、林地、草地和荒地。
太湖流域经济发达,人口密集,河网复杂。快速的城镇化进程导致土地利用类型发生了较大转变[12]。同时农业生产生活释放出大量的氮和磷,导致流域生态环境污染负荷日益加重,直接或间接地影响流域的水环境质量[13]。
本研究借助SWAT模型,通过输入土地利用数据和逐日气象数据模拟研究区内1980~2018年时间尺度非点源氮磷负荷变化,并分析该区域不同土地利用类型对非点源氮磷负荷变化贡献及特征。研究可为太湖流域非点源污染控制和治理提供理论支撑。
1. 研究区概况
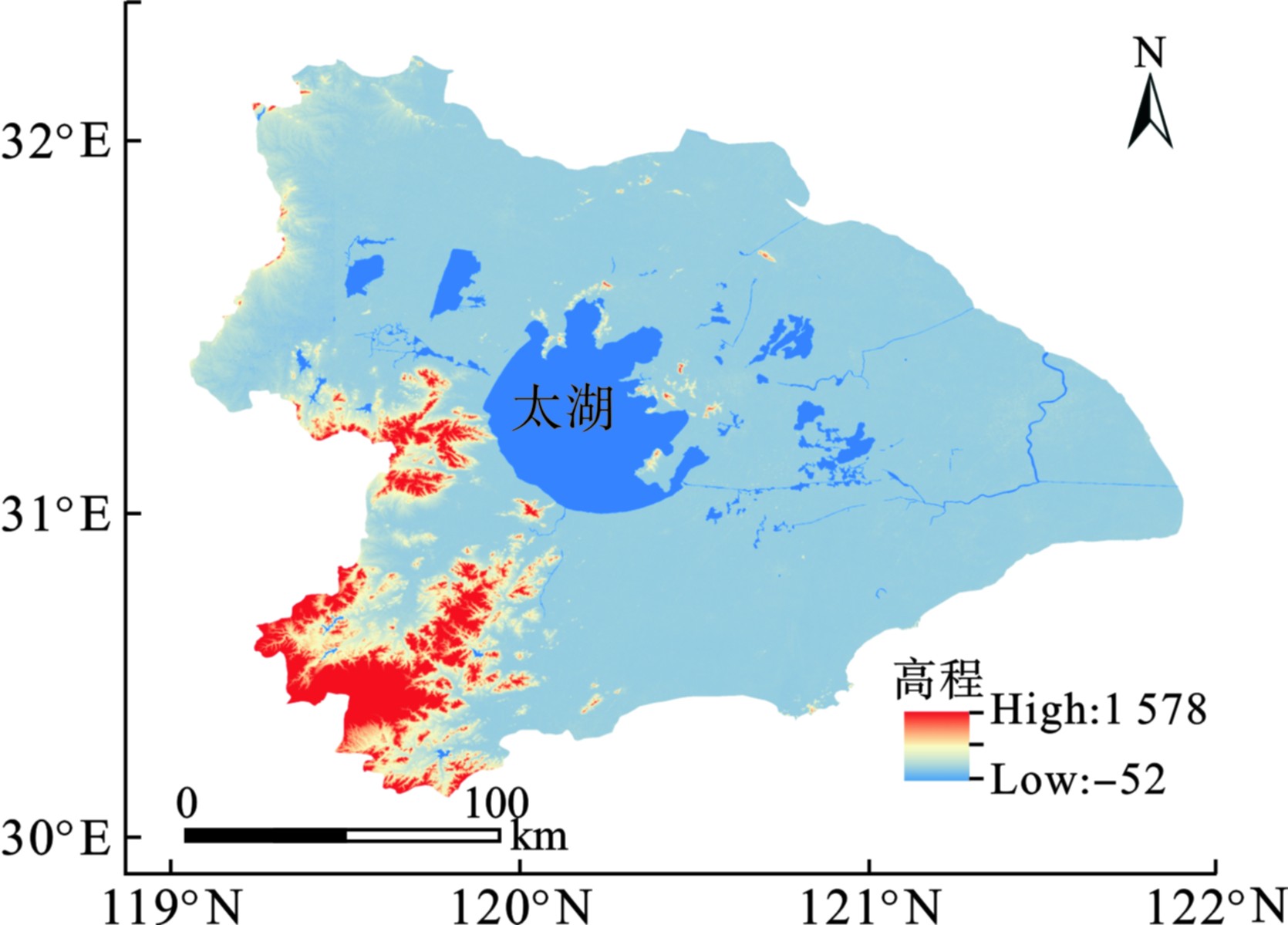
太湖流域地处我国东部长江河口段南侧与钱塘江、杭州湾之间,北滨长江,南滨钱塘江,东临东海,西以天目山、茅山等山区为界,流域总面积约36 800 km2。地形特点为地势周边高、中间低,呈现碟状分布,山区区域高程大约为200~500 m,丘陵区域高程大约为12~32 m,中部平原区域高程一般低于5 m,沿江滨海平原区域高程一般在5~10 m。流域河网分布如织,湖泊星罗棋布,河道狭长,水系干线总长120 000 km,上游水系有苕溪、南溪和洮滆水系等,经望虞河、太浦河等大江水闸流出,与长江、黄浦江水道相通。流域最主要土地利用类型为耕地,主要农作物耕作类型为水稻、小麦和其他经济作物[14-17]。太湖流域地理位置,见图1。
2. 土地利用变化分析
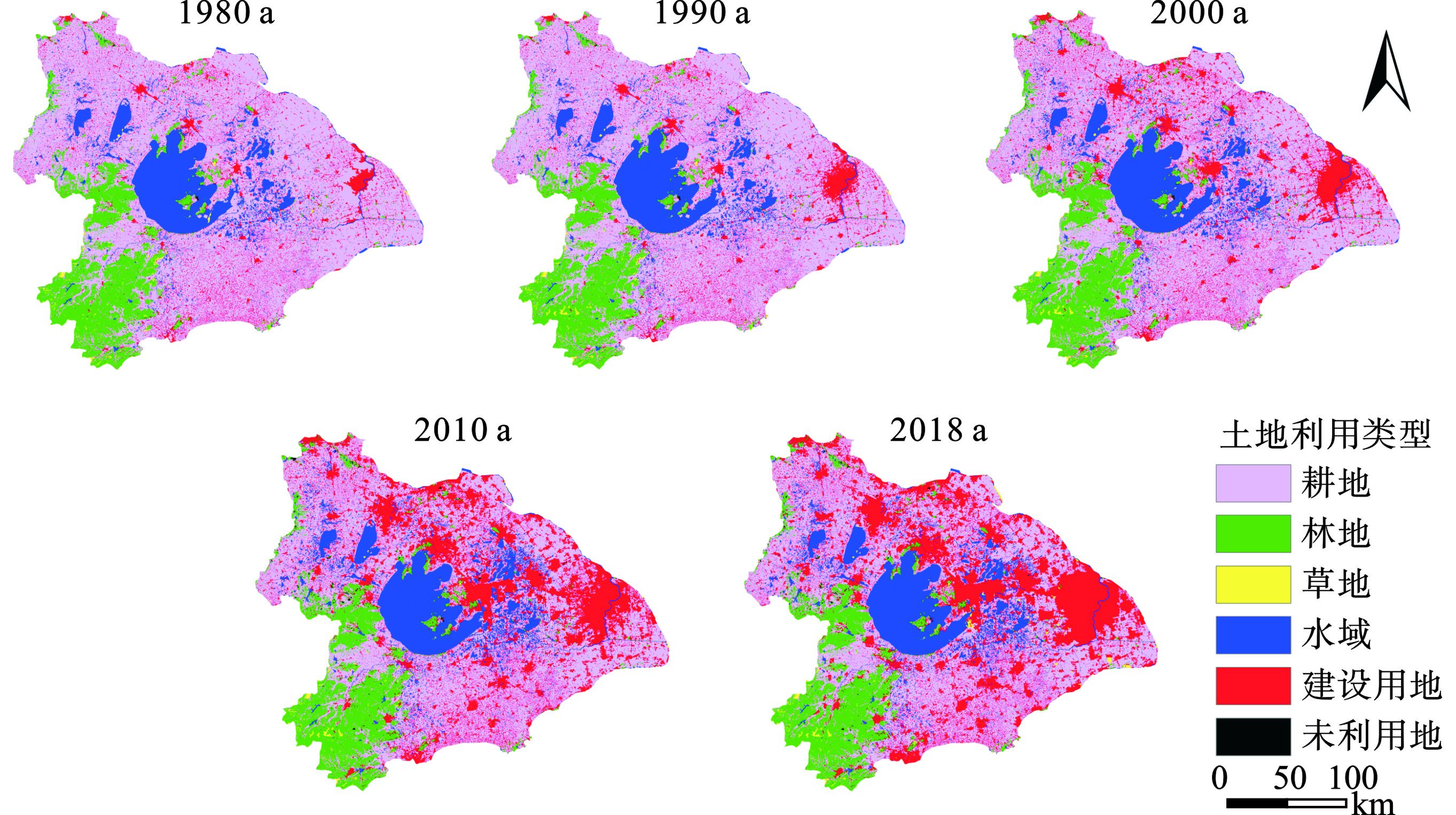
土地利用变化是影响区域环境变化的重要指标[18],土地利用方式与非点源污染氮磷负荷密切相关[19]。本研究运用ENVI 5.1软件中的监督分类工具对1980、1990、2000、2010和2018年5期太湖流域的遥感影像进行解译和重分类,结合Arcgis 10.5软件calculate工具分别得到1980、1990、2000、2010和2018年的太湖流域不同土地利用类型数据。本研究按照《土地利用现状分级分类标准》将研究区域土地利用分为6种,分别为:耕地、林地、草地、水域、建设用地和未利用地。太湖流域1980、1990、2000、2010和2018年土地利用类型,见图2。
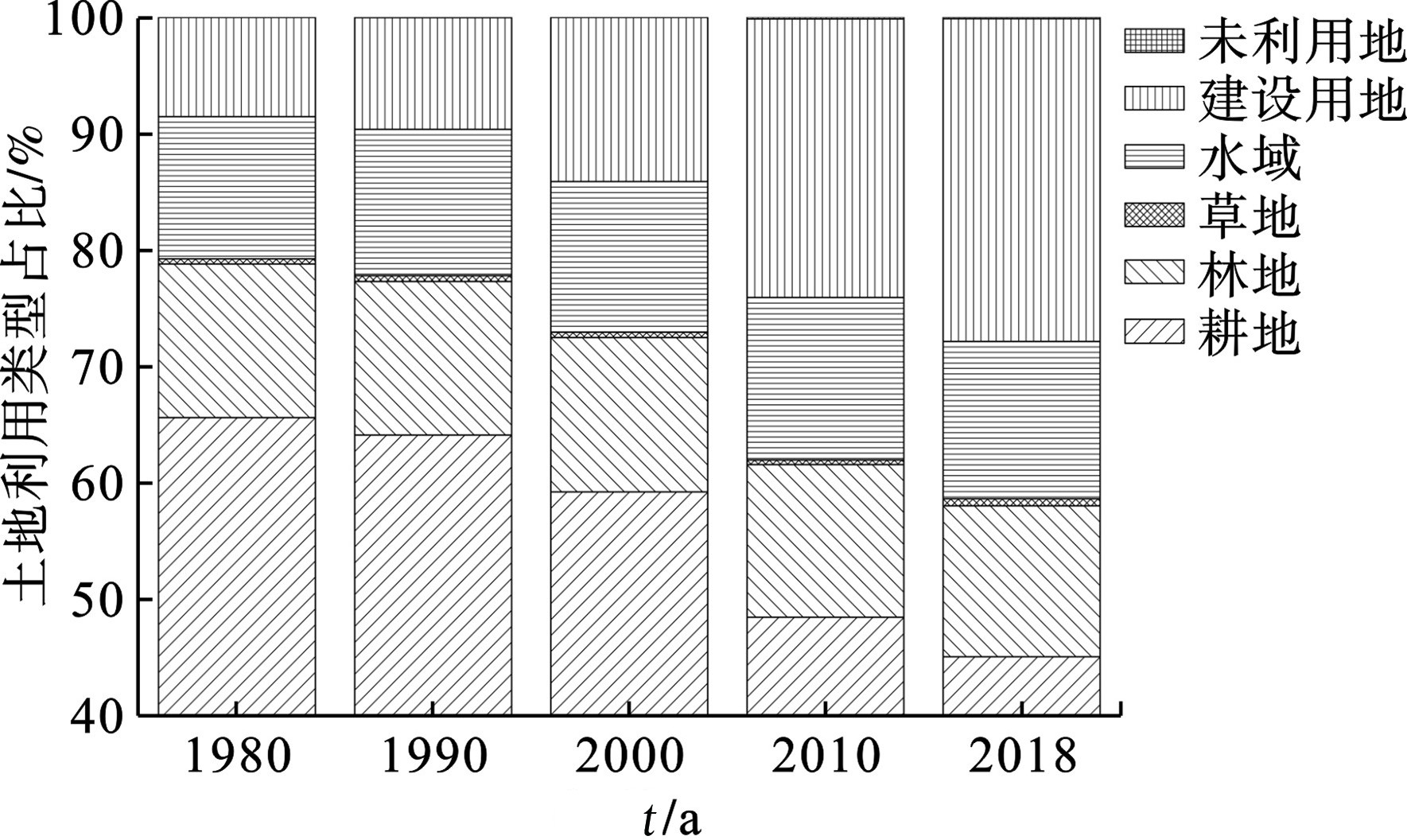
对太湖流域1980、1990、2000、2010和2018年6大土地利用类型面积占比进行统计,流域土地利用结构,见图3。
图2和图3可知,太湖流域1980~2018年主要土地利用类型为耕地,5个年度均占45%以上;草地和未利用地面积小,不足流域面积的1%。1980~2018年太湖流域土地利用变化明显,草地、建设用地和未利用地增长最多,分别为34.5%、225.4%和278.9%;林地和耕地分别减少1.7%和31.2%。
对太湖流域1980~2018年土地利用面积变化情况进行统计,得到土地利用转移矩阵,见表1。
表 1 1980~2018年太湖流域土地利用转移矩阵km2 土地利用类型 草地 耕地 建设用地 林地 水域 未利用地 1980年合计 草地 140.07 6.17 15.65 41.32 15.73 1.69 220.64 耕地 67.31 21 905.09 9 353.69 236.45 1 025.41 16.27 32 604.21 建设用地 3.24 224.24 3 967.40 8.01 22.59 0.81 4 226.29 林地 54.02 110.57 193.07 6 132.30 19.90 29.24 6 539.10 水域 32.16 175.48 225.22 7.56 5 613.76 0.53 6 054.71 未利用地 0.06 0.24 2.08 0.86 1.75 10.61 15.61 2018年合计 296.86 22 421.80 13 753.10 6 426.51 6 699.14 59.15 注:土地利用转移矩阵表示某种土地利用类型转变为其他类型时面积的变化量。 表1可知,太湖流域1980~2018年土地转变较剧烈,土地转变总面积11 887.3 km2,占流域总面积的23.9%。其中耕地转变面积最大,占变化总量的90%;未利用地、耕地和草地参与其他土地利用转变率最高,转变量分别占1980年未利用地、耕地和草地的32.0%、32.8%和36.5%。土地利用转变过程中,耕地主要向建设用地转变;未利用地主要向水域和建设用地转变;草地主要向水域和林地转变。
3. SWAT模型构建与运行结果
3.1 模型建立
SWAT(soil and water assessment tool)模型是由美国农业部开发的用于模拟流域水文过程的一款分布式水文模型。模型建立所需的数据包括空间数据和属性数据2部分。空间数据主要包括数字高程模型数据(digital elevation model,DEM)、土地利用类型数据、土壤类型数据、水系数据、水文监测数据,并将数据统一为相同的地理坐标和投影。本文采用的地理坐标系是WGS84坐标,投影方式采用墨卡托投影;属性数据主要包括土壤理化性质数据、气象数据和农作物管理数据。研究中所使用的数据来源及基本情况,见表2。
表 2 模型主要输入数据数据类型 数据描述 数据来源 数字高程模型 30 m×30 m数字高程模拟地形图 地理空间数据云 土地利用 中国30 m×30 m土地利用数据库 中国科学院地理科学与资源研究所 土壤数据 1∶100万土壤类型分布、土壤理化属性 世界土壤数据库HWSD V1.2数据集 气象数据 气象站分布、降雨、气温、风速、相对湿度和太阳辐射数据 CFSR气象数据库 水文数据 2008~2018年兰山嘴站径流 水利部太湖流域管理局 农业管理数据 农作物种类、施肥方式和时间等 统计年鉴、农业年鉴和调查数据 由于太湖流域河网复杂,为提高数字河网的准确性,本文采用burn-in算法,将流域实际河网输入到模型中。同时在综合考虑河网划分的准确性和子流域数量的前提下,将河道阈值面积定义为5 000 hm2,将研究区域划分为472个子流域。然后在模型中输入重分类后的土地利用类型数据和土壤类型数据,其中土壤类型数据包括物理属性和化学属性,参照SWAT模型土壤数据库建库方法[20]计算后分别存放在SWAT用户数据库(usersoil)和SWAT土壤输入文件(.chm)中。并对坡度进行划分。同时定义土地利用、土壤和坡度的划分阈值分别为面积的15%、5%和10%。最终将流域划分为3 205个水文响应单元。最后输入气象数据、土壤理化属性数据和农业管理数据,完成模型的构建。
3.2 参数敏感性分析及模型率定
采用SWAT-CUP中的SUFI-2算法对模型进行敏感性分析和参数率定,使用决定系数
R2 R2 R2 R2=(n∑i=1(Qobsi−Qobsavg)(Qsimi−Qsimavg))2n∑i=1(Qobsi−Qobsavg)2n∑i=1(Qsimi−Qsimavg)2 (1) Nash-Suttcliffe效率系数
Ens Ens=1−n∑i=1(Qobsi−Qsimi)2n∑i=1(Qobsi−Qobsavg)2 (2) 式中,
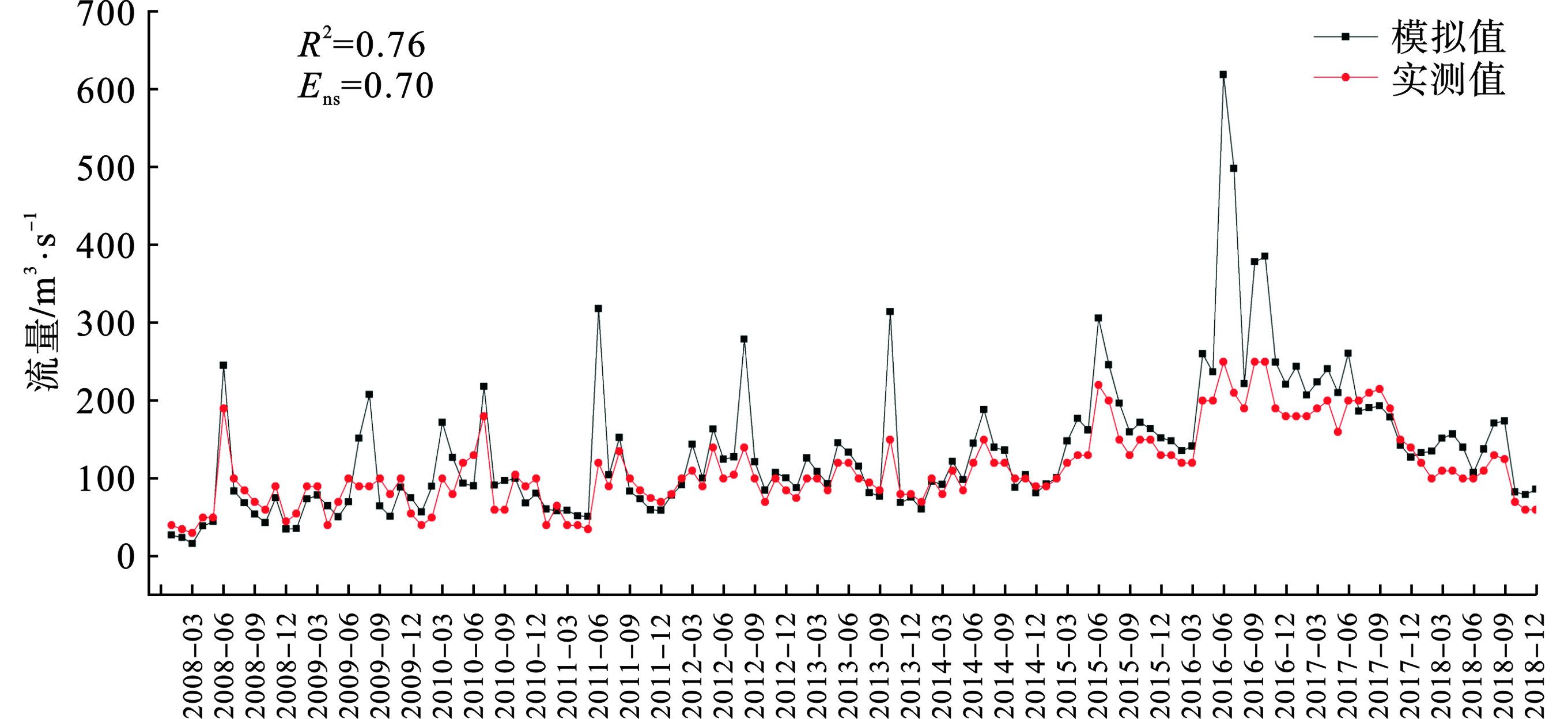
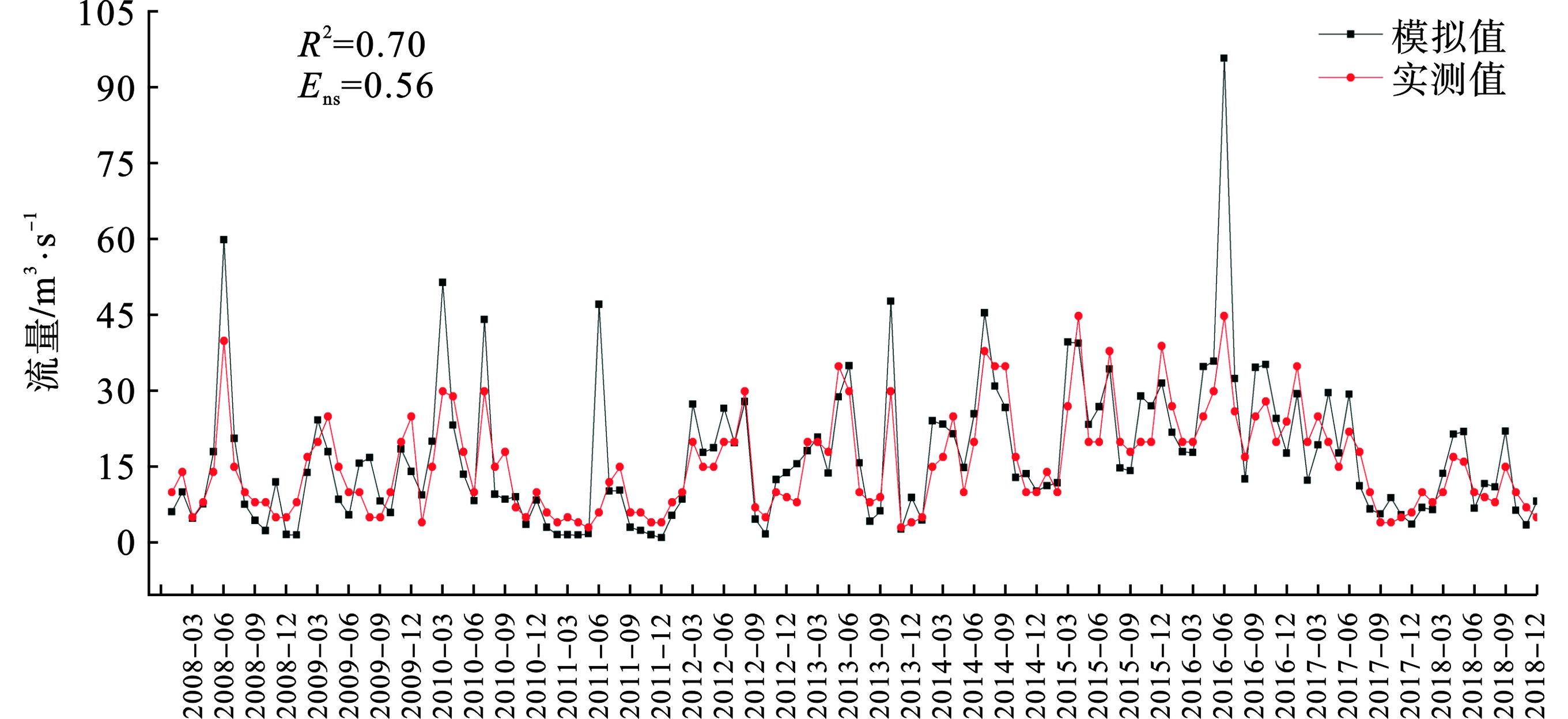
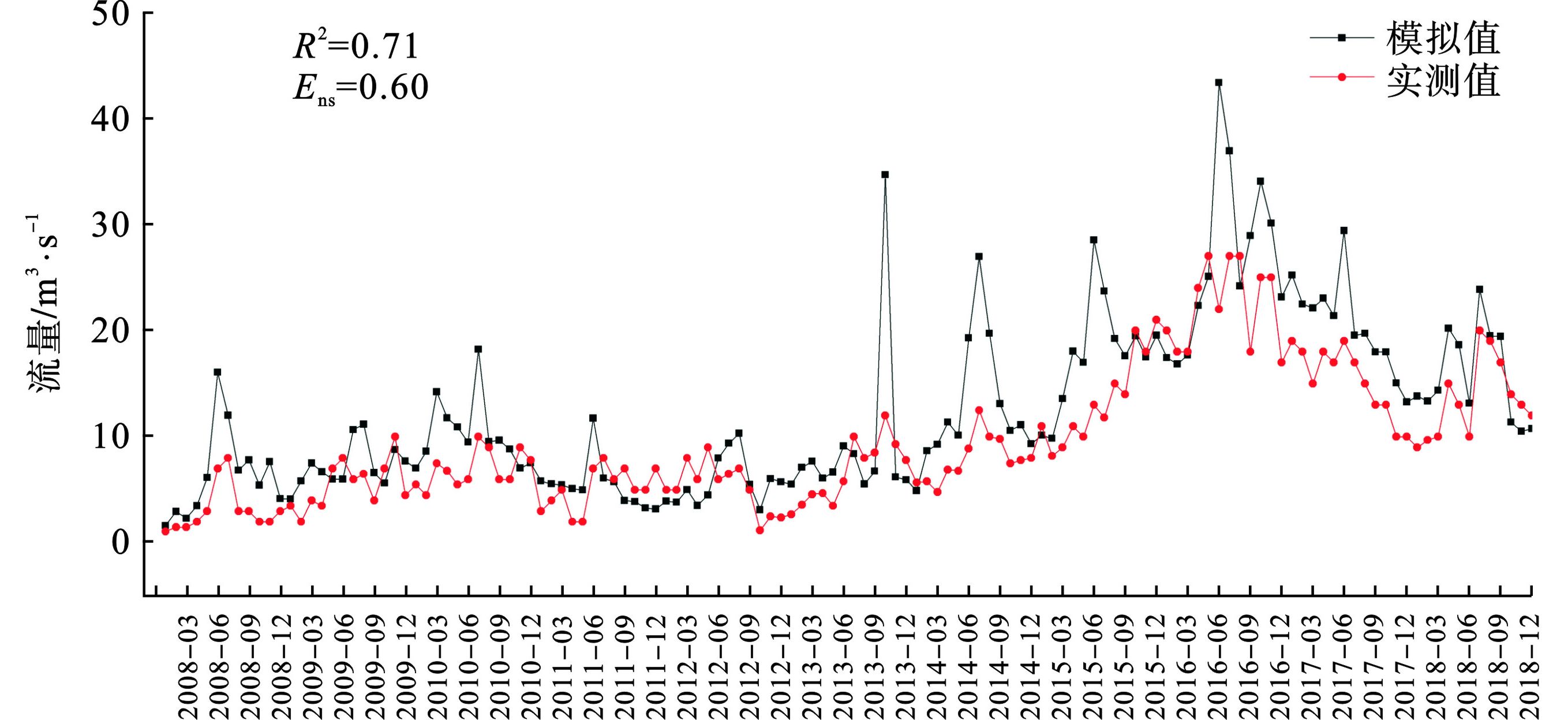
Qobsi Qsimi Qobsavg Qsimavg 采用2008~2018年兰山嘴水文站、王江泾水文站和急水港水文站实测径流资料进行模型的率定和验证,结果表明径流实测值与模拟值的吻合程度较好,
R2和Ens 表 3 模拟参数敏感性排序和参数最佳取值-兰山嘴站参数名称 参数意义 P-Value t-Stat 敏感性排序 修改方案 最佳值 GW_DELAY 地下水延迟系数 0.00 6.25 1 v 292.50 CN2 径流曲线数 0.01 −3.46 2 r −0.19 SOL_BD 土壤湿容重 0.03 −2.88 3 r −0.20 SOL_AWC 土壤有效含水 0.05 2.51 4 r 0.30 SOL_K 土壤饱和导水率 0.08 −2.12 5 r −0.44 SFTMP 降雪基温 0.23 1.35 6 v −2.25 ALPHA_BNK 河岸调蓄的基流α因子 0.27 −1.20 7 v 0.48 GWQMN 浅层地下水径流系数 0.38 0.94 8 v 0.15 CH_K2 主河道河床有效水利传导度 0.39 0.93 9 v 108.13 ALPHA_BF 基流回退系数 0.43 −0.84 10 v 0.03 GW_REVAP 浅层地下水再蒸发系数 0.46 0.79 11 v 0.14 ESCO 土壤蒸发补偿因子 0.92 0.10 12 v 0.94 CH_N2 主河道曼宁系数 0.94 −0.07 13 v 0.29 注:r表示原参数乘以(1+率定值);v表示用率定值替换原参数值。 表 4 模拟参数敏感性排序和参数最佳取值-王江泾站参数名称 参数意义 P-Value t-Stat 敏感性排序 修改方案 最佳值 SOL_AWC 土壤有效含水 0.00 −5.76 1 r −0.19 SOL_BD 土壤湿容重 0.00 4.99 2 r 0.24 GW_DELAY 地下水延迟系数 0.01 −3.76 3 v 61.50 CN2 径流曲线数 0.15 −1.66 4 r −0.11 GWQMN 浅层地下水径流系数 0.31 1.11 5 v 1.95 ALPHA_BNK 河岸调蓄的基流α因子 0.32 −1.08 6 v 0.38 SOL_K 土壤饱和导水率 0.38 0.95 7 r 0.20 ESCO 土壤蒸发补偿因子 0.46 −0.80 8 v 0.97 GW_REVAP 浅层地下水再蒸发系数 0.58 −0.58 9 v 0.05 ALPHA_BF 基流回退系数 0.60 0.55 10 v 0.28 SFTMP 降雪基温 0.74 −0.35 11 v −0.25 CH_K2 主河道河床有效水利传导度 0.78 −0.29 12 v 14.38 CH_N2 主河道曼宁系数 0.88 0.16 13 v 0.05 3.3 模型运行结果
将率定后的参数输入SWAT模型,对太湖流域非点源氮磷输出进行模拟,对模拟的结果,主要从时间变化和空间分布上分析氮磷输出规律和特征。
3.3.1 非点源氮磷负荷时间变化特征
读取模型结果对TN、TP负荷年际变化进行统计,见表7。
表 7 TN、TP负荷总量万t t/a TN负荷 TP负荷 1980 9.95 2.60 1990 6.72 1.15 2000 9.08 1.43 2010 7.38 1.15 2018 5.89 0.83 表7可知,1980年TN、TP负荷量分别为9.95和2.60万吨;2018年TN、TP负荷量分别为5.89和0.83万吨,总体上分别以−61.3 和−42.1 t/a的幅度呈现下降趋势,下降总量分别为4.06和1.77万t,TN下降总量更多;从污染物下降速率来看,TP下降速率是TN的2.5倍,TP负荷削减得更快。从年际变化趋势来看,TN、TP负荷量在20世纪80年代下降趋势最明显,1980~1987年间负荷总量分别下降6.31和1.98万吨,年均变化率分别达到9.4%和10.9%;20世纪90年代略有上升,1990~2000年间负荷总量分别上升2.05和0.28万吨,年均变化率为3.4%和2.5%;2000~2018年负荷量平稳下降,负荷总量分别下降2.54和0.60万吨,年均变化率分别是1.7%和2.3%。
3.3.2 非点源氮磷负荷空间分布特征
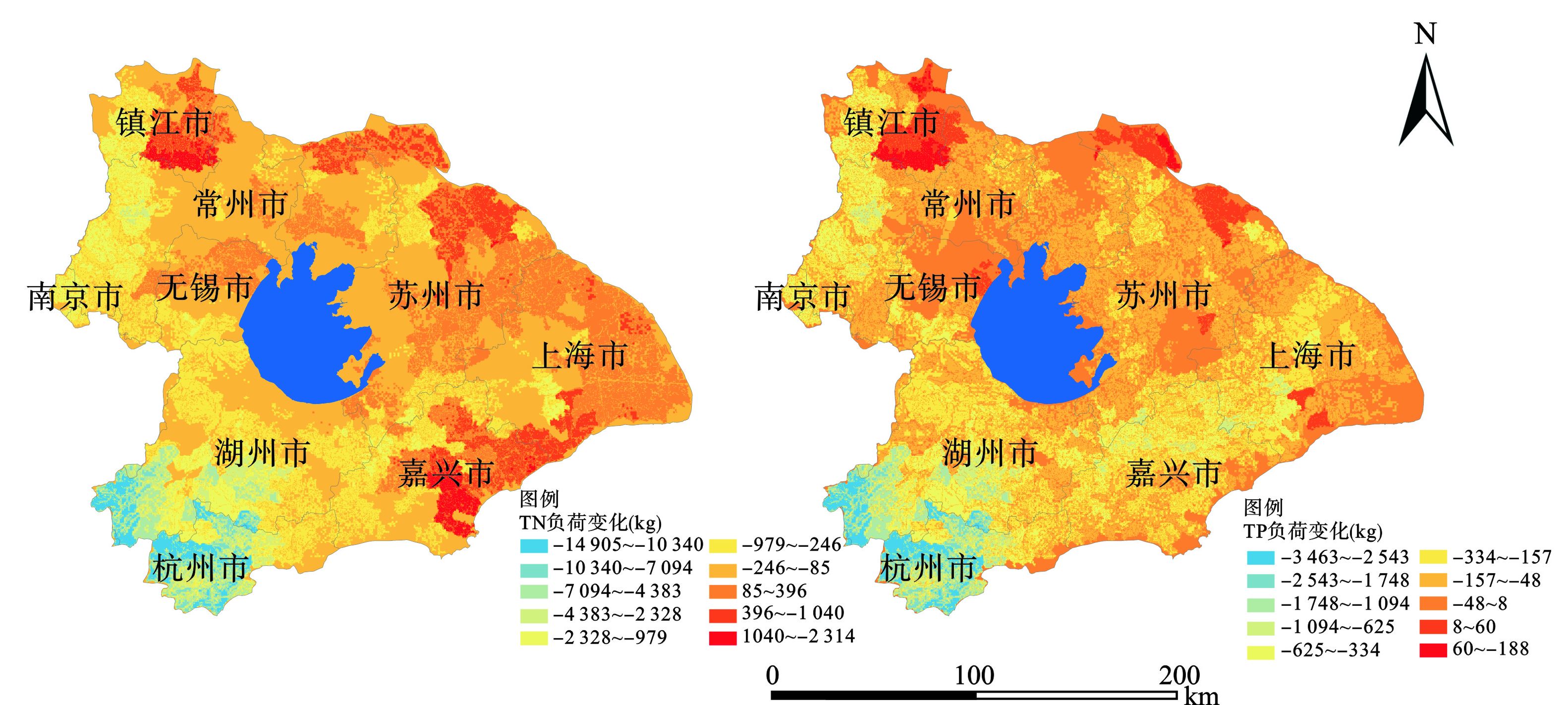
为了精细化评估流域非点源污染变化情况,对全流域进行栅格化处理,栅格大小1 km×1 km。在Arcgis软件中,将栅格化后的流域图依次与SWAT模型结果中包含非点源污染物的Watershed数据以及1980年、2018年土地利用数据进行处理,得到流域1980~2018年非点源氮磷负荷变化情况,正值表示污染物负荷增加,负值表示削减,见图7。
图7可知,TN、TP污染物负荷变化空间分布上表现较为一致,均是西北高、西南低的特点。研究期间,TN、TP污染负荷变化量在不同地区差异较大:TN、TP负荷增加量在镇江地区最高,且由北向南逐渐增加;TN、TP负荷削减量在杭州和湖州地区最高,且由北向南逐渐增加。
4. 非点源氮磷负荷变化对土地利用变化的响应
将6种土地利用类型对1980~2018年污染负荷变化量的贡献大小进行统计,见表8。
表 8 不同土地利用方式变化对TN、TP负荷变化量的贡献% 土地利用类型 TN负荷 TP负荷 耕地 27.31 47.63 林地 67.07 39.15 草地 1.99 1.20 水域 1.91 3.64 建设用地 1.70 8.37 未利用地 0.02 0.01 表8可知,对于TN污染负荷变化量来说,各土地利用类型的贡献率从大到小依次为:林地、耕地、草地、水域、建设用地和未利用地;对于TP污染负荷变化量来说,各土地利用类型的贡献率从大到小依次为:耕地、林地、建设用地、水域、草地和未利用地。对TN、TP负荷变化量的贡献率最高的地类均是耕地和林地,分别为94.38%和86.78%,其中林地对TN负荷变化影响更大,耕地对TP负荷变化影响更大。
TN、TP负荷变化转移矩阵表示某种土地利用类型发生转变的过程中污染负荷的变化量,正值表示污染负荷增加,负值表示污染负荷削减,见表9和表10。
表 9 TN负荷变化转移矩阵t 土地利用类型 草地 耕地 建设用地 林地 水域 未利用地 合计 草地 −647.81 −9.85 −15.84 −329.55 −3.09 −0.90 −1 007.03 耕地 −5.80 −9 808.98 −149.88 −769.92 −313.56 −7.79 −11 055.93 建设用地 −1.32 −42.29 −627.49 −12.60 −4.39 −0.42 −688.49 林地 −236.28 −53.46 −215.64 −26 268.70 −25.02 −48.36 −26 847.46 水域 −11.00 −52.43 −1.20 −9.63 −699.59 0.02 −773.84 未利用地 −0.07 −0.17 −0.26 −0.69 −0.08 −3.90 −5.17 表 10 TP负荷变化转移矩阵t 土地利用类型 草地 耕地 建设用地 林地 水域 未利用地 合计 草地 −171.02 −3.03 −4.79 −36.48 −1.38 −0.36 −217.06 耕地 −12.45 −6 324.35 −240.65 −1 839.45 −210.60 −3.88 −8 631.38 建设用地 −0.85 −4.06 −942.76 −563.54 −5.19 −0.21 −1 516.62 林地 −62.16 −97.09 −77.99 −6 835.72 −8.07 −14.06 −7 095.09 水域 −5.07 −41.01 −36.56 −3.08 −572.93 −0.10 −658.74 未利用地 −0.02 −0.07 −0.18 −0.23 −0.06 −1.74 −2.30 表9和表10可知,1980~2018年间,太湖流域某种土地利用类型转换为其他类型过程中,TN、TP负荷总体处于削减状态,削减总量分别约为1 431.16 t和2 577.8 t。某种土地利用类型转变为其他土地利用类型过程中,对TN、TP的削减程度不同。对于TN来说,耕地转为林地、草地转为林地时削减量最高,分别占地类转化TN削减总量的62.54%和26.77%;对于TP来说,耕地转为林地、建设用地转为林地时削减量最高,分别占地类转化TP削减总量的71.36%和21.86%。可见,耕地是影响流域非点源氮磷负荷量的最大的土地利用类型,林地则能有效削减氮磷负荷量。
表 5 模拟参数敏感性排序和参数最佳取值-急水港站参数名称 参数意义 P-Value t-Stat 敏感性排序 修改方案 最佳值 GW_DELAY 地下水延迟系数 0.00 6.75 1 v 355.50 CN2 径流曲线数 0.01 −3.99 2 r −0.17 SOL_AWC 土壤有效含水 0.02 3.11 3 r 0.36 SOL_K 土壤饱和导水率 0.34 −1.03 4 r 0.76 ESCO 土壤蒸发补偿因子 0.35 −1.02 5 v 0.89 SFTMP 降雪基温 0.41 0.89 6 v 1.75 SOL_BD 土壤湿容重 0.48 −0.76 7 r −0.31 ALPHA_BNK 河岸调蓄的基流α因子 0.49 −0.72 8 v 0.73 CH_K2 主河道河床有效水利传导度 0.50 0.71 9 v 26.87 CH_N2 主河道曼宁系数 0.52 −0.68 10 v 0.20 GW_REVAP 浅层地下水再蒸发系数 0.65 0.48 11 v 0.03 GWQMN 浅层地下水径流系数 0.65 0.47 12 v 1.45 ALPHA_BF 基流回退系数 0.99 −0.01 13 v 0.13 表 6 各水文站径流模拟结果水文站名 月平均流量/ m3⋅s−1 R2 Ens 实测值 模拟值 兰山嘴 112.65 136.83 0.76 0.70 王江泾 15.80 17.16 0.70 0.56 急水港 9.56 12.54 0.71 0.60 5. 结论
(1)从土地利用情况来看,太湖流域1980~2018年主要土地利用类型为耕地,占比45%以上;土地转变较剧烈,土地转变总面积11 887.3 km2,其中耕地转变面积最大,占变化总量的90%,耕地主要向建设用地转变。
(2)从TN、TP污染物负荷总量年际变化特征来看,1980年和2018年负荷总量分别为9.95万吨、2.60万吨和5.89万吨、0.83万吨,TN、TP分别以−61.3 t/a和−42.1 t/a的幅度呈下降趋势,TN下降总量更高、TP下降速率更高。
(3)从TN、TP污染物变化空间分布特征来看,TN、TP污染物负荷变化空间分布上表现较为一致,均是西北高、西南低的特点。TN、TP污染负荷变化量在不同地区差异较大:TN、TP负荷增加量在镇江地区最高,且由北向南逐渐增加;TN、TP负荷削减量在杭州和湖州地区最高,且由北向南逐渐增加。
(4)各土地利用类型对TN负荷变化贡献率从大到小依次为:林地、耕地、草地、水域、建设用地和未利用地;对TP负荷变化的贡献率从大到小依次为:耕地、林地、建设用地、水域、草地和未利用地。
(5)耕地是影响非点源氮磷负荷量的最大的土地利用类型,林地则能有效削减氮磷负荷量。某种土地利用转变为其他土地利用类型过程中,对TN、TP的削减程度不同。对于TN来说,耕地转为林地、草地转为林地时削减量最高;对于TP来说,耕地转为林地、建设用地转为林地时削减量最高。
-
表 1 ZVMg或Mg的双金属材料还原去除污染物研究总结
材料 制备方法 投加量/g·L−1 污染物 初始浓度/mg·L−1 反应溶液 反应速率常数/min−1 (除非特别标注) 去除率/% 参考文献 商业镁粉 - 2 硝酸盐 50 水溶液 0.35 91 [37] 商业镁粉 - 0.65 硝酸盐 90 水溶液 - 80 [36] Mg/Ag 湿式化学沉淀法 5 五氯苯酚 10 丙酮、乙醇 30 a > 85 [14, 38] Mg/Pd 湿式化学沉淀法 25 2-氯联苯 4 丙酮 0.33 > 90 [11] Mg/Pd 湿式化学沉淀法 10, 12 多氯联苯 3 乙醇 - > 90 [11] Mg/Pd 湿式化学沉淀法 4、6 2-氯联苯 4 乙醇、丙酮 - > 99 [39] ZVMg/Ag 湿式化学沉淀法 0.5 4-氯苯酚 10 - - 99 [12] Mg/Zn 湿式化学沉淀法 2.5 对硝基苯酚 19.8 - 0.066 9 - [40] Mg/Cu、Mg/Ni、Mg/Zn 湿式化学沉淀法 5 2,4-二硝基苯甲醚 250 水溶液 - 35~100 [41] Mg/Pd 机械球磨 25 多氯联苯 5 甲醇 0.002 26~0.007 16 a > 90 [5] Mg/Pd 机械球磨 25 多氯联苯 20 甲醇 1.72×10−4 a 80 [42] ZVMg 机械球磨 50 多氯联苯 1 乙醇 - > 94 [43] Mg/Pd 机械球磨 25 多氯联苯 10 甲醇 0.001 76 a - [44] ZVMg/C 机械球磨 25~50 多环芳烃 44.9~250 乙醇/乙酸乙酯 0.000 128~0.004 3 66~97 [18, 20, 45] ZVMg/C 机械球磨 50 五氯苯酚 20 乙醇 0.038 3~0.237 37~99 [18, 20, 45] ZVMg/C 机械球磨 50 六氯苯 20 乙醇/乳酸乙酯 0.222 99 [10] ZVMg, ZVMg/AC 机械球磨 50 八氯二苯并呋喃、2,8-二氯二苯并呋喃 20 乙醇 0.000 269~0.251 9 > 99 [19] 2-丁氧基乙醇 0.000 503~0.338 ZVMg 超声活化 5 硝酸盐 50 水溶液 - 90 [9] 注: a 表示反应速率常数的单位为L·(min·g)−1;- 表示文献里未说明。 -
[1] AYYILDIZ O, ACAR E, ILERI B. Sonocatalytic reduction of hexavalent chromium by metallic magnesium particles[J]. Water, Air, and Soil Pollution, 2016, 227(10): 1 − 9. [2] LEE G, PARK J, HARVEY O R. Reduction of Chromium(VI) mediated by zero-valent magnesium under neutral pH conditions[J]. Water Research, 2013, 47(3): 1136 − 1146. doi: 10.1016/j.watres.2012.11.028 [3] AGARWAL S, AL-ABED S R, DIONYSIOU D D. Chapter 25 - magnesium-based corrosion nano-cells for reductive transformation of contaminants[M]// Nanotechnology Applications for Clean Water (Second Edition). Oxford: William Andrew Publishing, 2014: 395-403. [4] SICILIANO A, CURCIO G M, LIMONTI C. Chemical denitrification with Mg0 particles in column systems[J]. Sustainability (Basel, Switzerland), 2020, 12(7): 2984. [5] DEVOR R, CARVALHO-KNIGHTON K, AITKEN B, et al. Dechlorination comparison of mono-substituted PCBs with Mg/Pd in different solvent systems[J]. Chemosphere, 2008, 73(6): 896 − 900. doi: 10.1016/j.chemosphere.2008.07.006 [6] IMAMURA H, NOBUNAGA T, KAWAHIGASHI M, et al. Preparation and hydriding behavior of magnesium metal clusters formed in low-temperature cocondensation: application of magnesium for hydrogen storage[J]. Inorganic Chemistry, 1984, 23(16): 2509 − 2511. doi: 10.1021/ic00184a027 [7] DOYLE J G, MILES T, PARKER E, et al. Quantification of total polychlorinated biphenyl by dechlorination to biphenyl by Pd/Fe and Pd/Mg bimetallic particles[J]. Microchemical Journal, 1998, 60(3): 290 − 295. doi: 10.1006/mchj.1998.1668 [8] THOMAS S, MEDHEKAR N V, FRANKEL G S, et al. Corrosion mechanism and hydrogen evolution on Mg[J]. Current Opinion in Solid State and Materials Science, 2015, 19(2): 85 − 94. doi: 10.1016/j.cossms.2014.09.005 [9] ILERI B, AYYILDIZ O, APAYDIN O. Ultrasound-assisted activation of zero-valent magnesium for nitrate denitrification: Identification of reaction by-products and pathways[J]. Journal of Hazardous Materials, 2015, 292: 1 − 8. doi: 10.1016/j.jhazmat.2015.03.004 [10] GARBOU A M, LIU M, ZOU S, et al. Degradation kinetics of hexachlorobenzene over zero-valent magnesium/graphite in protic solvent system and modeling of degradation pathways using density functional theory[J]. Chemosphere, 2019, 222: 195 − 204. doi: 10.1016/j.chemosphere.2019.01.134 [11] AGARWAL S, AL-ABED S R, DIONYSIOU D D. Enhanced corrosion-based Pd/Mg bimetallic systems for dechlorination of PCBs[J]. Environmental Science & Technology, 2007, 41(10): 3722 − 3727. [12] SOLANKI J N, MURTHY Z V P. Reduction of 4-chlorophenol by Mg and Mg–Ag bimetallic nanocatalysts[J]. Industrial & Engineering Chemistry Research, 2011, 50(24): 14211 − 14216. [13] MORALES J, HUTCHESON R, NORADOUN C, et al. Hydrogenation of phenol by the Pd/Mg and Pd/Fe bimetallic systems under mild reaction conditions[J]. Industrial & Engineering Chemistry Research, 2002, 41(13): 3071 − 3074. [14] PATEL U D, SURESH S. Effects of solvent, pH, salts and resin fatty acids on the dechlorination of pentachlorophenol using magnesium–silver and magnesium–palladium bimetallic systems[J]. Journal of Hazardous Materials, 2008, 156(1-3): 308 − 316. doi: 10.1016/j.jhazmat.2007.12.021 [15] 戴乐阳, 陈清林, 林少芬, 等. 高能球磨中促进粉体细化的主要因素研究[J]. 材料导报, 2009, 23(22): 59 − 61. doi: 10.3321/j.issn:1005-023X.2009.22.018 [16] 李学问. 机械球磨制备超细晶Mg-3Al-Zn合金及其组织性能的研究[D]. 哈尔滨: 哈尔滨工业大学, 2010. [17] SONG J, KIM H, KIM H, et al. Refinement behavior of coarse magnesium powder by high energy ball milling (HEBM)[J]. Journal of Korean Powder Metallurgy Institute, 2010, 17(4): 302 − 311. doi: 10.4150/KPMI.2010.17.4.302 [18] ELIE M R, WILLIAMSON R E, CLAUSEN C A, et al. Application of a magnesium/co-solvent system for the degradation of polycyclic aromatic hydrocarbons and their oxygenated derivatives in a spiked soil[J]. Chemosphere, 2014, 117: 793 − 800. doi: 10.1016/j.chemosphere.2014.10.042 [19] MOGHARBEL A T, YESTREBSKY C L. Dechlorination comparison of octachlorodibenzofuran over ball-milled zero-valent magnesium with and without activated carbon in different solvent systems[J]. Journal of Environmental Chemical Engineering, 2019, 7(2): 102950. doi: 10.1016/j.jece.2019.102950 [20] ELIE M R, CLAUSEN C A, YESTREBSKY C L. Reductive degradation of oxygenated polycyclic aromatic hydrocarbons using an activated magnesium/co-solvent system[J]. Chemosphere, 2013, 91(9): 1273 − 1280. doi: 10.1016/j.chemosphere.2013.02.031 [21] 魏鹏刚, 韩璐, 赵迎新, 等. 球磨零价镁/石墨(ZVMg/C)降解水中三氯乙烯[J]. 环境化学, 2022, 41(01): 276 − 287. [22] RIEKE R D. Preparation of highly reactive metal powders and their use in organic and organometallic synthesis[J]. Accounts of Chemical Research, 2002, 10(8): 301 − 306. [23] BARTMANN E, BOGDANOVI B, JANKE N, et al. Active magnesium from catalytically prepared magnesium hydride or from magnesium anthracene and its uses in the synthesis[J]. Chemische Berichte, 1990, 123(7): 1517 − 1528. doi: 10.1002/cber.19901230712 [24] HAAS I, GEDANKEN A. Synthesis of metallic magnesium nanoparticles by sonoelectrochemistry[J]. Chemical Communications, 2008, 15: 1795 − 1797. [25] TOSHIMA N, YONEZAWA T. Bimetallic nanoparticles–novel materials for chemical and physical applications[J]. New Journal of Chemistry, 1998, 22(11): 1179 − 1201. doi: 10.1039/a805753b [26] ZHANG W Y, WEI P G, CHEN M, et al. Trichloroethylene dechlorination rates, pathways, and efficiencies of ZVMg/C in aqueous solution[J]. Journal of Hazardous Materials, 2021, 417: 125993. doi: 10.1016/j.jhazmat.2021.125993 [27] SUN Y P, LI X Q, CAO J S, et al. Characterization of zero-valent iron nanoparticles[J]. Advances in Colloid and Interface Science, 2006, 120(1-3): 47 − 56. doi: 10.1016/j.cis.2006.03.001 [28] TIRAFERRI A, CHEN K L, SETHI R, et al. Reduced aggregation and sedimentation of zero-valent iron nanoparticles in the presence of guar gum[J]. Journal of Colloid and Interface Science, 2008, 324(1-2): 71 − 79. doi: 10.1016/j.jcis.2008.04.064 [29] LIU M H, WANG Y H, CHEN L T, et al. Mg(OH)2 supported nanoscale zero valent iron enhancing the removal of Pb(II) from aqueous aolution, Acs[J]. ACS APPL Mater Inter, 2015, 7: 7961 − 7969. doi: 10.1021/am509184e [30] LING L, HUANG X Y, LI M R, et al. Mapping the reactions in a single zero-valent iron nanoparticle[J]. Environmental Science & Technology, 2017, 51(24): 14293 − 14300. [31] LEE G, PARK J. Reaction of zero-valent magnesium with water: Potential applications in environmental remediation[J]. Geochimica et Cosmochimica Acta, 2013, 102: 162 − 174. doi: 10.1016/j.gca.2012.10.031 [32] BELDJOUDI T, FIAUD C, ROBBIOLA L. Influence of homogenization and artificial aging heat treatments on corrosion behavior of Mg-Al alloys[J]. Corrosion, 1993, 49(9): 738 − 745. doi: 10.5006/1.3316126 [33] BARIL G, PÉBÈRE N. The corrosion of pure magnesium in aerated and deaerated sodium sulphate solutions[J]. Corrosion Science, 2001, 43(3): 471 − 484. doi: 10.1016/S0010-938X(00)00095-0 [34] SONG G, ATRENS A. Understanding magnesium corrosion–a framework for improved alloy performance[J]. Advanced Engineering Materials, 2003, 5(12): 837 − 858. doi: 10.1002/adem.200310405 [35] REN Y, KANG S, ZHU J. Mechanochemical degradation of hexachlorobenzene using Mg/Al2O3 as additive[J]. Journal of Material Cycles and Waste Management, 2015, 17(4): 607 − 615. doi: 10.1007/s10163-015-0398-3 [36] MIRABI M, GHADERI E, RASOULI SADABAD H. Nitrate reduction using hybrid system consisting of zero valent magnesium powder/activated carbon (Mg0/AC) from water[J]. Process Safety and Environmental Protection, 2017, 111: 627 − 634. doi: 10.1016/j.psep.2017.08.035 [37] KUMAR M, CHAKRABORTY S. Chemical denitrification of water by zero-valent magnesium powder[J]. Journal of Hazardous Materials, 2006, 135(1-3): 112 − 121. doi: 10.1016/j.jhazmat.2005.11.031 [38] PATEL U, SURESH S. Dechlorination of chlorophenols by magnesium–silver bimetallic system[J]. Journal of Colloid and Interface Science, 2006, 299(1): 249 − 259. doi: 10.1016/j.jcis.2006.01.047 [39] AGARWAL S, AL-ABED S R, DIONYSIOU D D. Impact of organic solvents and common anions on 2-chlorobiphenyl dechlorination kinetics with Pd/Mg[J]. Applied Catalysis B:Environmental, 2009, 92(1-2): 17 − 22. doi: 10.1016/j.apcatb.2009.07.029 [40] KHAN S R, BATOOL M, JAMIL S, et al. Synthesis and characterization of Mg–Zn bimetallic nanoparticles: selective hydrogenation of p-nitrophenol, degradation of reactive carbon black 5 and fuel additive[J]. Journal of Inorganic and Organometallic Polymers and Materials, 2020, 30(2): 438 − 450. doi: 10.1007/s10904-019-01202-3 [41] HADNAGY E, MAI A, SMOLINSKI B, et al. Characterization of Mg-based bimetal treatment of insensitive munition 2, 4-dinitroanisole[J]. Environmental Science and Pollution Research International, 2018, 25(24): 24403 − 24416. doi: 10.1007/s11356-018-2493-1 [42] DEVOR R, CARVALHO-KNIGHTON K, AITKEN B, et al. Mechanism of the degradation of individual PCB congeners using mechanically alloyed Mg/Pd in methanol[J]. Chemosphere, 2009, 76(6): 761 − 766. doi: 10.1016/j.chemosphere.2009.05.007 [43] MALONEY P, DEVOR R, NOVAES-CARD S, et al. Dechlorination of polychlorinated biphenyls using magnesium and acidified alcohols[J]. Journal of Hazardous Materials, 2011, 187(1-3): 235 − 240. doi: 10.1016/j.jhazmat.2011.01.006 [44] COUTTS J L, DEVOR R W, AITKEN B, et al. The use of mechanical alloying for the preparation of palladized magnesium bimetallic particles for the remediation of PCBs[J]. Journal of Hazardous Materials, 2011, 192(3): 1380 − 1387. doi: 10.1016/j.jhazmat.2011.06.052 [45] ELIE M R, CLAUSEN C A, GEIGER C L. Reduction of benzo[a]pyrene with acid-activated magnesium metal in ethanol: A possible application for environmental remediation[J]. Journal of Hazardous Materials, 2012, 203-204: 77 − 85. doi: 10.1016/j.jhazmat.2011.11.089 [46] GARBOU A M, CLAUSEN C A, YESTREBSKY C L. Comparative study for the removal and destruction of pentachlorophenol using activated magnesium treatment systems[J]. Chemosphere, 2017, 166: 267 − 274. doi: 10.1016/j.chemosphere.2016.09.139 [47] THANGADURAI P, SURESH S. Reductive transformation of endosulfan in aqueous phase using magnesium–palladium bimetallic systems: A comparative study[J]. Journal of Hazardous Materials, 2013, 246-247: 245 − 256. doi: 10.1016/j.jhazmat.2012.12.031 [48] AGARWAL S, AL-ABED S R, DIONYSIOU D D, et al. Reactivity of substituted chlorines and ensuing dechlorination pathways of select PCB congeners with Pd/Mg bimetallics[J]. Environmental Science & Technology, 2009, 43(3): 915 − 921. [49] ENGELMANN M D, DOYLE J G, CHENG I F. The complete dechlorination of DDT by magnesium/palladium bimetallic particles[J]. Chemosphere, 2001, 43(2): 195 − 198. doi: 10.1016/S0045-6535(00)00163-6 [50] CWIERTNY D M, BRANSFIELD S J, ROBERTS A L. Influence of the oxidizing species on the reactivity of iron-based bimetallic reductants[J]. Environmental Science & Technology, 2007, 41(10): 3734 − 3740. [51] PATEL U, SURESH S. Dechlorination of chlorophenols using magnesium–palladium bimetallic system[J]. Journal of Hazardous Materials, 2007, 147(1-2): 431 − 438. doi: 10.1016/j.jhazmat.2007.01.029 [52] MORALES J. Dechlorination of chlorinated phenols by catalyzed and uncatalyzed Fe(0) and Mg(0) particles[J]. Journal of Hazardous Materials, 2002, 90(1): 97 − 108. doi: 10.1016/S0304-3894(01)00336-3 [53] GAUTAM S K, SURESH S. Dechlorination of DDT, DDD and DDE in soil (slurry) phase using magnesium/palladium system[J]. Journal of Colloid and Interface Science, 2006, 304(1): 144 − 151. doi: 10.1016/j.jcis.2006.08.052 [54] BEGUM A, GAUTAM S K. Dechlorination of endocrine disrupting chemicals using Mg0/ZnCl2 bimetallic system[J]. Water Research, 2011, 45(7): 2383 − 2391. doi: 10.1016/j.watres.2011.01.017 [55] USGS. Study and interpretation of the chemical characteristics of natural water[M]. Washington D C, USA: United States Geological Survey Water-Supply, 1992, 2254. [56] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 地下水质量标准: GB/T 14848—2007[S]. 北京: 中国标准出版社, 2017. [57] GULBRANDSEN E. Anodic behaviour of Mg in HCO3−/CO32− buffer solutions. Quasi-steady measurements[J]. Electrochimica Acta, 1992, 37(8): 1403 − 1412. doi: 10.1016/0013-4686(92)87014-Q -




 下载:
下载: