-
活性污泥法是目前应用最为广泛的污水处理技术之一。经过多年的发展,该技术可以通过设置水质水量调节池、调整运行参数等手段实现污水处理厂的稳定运行。然而,近些年来我国污水处理厂破坏性水质冲击呈频发的趋势,处理系统时常出现故障,影响污水厂的正常运行及出水水质的达标。因此,开展高负荷水质冲击研究并探究其规律,为城镇污水厂水质冲击的快速调控及恢复方法奠定基础,具有更为重要的现实意义和实际价值。
序批式反应器(SBR)是一种典型的活性污泥法污水处理工艺,其具有脱氮除磷效果好、可抑制丝状菌膨胀、耐冲击负荷、流程简单、操作方便灵活和占地面积小等优点,在小型废水处理站以及小型城镇污水处理厂被广泛应用。尽管进水时水质变化系数大,但SBR仍可一定程度减小其影响。傅金祥等[1]发现,当进水磷浓度特别低时,SBR工艺不具备较强的抗冲击负荷能力,随着进水负荷的增加,系统发生了污泥膨胀的现象。彭赵旭等[2]发现有机负荷从0.15 kg BOD5/(kg MLSS·d)骤增到0.30~0.45 kg BOD5/(kg MLSS·d)时,SBR系统在短期内能够有效地缓解进水冲击带来的影响,但超过缓冲时间时系统会突然崩溃。季民等[3]在使用SBR处理模拟高氨氮废水时发现,当游离氨冲击负荷﹥8.1 mg/L时,会对硝化作用产生抑制。尽管相关的研究在以不同形式展开,但有关COD的高冲击及其规律性研究鲜有报道。
鉴于此,以实际运行中最为常见的COD冲击为研究对象,通过实验室构建SBR模型及调整进水COD浓度等手段,探究不同浓度下的COD冲击对SBR工艺的影响并揭示其规律,以期为实际工程的运行调控提供依据。
-
SBR反应器采用有效容积为5 L的柱形有机玻璃容器(直径120 mm,高500 mm)。曝气装置为曝气砂石,采用转子流量计控制曝气量为100 mL/min,进水水温控制在(19±1)℃。反应器以间歇模式运行。1 d运行2个周期,1周期12 h,进水5 min,非限制性曝气480 min,沉淀闲置230 min,排水5 min。排水比为40%。控制污泥停留时间(SRT)为50 d,反应器初始污泥浓度(MLSS)为(9 000±300)mg/L。实验装置,见图1。
-
试验进水采用人工模拟城市污水,配水使用的试剂为淀粉、乙酸钠(CH3COONa)、氯化铵(NH4Cl)、磷酸二氢钾(KH2PO4)、高岭土、牛肉膏、蛋白胨和碳酸氢钠(NaHCO3)。其中NaHCO3用于调节pH,微量元素由牛肉膏、蛋白胨提供,所用试剂均为分析纯。通过投加淀粉来控制进水COD浓度。试验各阶段进水水质,见表1。试验接种污泥取自长春市某污水处理厂。
运行期间,pH为7.81~8.13,TN、NH4+-N和TP的质量浓度范围分别为34.52~49.71、21.71~31.62和2.92~4.52 mg/L。
-
常规指标:COD采用重铬酸钾法测定,NH4+-N采用纳氏试剂分光光度法测定,TN采用碱性过硫酸钾消解紫外分光光度法测定,TP采用钼锑抗分光光度法测定,混合液挥发性悬浮固体浓度(MLVSS)采用灼烧减量法测定。pH检测使用上海雷磁生产的PHSJ-4A酸度计,温度及溶解氧(DO)使用德国WTW生产的Oxi3310便携式溶解氧仪检测。MLSS采用重量法测定,污泥体积指数(SVI)采用100 mL量筒沉淀法测定。
胞外聚合物(EPS)含量:其中蛋白质(PN)含量采用考马斯亮蓝法,多糖(PS)含量采用硫酸-蒽酮比色法[4-5]。
脱氢酶活性(DHA):1,3,5-氯化三苯基四氮唑(TTC)还原法,常温萃取检测[6]。
粒度粒径:激光粒度分析仪检测。
-
不同运行阶段下COD的去除情况,见图2。
各阶段COD的平均去除率分别为94.13%、96.61%、98.56%、98.75%、98.83%、98.6%和91.62%。阶段4时,COD的去除率达到最大。
在反应器运行初期,系统内微生物较少,且处于适应阶段,此时的COD去除率较低。随着进水COD浓度的升高,反应器中异养菌迅速增殖,系统去除COD的能力不断提高直至稳定。从阶段1到阶段3,每阶段的进水COD浓度虽突然变大,但反应器对COD的去除率却得到提升。由此可见,在一定的COD浓度冲击范围内,随着COD浓度的增加,有利于系统微生物的生长繁殖。阶段4到阶段6,反应器对COD的去除率并不显著,可稳定保持在98%以上。系统对COD的去除包括两方面:1)活性污泥的快速增加使得系统储存有机物的能力增大[7],同时微生物为维持生命活动所消耗的有机物量也增多;2)为生物脱氮提供碳源,被异养反硝化细菌利用进行反硝化脱氮。系统进入阶段7时,COD出水浓度突然升至210.7 mg/L,此后的5 d,COD的出水浓度均在200 mg/L上下浮动。此时系统进水COD浓度过高,反应器内异养型细菌通过消耗有机物而大量增殖,使得系统DO浓度下降,从而抑制了硝化菌的生长,造成系统硝化速率下降,进而对系统脱氮产生不利影响[8]。硝化进程受阻使得用于脱氮的碳源利用量减少,且此时MLSS较高,DO、有机物等底物的传质受到影响,COD的去除率降低。
-
不同运行阶段下TN和NH4+-N的去除情况,见图3。
反应器进水TN浓度范围为34.52~49.71 mg/L,NH4+-N浓度范围为21.71~31.62 mg/L。不同阶段TN的平均去除率分别为64.03%、75.61%、89.00%、97.33%、97.19%、95.62%和89.34%,NH4+-N的平均去除率分别为99.46%、98.68%、98.94%、99.43%、99.33%、99.35%和96.27%。阶段4时,TN和NH4+-N的去除效果最佳。
图3可知,阶段1,TN的去除率较低,而NH4+-N的去除率达到99.46%。此时反应器处于运行初期,系统内DO充足,硝化菌得到大量繁殖,硝化反应进行的较彻底,而反硝化菌受到抑制,NH4+-N几乎全部转化为NO2−-N或NO3−-N,反硝化成为系统脱氮的限制条件。其次系统内有机物浓度低,反硝化菌受碳源不足的影响,使得NOx−-N无法被进一步转化,导致出水TN偏高。阶段2到阶段3,随着进水COD浓度的升高,异养型细菌迅速增殖,底物和DO得到充分的利用,活性污泥絮凝体内外部形成明显的缺氧-好氧的微环境,反硝化菌生存环境较好。硝化反应产生的NO2−-N和NO3−-N进行了反硝化脱氮,从而提高了脱氮效果。系统进入阶段4时,TN出水浓度逐渐降低,TN平均出水浓度仅为1.14 mg/L,去除率达到97.33%,此时系统的同步脱氮效率达到最大。SAJJAD et al[9]指出,小粒径的污泥具有较大的比表面积,脱氮性能更好。在本试验中,从阶段5到阶段6,污泥的中值粒径(D50)由138.19 μm迅速增加到151.1 μm,由于阶段6的污泥粒径大,EPS的边界蛋白不能更多地暴露于氮中,因此蛋白质与氨和硝酸盐氮原子之间的亲电亲核相互作用较弱,系统对TN的去除效率降低。阶段7时,系统处于运行末期,由于丝状菌的大量繁殖,硝化菌以及反硝化菌的生存空间都受到抑制,TN和NH4+-N的去除率均降低。
-
不同运行阶段对TP的去除情况,见图4。
反应器进水TP浓度范围为2.92~4.52 mg/L,不同阶段下TP的平均去除率分别为83.64%、95.42%、98.39%、99.07%、99.10%、98.69%和94.35%。在阶段5时,系统TP的去除率达到最大。
阶段1,反应器处于运行初期,接种污泥中的聚磷菌数量较少,TP的去除有较大波动。随着系统环境的稳定,聚磷菌世代时间短,迅速繁殖,TP出水逐渐降低。由阶段2到阶段5分析可知,系统TP的去除率一直在提升,表明有机物浓度的升高使聚磷菌的代谢活性增强,系统除磷能力提高。在阶段5时,TP去除率达到最大,出水浓度均低于0.05 mg/L,此时系统达到最优的除磷性能。王亚宜等[10]发现在缺氧条件下有机物浓度过高时,有机碳源会对缺氧释磷产生抑制作用。在反应器运行至阶段6,进水COD浓度达到2 400 mg/L时,由于系统内溶解氧过低,出现长时间厌氧环境,同时系统存在过量的有机物,多余的有机物优先被用于反硝化脱氮,却不进行反硝化吸磷作用,使得系统缺氧吸磷能力明显降低,出水TP浓度升高,此时TP的平均出水浓度为0.25 mg/L。阶段7时,系统发生了严重的污泥膨胀,抑制了吸磷作用,出水TP浓度进一步升高。结果表明,当进水COD浓度超出系统的承受能力范围后,将对系统的除磷效果产生不利影响。
-
不同阶段下污泥负荷及沉降性能的变化情况,见图5。
污泥负荷(Ns)为0.057 kg COD/(kg MLSS·d)时,系统运行第20 d,SVI迅速上升至60 mL/g,此时影响SVI最关键的因素是微生物处于系统适应阶段,其增殖速率决定此时期的SVI值的变化趋势;Ns为0.083 kg COD/(kg MLSS·d)时,SVI降低至42 mL/g,反应出水较为清澈,污泥沉降性能较好;Ns为0.077 kg COD/(kg MLSS·d)时,系统运行第60 d,MLSS达到24 980 mg/L,SVI为33.9 mL/g;Ns为0.076 kg COD/(kg MLSS·d)时,污泥增加速率减缓,SVI增至35 mL/g。原因是MLSS太高,有机质含量多,无机质含量少,不利于污泥沉降。同时,生物相镜检观察到污泥内存在大量丝状菌,这导致污泥沉降性能变差,系统发生了污泥膨胀。
-
EPS是微生物分泌于细胞表面的大分子黏性物质,主要由多糖(PS)、蛋白质(PN)、腐殖质酸和油脂等组成,其中,PN与PS的含量之和约占EPS总量的40%~95%[11]。活性污泥一般通过检测PS与PN来表征EPS,其变化规律,见图6。
对比各阶段EPS的变化,可以看出进水COD浓度对EPS的含量影响较大。首先从EPS总量上看,反应器运行初期,为适应新环境,微生物通过分泌EPS来抵御外界环境的变化,EPS的含量从47.89增至72.31 mg/g VSS。阶段2至阶段5,EPS总量并没有随着进水COD浓度的增加而增加,反而呈降低的趋势。这是由于系统内微生物活性逐渐降低,使得微生物新陈代谢分泌的EPS的总量降低。随着反应器污泥量的增加,系统进入阶段6时,DO浓度较低,在有限的溶解氧下,丝状菌由于菌丝较长,比表面积大,同时对氧有较强的亲和力,在与菌胶团的竞争中处于优势[12],反应器内丝状菌数量增多,结果导致EPS总量升高。而在阶段7,系统长时间处于低溶氧下,此时DHA含量仅为1.412 mg/g VSS,微生物已处于内源呼吸期,微生物不得不利用自身储存的有机物以维持生命活动,EPS总量减少。
其次随着反应器的运行,PS含量持续增加,由13.47增加至27.30 mg/g VSS,这与系统的有机底物有关。微生物合成PS的重要途径是由淀粉水解后产生的葡萄糖转化而来,本试验主要以淀粉和乙酸钠作为碳源,使得微生物可合成较多的PS,这一结果与刘燕等[13]的研究相符。另外PS/PN的值由0.39增至1.2,在1.2时系统发生了丝状菌膨胀,而当PS/PN的值为1.0时反应器运行状态最佳。有关研究认为PS的大量生成会在一定程度上阻止微生物的聚集[14]。由此可看出,PS/PN在一定的范围内可保证系统内污泥活性良好,而当EPS中PS的比重过大时,污泥沉降性能将恶化。原因是PS具有亲水性,当PS数量过多时,将不利于微生物絮体的凝结,因此降低了污泥的沉降性能[15]。
-
活性污泥的粒径表示污泥絮体的大小,污泥絮体的表面特性和形态结构对控制固液分离过程有重要意义。各阶段的变化规律,见表2。
对比分析不同进水COD浓度下系统粒度粒径的变化,利用正态分布公式进行粒径分布模拟,各阶段的平均粒径(μ值)、方差分别为140.289 μm、64.388;144.36 μm、56.846;144.028 μm、56.898;150.558 μm、52.116;162.615 μm、56.294;169.409 μm、51.504;173.273 μm、57.214。从数据可以看出,随着反应器的运行,污泥粒径不断增加。阶段1到阶段3粒径增加的原因是由于反应器启动初期MLSS较低,污泥颗粒较分散,使得污泥絮体有足够的空间充分生长,因此污泥粒径逐渐增加。阶段4到阶段6粒径增加的原因是随着反应的进行,系统内MLSS升高,污泥絮体之间紧密的排列使其受到的水力剪切力减小,絮体很难被打碎,因此粒径增大。阶段7粒径虽然仍在增加,但此时方差由51.504升高至57.214,系统MLSS达到最大值,氧传质能力减弱,DO浓度较低,粒径较大的絮体由于氧传质的减弱逐渐裂解,造成了粒径分布分散。
上述分析结果可知,在一定的MLSS范围内,粒径的增加有利于污泥絮凝,但当MLSS过高时,粒径增加使得底物的传质过程受到影响,容易使得较大絮体内部出现缺氧或厌氧区域,累积气体,从而破坏污泥絮体的紧密度和结构强度,造成污泥解絮,进而对系统的处理效果造成不利影响。
-
DHA可以准确地反映微生物的活性,能够表征活性微生物对其基质降解能力的强弱[16]。不同进水COD浓度下活性污泥DHA的变化情况,见图7。
图7可知,活性污泥的DHA随着进水COD浓度的升高呈现先增加后持续减小的趋势。阶段1到阶段2,DHA从4.977 增至5.422 mg/g VSS,原因是系统运行初期,微生物为抵御外界环境的变化做出的应激反应[17]。阶段2到阶段7,DHA从5.422 减至1.412 mg/g VSS,原因可能是随着COD浓度的升高增加了SBR系统的渗透压,当渗透压超过微生物的耐受范围,将会抑制微生物的正常代谢并破坏脱氢酶在内的酶,导致微生物活性不断下降。洪梅等[18]发现较高浓度的COD在很大程度上会抑制微生物活性,当进水COD浓度>1 000 mg/L时,出水COD浓度﹥150 mg/L时,脱氢酶活性明显减弱,这与本试验得出的结论相一致。
-
各阶段污泥絮体及微生物相,见图8。
图8可知,反应器运行初期(阶段1),系统内污泥结构松散,微生物数量较少。随着运行时间的延长,系统稳定运行后,絮体密实且结构分布均匀,此时污泥絮体发育良好,性能稳定,对污染物有较高的去除效果。在运行中期(阶段2~5),系统内微生物种类丰富,有大量的钟虫、累枝虫和表壳虫属等指示处理效果好的微生物出现,这对于系统的稳定运行极其有利。运行后期(阶段6~7),随着系统内MLSS的升高,镜检观察到累枝虫等微生物被大量丝状菌缠绕,且丝状菌数量较多,这导致污泥沉降性能变差,发生了污泥膨胀。此时在系统内还观察到很多深褐色的厢壳虫,说明系统内污泥已经开始解体。同时反应器在运行后期由于系统MLSS的增加造成的缺氧环境,使部分好氧微生物逐渐消亡,导致系统内微生物数量明显减少,系统的除污能力减弱。
-
本研究采用序批式(SBR)反应器处理不同COD浓度下的城市污水。当COD浓度为400~2 000 mg/L时,随着进水COD浓度的升高,污染物的去除效果得到增强。COD浓度为2 000 mg/L时,系统运行良好,污染物去除效果达到最佳,COD、TN、NH4+-N和TP平均去除率分别为98.83%、97.19%、99.33%和99.10%。此时PS/PN的值为1.0,系统可稳定运行。
当COD浓度达到2 400 mg/L时,系统内MLSS过高,较大的粒径使得微生物的正常代谢受到影响,DHA明显降低,从5.422 mg/g VSS持续减至1.412 mg/g VSS。此时PS/PN上升至1.2,系统发生了严重的丝状菌膨胀,活性污泥系统受到破坏。
COD冲击对SBR污水处理效果及污泥特性的影响
Influence of COD shock on the effect of SBR wastewater treatment and its sludge characteristics
-
摘要: 针对我国污水处理厂破坏性水质冲击频发的问题,该研究通过将COD浓度由400 mg/L逐步提至2 400 mg/L,探究COD冲击对SBR系统污染物的处理效果及污泥特性的影响。结果表明:当COD浓度为2 000 mg/L时,SBR工艺对COD、TN、NH4+-N和TP的去除率分别为98.83%、97.19%、99.33%和99.10%,此时系统的脱氮除磷效果最佳,且污泥沉降性能良好;当COD浓度达到2 400 mg/L时,活性污泥的脱氢酶活性(DHA)由5.422 mg/g VSS降至1.412 mg/g VSS,此时多糖(PS)/蛋白质(PN)为1.2,系统发生了污泥膨胀。Abstract: In view of the frequent problem of destructive water quality shock in sewage treatment plants in China, this study investigated the influence of COD impact on the treatment effect of pollutants in the SBR system and sludge characteristics by gradually increasing the COD concentration from 400 mg/L to 2 400 mg/L. The results showed that when the COD concentration was 2 000 mg/L, the removing rates of COD, TN, NH4+-N and TP by SBR process were 98.83%, 97.19%, 99.33% and 99.10%, respectively. The system had the best denitrification and phosphorus removal effect and a good sludge settling performance under this COD concentration. The DHA of the activated sludge decreased from 5.422 mg/g VSS to 1.412 mg/g VSS when the COD concentration increased to 2 400 mg/L. The PS/Pn was 1.2, and the sludge bulking occurred in the system.
-
近年来,汞(Hg)作为最危险的有毒重金属之一,已引起了人们的广泛关注[1]。汞离子(Hg2+)具有生物聚集性,在自然界中,Hg2+能通过放大作用,在食物链之间不断传递,自下而上积累,营养级越高,Hg2+的浓度就越大。Hg2+还具有强毒性,进入人体以后,会破环肾脏,影响人体的呼吸系统和神经系统[2]。因此,急需开发一种有效的Hg2+选择性检测技术,并将其应用于生物科学和环境科学。
光学检测(通过荧光变化或比色变化)是最方便的测量技术。因此,近年来荧光探针因其操作简单、灵敏度高、对生物系统无损伤等特点而备受关注[3-4]。在过去的几十年里,大多数测定Hg2+的荧光探针都是基于螯合反应的荧光猝灭型探针,Hg2+充当荧光猝灭剂,然而它们往往会受到其他具有相似配位性能的金属离子的影响[5-6]。相比之下,基于Hg2+促进脱硫反应释放荧光团从而增强荧光强度的方法,就具有更好的专一性。目前,科研工作者开发了大量荧光增强型探针,并将它们用于Hg2+的选择性检测[7-12]。然而,它们有些激发/发射波长较短,有些则需要大量有机试剂作为助溶剂。因此,亟待发展发射波长长、水溶性好、灵敏度和选择性高的新型荧光增强型探针,并将其用于环境中Hg2+浓度的特异性检测。
半花菁席夫碱染料具有良好的光物理和光化学性质,如理想的激发/发射波长,大的摩尔吸收系数,其在水溶液中存在席夫碱(SB)和质子化席夫碱(PSB)两种形式,SB形式的吸收波长较短,没有荧光,而PSB形式的吸收波长较长,并且有荧光,SB形式转换为PSB形式之后,会造成体系荧光信号的增加,这非常有利于构建以半花菁席夫碱染料为荧光团的荧光探针[13-14]。基于此,本文报道了一种新型的以半花菁席夫碱染料为荧光团,与Hg2+有较高的亲和力的硫代碳酸酯基团为识别受体的荧光探针(MC-Hg)。由于硫代碳酸酯基团强的吸电子能力,探针MC-Hg的pKa值较低,在弱酸和中性条件下,主要以SB形式存在,没有荧光,当与Hg2+反应后,硫代碳酸酯离去,释放出半花菁荧光团MCF,pKa值升高,在弱酸和中性条件下,主要以PSB形式存在,有荧光,从而实现对Hg2+的选择性检测(机理示意图如图1所示)。
1. 实验部分(Experimental section)
1.1 仪器与试剂
日立F-4600荧光分光光度计(日本,日立公司);岛津UV-2600紫外分光光度计(日本,岛津公司);布鲁克micrOTOF-QⅡ型质谱仪(德国,布鲁克公司)。
硫代氯甲酯苯酯、N, N-二异丙基乙胺(DIPEA)、硝酸汞均购于上海阿拉丁生化技术有限公司,其它化学试剂均为分析纯试剂。整个实验中所用水均为二次蒸馏水。
1.2 光谱测试
将探针(5.7 mg,0.01 mmol)溶于10 mL丙酮中,得到储备溶液(1.0 × 10−3 mol·L−1),密封避光保存。金属阳离子Na+、K+、Cu2+、Zn2+、Mn2+、Ni2+、Cd2+、Pb2+、Co2+、Hg2+、Mg2+、Ca2+、Al3+、Fe2+,阴离子Cl−、CO32−分别溶解在蒸馏水中以制备浓度为10−2 mol·L−1的溶液。
在10 mL比色管中依次加入25 μL探针储备液、500 μL乙醇、500 μL不同pH的磷酸氢二钠-柠檬酸缓冲液(0.2 mol·L−1),蒸馏水定容至5 mL,摇匀。移取3 mL到1 cm × 1 cm的比色皿中,分别测试荧光光谱图和紫外-可见吸收光谱图,激发波长为580 nm,激发和发射狭缝均为5 nm,扫描速度为2400 nm·min−1。
1.3 水样中Hg2+的检测
实验之前,将自来水和汉江水(汉中段)用微量滤膜过滤,再用磷酸氢二钠-柠檬酸缓冲液(2.0 ×10−2 mol·L−1,pH 6.4)调节实际水样的pH值。随后,在实际水样中加入不同浓度的Hg2+和探针MC-Hg,摇匀,在室温下反应3 min后,检测645 nm处的荧光强度。
1.4 探针的合成与表征
化合物1的合成:见参考文献[15]。
化合物2的合成(图2):向25 mL的圆底烧瓶中加入30 mL二氯甲烷、硫代氯甲酸苯酯(0.4665 g,2.7 mmol)、化合物1(0.5643 g,2.7 mmol)和N, N-二异丙基乙胺(DIPEA)(0.3705 g,2.80 mmol),混合后在室温下搅拌2 h,至反应完全后,用柱色谱法纯化(体积比为石油醚:乙酸乙酯 = 10:1)。分离后旋干,得到白色固体为化合物2(0.80 g,产率85%)。1H NMR (600 MHz, CDCl3) 化学位移(δ): 7.468—7.441 (m, 4H), 7.32 (t, J = 7.4 Hz, 1H), 7.217—7.202 (m,2H), 7.155—7.146 (m,2H), 6.53 (s,1H), 1.521 (s,9H). 13C NMR (150 MHz, CDCl3) δ: 195.23, 153.72, 152.75, 148.94, 137.09, 129.80, 126.95, 122.41, 121.95, 119.48, 116.29, 80.99, 28.44. HRMS (ESI, m/z) calculated for [C18H19NO4S+H]+: 346.1113,found: 346.1575。
化合物3的合成(如图2):向25 mL的圆底烧瓶加入2 mL三氟乙酸、8 mL二氯甲烷和化合物2(0.1794 g,0.52 mmol),混合后在常温下搅拌反应2.5 h,等反应完成后,旋干。用柱色谱法纯化,得到白色的固体产物为化合物3(0.12 g,产率98%)。1H NMR (600 MHz, DMSO-d6) δ: 7.50 (t, J = 7.9 Hz, 2H), 7.36 (t, J = 7.4 Hz, 1H), 7.31 (d, J = 7.8 Hz, 2H), 7.20 (d, J = 8.8 Hz, 2H), 7.04 (d, J = 8.7 Hz, 2H). 13C NMR (150 MHz, DMSO) δ: 195.11, 153.66, 148.32, 130.35, 127.39, 124.78, 123.03, 122.23, 119.69, 116.60. HRMS (ESI, m/z) calculated for [C13H11NO2S+H]+: 246.0589,found: 246.0510。
化合物4的合成(图2):见参考文献[16]。1H NMR (400 MHz, CDCl3), δ: 10.28 (s, 1H), 7.88 (d, J = 8.0 Hz, 1H), 7.29 (d, J = 8.0 Hz, 1H), 7.26—7.24 (m, 1H), 6.99 (t, J = 8.0 Hz, 1H), 6.77 (d, J = 4.0 Hz, 1H), 5.56 (d, J = 6.0 Hz, 1H), 3.81 (q, J = 8.0 Hz, 2H), 2.63 (t, J = 4.0 Hz, 2H), 2.53 (t, J = 4.0 Hz, 2H), 1.81 (t, J = 8.0 Hz, 2H), 1.68 (s, 6H), 1.34(t, J = 8.0 Hz, 3H). 13C NMR (100 MHz, CDCl3), δ: 191.19, 162.14, 149.21, 144.05, 139.76, 131.84, 128.89, 128.34, 123.42, 122.30, 121.33, 107.22, 92.85, 47.04, 30.14, 28.77, 27.12, 25.01, 24.72, 21.37, 11.67. HRMS (ESI): m/z calcd for C21H25ClNO [M+H]+: 342.1625; found: 342.1613。
探针MC-Hg的合成(如图2):向50 mL圆底烧瓶中加入15 mL乙醇、化合物4(0.1671 g,0.49 mmol)、化合物3(0.1200 g,0.49 mmol)和醋酸钠(0.1805 g,2.20 mmol),在80 ℃的条件下搅拌并回流45 min。再用柱色谱法纯化(二氯甲烷:甲醇 = 50:1),得到蓝色固体(MC-Hg)为探针MC-Hg(0.25 g,产率90%)。1H NMR (600 MHz, DMSO-d6), δ: 8.54 (s, 1 H), 7.47—7.44 (m, 3H), 7.34—7.32 (m, 4H), 7.23—7.20 (m, 4H), 6.82—6.62 (m, 3H), 5.57 (d, J = 6.0 Hz, 1H), 4.12 (q, J = 8.0 Hz, 2H), 2.83 (t, J = 4.0 Hz, 2H), 2.63 (t, J = 4.0 Hz, 2H), 1.79 (t, J = 8.0 Hz, 2H), 1.69 (s, 6H), 1.36(t, J = 8.0 Hz, 3H). 13C NMR (150 MHz, DMSO-d6), δ: 189.19, 172.11, 162.16, 153.32, 151.22, 148.21, 146.02, 144.05, 139.76, 132.21, 131.84, 127.86, 127.14, 126.23, 123.42, 122.30, 121.33, 117.51, 116.32, 107.22, 104.36, 47.04, 30.14, 38.87, 28.12, 25.21, 23.62, 21.27, 13.67. HRMS (ESI, m/z) calculated for [C34H33ClN2O2S]: 568.1951,found: 568.3020。
2. 结果与讨论(Results and discussion)
2.1 pH对探针MC-Hg光谱的影响
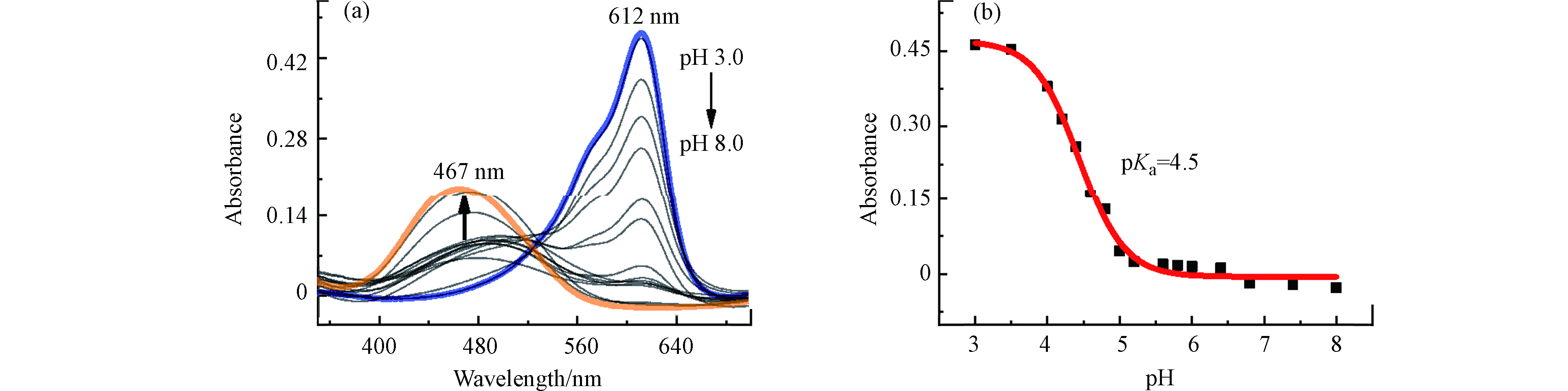
首先,本工作研究了MC-Hg在不同pH值溶液中吸收光谱的变化,结果如图3a所示。当pH ≥ 5.0时,MC-Hg主要以没有荧光的SB形式存在,最大吸收峰在467 nm处。随着溶液H+浓度的增加,MC-Hg的最大吸收峰红移至612 nm处。这一现象说明探针MC-Hg在酸性溶液中主要以具有荧光的PSB形式存在。图3b为MC-Hg在612 nm处吸收强度随H+浓度变化的趋势,可以得出MC-Hg的pKa值为4.5[17]。
研究了MC-Hg荧光光谱随pH值变化的趋势图(图4)。当pH从8.0减少到3.0时,MC-Hg溶液的荧光强度增加了183倍,这一现象表明随着溶液pH值的降低,探针从没有荧光的SB形式转变为具有荧光的PSB形式。图4b为645 nm处MC-Hg荧光强度随H+浓度变化的趋势,可以得出探针的pKa值为4.7,这与上述紫外-可见吸收光谱数据得到的pKa值基本一致。
2.2 MC-Hg与Hg2+的反应条件优化
研究了溶液pH对MC-Hg与Hg2+反应的影响。如图5a所示,随着溶液pH值的增加,MC-Hg与Hg2+反应体系荧光强度的变化值先增加后减小,在pH = 6.4时达到最大值。因此,MC-Hg与Hg2+反应的最佳pH值为6.4。
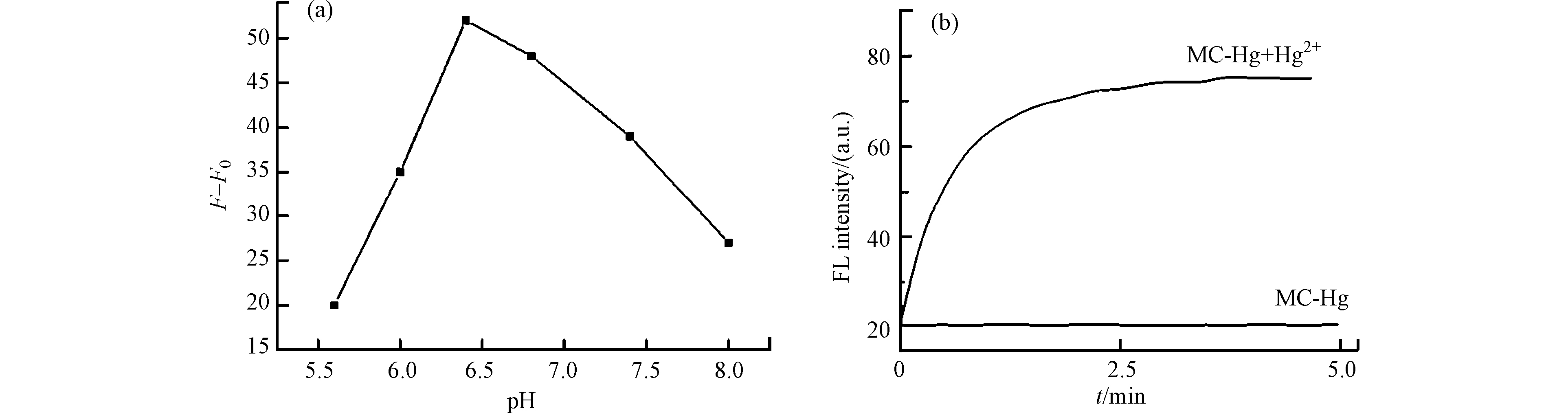 图 5 加入Hg2+前后的MC-Hg溶液荧光强度的差值随pH值的变化图(a);探针MC-Hg和加入Hg2+的MC-Hg溶液的荧光强度随时间的变化图(b);Figure 5. (a) Fluorescence intensity of MC-Hg solution added with Hg2+ varied with pH value where F0 and F are the fluorescence intensity of the probe before and after adding Hg2+; (b) Time-coursed fluorescence responses of probe MC-Hg to Hg2+;F0和F分别为探针加入Hg2+前后体系的荧光强度,MC-Hg浓度为5 × 10−6 mol·L−1,Hg2+的浓度为12 × 10−6 mol·L−1The concentrations of MC-Hg and Hg2+ were 5 × 10−6 mol·L−1 and 12 × 10−6 mol·L−1, respectively
图 5 加入Hg2+前后的MC-Hg溶液荧光强度的差值随pH值的变化图(a);探针MC-Hg和加入Hg2+的MC-Hg溶液的荧光强度随时间的变化图(b);Figure 5. (a) Fluorescence intensity of MC-Hg solution added with Hg2+ varied with pH value where F0 and F are the fluorescence intensity of the probe before and after adding Hg2+; (b) Time-coursed fluorescence responses of probe MC-Hg to Hg2+;F0和F分别为探针加入Hg2+前后体系的荧光强度,MC-Hg浓度为5 × 10−6 mol·L−1,Hg2+的浓度为12 × 10−6 mol·L−1The concentrations of MC-Hg and Hg2+ were 5 × 10−6 mol·L−1 and 12 × 10−6 mol·L−1, respectively研究了加入Hg2+前后,探针MC-Hg溶液的荧光强度随时间的变化。如图5b所示,探针MC-Hg的荧光强度不随时间的变化而变化,表明探针在该检测条件下具有较好的稳定性。此外,加入Hg2+后,探针MC-Hg的荧光强度迅速增加,在3 min内基本完成反应,相比之下,响应速度优于很多已经报道的荧光探针[18-21]。因此,所有测量的检测时间设置为3 min。
为了研究探针在酸性条件下的稳定性,测试了pH 6.4下,探针MC-Hg溶液的紫外吸收和荧光光谱随时间的变化。如图6所示,在80 min内,探针MC-Hg溶液的紫外-可见吸收和荧光光谱没有明显的变化,表明探针在pH 6.4条件下具有很好的稳定性。
2.3 MC-Hg对Hg2+的光学响应
考察了MC-Hg对不同浓度Hg2+的荧光响应。如图7a所示,在pH = 6.4时,MC-Hg主要以没有荧光的SB形式存在,体系的荧光很弱。随着Hg2+的加入,MC-Hg的荧光强度逐渐增大。当Hg2+的浓度高于12 × 10−6 mol·L−1时,荧光强度达到最大。此外,MC-Hg在645 nm处的荧光信号与Hg2+的浓度呈现良好的线性关系,线性范围为0.0—7.0 × 10−6 mol·L−1(如图7b所示)。
检出限(LOD)为2.7 × 10−7 mol·L−1(S/N=3)。另外我们用等摩尔法连续变化法测定了探针MC-Hg与Hg2+的化学计量关系。如图8所示,从图中可以看出反应的摩尔分数为0.5左右,这可以证明探针MC-Hg与Hg2+的反应是按化学计量关系为1: 1反应的。
2.4 MC-Hg对Hg2+的检测机理探讨
根据文献报道,Hg2+和硫化物具有高亲和力且吸电子基团可以显著降低半花菁席夫碱染料中亚胺基团的pKa值[22]。因此,半花菁探针MC-Hg以具有强吸电子能力且可选择性识别Hg2+的碳酸酯基团为识别受体。由于碳酸酯基团的强吸电子能力,MC-Hg的pKa值较低(如图3和图4所示),与Hg2+反应后,碳酸酯基团断裂,释放出pKa值较高的荧光团,经二氯甲烷萃取、柱色谱分离后,对所得产物进行表征:1H NMR (600 MHz, DMSO-d6), δ: 9.46 (s, 1H), 8.74 (s, 1H), 7.52 (d, J = 12.7 Hz, 1H), 7.29 (d, J = 7.3 Hz, 1H), 7.18 (t, J = 7.8 Hz, 1H), 7.07 (d, J = 8.4 Hz, 2H), 6.89—6.83 (m, 2H), 6.77 (d, J = 8.5 Hz, 2H), 6.64 (dd, J = 28.0, 9.9 Hz, 1H), 5.57 (d, J = 12.7 Hz, 1H), 3.78 (q, J = 7.1 Hz, 2H), 2.67 (t, J = 6.1 Hz, 2H), 2.60 (t, J = 6.3 Hz, 2H), 1.75 (t, J = 6.2 Hz, 2H), 1.57 (s, 6H), 1.15 (t, J = 7.1 Hz, 3H). 13C NMR (151 MHz, DMSO), δ: 159.21, 156.55, 155.79, 144.01, 140.08, 139.13, 129.22, 128.37, 127.47, 123.71, 122.77, 122.26, 120.56, 116.29, 115.61, 107.30, 92.78, 46.08, 36.75, 28.31, 26.88, 26.67, 21.43, 14.56. HRMS (ESI): m/z calcd for C27H29ClN2O [M+H]+: 433.2047; found: 433.2040. 实验结果表明所生成产物为MCF(该反应机理已有文献报道[8]),从而导致检测体系的吸收波长红移,荧光强度显著升高(如图1和图7所示)。
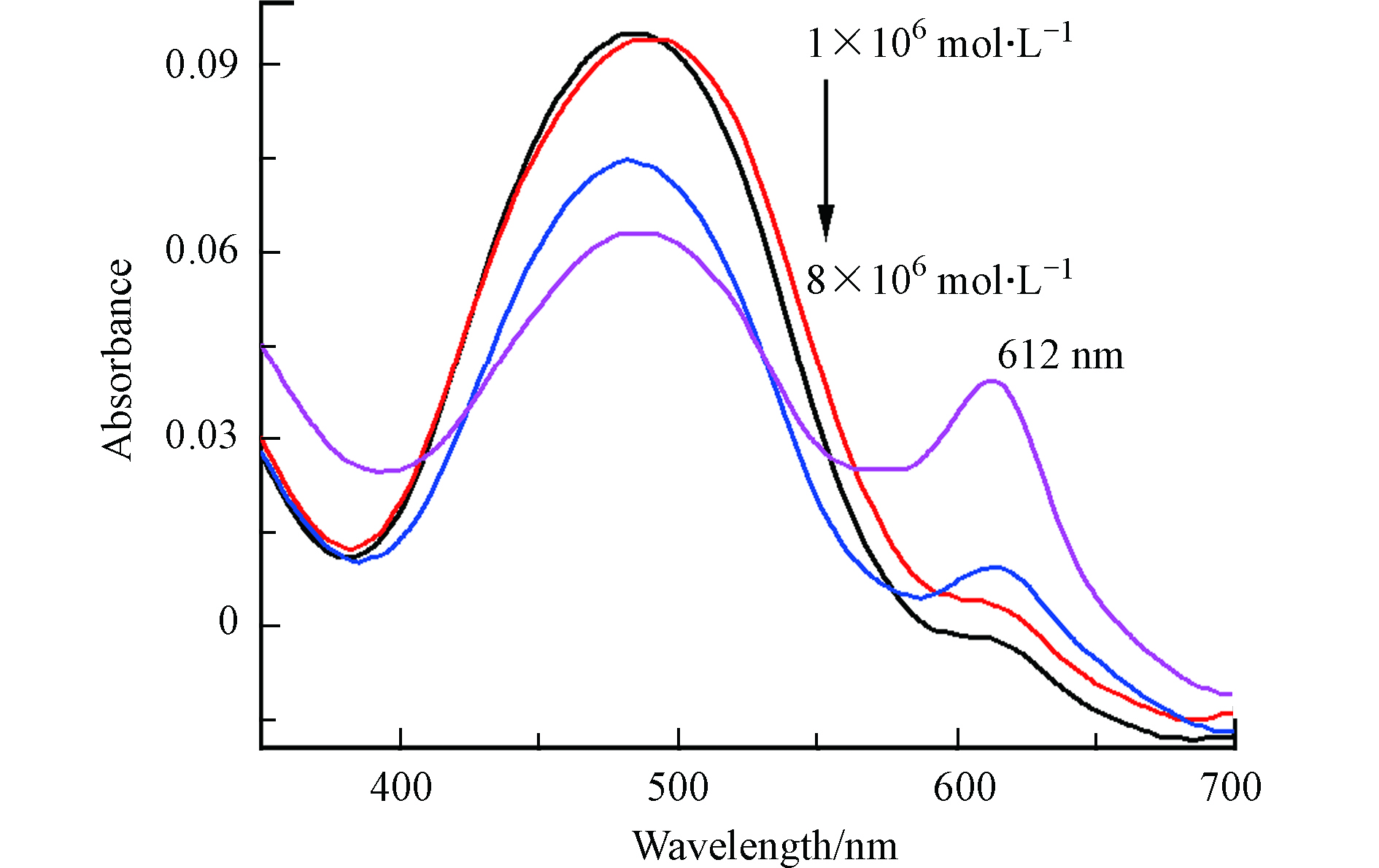
为了进一步探究MC-Hg与Hg2+的反应机理,考察了MC-Hg和Hg2+在磷酸氢二钠-柠檬酸缓冲液中(pH 6.4,2.0 × 10−2 mol·L−1)反应后,紫外-可见吸收光谱的变化。如图9所示,探针在短波长处有一个主要的吸收峰,表明它在此检测条件下主要以SB形式存在。
然而,随着一系列不同浓度的Hg2+加入,MC-Hg在612 nm处的吸收强度逐渐增加。紫外-可见吸收光谱的变化表明水溶液中PSB形式的增加,也就是说MC-Hg与Hg2+反应后,所生成荧光团MCF的pKa值升高,主要以PSB形式存在。这些结果证明MC-Hg与Hg2+高选择性反应前后,pKa值产生移动(由低到高),造成感应体系中荧光信号的增强。
2.5 选择性实验
在上述条件下,考察了MC-Hg对Hg2+的选择性(如图10所示)。
 图 10 MC-Hg(5 × 10−6 mol·L−1)对Hg2+的选择性Figure 10. Selectivity of MC-Hg (5 × 10−6 mol·L−1) towards Hg2+干扰离子的浓度均为5.0 × 10−4 mol·L−1,Hg2+浓度为1.0 × 10−5 mol·L−1;λex/λem = 580/645 nmThe concentrations of interfering ions were all 5.0 × 10−4 mol·L−1, and the concentration of Hg2+ was 1.0 × 10−5 mol·L−1; λex/ λem = 580/645 nm
图 10 MC-Hg(5 × 10−6 mol·L−1)对Hg2+的选择性Figure 10. Selectivity of MC-Hg (5 × 10−6 mol·L−1) towards Hg2+干扰离子的浓度均为5.0 × 10−4 mol·L−1,Hg2+浓度为1.0 × 10−5 mol·L−1;λex/λem = 580/645 nmThe concentrations of interfering ions were all 5.0 × 10−4 mol·L−1, and the concentration of Hg2+ was 1.0 × 10−5 mol·L−1; λex/ λem = 580/645 nm通过监测探针MC-Hg在加入其他离子后荧光发射信号的变化,研究其对Hg2+的选择性。结果表明,只有Hg2+会导致检测体系荧光强度的明显升高,其他常见离子,如Na+、K+、Cu2+、Zn2+、Mn2+、Ni2+、Cd2+、Pb2+、Co2+、Mg2+、Ca2+、Al3+、Fe2+、Cl−、CO32−,均没有明显的变化。为了进一步验证这些竞争离子对Hg2+的荧光检测没有影响,在其他离子同时存在的情况下,研究了探针MC-Hg对Hg2+的反应。从图10中可以看出,探针MC-Hg在645 nm处的荧光强度响应值只有轻微的变化。所有实验结果表明,其他竞争离子对Hg2+的检测没有或影响不大,因此,探针MC-Hg对Hg2+表现出较高的选择性。
2.6 水样中Hg2+的检测
利用标准加入法研究了探针MC-Hg检测实际水样中Hg2+浓度的能力[8, 23-24]。将实验室自来水和从汉江汉中段取得的水样过滤,pH值调节到6.4。将3种Hg2+浓度(1.0×10−6、2.0×10−6、4.0×10−6 mol·L−1)分别加入到实际水样中,然后加入MC-Hg,反应3 min后进行检测。结果如表1所示,用上述方法检测水样中的Hg2+浓度时,回收率均不低于96%,表明该探针MC-Hg可实现水样中Hg2+的定量检测,回收率良好.
表 1 实际水样中Hg2+浓度的检测Table 1. Analysis of Hg2+ concentrations in real water samples水样Water samples 加入Hg2+(×10−6)/(mol·L−1)Hg2+ spiked a回收Hg2+(×10−6)/(mol·L−1)Hg2+ recovered 回收率/%Recovery 汉江水Hanjiang River 0.0 未检出 1.0 1.02 102 2.0 1.96 98.0 4.0 3.93 98.3 自来水Tap water 0.0 未检出 1.0 0.96 96.0 2.0 2.01 101 4.0 3.97 99.3 a3次测量结果的平均值. aMean of three determinations. 最后,将MC-Hg检测Hg2+的特性与已报道的Hg2+荧光探针相比较。结果表明,半花菁荧光探针MC-Hg对Hg2+的检测具有响应速度快、水溶性好的特点(表2)[25-29],但该方法的检出限还需在后续的工作中继续改进。
表 2 检测Hg2+的荧光分析方法对比Table 2. A comparison of fluorescent methods for detection of Hg2+材料Materials 线性范围/(μmol·L−1)Linear range 检出限/(nmol·L−1)Detection limit 响应时间/minResponse time 激发/发射波长/nmλex/λem 溶剂Solvent 文献References 基于花菁染料的荧光探针 1.5—7.5 7.3 5.0 600/790 乙醇/水(5/95,V/V) [25] 基于半花菁染料的荧光探针 2.0—10.0 320 5.0 630/710 乙腈/水(1/99,V/V) [26] 基于半花菁染料的荧光探针 3.0—5.5 180 5.0 587/708 二甲基亚砜/水(2/8,V/V) [27] 基于罗丹明B染料的荧光探针 1.0—20.0 330 15.0 530/583 乙醇/水(2/8,V/V) [28] 基于苯并噻唑染料的荧光探针 5.0—100.0 310 30.0 405/525 乙腈/水(1/1,V/V) [29] 基于半花菁染料的荧光探针 0.0—7.0 270 3 580/645 丙酮/水(1/99,V/V) 本工作 3. 结论(Conclusion)
结果表明,本文成功制备了一种合成步骤简单、成本低的新型荧光探针MC-Hg,其对Hg2+的检测具有较高的灵敏度和选择性。相关竞争离子对Hg2+检测的干扰很小或不存在,说明硫代碳酸酯基团可以选择性地识别Hg2+。此外,在实际应用中,探针MC-Hg对环境水样中Hg2+的测定具有很好的回收率。以上这些显著的优点表明MC-Hg在环境样品Hg2+的检测方面具有良好的应用前景。
-
表 1 各阶段进水COD浓度
试验阶段 浓度范围/mg·L−1 平均值/mg·L−1 运行时间/d 阶段1 376.2~457.4 416.8 10 阶段2 735.1~827.8 781.5 10 阶段3 1 121~1 249 1 185.0 10 阶段4 1 535~1 669 1 602.0 10 阶段5 1 949~2 174 2 061.5 10 阶段6 2 307~2 460 2 383.5 10 阶段7 2 415~2 596 2 505.5 5 表 2 各阶段粒径分布
μm 反应阶段 平均粒径 D10 D50 D90 阶段1 118.35 55.24 116.46 186.43 阶段2 122.07 56.73 120.54 187.48 阶段3 124.23 62.36 122.42 194.36 阶段4 132.33 66.71 132.37 198.65 阶段5 141.15 73.62 138.69 208.75 阶段6 148.80 78.59 151.13 212.41 阶段7 149.71 78.48 152.78 218.35 -
[1] 傅金祥, 陈正洋, 罗迪, 等. 水力停留时间对SBR工艺处理低磷污水的影响[J]. 工业用水与废水, 2020, 51(4): 21 − 24. doi: 10.3969/j.issn.1009-2455.2020.04.005 [2] 彭赵旭, 彭永臻, 桂丽娟, 等. 氨氮冲击负荷对硝化过程的短期影响[J]. 中国给水排水, 2010, 26(11): 9 − 12. [3] 季民, 刘灵婕, 翟洪艳, 等. 高浓度游离氨冲击负荷对生物硝化的影响机制[J]. 环境科学, 2017, 38(1): 260 − 268. [4] DU P, YANG S Y, LI W H, et al. Extraction and structural characteristics of extracellular polymeric substances (EPS), pellets in autotrophic nitrifying biofilm and activated sludge[J]. Chemosphere: Environmental Toxicology and Risk Assessment, 2010, 81(5): 626 − 632. [5] ADAV S S, LEE D J. Extraction of extracellular polymetic substances from aerobic granule with compact interior structure[J]. Journal of Hazardous Materials, 2008, 154(1/3): 1120 − 1126. [6] 赵连梅, 池勇志, 张春青. TTC-脱氢酶活性测定中标准曲线的影响因素研究[J]. 实验室科学, 2009(4): 72 − 74. doi: 10.3969/j.issn.1672-4305.2009.04.028 [7] MA A, HE J J. Effect of feeding pattern on biochemical storage by activated sludge under anoxic conditions[J]. Water Research: A Journal of the International Water Association, 2007, 41(4): 924 − 934. [8] 王淑莹, 高春娣, 彭永臻, 等. SBR法处理工业废水中有机负荷对污泥膨胀的影响[J]. 环境科学学报, 2000, 20(2): 129 − 133. doi: 10.3321/j.issn:0253-2468.2000.02.001 [9] SAJJAD M, KIM K S. A study on TOC and nutrients removal in SBR and CFSTR systems in relation to sludge EPS during granulation process[J]. Desalination and Water Treatment, 2015, 55(6): 1683 − 1689. doi: 10.1080/19443994.2014.943062 [10] 王亚宜, 彭永臻, 王淑莹, 等. 碳源和硝态氮浓度对反硝化聚磷的影响及ORP的变化规律[J]. 环境科学, 2004(4): 54 − 58. doi: 10.3321/j.issn:0250-3301.2004.04.011 [11] TAY J H, LIU Q S, LIU Y. The role of cellular polysaccharides in the formation and stability of aerobic granules[J]. Letters in Applied Microbiology, 2001, 33(3): 222 − 226. doi: 10.1046/j.1472-765x.2001.00986.x [12] 王文斌, 丁忠浩, 董有. 同步硝化反硝化的研究与机理分析[J]. 环境科学与技术, 2004, 27(2): 38 − 39. doi: 10.3969/j.issn.1003-6504.2004.02.017 [13] 刘燕, 王越兴, 莫华娟, 等. 有机底物对活性污泥胞外聚合物的影响[J]. 环境化学, 2004, 23(3): 252 − 257. doi: 10.3321/j.issn:0254-6108.2004.03.003 [14] YANG S F, TAY J H, LIU Y. Inhibition of free ammonia of the formation of aerobic granules[J]. Biochemical Engineering Journal, 2004, 17(1): 41 − 48. doi: 10.1016/S1369-703X(03)00122-0 [15] 周律, 邢秀娟, 彭标, 等. 低水温下悬浮和附着活性污泥胞外多聚物特性[J]. 清华大学学报(自然科学版), 2016, 56(9): 1009 − 1015. [16] 李静, 严红, 肖本益. 活性污泥活性的表征及其检测方法研究[J]. 工业水处理, 2016, 36(8): 5 − 10. doi: 10.11894/1005-829x.2016.36(8).005 [17] MATYJA K, MAŁACHOWSKA-JUTSZ A, MAZUR A K, et al. Assessment of toxicity using dehydrogenases activity and mathematical modeling[J]. Ecotoxicology, 2016, 25(5): 924 − 939. doi: 10.1007/s10646-016-1650-x [18] 洪梅. 脱氢酶活性检测技术在污水处理厂的应用研究[J]. 石油化工环境保护, 2001(4): 30 − 33. -





 下载:
下载: