-
铬作为一种重要的金属原料,在冶金、化工、皮革和制药等行业中广泛使用[1-2],但是,如果处置不当,会随废弃物进入自然环境,造成污染。环境中常见的是Cr(Ⅲ)和Cr(Ⅵ),以Cr3+、CrO2−、CrO42-和Cr2O72-这4种形态存在[3]。其中,Cr(Ⅲ)是人体和动植物的必需微量元素,而Cr(Ⅵ)则会对人体产生严重毒害,毒性是Cr(Ⅲ)的100倍左右,对人体皮肤、呼吸道和眼睛等器官存在危害,摄入过量会导致肾衰竭及癌症,即使在μg级仍具有毒性[3-5]。因此,《地表水环境质量标准:GB 3838—2002》[6]严格限定可作饮用水源的Ⅲ类水中Cr(Ⅵ)浓度不得高于0.05 mg/L。
含铬废水的处置方法主要包括:物理法、化学法、物化法和生物法等。其中,生物法处理是通过微生物的生长代谢将可溶的Cr(Ⅵ)转化为低毒或无毒的Cr(Ⅲ)[7-8],虽然效率低于物理和化学方法,但是具有成本低和无二次污染风险等优点,成为低含量Cr(Ⅵ)污染环境的主要修复方法之一。
异化金属还原菌(Dissimilatory Metal Reduction Bacteria,DMRB)是一种能够以金属氧化物作为电子受体,并且通过还原金属氧化物获得能量的细菌[9]。其还原机理主要有3种:(1)借助电子传递中间体复合物进行电子传递[10];(2)与金属氧化物表面接触直接传递电子[11];(3)借助金属螯合剂溶解金属离子螯合物后再还原[12-13]。Geobacter metallireducens是最早被发现的DMRB,能够以Fe(Ⅲ)为唯一电子受体将有机物氧化为CO2[14]。随着研究的深入,DMRB也被发现具有重金属污染处置能力。文献[15-16]研究发现,Shewanella oneidensis和Bacillus anthracis可以分别将V(V)和Cr(Ⅵ)还原为V(IV)和Cr(Ⅲ)。牛永艳等[17] 将Cr(Ⅵ)还原菌Cellulosimicrobium cellilans应用在微生物燃料电池处理含铬废水的研究中,Cr(Ⅵ)还原率达到68.9%。魏蓝[18]利用芽孢杆菌属细菌修复Cr(Ⅵ)污染土壤,还原率达到87.7%。DMRB对重金属的还原作用为环境中重金属的处置和无害化提供了新思路。
本研究以1株耐盐碱的异化金属菌Tindallia magadiensis为研究对象,考察了初始Cr(Ⅵ)浓度、初始pH和碳源等条件对菌株生长和Cr(Ⅵ)还原的影响,探讨了共存金属离子对菌株的扰动作用,获得了该菌的最佳生长条件和Cr(Ⅵ)还原效率。该菌株自1996年分离至今,只进行过系统发育分析,从未开展环境功能性探究,本研究为高盐碱极端环境下铬污染的处理提供新的探索方向。
-
实验菌株Tindallia magadiensis Z-7934T购自德国微生物菌种保藏中心 (Deutsche Sammlung von Mikroorganismen und Zellkulturen )。该菌于1996年从肯尼亚马加迪湖的苏打沉积物中分离,其后仅进行了系统发育进化研究,为该菌属的模式菌株[13]。该菌为G+的嗜碱专性厌氧菌,可以在pH 7.5~10.5和高Na+环境中生长。
培养基组成为:蛋白胨5 g/L,NaHCO3 40 g/L,KH2PO4 0.3 g/L,NH4Cl 0.5 g/L。50 mL培养基分装入100 mL厌氧瓶中,通入高纯Ar气排除残留的O2,胶塞密封,121 ℃灭菌10 min备用。按照5%比例接种,35 ℃摇床震荡培养。
-
高浓度的Cr(Ⅵ)对生物具有严重的毒害作用,为了探讨T. magadiensis对Cr(Ⅵ)的还原能力,首先要获得其对Cr(Ⅵ)的耐受性。初始Cr(Ⅵ)浓度分别设定为10、20、30、40和50 mg/L,以5%接种量接种对数期种子液,每组设3个平行。35 ℃,120 r/min恒温振荡培养。每12 h取样,测定细胞生物量和Cr(Ⅵ)的浓度。
-
采用常用的3种碳源考察对T. magadiensis生长和Cr(Ⅵ)还原的影响。保持初始碳源物质的量相同,碳酸氢钠、丁酸钠和乙酸钠分别为40、13.08和32.35 g/L,选择最适Cr(Ⅵ)浓度,初始pH保持与碳酸氢钠组一致。实验条件和测试指标与前一组实验相同。
-
探讨初始pH对菌株还原Cr(Ⅵ)的影响。以5%接种对数期种子液至适宜初始Cr(Ⅵ)浓度,初始pH分别为7~11的培养基当中。实验条件和测试指标与第一组实验相同。
-
选取环境中常见与Cr共存的Zn2+、Mn2+和Cu2+探讨共存金属离子对菌株还原Cr(Ⅵ)的影响。以5%接种对数期种子液至适宜初始Cr(Ⅵ)浓度和pH的培养基中,探讨分别投加0.5 mmol/L的Cu2+、Mn2+或Zn2+对菌株还原Cr(Ⅵ)的影响,以未添加其他金属离子的培养基作为对照。实验条件和测试指标与第一组实验相同。
-
溶液中总铬和Cr(Ⅵ)的含量分别参照《水质总铬的测定二苯碳酰二肼分光光度法:GBT 7466—1987》和《水质Cr(Ⅵ)的测定二苯碳酰二肼分光广度法:GB 7467—87》测定[6]。细胞生物量使用分光光度计UVmini-1240(日本岛津)以OD600计算。pH使用S220型pH计(Mettler Toledo,Switzerland)测定。
-
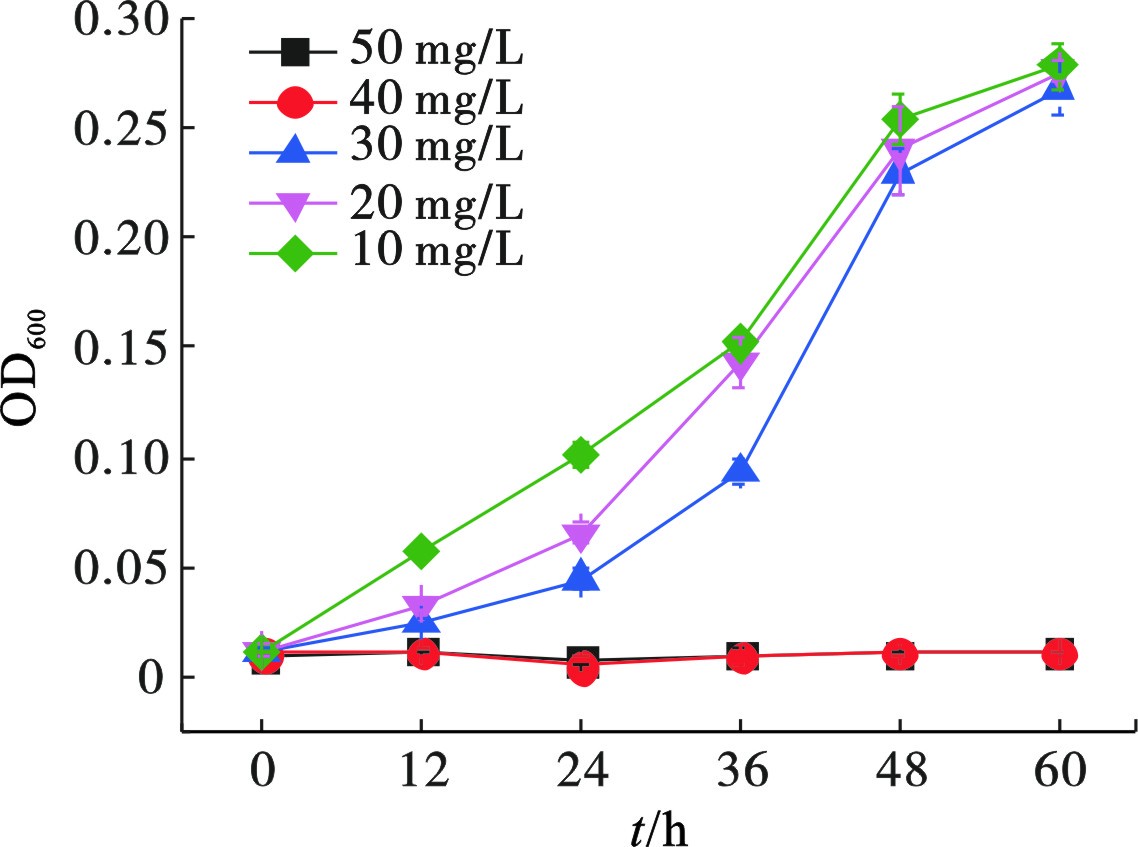
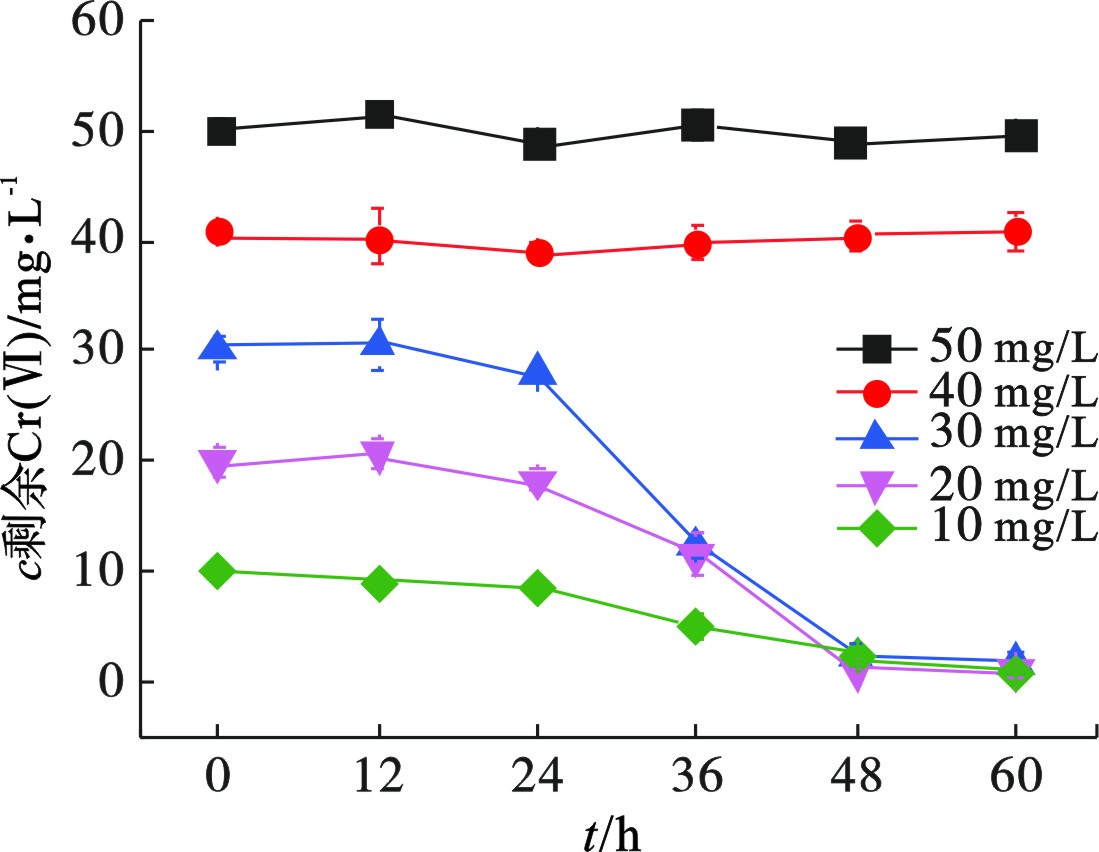
Cr(Ⅵ)对微生物的生长有显著影响,过高浓度会直接杀死细菌。初始Cr(Ⅵ)浓度对菌株Z-7934生长的影响,见图1。
Cr(Ⅵ)浓度高于40 mg/L时,菌株Z-7934无法存活,未检测到细胞生物量。初始Cr(Ⅵ)浓度为10、20和30 mg/L时,经60 h培养的细胞生物量(OD600)分别为0.29、0.28和0.27,说明菌株Z-7934可以在Cr(Ⅵ)浓度低于40 mg/L时生长。
菌株Z-7934对不同初始浓度Cr(Ⅵ)的还原,见图2。
初始Cr(Ⅵ)浓度高于40 mg/L时,细菌无法生长,Cr(Ⅵ)未被还原。Cr(Ⅵ)浓度为10~30 mg/L时,培养前24 h,细胞量较少,Cr(Ⅵ)还原量较低,剩余量分别为9.03、18.26 和28.03 mg/L。随着培养时间的延长,生物量增加,还原率提升。在第60 h,菌株对Cr(Ⅵ)的还原量分别为9.1、19.07和28.24 mg/L,说明菌株Z-7934在可耐受的Cr(Ⅵ)浓度范围内具有很好的还原性。初始Cr(Ⅵ)浓度为30 mg/L 时,还原率可达94.13%,还原速率达到每小时0.47 mg/L。
-
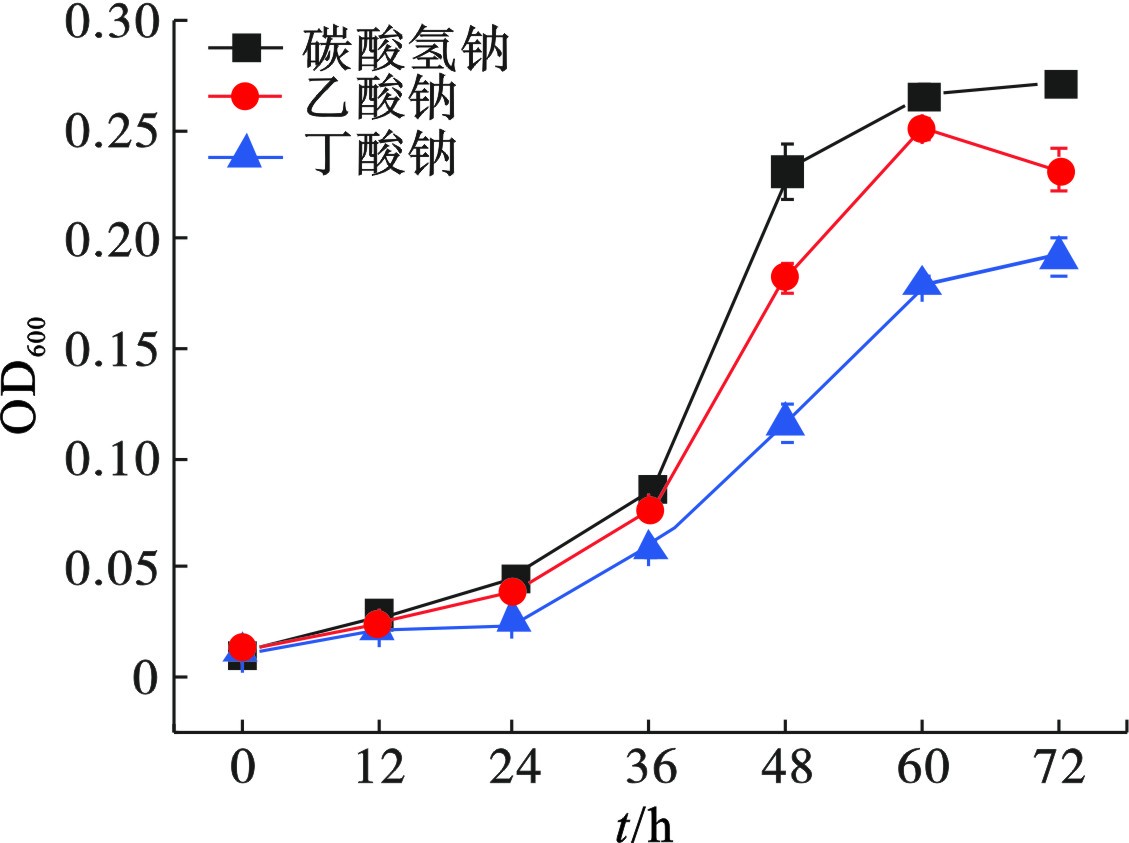
不同碳源对菌株Z-7934生长的影响,见图3。
菌株在前24 h生长较慢,在碳酸氢钠、乙酸钠或丁酸钠为碳源的培养基中,生物量(OD600)分别为0.04、0.04和0.02。随着培养时间的延长,在第36 h后生长明显提升,第48 h时,菌株的生物量(OD600)分别达到0.23、0.18和0.13,菌株Z-7934更适宜以碳酸氢钠为碳源生长。
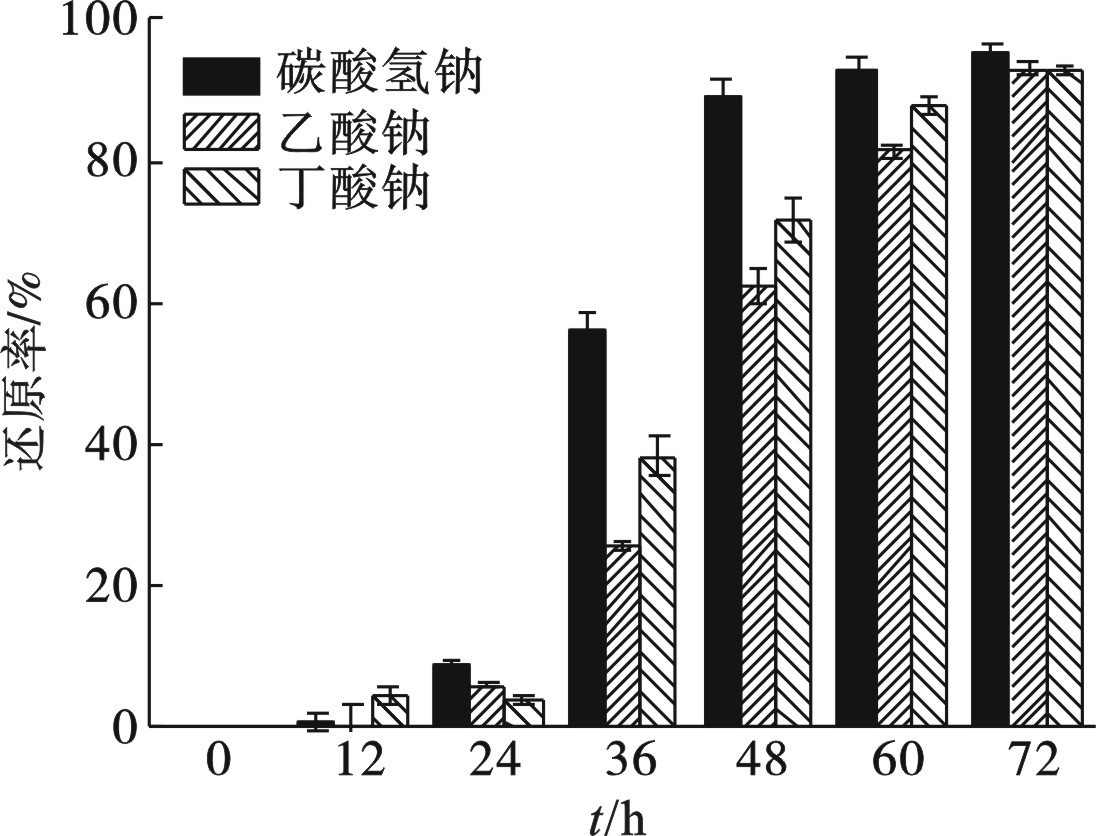
碳源对菌株Z-7934还原Cr(Ⅵ)的影响,见图4。
以碳酸氢钠为碳源时,菌株对Cr(Ⅵ)的还原速率最快。在第24 h,菌株在碳酸氢钠、乙酸钠和丁酸钠的培养基中对Cr(Ⅵ)的还原率分别为8.90%、6.20%和3.23%。随着时间和生物量的变化,在第48 h,菌株在3种碳源的培养基中对Cr(Ⅵ)的还原率分别为89.05%、63.33%和71.72%,以碳酸氢钠为碳源时,菌株对Cr(Ⅵ)的还原速率最快。在第60 h,菌株在3种碳源的培养基中的Cr(Ⅵ)还原率分别达到95.13%、93.13%和93.06%,此时接近还原终点,三者还原率基本相同。
实验结果表明生物量与Cr(Ⅵ)的还原速率成正相关。36~48 h是菌株Z-7934快速生长阶段,Cr(Ⅵ)的还原速率也明显提升。以碳酸氢钠作为碳源可以更好地促进菌株Z-7934对Cr(Ⅵ)的还原,以实现能量的传递,供给自身的繁殖与生长。因此,相比有机小分子碳源,无机碳源碳酸氢钠对菌株Z-7934的生长和金属异化过程更为有利。
-
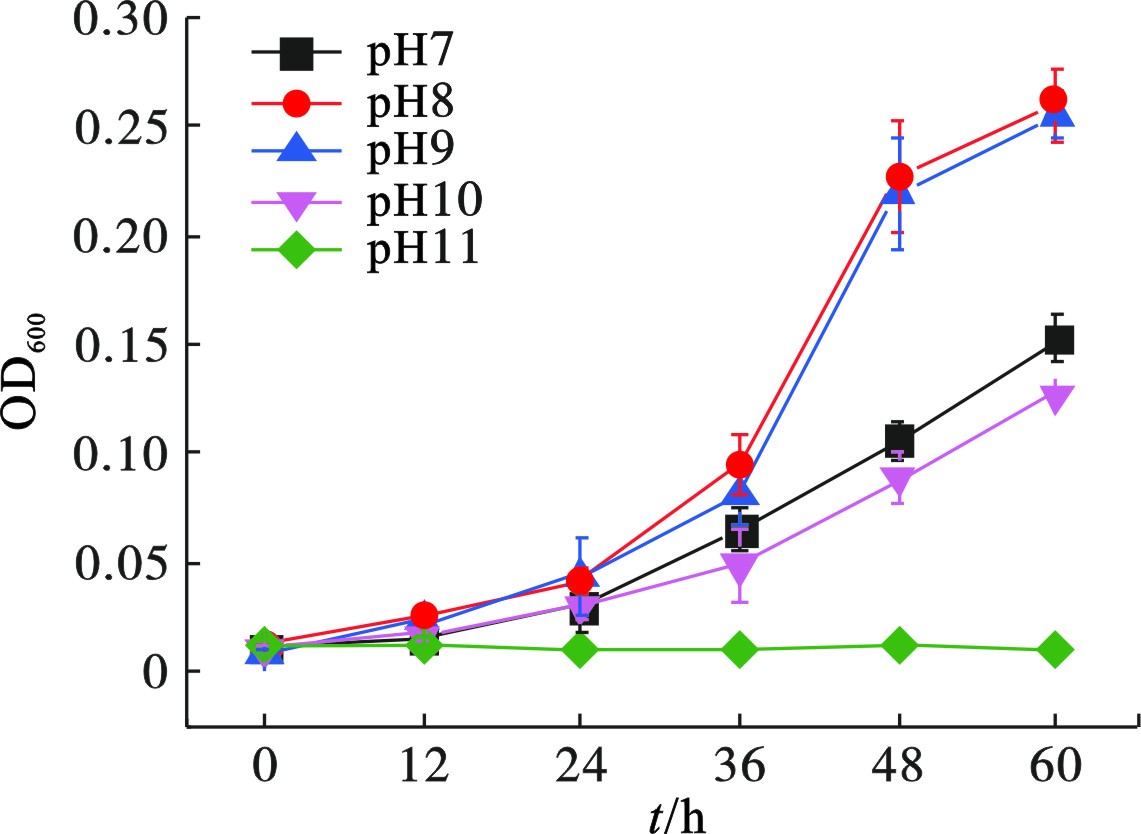
菌株Z-7934在初始pH 8~9的偏碱性条件生长较好,明显优于初始pH 7或pH 10时,见图5,但是无法耐受高于pH 11。在第60 h,菌株Z-7934在初始pH为7、8、9和10的培养基中,生物量(OD600)分别为0.15、0.26、0.25和0.13。
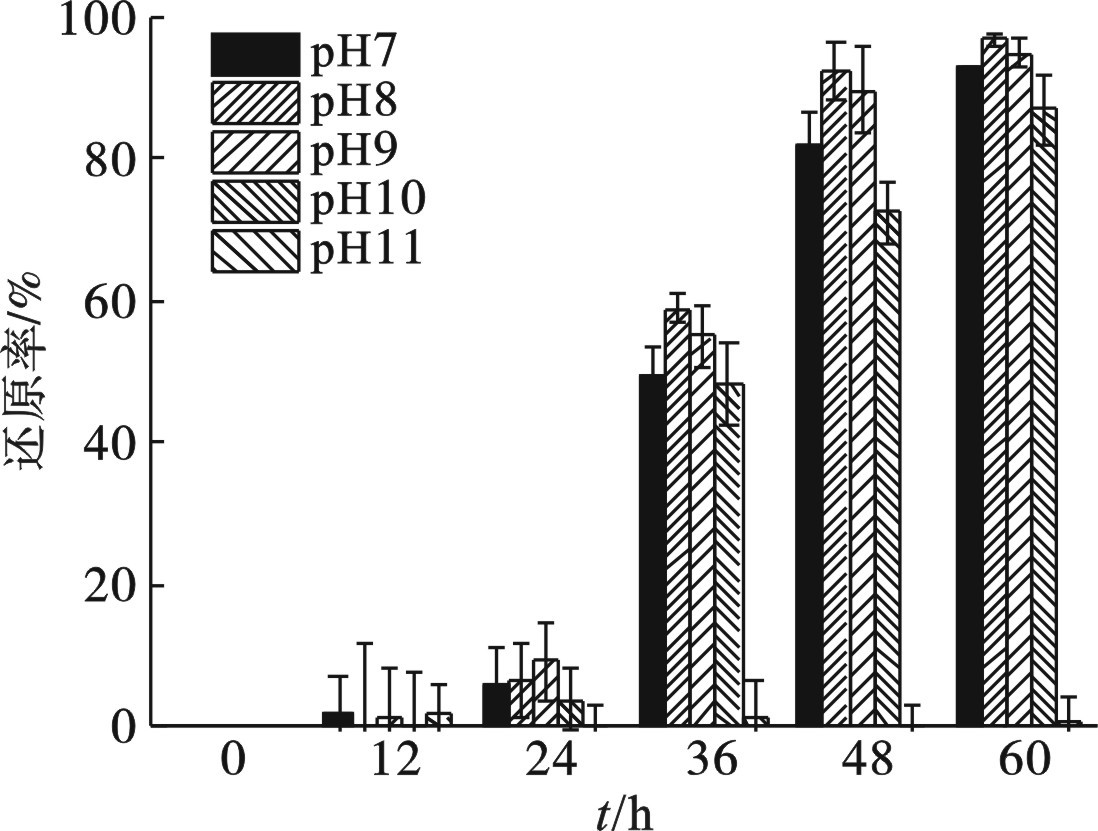
初始pH对菌株Z-7934还原Cr(Ⅵ)的影响,见图6。
在最初的24 h,生物量和Cr(Ⅵ)的还原率均较低。随着生物量的大幅提升,Cr(Ⅵ)的还原率也随之增长。第48 h时,初始pH 8和9的培养基中,Cr(Ⅵ)的还原率分别达到92.56%和89.81%,并在第60 h时分别达到96.89%和94.91%;而初始pH 10的培养基中Cr(Ⅵ)的还原率最低,仅为87.02%。
菌株Z-7934在初始pH 7~10时,均能生长并实现Cr(Ⅵ)的还原,在pH 8~9时具有更高的还原效率,说明该菌株耐碱性较好,可以实现碱性条件下的重金属异化还原。
-
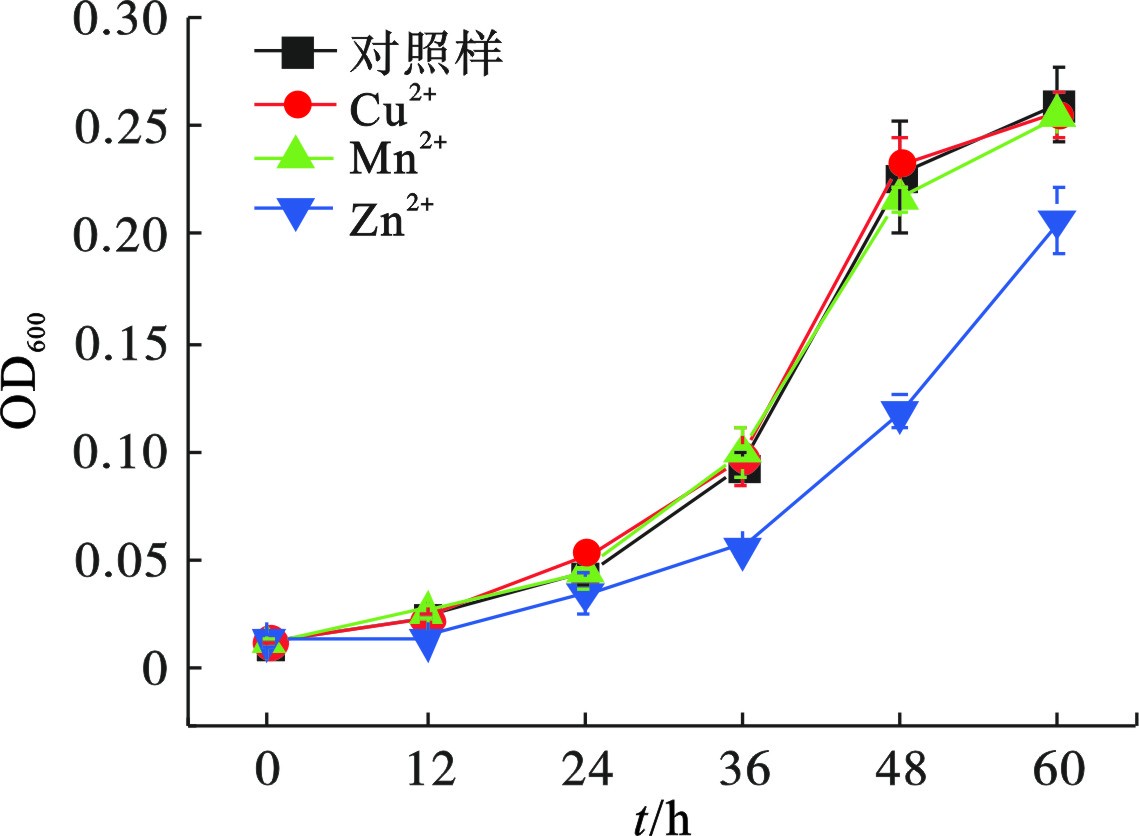
共存金属离子对菌株Z-7934生长的影响差异明显,见图7。
在添加少量Cu2+和Mn2+的培养基中,菌株Z-7934的生长与对照组并无差异,但是受到Zn2+的影响显著。在36 h时,菌株Z-7934在添加Cu2+、Mn2+和Zn2+的培养基中,生物量(OD600)分别为0.10、0.10和0.06;在60 h时,生物量(OD600)分别为0.26、0.26和0.21。
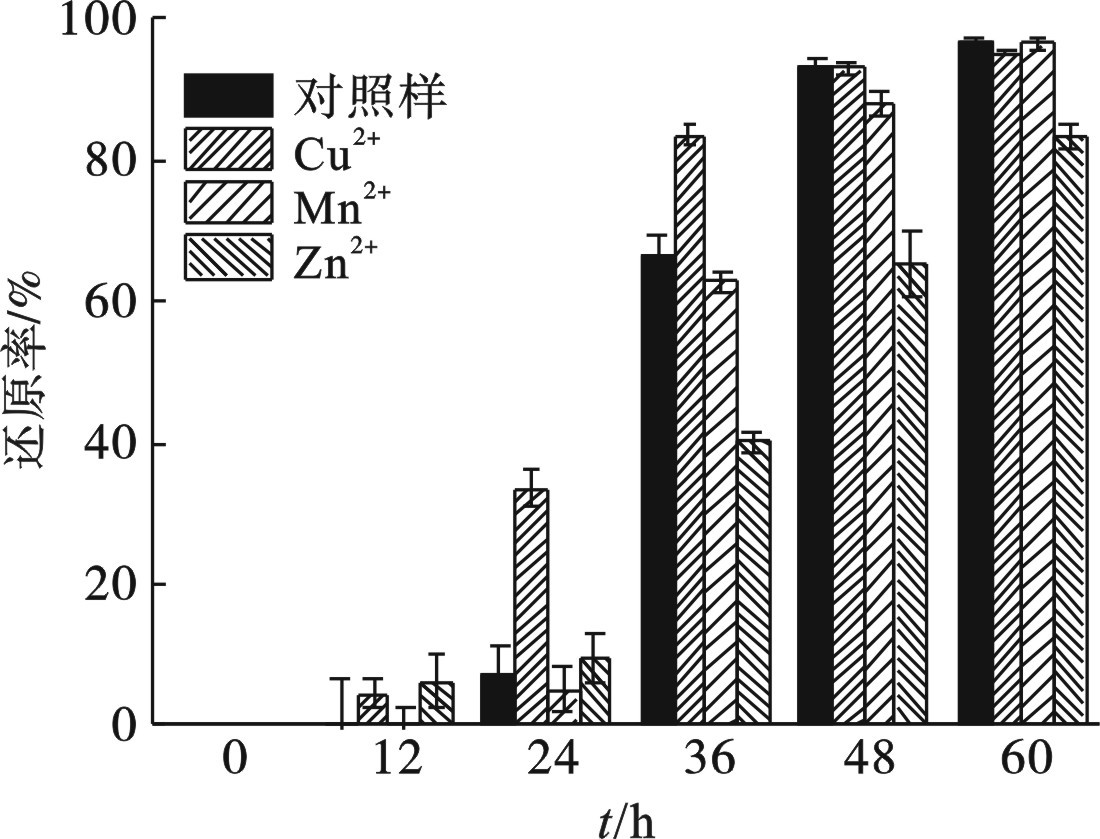
共存金属离子对菌株Z-7934还原Cr(Ⅵ)的影响,见图8。
实验结果表明,Mn2+共存对菌株Z-7934还原Cr(Ⅵ)没有显著影响。而Zn2+会抑制菌株生长,影响对Cr(Ⅵ)的还原。少量的Cu2+对菌株生长影响很小,却提升了其对Cr(Ⅵ)的还原速率。Cu2+对菌株生长和还原Cr(Ⅵ)的影响并不相同,推断原因有2种:(1)铜是微生物必需的微量元素,可能是某些还原性功能酶辅基的组成原子,在微量Cu2+的存在下,激活了与还原Cr(Ⅵ)相关酶的活性,促进了其对Cr(Ⅵ)的还原;(2)Cu2+在T. magadiensis的电子传递过程中起着一定的作用,可以辅助还原Cr(Ⅵ)进行能量代谢[19]。由于T. magadiensis被分离后,没有进行过相关代谢的研究,而其生境和生长代谢存在一定的特殊性,对其环境功能性的研究可能有一些新的发现。
添加少量的Zn2+对菌株还原Cr(Ⅵ)有抑制作用,第60 h时总还原率为83.54%,明显低于另外3组。添加Mn2+对Cr(Ⅵ)的还原影响较小,第24 h时,对照组和Mn2+实验组中Cr(Ⅵ)的还原率分别为7.11%和5.07%;第36 h时,还原率分别增长至66.46%和62.79%。添加少量Cu2+对菌株Z-7934还原Cr(Ⅵ)有促进作用,在24~36 h,对Cr(Ⅵ)的还原速率较其余3组具有明显优势,第24和第36 h时还原率分别达到33.41%和83.41%。第60 h时,由于接近还原终点,除添加Zn2+的实验组外,Cr(Ⅵ)的还原率均在95%左右,对照组、Cu2+和Mn2+实验组的Cr(Ⅵ)还原率分别为96.57%、95.06%和96.39%。
-
碱性异化金属还原菌Tindallia magadiensis可以在厌氧条件下还原少量Cr(Ⅵ),转化为Cr(Ⅲ),实现铬的减毒。在少量Cr(Ⅵ)浓度(30 mg/L),碱性条件(初始pH 8),无机碳源(NaHCO3)条件下,获得最高Cr(Ⅵ)还原率96.89%。在少量Cu2+共存时,可以加快Cr(Ⅵ)的还原。细菌T. magadiensis作为碱性厌氧环境条件下一定浓度Cr(Ⅵ)减毒的新选择,具有一定的应用潜质。
碱性异化金属还原菌T. magadiensis对Cr(Ⅵ)的还原研究
Reduction of Cr(Ⅵ) by an alkaline dissimilative metal reduction bacterium of T. magadiensis
-
摘要: 铬(Cr)作为一种环境中常见的重金属污染物,可以通过还原作用,从Cr(Ⅵ)降低价态至Cr(Ⅲ),实现减毒。该研究探讨了碱性厌氧异化金属还原菌Tindallia magadiensis对模拟含铬废水的减毒能力,分别研究了初始Cr(Ⅵ)浓度、碳源、初始pH和共存金属离子对其生长和Cr(Ⅵ)还原能力的影响。结果表明:该菌具有较好的Cr(Ⅵ)耐受能力,可在初始Cr(Ⅵ)浓度30 mg/L、pH 8、NaHCO3为碳源时,实现96.9%的Cr(Ⅵ)还原;微量Cu2+的存在还可以进一步促进对Cr(Ⅵ)的还原;T. magadiensis为碱性环境中少量Cr(Ⅵ)的微生物减毒提供了新的研究思路和菌种选择。
-
关键词:
- Cr(Ⅵ)还原 /
- 异化金属还原菌 /
- Tindallia magadiensis /
- 碱性厌氧 /
- 共存金属离子
Abstract: As a common environmental heavy metal pollutant, the toxicity attenuation of chromium (Cr) can be archived by valence state reducing from Cr(Ⅵ) to Cr(Ⅲ). In this study, the attenuation ability of an alkaline anaerobic dissimilative metal-reducing bacterium of Tindallia magadiensis was investigated in the simulated chromium-containing wastewater. Effects of initial Cr(Ⅵ) concentration, carbon source, initial pH and coexisting metal ions on its growth and Cr(Ⅵ) reduction ability were studied. The experimental results indicated that the bacterium had a good Cr(Ⅵ) tolerance, and a 96.9% Cr(Ⅵ) reduction was achieved with the initial Cr(Ⅵ) concentration of 30 mg/L, pH of 8, and NaHCO3 as the carbon source. The presence of trace Cu2+ had a promotion on the reduction of Cr(Ⅵ). The reduction of Cr(Ⅵ) by T. magadiensis provided a new research idea and an alternative way for the microbial attenuation of small amount of Cr(Ⅵ) in the alkaline environment. -
骆马湖地处江苏省北部,作为徐州市和宿迁市的重要水源地,以及我国南水北调东线工程的重要调节水库,其水质状况对人体健康和环境生态安全具有重要意义。
作为典型持久性有机污染物,多环芳烃(PAHs)具有较强的致癌、致畸、致突变等毒性[1],严重影响人体健康和生态安全。美国环境保护局(US EPA)对此高度重视,已将毒性较强的16种PAHs列在优先控制污染物[2-3]名单中。我国在发展过程中也紧跟国际社会发展需要,并结合我国实际环境污染状况,也已将7种PAHs列在我国水中优先控制污染物名单中[4]。环境中的PAHs主要来自石油等不完全燃烧、泄露、精炼及加工[5]。研究表明,我国多个地表水已被PAHs污染[6-9],且污染水平相对较高[9-11]。随着我国能源消耗的飞速增加,PAHs污染已成为我国面临的最严重环境问题之一[12]。作为京杭运河的一部分,骆马湖担负着江苏省南北航运的交通重任。船舶石油泄漏,以及骆马湖流域农业生物质的燃烧、车船尾气排放等均可对水质产生不良影响,威胁骆马湖供水和灌溉功能。然而,关于骆马湖及其入湖河流水中PAHs的时空分布特征与风险评估的报道较少。开展骆马湖流域水中PAHs的污染水平、分布及风险状况研究,对保障骆马湖水源地和饮用水安全具有重要意义。
1. 材料与方法
1.1 研究区概况
骆马湖位于江苏省北部,横跨宿迁、徐州两市,长约27 km,最大宽度约20 km,湖水面积为296 km2。充分考虑上游来水、入湖河流和骆马湖不同功能区,43个采样点覆盖水源地、国考断面、省考断面、入湖河流、入湖河流支流汇入口和骆马湖出口,采样点位布设见图1。
1.2 样品采集与处理
分别于2019年11月5~7日(枯水期)、2020年4月24~26日(平水期)和2020年7月15~16日(丰水期)采集骆马湖流域监测点位的水样,样品运输至实验室后尽快处理。
参照《气相色谱/质谱联用法测定 半挥发性有机物》 (US EPA 8270E)[13]进行水样前处理,主要过程如下:1 L水样放置于2 L分液漏斗中,加入60 g的氯化钠完全溶解后,加入60 mL二氯甲烷,振荡10 min进行液液萃取,静置后收集有机相。萃取2次后,有机相经无水硫酸钠除水,氮吹至1.0 mL以下,加入内标,定容至1.0 mL后,待测。
1.3 样品分析
运用气相色谱-质谱联用仪(Thermo, GC Trace 1300/MS ISQ7000)对16种优控的PAHs进行分析,包括萘(Nap)、苊烯(Acy)、二氢苊(Ace)、芴(Flu)、蒽(Ant)、菲(Phe)、荧蒽(Fla)、芘(Pyr)、苯并[a] 蒽(BaA)、䓛(Chr)、苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、苯并[a]芘(BaP)、二苯并[a, h]蒽 (DbA)、茚并[1, 2, 3-cd]芘(IcdP)和苯并[g,h,i]苝(BghiP)。
GC-MS色谱柱为DB-5MS石英毛细柱(30 m×250 μm×0.25 μm);进样口温度280 ℃,不分流进样;载气氦气流量1.0 mL/min;程序升温:
80℃20℃/min→180℃(5min)10℃/min→290℃(10min) 1.4 风险评估
1.4.1 健康风险评价方法
采用US EPA评价模型对骆马湖湖区水中PAHs进行健康风险评价。PAHs的日均暴露量分别计算经饮用水途径摄入量(ADIing, μg/(kg·d))和经皮肤接触水体途径摄入的量(ADIderm, μg/(kg·d)),见式(1)和(2):
stringUtils.convertMath(!{formula.content}) (1) 式中,cw为水中PAHs的实测浓度,μg/L;IR为成人每日饮用水摄入量,1.9 L/d[14];EF为暴露频率,365 d/a [14];ED为暴露期,70 a [14];BW为人体体重,62 kg [14];AT为暴露时间,25 550 d[14];
stringUtils.convertMath(!{formula.content}) (2) 式中:cw为水中PAHs的实测浓度,μg/L;KP为PAHs在皮肤中的渗透系数,cm/h;SA和ET分别为皮肤接触表面积,16 000 cm2 [14]和接触时间,
1060 PAHs单体的致癌风险指数Ri、非致癌风险指数HQi,以及总PAHs致癌风险RT和总非致癌指数HI的计算公式,见式(3~6):
stringUtils.convertMath(!{formula.content}) (3) stringUtils.convertMath(!{formula.content}) (4) stringUtils.convertMath(!{formula.content}) (5) stringUtils.convertMath(!{formula.content}) (6) 式中:ADIij为PAHi单体在第j种暴露途径的日均暴露量,μg/(kg·d);SFij为PAHi单体在第j种暴露途径的致癌物斜率因子,(kg·d)/mg;RfDij为PAHi单体在第j种暴露途径的非致癌参考剂量,mg/(kg·d)。Ri或RT在1×10−4时为最大可接受风险水平,≤10−6时表明致癌风险可忽略;HQi或HI>1表示水中PAHs存在潜在非致癌风险,<1时表示其非致癌风险可忽略[15]。
1.4.2 生态风险评价
本研究采用风险商值(RQ)评估骆马湖及其入湖河流水中PAHs对水生生物的潜在生态风险[15-16],计算见式(7~9):
stringUtils.convertMath(!{formula.content}) (7) stringUtils.convertMath(!{formula.content}) (8) stringUtils.convertMath(!{formula.content}) (9) 式中:cPAHs为水中多环芳烃的实测浓度,ng/L;cQV为风险标准值,ng/L;cQV(NCs)和cQV(MPCs)分别为PAHs的最低和最高风险标准值[16],ng/L(表1);RQNCs为最低生态风险商值,RQNCs<1时,表示生态风险极低,RQNCs≥1时,表示具有中等生态风险;RQMPCs为最高生态风险商值,RQMPCs<1为具有中等生态风险,RQMPCs≥1表示具有高生态风险[17];RQΣPAHs为16种PAHs的RQ之和,其风险评见表2。具有RQNCs和RQMPCs的10种PAHs可直接进行生态风险评价,其余6种PAHs(Ace、Acy、Fla、Pyr、BbF和 DbA)需采用毒性等效因子推出其RQNCs和RQMPCs后再进行评估[17]。
表 1 部分PAHs暴露浓度及风险计算参数物质 化合物质登记号(CAS) 皮肤渗透系数[17] SF/(kg·d) ·mg−1 RfD/mg·(kg·d)−1 c QV(NCs)/ng·L−1 cQV( MPCs)/ng·L−1 经口摄入 皮肤接触 经口摄入 皮肤接触 NaP 91-20-3 0.069 0.007 3 0.007 3 0.02 0.016 0 12.0 1 200 Acy 208-96-8 0.138 0.007 3 0.007 3 0.06 0.018 6 0.7 70 Ace 83-32-9 0.155 0.007 3 0.007 3 0.06 0.060 0 0.7 70 Flu 86-73-7 0.214 0.007 3 0.007 3 0.04 0.020 0 3.0 300 Phe 85-01-08 0.300 0.007 3 0.007 3 0.03 0.030 0 3.0 300 Fla 206-44-0 0.360 0.007 3 0.007 3 0.04 0.040 0 0.7 70 Pyr 129-00-0 0.510 0.007 3 0.007 3 0.03 0.040 0 0.7 70 BghiP 191-24-2 2.068 0.07 3 0.073 0 0.03 0.030 0 0.3 30 表 2 ∑PAHs的风险分级风险等级 RQ∑PAHs(NCs) RQ∑PAHs(MPCs) 极低风险 0~1 - 低风险 ≥1;<800 =0 中等风险 1 ≥800 =0 中等风险 2 <800 ≥1 高风险 ≥800 ≥1 部分PAHs的皮肤渗透系数、致癌斜率因子(SF)、非致癌参考计量(RfD)、最低风险标准值(cQV(NCs))和最高风险标准值(cQV(MPCs)),见表1。
2. 结果与讨论
2.1 PAHs污染水平及分布
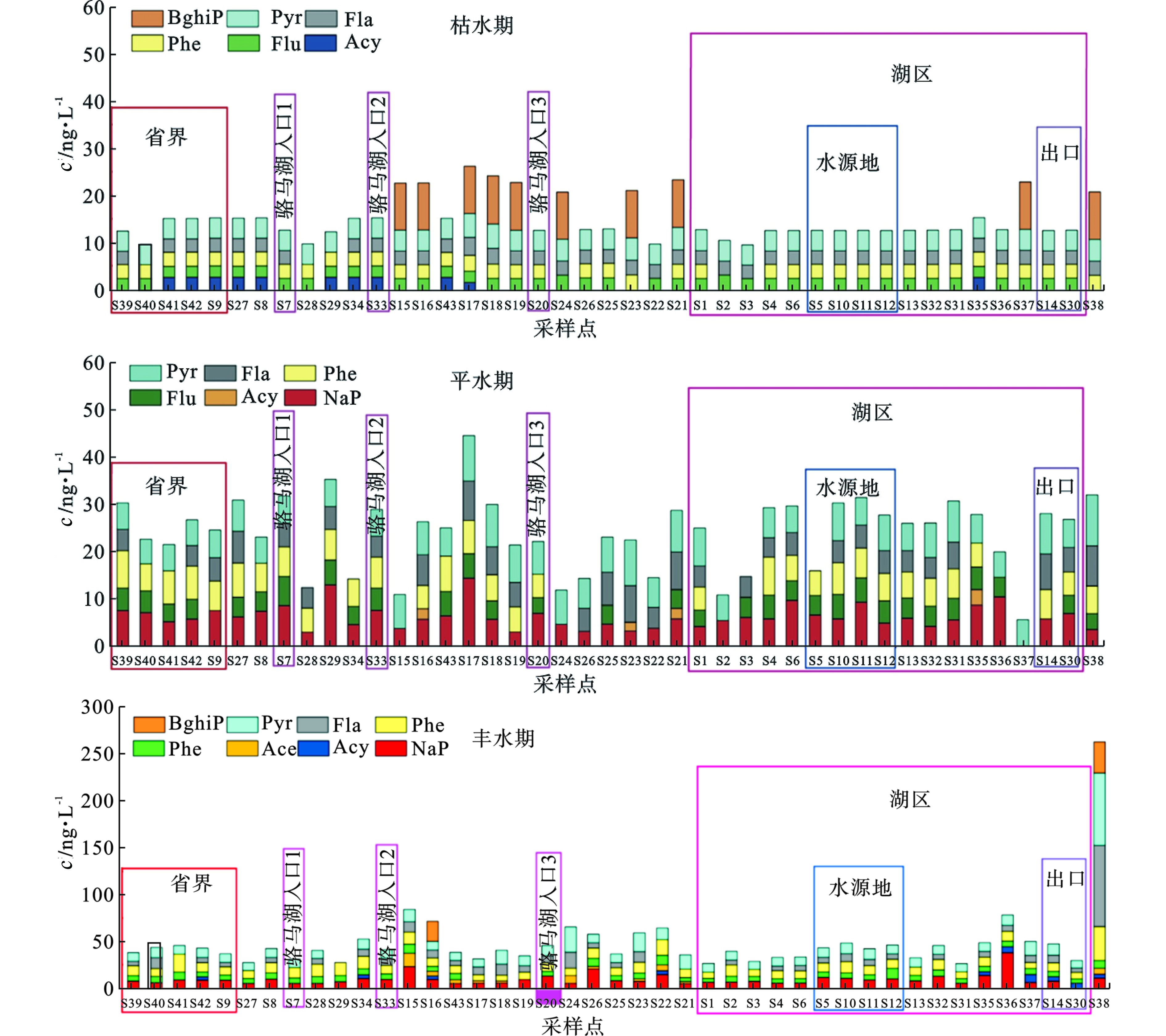
骆马湖及入湖河流水中PAHs含量,见图2。
8种PAHs检出率较高,2019年11月、2020年4月和2020年7月水中PAHs总量分别在9.45~26.1、5.45~44.3和26.3~264 ng/L。图2可知,骆马湖流域水中污染水平随时间而波动,丰水期∑PAHs的含量较高,枯水期较低。这可能因为丰水期大量的外来径流输入和大气沉降增加了PAHs的输入量[18]。此外,丰水期的风浪潮流作用等可能造成沉积物的再悬浮,再悬浮沉积物中PAHs的解析释放也可能造成水中PAHs浓度水平的增加[19]。骆马湖及入湖河流水中低环PAHs(2~3环)浓度明显高于高环PAHs(4~6环),这可能是由于PAHs在水中的溶解度随着其环数的增加而减少的原因。
骆马湖湖区水中∑PAHs含量分别为10.4~22.8 ng/L(枯水期)、10.7~31.3 ng/L(平水期)、26.3~78.2 ng/L(丰水期)。骆马湖中4个水源地点位水中PAHs含量相对较低,浓度范围在12.5~48.2 ng/L。骆马湖4个水源地、2个国考断面、1个省考断面和5个省界采样点位水中PAHs浓度均未超出我国地表水环境质量标准[20]、美国国家水质标准[21]和加拿大环境质量准则[22]中PAHs的浓度限值。骆马湖水源地水中PAHs污染水平低于京津冀(15.49~212.69 ng/L)[23]、广州(86.15~177.35 ng/L)[24]、太湖(63.5~393.9 ng /L)[25]、松花江(100 ng/L)[26]和南京(234.96 ng/L)[27]等水源地。
骆马湖及入湖河流水中ΣPAHs含量较高的点位主要位于京杭运河河道S17~S24点位。该河道S17~S24点位位于徐州市工业较密集的区域,该地区含有较高浓度PAHs的大气颗粒物和土壤可能通过干湿沉降和雨水径流等途径汇入该河道,导致S17~S24点位水中PAHs浓度较高。此外,该河道船只来往频繁,其含油废水和石油泄漏也可能造成水中PAHs含量较高。此外,宿迁船闸(S38)作为京杭运河苏北段10座大型船闸的第四梯级,承担着“北煤南运”、成品油和矿建等重点物资的运输任务,常年有苏、鲁、豫、皖、沪和浙等10多个省(市)船舶通行,航运交通繁忙可能导致该点位ΣPAHs浓度较高。
研究表明,相同分子量的PAHs环境行为相似,其挥发性、吸附性和溶解性等差异性较小,因此,相同分子量PAHs之间的浓度比值常用来推测PAHs的来源[28]。本研究采用Flu/(Flu+Pyr)的比值分析骆马湖及入湖河流水中PAHs的来源。通常情况下,Flu/(Flu+Pyr)值﹤0.4表明主要来自石油类排放,介于0.4~0.5之间表明主要来自石油和石化产品类燃烧,>0.5表明主要来自生物质、煤等燃烧[28]。京杭运河(中运河)点位及S38的Flu/(Flu+Pyr)值均﹤0.4,表明上述点位的PAHs主要来自石油排放,该地区航运交通过程中石油类燃料的泄漏可能是其主要原因。
2.2 骆马湖流域水中PAHs风险评估
2.2.1 骆马湖湖区水中PAHs健康风险评估
健康风险评价主要考虑饮水及皮肤接触途径导致的健康风险,所以仅对湖区的点位进行评价。骆马湖湖区水体中PAHs在枯水期经饮用水摄入途径及皮肤接触途径的非致癌风险值分别为8.34×10−6~2.19×10−5、1.89×10−13~6.35×10−13;平水期分别为5.57×10−6~3.40×10−5、1.00×10−13~6.93×10−13;丰水期分别为2.50×10−5~2.45×10−4、5.14×10−13~6.28×10−12,丰水期非致癌风险高于枯水期和平水期,经饮用水摄入产生的非致癌风险对总非致癌风险贡献较大。骆马湖湖区3个水期水中PAHs产生的HQ和HI均<1,表明其非致癌风险可忽略。
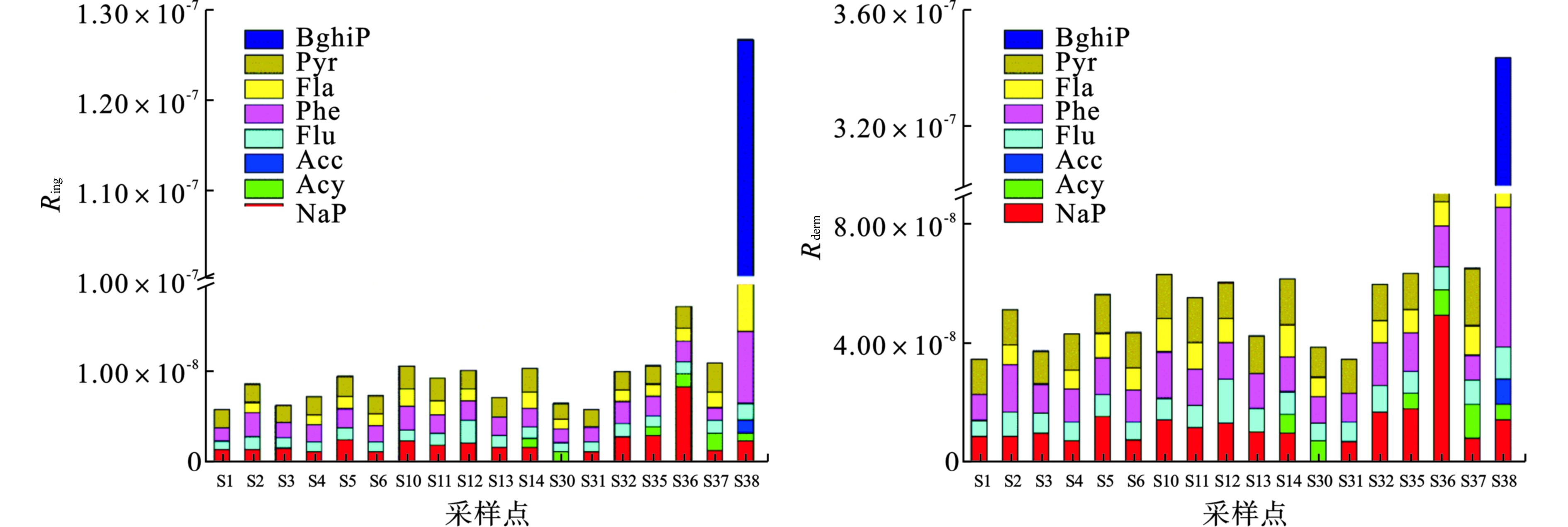
湖区水体中PAHs在枯水期经饮用水摄入途径及皮肤接触途径的致癌风险值分别2.11×10−9~2.54×10−8、1.23×10−8~2.97×10−8;平水期分别为1.92×10−9~7.11×10−9、7.08×10−9~4.13×10−8;丰水期分别为5.88×10−9~1.27×10−7、3.42×10−8~3.43×10−7。丰水期骆马湖湖区水中PAHs经饮用水摄入及皮肤接触所导致的致癌风险值,见图3。与非致癌相似,丰水期致癌风险高于枯水期和平水期,但皮肤接触暴露途径对总致癌风险贡献率大。骆马湖湖区水中的总致癌风险低于可忽略风险水平。丰水期S38水中PAHs浓度最高,其所致的致癌风险最高。由丰水期S38水体中BghiP经口摄入和Fla、Pyr经皮肤接触途径所贡献较大,其中BghiP对经饮用水摄入途径致癌风险贡献率为59.3%,Fla和Pyr对经皮肤接触途径致癌风险贡献率分别33.0%和29.3%,见表3。如前所述,S38位于宿迁船闸,航运繁忙,导致该点位水中致癌风险对其他点位较高。
表 3 点位S38和S16PAHs单体对致癌风险值和RQMPCs的贡献% 物质 S38 S16 Ring Rderm RQ∑PAHs(MPCs) RQ∑PAHs(MPCs) NaP 1.9 4.0 0.2 0.6 Acy 0.7 1.5 1.5 4.6 Ace 1.2 2.5 2.5 6.5 Flu 1.5 3.1 0.7 1.5 Phe 6.4 13.8 3.2 2.5 Fla 15.4 33.0 33.0 10.8 Pyr 13.7 29.3 29.3 11.2 BghiP 59.3 12.7 29.6 62.2 研究期间,骆马湖湖区水中单一及总致癌风险、非致癌风险均低于可忽略风险值,但在丰水期S38水中PAHs致癌风险相对较高,为保护骆马湖水资源安全,应长期关注该点位PAHs的污染水平变化。
2.2.2 骆马湖流域水中多环芳烃生态风险评估
根据表1、表2及PAHs的监测结果,2019年11月,骆马湖入湖河流水体中PAHs的RQMPCs值<1,检出的Fla、Pyr和Acy的RQNCs值>1,S2、S17、S18、S23、S25~S27、S35、S36、S41检出的Phe的RQNCs值>1,表明骆马湖流域水中Fla、Pyr、Acy和Phe具有中等风险。2020年4月,PAHs的RQMPCs值<1,Flu、Pyr、Acy和Phe的RQNCs值>1,为中等风险。
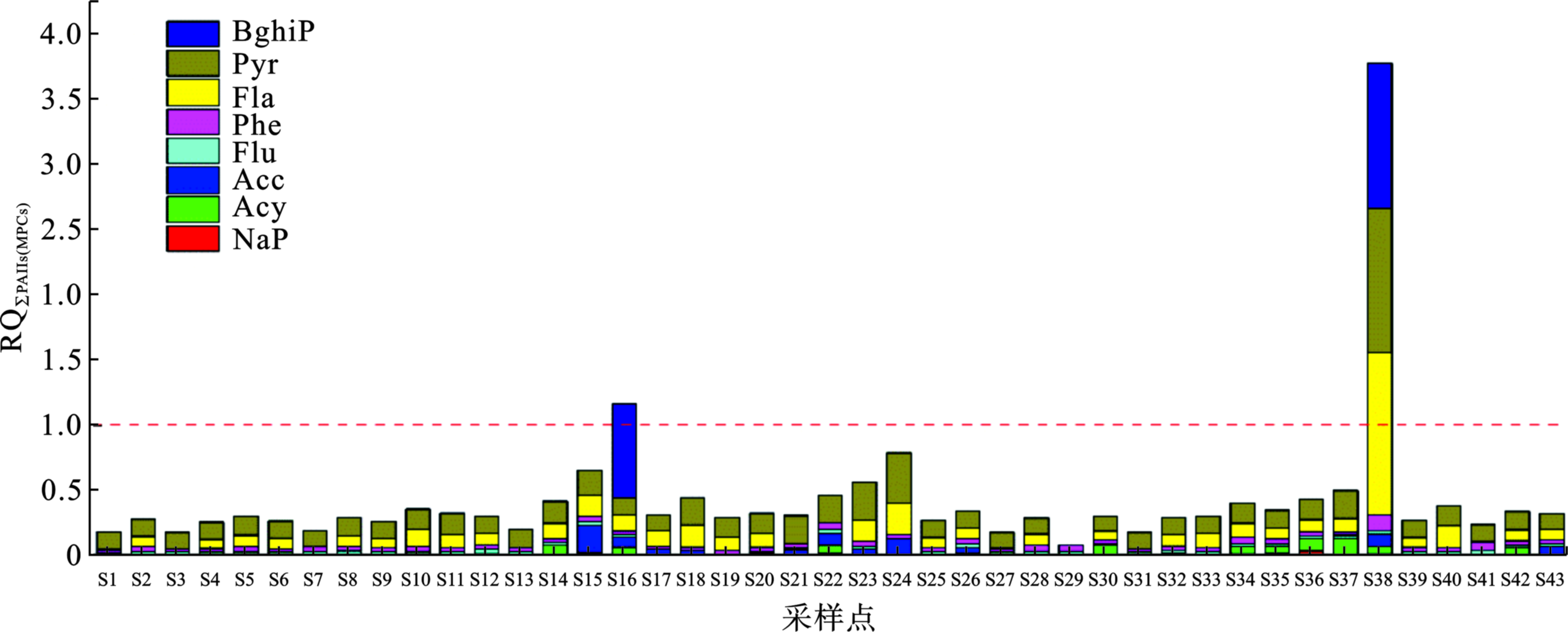
2020年7月S38水中Fla、Pyr和BghiP的RQMPCs值>1,表明S38的Fla、Pyr和BghiP为高风险,其他点位的RQMPCs值<1,Flu、Pyr、Acy、Phe、Ace及S15、S20、S22、S26、S32、S35、S36的NaP,其RQNCs值>1,表明具有中等风险。RQ∑PAHs(NCs)和RQ∑PAHs(MPCs)分析表明,2020年7月,S16和S38水中RQ∑PAHs(MPCs)≥1,见图4,RQ∑PAHs(NCs)<800,表明该2个点位水中PAHs可能对水生生物造成中等生态风险,应当重点关注。
S16水中BghiP对该点位的RQ∑PAHs(MPCs)贡献最大(62.2%),S38水中Fla、BghiP和Pyr对该点位的RQ∑PAHs(MPCs)贡献大,分别为33.0%、29.6%和29.3%;BghiP、Pyr、Fla、Phe和Flu对生态风险RQ∑PAHs(NCs)贡献也较大,见表3。骆马湖流域水中RQ∑PAHs( MPCs)和RQ∑PAHs(NCs)总体呈丰水期>平水期>枯水期,与PAHs的浓度变化规律一致。
3. 结论
(1)骆马湖及其入湖河流枯水期、平水期和丰水期水中PAHs总量分别在9.45~26.1 、5.45~44.3和26.3~264 ng/L。ΣPAHs含量较高的点位主要位于京杭运河河道等航运繁忙的区域。骆马湖流域内的4个水源地、2个国考断面、1个省考断面和5个省界采样点位水中PAHs质量浓度均低于相应的水质标准限值。
(2)骆马湖湖区水中PAHs的致癌风险和非致癌风险可忽略,经饮用水暴露途径对非致癌风险贡献率较大,经皮肤接触暴露途径对致癌风险贡献率较大。
(3)骆马湖及入湖河流S16和S38水体中ΣPAHs在丰水期可能对水生生物造成中等生态风险,其中S38水中Fla、BghiP和Pyr为高风险PAHs单体。
(4)骆马湖流域中宿迁闸(S38)航运繁忙,其水体中ΣPAHs含量较高,致癌风险相对较大,生态风险较高,需对该点位给予重点关注。
-
[1] JOBBY R, JHA P, YADAV A K, et al. Biosorption and biotransformation of hexavalent chromium [Cr(Ⅵ)]: A comprehensive review[J]. Chemosphere, 2018, 207(SEP.): 255 − 266. [2] LI Z , MA Z , KUIJP T J V D , et al. A review of soil heavy metal pollution from mines in China: Pollution and health risk assessment[J]. Science of the Total Environment, 2014, s 468-469: 843 − 853. [3] 赵堃, 柴立元, 王云燕, 等. 水环境中铬的存在形态及迁移转化规律[J]. 工业安全与环保, 2006(8): 1 − 3. [4] 徐衍忠, 秦绪娜, 刘祥红, 等. 铬污染及其生态效应[J]. 环境科学与技术, 2002(增1): 8 − 9. [5] 王谦, 李延, 孙平, 等. 含铬废水处理技术及研究进展[J]. 环境科学与技术, 2013, 36(增2): 150 − 156. [6] 国家环境保护总局, 国家质量监督检验检疫总局. 地表水环境质量标准: GB 3838—2002 [S/OL]. (2006-10-27)[2020-10-20]. http://www.mee.gov.cn/ywgz/fgbz/bz/bzwb/shjbh/shjzlbz/200206/W020061027509896672057.pdf. [7] 刘婉, 李泽琴. 水中铬污染治理的研究进展[J]. 广东微量元素科学, 2007(9): 5 − 9. [8] 江澜. 微生物治理铬污染的应用与发展[J]. 重庆工商大学学报(自然科学版), 2006(2): 132 − 135. [9] 刘丽红, 谢桂琴, 王晓萍. 异化金属还原菌及其应用[J]. 哈尔滨师范大学自然科学学报, 2008(3): 81 − 84. [10] KEVBRIN V V, ZHILINA T N, RAINEY F A, et al. Tindallia magadii gen. nov. sp. nov. : An alkaliphilic anaerobic ammonifier from soda lake deposits[J]. Current Microbiology, 1998, 37(2): 94 − 100. doi: 10.1007/s002849900345 [11] CHILDERS S E, CIUFO S, LOVLEY D R. Geobacter metallireducens accesses insoluble Fe(Ⅲ) oxide by chemotaxis[J]. Nature, 2002, 416(6882): 767 − 769. doi: 10.1038/416767a [12] LOVLEY D R, FRAGA J L, BLUNT-HARRIS E L, et al. Humic substances as a mediator for microbially catalyzed metal reduction[J]. Acta Hydrochimica et Hydrobiologica, 2010, 26(3): 152 − 157. [13] NEVIN K P, LOVLEY D R. Mechanisms for accessing insoluble Fe(Ⅲ) oxide during dissimilatory Fe(Ⅲ) reduction by geothrix fermentans[J]. Appl Environ Microbiol, 2002, 68(5): 2294 − 2299. doi: 10.1128/AEM.68.5.2294-2299.2002 [14] VALI H, WEISS B, LI Y L, et al. Formation of tabular single-domain magnetite induced by Geobacter metallireducens GS-15[J]. Proceedings of the National Academy of Sciences, 2004, 101(46): 16121 − 16126. doi: 10.1073/pnas.0404040101 [15] 汪明霞, 王娟, 司友斌. Shewanella oneidensis MR-1异化还原Fe(Ⅲ)介导的As(Ⅲ)氧化转化[J]. 中国环境科学, 2014, 34(9): 2368 − 2373. [16] 徐卫华. 微生物还原Cr(Ⅵ)的特性与机理研究[D]. 长沙: 湖南大学, 2007. [17] 牛永艳, 陈正军, 赵帅, 等. 铬还原菌的分离筛选及其在微生物燃料电池生物阴极中的应用[J]. 微生物学通报, 2017, 44(7): 1631 − 1638. [18] 魏蓝. 土壤微生物对六价铬的还原及稳定化效果研究[D]. 苏州: 苏州科技大学, 2017. [19] ABE F, MIURA T, NAGAHAMA T, et al. Isolation of a highly copper-tolerant yeast, Cryptococcus sp. from the Japan Trench and the induction of superoxide dismutase activity by Cu2+[J]. Biotechnology Letters, 2001, 23(24): 2027 − 2034. doi: 10.1023/A:1013739232093 -





 下载:
下载: