-
厌氧氨氧化 (anammox) 是新型的生物脱氮技术,相较传统的硝化-反硝化生物脱氮工艺具有无需依赖外部碳源、能耗低、排泥量小等优势。然而,由于该工艺体系中厌氧氨氧化菌通常与反硝化菌共存,anammox过程中的N2O排放问题不容忽视[1-2]。作为非碳型温室气体,N2O在100年时间尺度的全球增温潜势是CO2的273倍[3]。因此,由此产生的温室效应对评估anammox工艺的降碳潜力影响巨大。传统硝化-反硝化工艺的N2O排放因子 (即消耗每单位氮素所产生的N2O量) 为0.01%~3.3%,而anammox工艺的N2O排放因子可达1.2%~12% ,且受到多种环境因子的影响,包括进水亚硝酸盐(NO2−)的浓度、中间产物羟胺 (NH2OH) 积累与消耗速率,以及微生物群落演替[4-6]。LAWSON等[1]发现anammox菌与其颗粒中的反硝化菌相互依赖,虽然anammox过程本身不涉及N2O的产生,但考虑到体系中与anammox菌共存的反硝化菌同步反硝化途径的作用,会导致anammox体系排放N2O [7]。因此,有必要研究不同工艺条件下anammox体系的N2O排放变化规律及其调控机制。
NO2−和NH2OH对anammox工艺有不同的影响。NO2−对于anammox是一种抑制剂,其对于anammox的抑制作用随环境条件 (pH、温度等) 的变化而不同,最低抑制阈值一般不低于100~300 mg·L−1;NO2−的IC50范围为150~600 mg·L−1[8]。而NH2OH对anammox体系有抑制作用,当[NH2OH]为40~80 mg·L−1时anammox受到抑制,通过PCR实验测定其阈值为70 mg·L−1,超过阈值时菌体将失去活性[9]。少量的NH2OH不会抑制氨氧化菌 (ammonia-oxidizing bacteria,AOB) 与anammox,还可恢复anammox菌的活性,[NH2OH]为5 mg·L−1时即可选择性抑制NOB,并促进硝化反应启动[10]。
NH2OH氧化与NO2−还原也是产生N2O的重要代谢途径,涉及功能微生物主要是氨氧化菌 (AOB) 以及反硝化菌[11]。NH2OH氧化途径可通过生物或非生物过程实现,但一些研究表明NH2OH的非生物途径产生的N2O可忽略不计[5]。在生物途径中,AOB菌可通过羟胺氧化还原酶 (hao) 氧化NH2OH并分解,NO是这个过程的中间体;另外,NH2OH还可通过cytochrome P460氧化成N2O,并与NO络合物相互作用[12-13]。而NO2−还原途径中,AOB菌在此途径下以氨、氢、丙酮酸盐作为电子供体还原NO2−,特别是在缺氧条件或NO2−累积的条件下[14]。NH2OH氧化及NO2−还原是脱氮系统中N2O的主要来源,且这2种方式可同时发生[15-17]。虽然许多研究致力于区分NH2OH氧化、NO2−还原对N2O的贡献,但结论大都表明两者难以区分,脱氮体系中N2O的产生被认为是这些途径的单一或协同作用[18]。因此,在anammox体系中,NH2OH和NO2−对anammox系统中N2O的产生机制仍不明确。对此,虽然有研究表明当[NO2−]为400 mg·L−1 时,体系中N2O随NH2OH增加,但对不同[NO2−]条件下的研究仍有所欠缺[6, 19]。
基于此,本研究以anammox体系作为研究对象,设定不同[NO2−]条件以考察NH2OH对N2O产量的影响,探究体系脱氮效率与功能菌群结构的变化,从而优化NH2OH与NO2−的投加策略,为anammox体系的低碳运行提供参考。
-
本实验使用anammox颗粒污泥作为菌种,该颗粒污泥在实验室规模的UASB反应器中连续运行一年,其厌氧氨氧化活性 (specific anammox activity, SAA) 为(79±4.08)mg·(g·h)−1。实验所用UASB反应器的工作体积为1 L,运行温度控制在(35±1) ℃,并用遮光布包裹反应区。蠕动泵将模拟废水连续泵入反应器底部,反应器上部的溢流堰出水,菌体产气则从反应器顶部的气室收集排出。除了分析取样外,反应器不额外排泥。模拟废水中的成分主要为NH4+、NO2−、无机盐溶液及微量元素,其中NH4+、NO2−分别以(NH4)2SO4、NaNO2的形式添加,具体配方参考文献[20]。
-
批次实验采用血清瓶作为容器,其总体积为250 mL,有效体积为180 mL。在每升无菌水加入100 mL无机盐溶液和0.15 mL微量元素I和II,初始COD设定为500 mg·L−1。批次实验中的组分与母反应器的模拟废水一致,即微量元素I中含有5 g·L−1 EDTA,9.14 g·L−1FeSO4·7H2O;微量元素II含有15 g·L−1 EDTA,0.014 g·L−1 H3BO4,0.99 g·L−1 MnCl2·4H2O,0.43 g·L−1 ZnSO4·7H2O,0.25 g·L−1 CuSO4·5H2O,0.24 g·L−1 CoCl2·6H2O,0.22 g·L−1 NaMoO4·2H2O和0.21 g·L−1 NiCl2·6H2O[20]。在实验前,为去除泥浆中残存的NH4+与NO2−,用无机盐溶液对颗粒污泥样品进行清洗 (3次以上) 。将anammox菌分别暴露于[NO2−]为100、300、500 mg·L−1 条件下,继而向实验组中添加不同浓度NH2OH(0、10、30、50 mg·L−1)。NH2OH的生成和消耗速度都很快,故本研究采用性质较为稳定的盐酸羟胺(NH2OH·HCl)进行批次实验(表1)。另外,用1 mol·L−1的HCl和NaOH将用每各血清瓶内的pH调至约7.5。然后,用N2吹扫血清瓶顶空气体以及液相 (15min及以上) 以去除O2,并及时密封。所有批次实验均在恒温振动培养箱中进行,转速与温度控制在120 r·min−1和35 ℃。用注射器定时取样 (4 ℃保存) ,结束后测定瓶内污泥的浓度 (SS和VSS) 和水样氮素质量浓度,每组实验均重复3次。
-
[NH4+]、[NO2−]、[NO3−]、COD分别使用纳氏试剂分光光度法、N- (1-萘基) -乙二胺分光光度法和紫外分光光度法、重铬酸钾法测定。SS、VSS使用焚烧称重法 (国家环保局,2002) 测定, 比厌氧氨氧化活性 (SAA) 定义为每天每克挥发性悬浮物 (VSS) 的基质消耗速率[21]。亚硝氮及氨氮的去除率分别定义为NRE(nitrite removal efficiency)、ARE(ammonium removal efficiency);总氮的去除率则定义为TNRE(total nitrogen removal efficiency)。通过气袋收集N2O,并用配备微池电子捕获检测器 (µ-ECD) 的Agilient 6890N气相色谱测定其排放量。
在实验结束时,采集约5 mL污泥,保存于-80 ℃冰箱中。选取3组中的对照组,以及实验组中N2O排放量最小和最大的组共9个样本进行Illumina MiSeq测序分析 (Majorbio Company ,中国上海) 。利用通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5’-GGACTACHVGGGTWTCTAAT-3’) 对16s rRNA基因的V3~V4区扩增并测序。采用主成分分析法 (principal component analysis, PCA) 分析比较不同分组样品间群落的β多样性差异,并用相似性分析 (ANOSIM) 进行差异检验。通过PICRUSt2功能预测结果与KEGG数据库对比,得到KO(KEGG Orthology)功能的丰度预测,从而得出功能基因丰度。
-
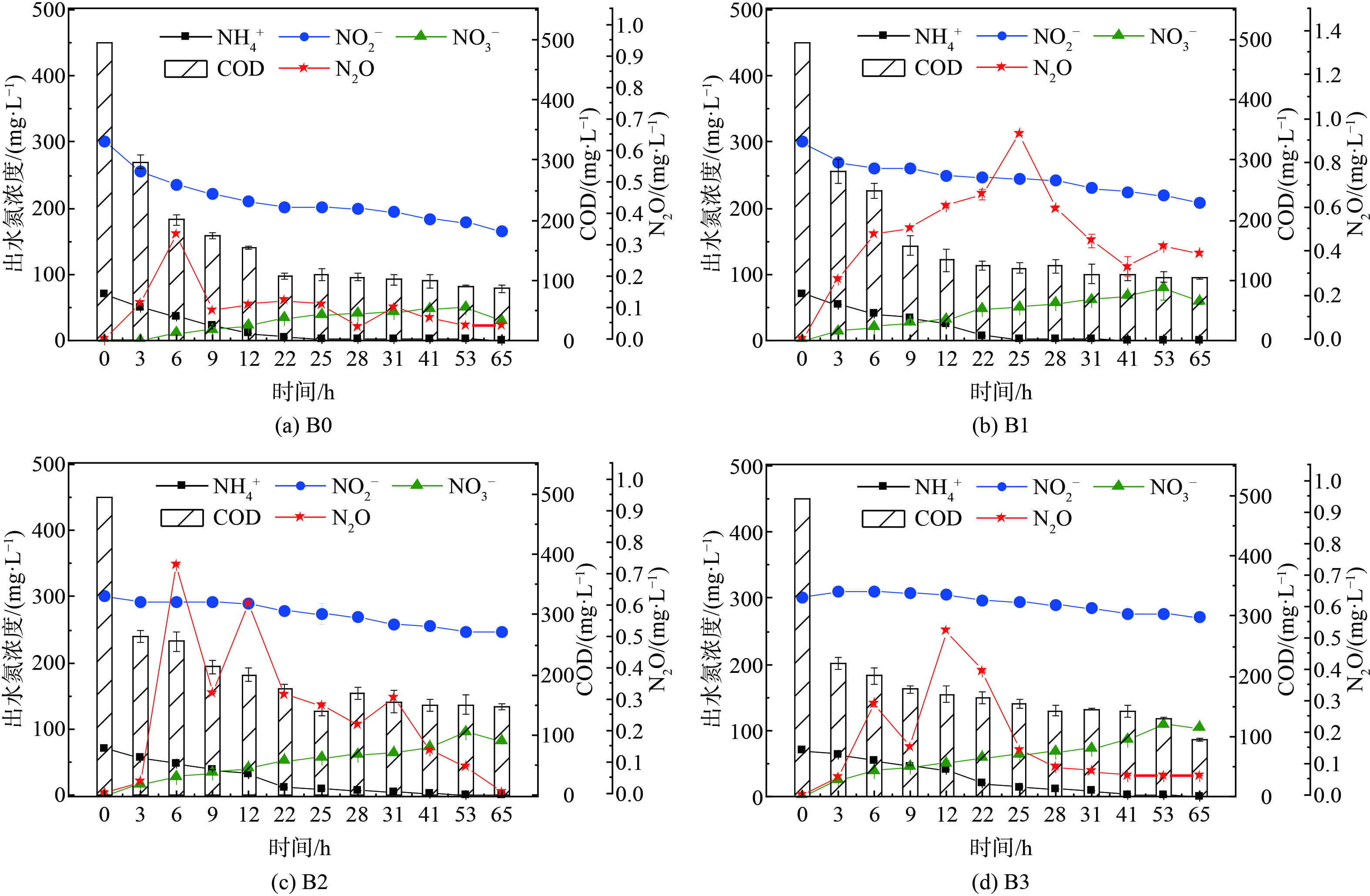
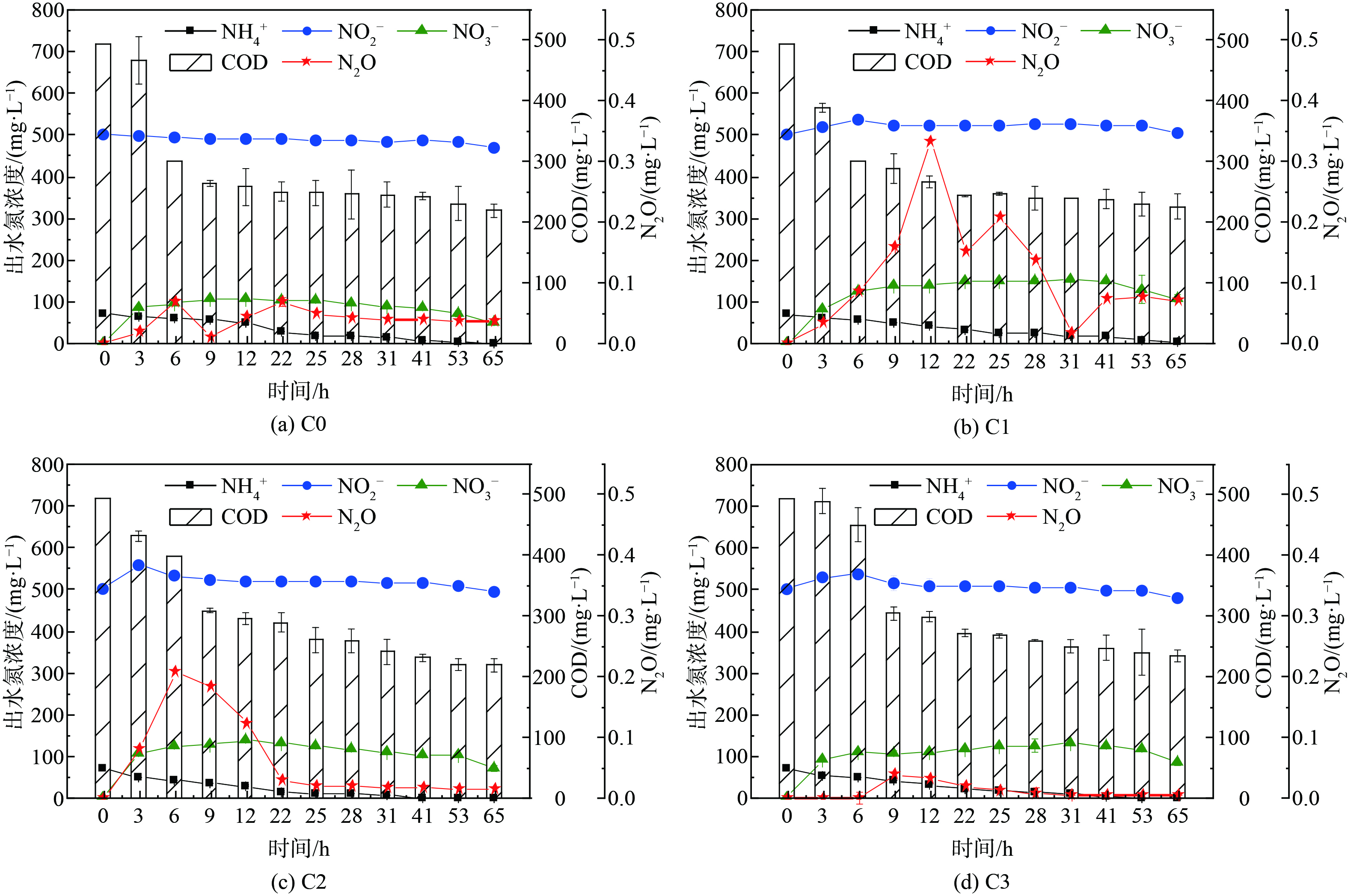
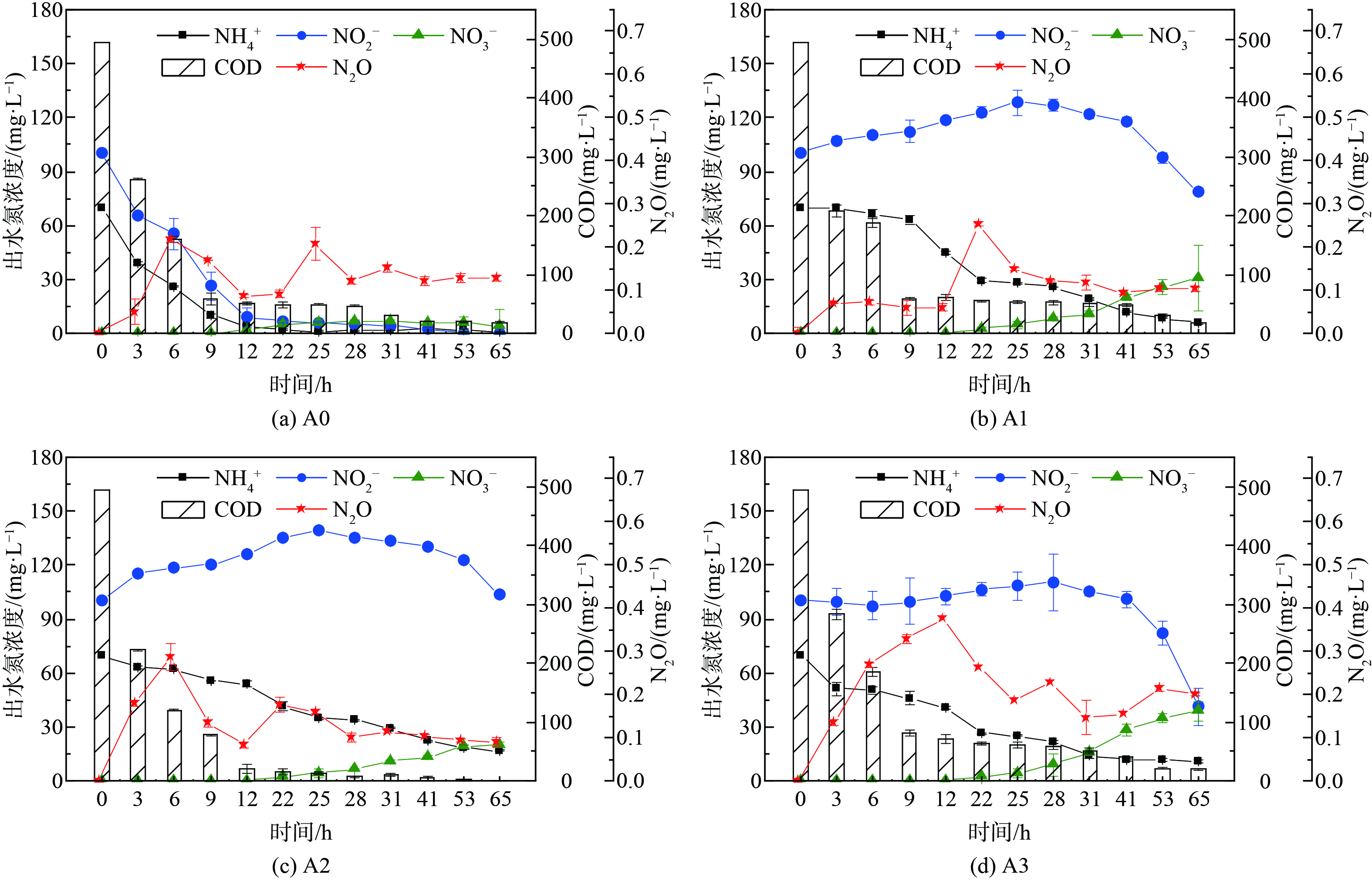
如图1~3所示,当anammox菌分别暴露于[NO2−]为100、300、500 mg·L−1 的体系中,添加不同浓度的NH2OH(0、10、30、50 mg·L−1)。在反应结束时 (65 h) ,各组中 (除A0外) NO2−均有残留,这说明添加NH2OH后NO2−在体系内累积,而NH4+的残留量均较低,同时体系中的NO3−也逐渐积累。另外,anammox体系中N2O的产量随时间波动,但大致先增加后下降,各组N2O分别在6~25 h达到最高峰。
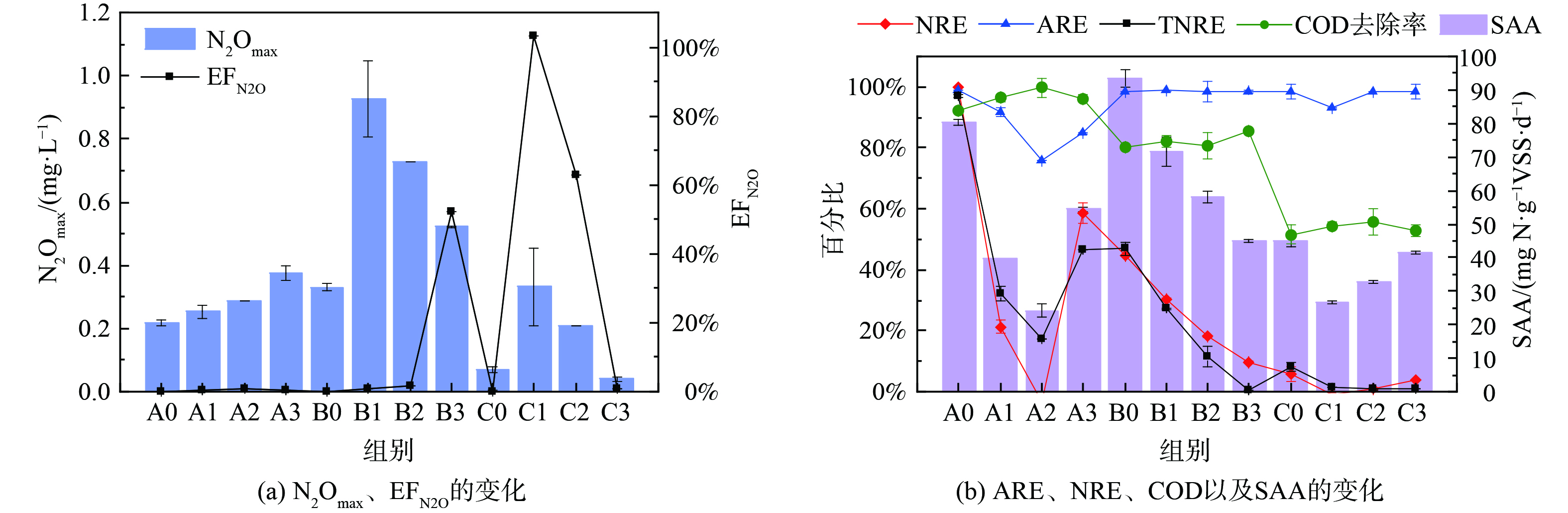
为探究NH2OH与NO2−对anammox体系的综合影响,在不同[NO2−]下分别添加质量浓度为0、10、30、50 mg·L−1 NH2OH。有趣的是,不同[NO2−]下A、B、C三组对NH2OH的反应不一致。图4(b)表明,对比不同[NH2OH]下的脱氮效率,发现anammox体系中NRE、TNRE、SAA的总体趋势均为下降,而A、C两组中A3、C3的脱氮效率略有恢复,这说明NH2OH对于anammox体系的抑制作用可能是可逆的。各组的ARE值始终保持在较高水平,在A组中的变化趋势与NRE一致,始终高于75%,在B、C两组中则始终高于98%;说明当NO2−浓度为100 mg·L−1时,ARE会受NH2OH浓度影响;但当NO2−浓度提高到300和500 mg·L−1时,NH2OH对ARE没有明显影响,并且始终保持在较高水平。大量研究证明NH2OH对于NOB有抑制作用,而对于AOB有促进作用,从而有利于anammox体系中NH4+的消耗及NO2−的积累[9-10, 22-23]。如图4(a)所示,在A组中,N2Omax随[NH2OH]递增,而B、C两组均为先增加后下降,B、C两组中N2Omax最高的是B1和C1组,且B1>C1。因此,在[NO2−]为100~300 mg·L−1时,anammox体系中微生物可能倾向于通过NH2OH氧化途径生产N2O;而[NO2−]为300~500 mg·L−1时,anammox体系中加入10 mg·L−1 NH2OH会刺激N2O的产生,而进一步提高[NH2OH](30、50 mg·L−1)能抑制N2O增长[15]。EFN2O (去除每单位氮素所排放的N2O) 与N2Omax的变化趋势不一致,A、C两组中的EFN2O值均为先增加后下降,而B组则随[NH2OH]增加而递增;3组实验中EFN2O的最高值主要集中在[NH2OH]较高 (即A2、B3、C1组) 时,且C1>B3>A2。值得注意的是,对比各实验组的脱氮效率与N2O排放量,发现TNRE、NRE及SAA的变化趋势与EFN2O呈反比,但与其直接产量 (N2Omax) 没有明显相关性,这说明anammox体系脱氮效果越好,N2O的单位产量 (EFN2O) 越低。以上分析表明,anammox体系的脱氮效率及N2O产量是NO2−与NH2OH综合作用的结果。本研究针对anammox体系中N2O的减排提出了NH2OH与NO2−的投加策略,但在实际污水处理工程中,如何进一步提高anammox菌的富集度及有效控制NO2−的去除率 (NRE) 仍是一个挑战,需通过连续流anammox反应器长期运行以寻求最佳平衡点。
-
1) 微生物群落分析。选取各组中N2Omax与EFN2O最高及最低的组别进行16s rRNA分析。细菌群落的丰富度和多样性如表2所示,其中ACE和Chao指数越大,表明物种丰富度越多,而Shannon指数越大和Simpson指数越小,表明群落的多样性越高[24]。在实验结束时,A、C两组的群落丰富度ACE、Chao指数随[NH2OH]增长而增加,Shannon指数则随之增大,说明其群落丰富度与多样性均增加。B组中的ACE与Chao指数随[NH2OH]先减少后增加,而Shannon指数增加,Simpson指数减少,说明其群落丰富度先减后增,而多样性则持续增加。因此,NH2OH有提高anammox体系的群落丰富度和多样性的潜力,但在不同[NO2−]下有不同效果。
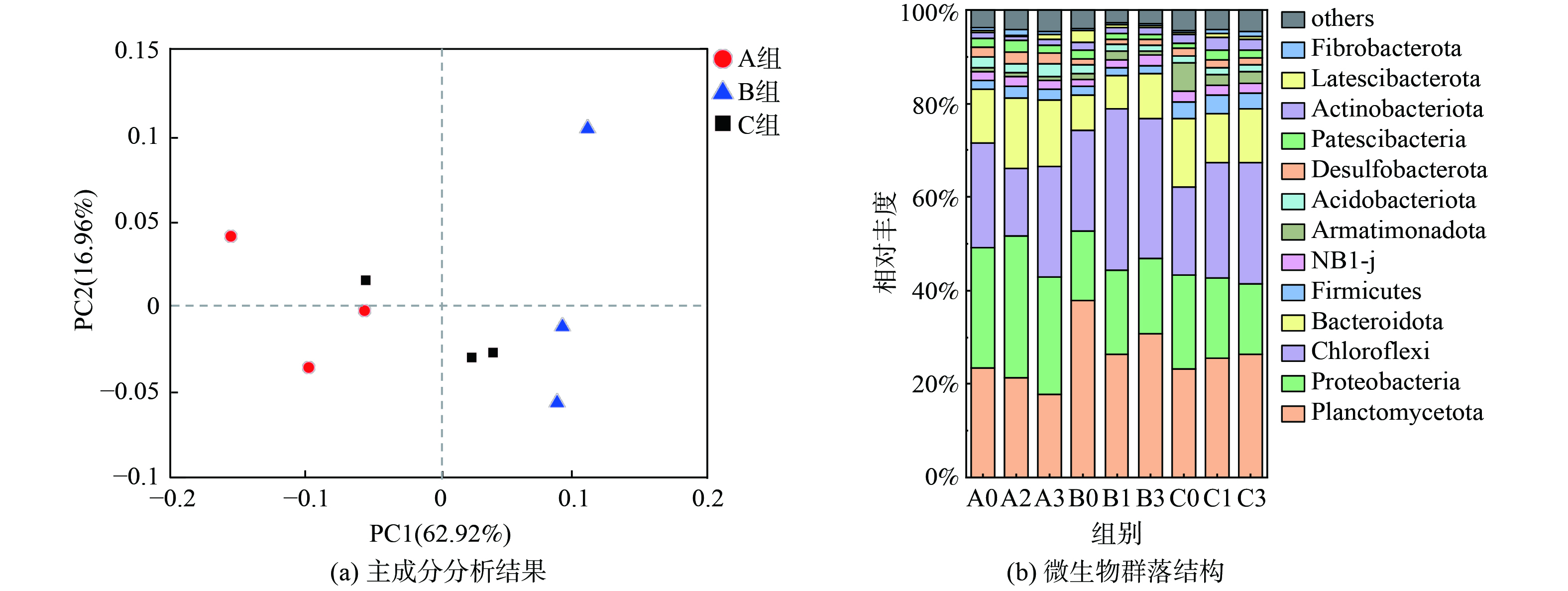
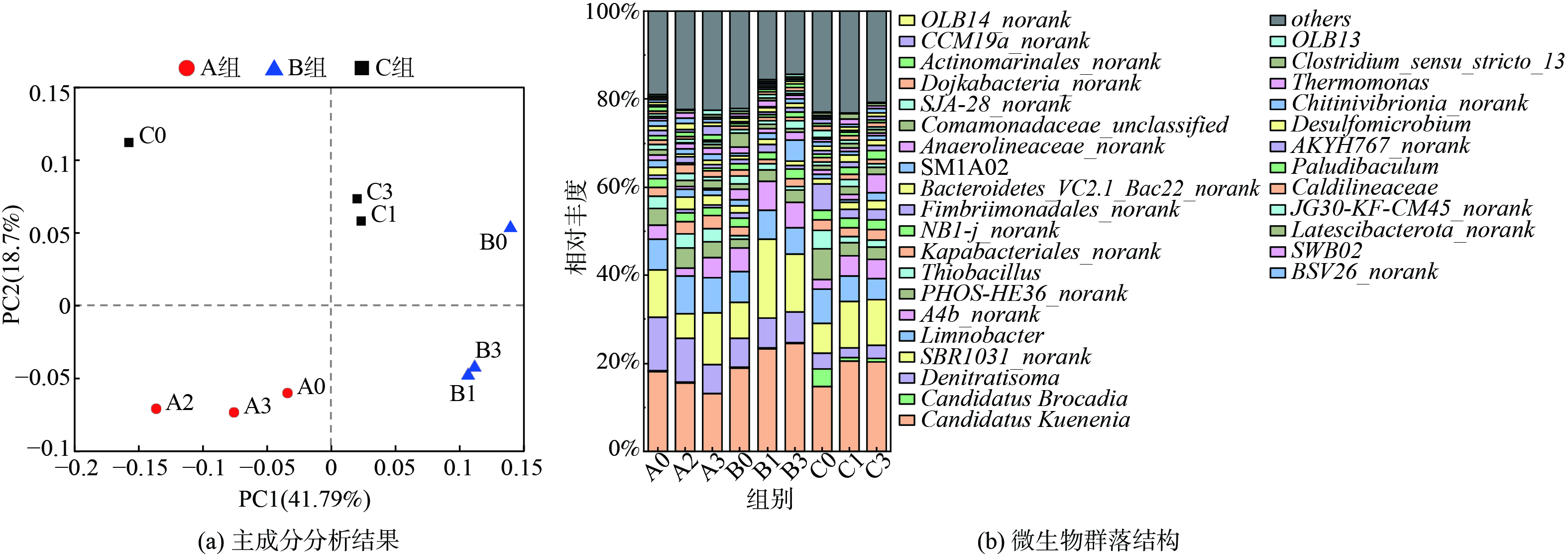
微生物门水平的主成分分析 (PCA) 结果如图5 (a) 所示,成分因子1 (PC1) 与成分因子2 (PC2) 对数据点差异性贡献率分别为62.92%和16.96%。从象限分布来看,A、B、C三组之间的群落结构差异比组内样本间的差异更大,说明NO2−与NH2OH的质量浓度变化对anammox菌落都有影响,但NO2−的影响更大。如图5 (b) 所示,在门水平上 (相对丰度>0.1%) 各反应器的优势菌均为Planctomycetes、Chloroflexi、Proteobacteria。Proteobacteria和Chloroflexi经常被发现与Planctomycetes共生,Planctomycetes和Proteobacteria含有许多与脱氮相关的细菌,对anammox系统有重大贡献[25]。对比不同[NH2OH]下anammox菌门水平的变化,发现当[NO2−]较低时(100 mg·L−1),三组菌群中Planctomycetes的相对浓度逐渐降低;当[NO2−]提高(300 mg·L−1)时,B1与B3组的Planctomycetes相比B0组降低27.58 %、16.97 %;当[NO2−]提高到500 mg·L−1时,三组中Planctomycetes的相对浓度逐渐提高。在A组中,Bacteroidetes、Proteobacteria和Chloroflexi的相对丰度之和逐渐增加,分别为59.70%、59.74%、62.94%;B组中先增加后下降,分别为43.94%、59.69%、55.76%,而C组中三者的相对丰度之和相近,分别为53.46%、52.35%、52.33%。Planctomycetes主要负责anammox过程,在缺乏NO2−时,anammox反应会减弱;而anammox 颗粒污泥中 Bacteroidetes、Proteobacteria和Chloroflexi等门均为异养菌,能以微生物源有机物 (如胞外多聚物、溶解性微生物产物和细胞凋亡产物) 为能源,并能进行反硝化作用,故具有释放N2O的潜能[24, 26]。
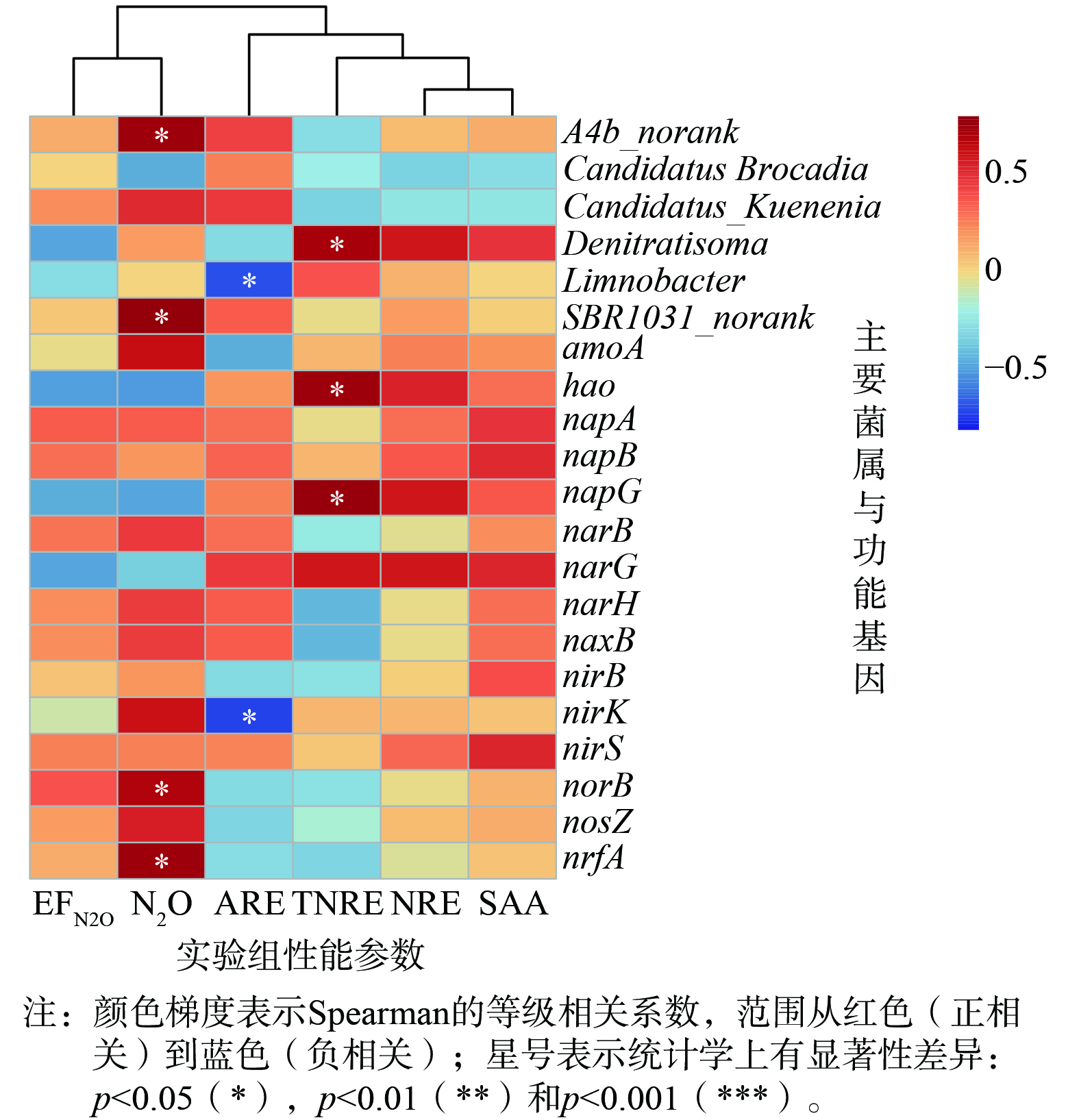
微生物属水平结构的PCA结果如图6 (a) 所示,成分因子1 (PC1) 与成分因子2 (PC2) 对数据点差异性贡献率分别为41.79%和18.7%。从象限分布来看,A、B、C三组的组间差异较为显著,而组内样本差异较小,说明[NO2−]对anammox菌体的影响较大。如图6 (b) 所示,在属水平上 (相对丰度>0.05 %) Candidatus Kuenenia (13.11%~24.51%) 和Candidatus Brocadia (0.084%~4.03%) 被鉴定为anammox功能菌。其中,Candidatus Kuenenia是系统中始终占优势的anammox菌属。当不添加NH2OH时,[NO2−]为100、300、500 mg·L−1的3个实验组 (A0、B0、C0) 中,Candidatus Kuenenia的相对丰度逐渐降低,B0、C0组相比A0组分别降低了16.53%、18.80%,说明anammox菌的生长受到NO2−的不利影响。另外,C0组中Candidatus Brocadia的浓度是A0、B0组的22.71、17.59倍,说明anammox菌能够应对高[NO2−] (500 mg·L−1) 的抑制,而且Candidatus Brocadia对于NO2−的适应性比Candidatus Kuenenia更强。对比不同[NO2−]下NH2OH对anammox体系的影响,发现添加NH2OH能缓解高质量浓度NO2− (500 mg·L−1) 的毒性,从而促进Candidatus Kuenenia的生长,但在[NO2−]较低时 (100 mg·L−1) 反而会产生抑制作用。此外,Denitratisoma、SBR1031、Limnobacter以及A4b_norank也是优势菌属。异养菌SBR1031 (9.28%~17.91%) 与A4b_norank (2.04%~7.32%) 与N2O之间存在显著相关性 (P<0.05) 。A2、A3组中SBR1031的相对丰度比A0组增加了5.69%、9.47%,而B组中B1、B3组是B0组的2.73倍、2.00倍,C1、C3组较C0组高56.36%、35.54%;A4b_norank在各组中的变化趋势与SBR1031相同。值得注意的是,上述相对丰度的变化与N2Omax的变化趋势 (见图4 (a) ) 一致。SBR1031和A4b_norank都属于Chloroflexi门,其中 SBR1031属于Anaerolineae科,在体系其代谢功能与NH4+相关,可清除细胞碎片和细胞外蛋白,促进anammox污泥颗粒化,但SBR1031其他的特殊功能还不清楚;A4b_norank则属于Anaerolineae纲,此类菌带有亚硝酸盐还原酶基因 (nir) ,能够将NO2−转化为NO[27-28],其作为异养菌在anammox体系中广泛存在,有利于维持厌氧微环境并维持脱氮系统的稳定,anammox中几乎所有的异养菌都具有部分反硝化的能力,将NO3−转化为NO2−,从而与NOB细菌一同完成亚硝酸盐循环,也因此具有释放N2O的潜能[1, 29]。本研究发现当[NO2−]较低时 (100 mg·L−1) ,NH2OH会增加体系中异养菌的相对丰度,降低anammox菌的丰度,从而促进体系内N2O的释放;在[NO2−]较高时 (300 mg·L−1、500 mg·L−1) ,添加NH2OH有利于anammox菌和异养菌的生长,而且anammox是NO的消耗者,能将NO与NH4+偶联,也可通过NO还原来保存能量和生长,从而降低体系内N2O的释放量,故N2Omax (图4(a)) 随[NH2OH]增大而回落[30-31]。另外,体系中存在的Denitratisoma (57.62%±2.96%) 、Limnobacter (60.24%±1.22%) 都是反硝化菌,属于Proteobacteria门。Denitratisoma具有盐还原基因 (nitrite reductase, nir) ,使得anammox体系具有积累N2O的可能性,而Limnobacter则具有降解N2O的潜力,因此,anammox体系中的N2O积累也可是反硝化菌综合作用的结果。综上所述,anammox体系的脱氮效率与N2O排放是NO2−和NH2OH共同作用的结果,当[NO2−]较高时可提高NH2OH的投加量,在刺激anammox生长同时控制N2O的产量,而[NO2−]较低时不投加NH2OH可能是更好的选择。
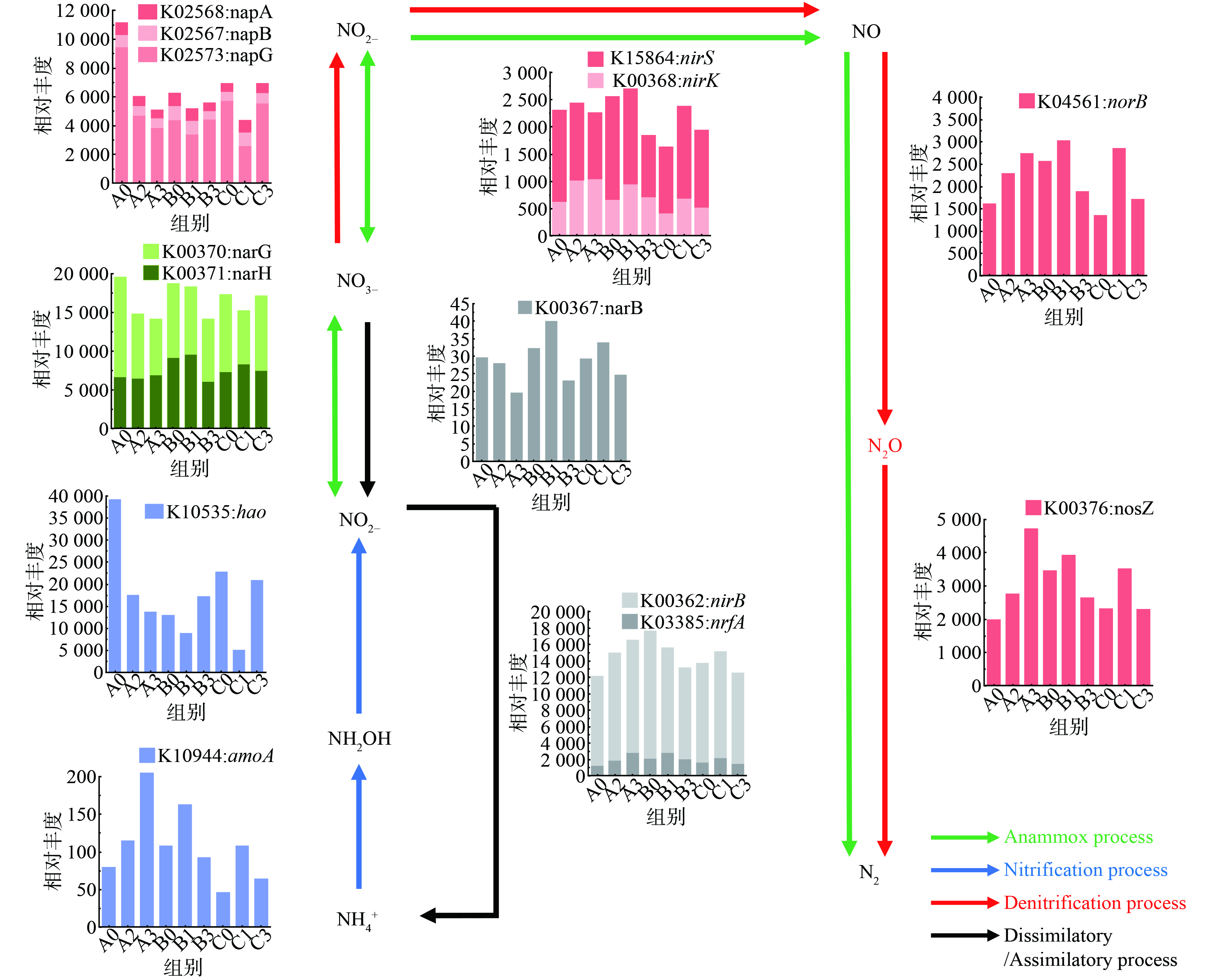
2) 功能基因分析。在生物脱氮过程中,N2O主要来源于NH2OH氧化或硝化反硝化途径。如图7所示,NH4+通过氨单加氧酶 (amo) 的作用被分子氧氧化为NH2OH,之后NH2OH在羟胺氧化还原酶 (hao) 的作用下以分子氧作为电子受体被氧化为NO2−。此时,N2O主要产生于NH2OH的不完全氧化。亚硝酸盐还原酶 (nirK) 和—氧化氮还原酶 (norB) 都是与AOB菌相关的酶,NirK将NO2−还原为NO,norB再将NO还原为N2O。反硝化过程的中间产物主要包括NO2−,NO,N2O,分别由硝酸盐还原酶 (nar),亚硝酸盐还原酶 (nir),一氧化氮还原酶 (nor) 及氧化亚氮还原酶 (nos) 催化产生[2, 15, 17, 30, 32-34]。
如图7所示,硝化途径中当[NO2−]较低时 (A组) ,A2、A3组中的丰度是A0组的1.44倍、2.56倍,此时NH2OH将促进amoA的生长;而当[NO2−]增大 (B、C组中) 时,其中B1组中的丰度相比B0、B3组增长50.93%、75.27%,C1组中的丰度是C0、C3组的2.35倍、1.69倍,B1、C1 (即[NH2OH]为10 mg·L−1时) amoA的丰度最高,这与N2Omax的变化趋势 (图4 (a) ) 相同,而hao的变化则与amoA相反。有研究表明,amoA (氨单加氧酶) 基因存在于AOA当中,可将NH4+氧化成NH2OH,AOB相比异养反硝化菌而言具有更强的NO2−还原能力,N2O是其最终产物;Hao (羟胺氧化还原酶) 作为anammox系统中常见的基因,也参与NO的氧化还原,进一步验证了NH2OH代谢对于anammox中N2O释放的影响[35]。在反硝化途径中,norB与nosZ的变化趋势相似,而且norB的丰度与N2O排放量呈现显著正相关 (图8) ,可见此体系中反硝化途径对N2O有较强的促进作用。当[NO2−]较低 (100 mg·L−1) 时,norB与nosZ的丰度都随[NH2OH]而上升,其中A2、A3组中norB的丰度相比A0组增长41.54%和68.76%,nosZ则分别增加39.56%、138.36%。但当[NO2−]较高 (300、500 mg·L−1) 的B、C两组中,B3中norB的丰度相较B0、B1组减少26.29%、60.29%,nosZ的丰度则分别减少23.75%、48.74%;在C组中,C3组中norB的丰度相较C1组减少39.97%,nosZ的丰度则减少34.27%。可见当[NO2−]较高时,高浓度 (50 mg·L−1) NH2OH下norB与nosZ的丰度均降低,由此减少anammox体系中N2O的排放。有研究表明,在氮代谢途径中,反硝化基因norB和nosZ是与N2O代谢直接相关的基因,norB的作用在于将NO还原成N2O,而nosZ是现今唯一被发现的N2O还原酶,能将N2O转化成N2,norB与nosZ来源于Bacteroidetes、Chloroflexi、Planctomycetes及Proteobacteria,其中Proteobacteria的贡献最大。一系列研究表明,其丰度与N2O释放量呈正相关[31, 36]。除此以外,本实验还发现反硝化途径中各组的nirK的变化趋势与N2Omax趋同 (将图7与图4(a)对比) ,而nirS变化趋势与A0、B0、C0三组 (变量仅为NO2−) 的N2Omax相同。大多数nirS来源于Proteobacteria,是一种同时含有c和d1型血红素的亚硝酸盐还原酶,nirK则是一种含铜的亚硝酸盐还原酶[37]。有研究证明,一些硝化细菌含有nirK和nirS基因,可在厌氧条件下通过反硝化释放N2O,而nirS的相对丰度与反硝化过程中的N2O相关[11, 35]。因此,猜测anammox体系能通过nirS和nirK形成NO,进而增加体系中的N2O,nirK在NH2OH氧化与NO2−还原途径中均可能存在,而nirS在NO2−还原途径中担任更重要的作用。值得注意的是,不同[NO2−]下nrfA (亚硝酸还原酶) 与N2O排放量也呈现显著正相关 (图8) ,这说明DNRA途径也参与N2O代谢。完全的DNRA反应 (NO2−完全转化为NH4+) 不会产生N2O,但anammox体系中NO2−的大量积累会导致不完全的DNRA反应,N2O也由此产生,如何避免这种不完全的DNRA仍需进一步研究[38]。
-
1) 在anammox体系中,NO2−和NH2OH都不利于anammox体系的脱氮效率,N2O产量则是NO2−与NH2OH综合作用的结果。当[NO2−]为100~300 mg·L−1时, NH2OH不利于N2O的减排;当[NO2−]增至300、500 mg·L−1时,质量浓度为10 mg·L−1 NH2OH会刺激N2O,而[NH2OH]为30、50 mg·L−1 则能抑制N2O。2) 异养菌SBR1031与A4b_norank与N2O排放量之间存在显著相关性 (P<0.05) 。NO2−为100~300 mg·L−1时,NH2OH促进异养菌的生长,并抑制Candidatus Kuenenia;在NO2−增至300 mg·L−1、500 mg·L−1时,NH2OH有利于Candidatus Kuenenia和异养菌的生长。3) N2O的释放量与硝化途径(amoA、hao) 、反硝化途径(nirS、nirK、norB、nosZ)以及DNRA途径(nrfA)有关,并与功能基因norB、nrfA呈显著正相关(P<0.05) 。
NH2OH与NO2−对anammox体系中N2O排放的影响
Effect of NH2OH and NO2− on N2O emission of anammox system
-
摘要: 厌氧氨氧化(anammox)为新型生物脱氮工艺,面临N2O温室气体排放问题。羟胺(NH2OH)与亚硝酸盐 (NO2−) 是影响anammox体系N2O排放的重要环境因子。基于批次实验,考察了不同质量浓度NH2OH和NO2−对anammox体系中N2O释放的影响。结果表明,在[NO2−]为100~300mg·L−1条件下,N2O排放量随NH2OH质量浓度递增;而当[NO2−]增至300~500 mg·L−1,投加高质量浓度NH2OH(30、50 mg·L−1)能抑制N2O的产生。微生物群落多样性分析表明,低[NO2−]的环境中,NH2OH会增加体系中异养菌的相对丰度,并抑制anammox菌的生长;而在高[NO2−]的环境中,高质量浓度的NH2OH可促进anammox菌与共存异养细菌的生长。功能基因分析表明,N2O的排放量受到硝化、反硝化及硝酸盐异化还原产铵(DNRA)代谢途径调控,并与norB、nrfA基因丰度呈显著正相关(P<0.05 ) 。因此,anammox体系N2O产量受到NO2−与NH2OH综合作用的影响,当进水[NO2−]较高时可通过投加适量NH2OH降低N2O排放量,而当进水NO2−不足时可通过抑制NH2OH的累积量以减少N2O的生成。该研究结果可为anammox工艺的低碳运行提供参考。Abstract: As a new biological nitrogen removal technology, anaerobic ammonium oxidation (anammox) is faced with N2O emissions, a greenhouse gas with high global warming potential. Hydroxylamine (NH2OH) and nitrite (NO2−) are key environmental factors affecting N2O emissions in the anammox system. Based on batch experiments, the effects of NH2OH and NO2− concentrations on N2O release in anammox process were investigated. The results showed that at low NO2− concentration (100 mg·L−1), the N2O emission increased with NH2OH concentration. However, at high NO2− concentration (300,500 mg·L−1), adding high concentrations of NH2OH (30, 50 mg·L−1) could reduce N2O production. Microbial community analysis showed that at low NO2− concentration, adding NH2OH increased the relative abundance of heterotrophic bacteria while inhibited the growth of anammox bacteria. At high NO2− concentration, high doses of NH2OH promoted the growth of anammox bacteria and coexisting heterotrophic bacteria. Functional gene analysis showed that N2O emissions were regulated by nitrification, denitrification, and dissimilatory nitrate reduction to ammonium (DNRA) pathways and were positively correlated with the abundance of norB and nrfA genes (P<0.05). Therefore, the N2O production in the anammox system is influenced by the combined effects of NO2− and NH2OH. When treating influent with high NO2− concentration, supplying an appropriate amount of NH2OH can reduce N2O emissions. On the other hand, in the case of insufficient nitrite, reducing NH2OH accumulation may mitigate N2O formation. This study provides a reference for operating the anammox process in a low-carbon-emission manner.
-
Key words:
- anammox /
- N2O /
- hydroxylamine /
- NO2− /
- microbial community /
- functional genes
-

-
表 1 不同实验组NO2−/ NH2OH的初始质量浓度
Table 1. Initial NO2−/ NH2OH concentration in different experimental groups
组别 [NO2−]/(mg·L−1) [NH2OH]/(mg·L−1) A0 100 0 A1 100 10 A2 100 30 A3 100 50 B0 300 0 B1 300 10 B2 300 30 B3 300 50 C0 500 0 C1 500 10 C2 500 30 C3 500 50 表 2 微生物群落的丰富度和多样性
Table 2. Richness and diversity of microbial communities
组别 群落丰富度指数 群落多样性指数 ACE Chao Shannon Simpson A0 868.9 919.3 4.140 0.053 A2 882.4 889.2 4.260 0.045 A3 903.4 923.3 4.401 0.037 B0 889.3 911.2 3.904 0.085 B1 803.4 814.2 3.937 0.058 B3 843.4 831.1 3.961 0.055 C0 929.3 976.2 4.366 0.035 C1 942.1 942.1 4.487 0.033 C3 956.4 961.0 4.376 0.036 -
[1] LAWSON C E, WU S, BHATTACHARJEE A S, et al. Metabolic network analysis reveals microbial community interactions in anammox granules[J]. Nature Communications, 2017, 8: 15416. doi: 10.1038/ncomms15416 [2] LU X, PEREIRA D S, AL-HAZMI H E, et al. Model-based evaluation of N2O production pathways in the anammox-enriched granular sludge cultivated in a sequencing batch reactor[J]. Environmental Science & Technology, 2018, 52(5): 2800-2809. [3] IPCC. Climate Change 2021: The Physical Science Basis[R]. Cambridge: Cambridge University Press, 2021. [4] LACKNER S, GILBERT E M, VLAEMINCK S E, et al. Full-scale partial nitritation/anammox experiences-An application survey[J]. Water Research, 2014, 55: 292-303. doi: 10.1016/j.watres.2014.02.032 [5] LAW Y , LANT P, YUAN Z. The confounding effect of nitrite on N2O production by an enriched ammonia-oxidizing culture[J]. Environmental Science & Technology, 2013, 47(13): 7186-94. [6] TERADA A, SUGAWARA S, HOJO K, et al. Hybrid nitrous oxide production from a partial nitrifying bioreactor: Hydroxylamine interactions with nitrite[J]. Environmental Science & Technology, 2017, 51(5): 2748-2756. [7] 郝晓地, 杨振理, 于文波, 等. 污水处理过程N2O排放: 过程机制与控制策略[J]. 环境科学, 2023, 44(2): 1163-1173. [8] LIN L M, STEVEN P, RATTIER M, et al. Individual and combined effect of salinity and nitrite on freshwater Anammox bacteria (FAB)[J]. Water Research, 2020, 169: 114931. doi: 10.1016/j.watres.2019.114931 [9] 邢崇阳, 范禹辰, 陈璇等. 羟胺对厌氧氨氧化污泥群落的影响[J]. 环境科学, 2020, 41(7): 3365-3372. [10] LI J, ZHANG Q, LI X, et al. Rapid start-up and stable maintenance of domestic wastewater nitritation through short-term hydroxylamine addition[J]. Bioresource Technology, 2019, 278: 468-472. doi: 10.1016/j.biortech.2019.01.056 [11] WUNDERLIN P, MOHN J, JOSS A, et al. Mechanisms of N2O production in biological wastewater treatment under nitrifying and denitrifying conditions[J]. Water Research, 2012, 46(4): 1027-37. doi: 10.1016/j.watres.2011.11.080 [12] LAW Y, NI B, LANT P, et al. N2O production rate of an enriched ammonia-oxidising bacteria culture exponentially correlates to its ammonia oxidation rate[J]. Water Research, 2012, 46(10): 3409-19. doi: 10.1016/j.watres.2012.03.043 [13] EMILIE N P , COURTENSA H D C, SIEGFRIED E V, ROBIN J, et al. Nitric oxide preferentially inhibits nitrite oxidizing communities with high affinity for nitrite[J]. Journal of Biotechnology, 2015, 193. [14] WRAGEA N, VELTHOFB G L, BEUSICHEMA M L, et al. Role of nitrier denitrication in the production of nitrous oxide[J]. Soil Biology & Biochemistry, 2001, 33(2001): 1723±1732. [15] ALI M, RATHNAYAKE R M, ZHANG L, et al. Source identification of nitrous oxide emission pathways from a single-stage nitritation-anammox granular reactor[J]. Water Research, 2016, 102: 147-157. doi: 10.1016/j.watres.2016.06.034 [16] IRISA T, HIRA D, FURUKAWA K, et al. Reduction of nitric oxide catalyzed by hydroxylamine oxidoreductase from an anammox bacterium[J]. Journal of Bioscience and Bioengineering, 2014, 118(6): 616-21. doi: 10.1016/j.jbiosc.2014.05.018 [17] MA C, JENSEN M, SMETS B F, et al. Pathways and controls of N2O production in nitritation-anammox biomass[J]. Environmental Science & Technology, 2017, 51(16): 8981-8991. [18] XIAO P, AI S, ZHOU J, et al. N2O profiles in the enhanced CANON process via long-term N2H4 addition: Minimized N2O production and the influence of exogenous N2H4 on N2O sources[J]. Environmental Science and Pollution Research, 2020, 27(30): 37188-37198. doi: 10.1007/s11356-019-06508-w [19] ZHAO J, ZHAO JQ, YANG W, et al. Mechanisms of NO and N2O production by enriched nitrifying sludge in a sequencing batch reactor: Effects of hydroxylamine[J]. Journal of Environmental Management, 2022, 316: 115237. doi: 10.1016/j.jenvman.2022.115237 [20] XU J, WU X, ZHU N, et al. Anammox process dosed with biochars for enhanced nitrogen removal: Role of surface functional groups[J]. Science of the Total Environment, 2020J 748: 141367. [21] WANG Y, MA X, ZHOU S, et al. Expression of the nirS, hzsA, and hdh Genes in Response to Nitrite Shock and Recovery in Candidatus Kuenenia stuttgartiensis[J]. Environmental Science & Technology, 2016, 50(13): 6940-7. [22] ZHAO J, ZHAO JQ, XIE S, et al. The role of hydroxylamine in promoting conversion from complete nitrification to partial nitrification: NO toxicity inhibition and its characteristics[J]. Bioresource Technology, 2021, 319: 124230. doi: 10.1016/j.biortech.2020.124230 [23] XU G, XU X, YANG F, et al. Partial nitrification adjusted by hydroxylamine in aerobic granules under high DO and ambient temperature and subsequent Anammox for low C/N wastewater treatment[J]. Chemical Engineering Journal, 2012, 213: 338-345. doi: 10.1016/j.cej.2012.10.014 [24] XU J, WU X, ZHU N, et al. Roles of MnO2 on performance, sludge characteristics and microbial community in anammox system[J]. Science of the Total Environment, 2018, 633: 848-856. doi: 10.1016/j.scitotenv.2018.03.214 [25] ZHAO Y P, LIU S F, JIANG B, et al. Genome-centered metagenomics analysis reveals the symbiotic organisms possessing ability to cross-feed with anammox bacteria in anammox consortia[J]. Environmental Science & Technology, 2018, 52(19): 11285-11296. [26] ZHANG X J, ZHOU Y X, ZHENG T F, et al. Toxic effects of CuO, ZnO and TiO2 nanoparticles in environmental concentration on the nitrogen removal, microbial activity and community of Anammox process[J]. Chemical Engineering Journal, 2018, 332: 42-48. doi: 10.1016/j.cej.2017.09.072 [27] JIANG H, WANG Z, REN S, et al. Culturing sludge fermentation liquid-driven partial denitrification in two-stage Anammox process to realize advanced nitrogen removal from mature landfill leachate[J]. Journal of Hazardous Materials, 2021, 415: 125568. doi: 10.1016/j.jhazmat.2021.125568 [28] JIANG M, JI S, WU R, et al. Exploiting refractory organic matter for advanced nitrogen removal from mature landfill leachate via anammox in an expanded granular sludge bed reactor[J]. Bioresource Technology, 2023, 371: 128594. doi: 10.1016/j.biortech.2023.128594 [29] LI J, LIU Q, GU Y, et al. The response of anaerobic ammonium oxidation process to bisphenol-A: Linking reactor performance to microbial community and functional gene[J]. Science of the Total Environment, 2022, 838: 156030. doi: 10.1016/j.scitotenv.2022.156030 [30] HU Z, WESSELS H J, ALEN T V, et al. Nitric oxide-dependent anaerobic ammonium oxidation[J]. Nature Communications, 2019, 10(1): 1244. doi: 10.1038/s41467-019-09268-w [31] KARTAL B, TAN N C, BIEZEN V D, et al. Effect of nitric oxide on anammox bacteria[J]. Applied and Environmental Microbiology, 2010, 76(18): 6304-6. doi: 10.1128/AEM.00991-10 [32] OKABE S, OSHIKI M, TAKAHASHI Y, et al. N2O emission from a partial nitrification-anammox process and identification of a key biological process of N2O emission from anammox granules[J]. Water Research, 2011, 45(19): 6461-70. doi: 10.1016/j.watres.2011.09.040 [33] YANG Q, CUI B, ZHOU Y, et al. Impact of gas-water ratios on N2O emissions in biological aerated filters and analysis of N2O emissions pathways[J]. Science of the Total Environment, 2020, 723: 137984. doi: 10.1016/j.scitotenv.2020.137984 [34] SUENAGA T, OTA T, OBA K, et al. Combination of 15N Tracer and Microbial Analyses Discloses N2O Sink Potential of the Anammox Community[J]. Environmental Science & Technology, 2021, 55(13): .9231-9242. [35] XIONG J, MA S, HE X, et al. Nitrogen transformation and dynamic changes in related functional genes during functional-membrane covered aerobic composting[J]. Bioresource Technology, 2021, 332: 125087. doi: 10.1016/j.biortech.2021.125087 [36] LI S, WANG S , JI G. Influences of carbon sources on N2O production during denitrification in freshwaters: Activity, isotopes and functional microbes[J]. Water Research, 2022, 226: 119315. [37] WANG H, FAN Y, ZHOU M, et al. Function of Fe(III)-minerals in the enhancement of anammox performance exploiting integrated network and metagenomics analyses[J]. Water Research, 2022, 210: 117998. doi: 10.1016/j.watres.2021.117998 [38] QUICK A M, REEDER W J, FARRELL T B, et al. Nitrous oxide from streams and rivers: A review of primary biogeochemical pathways and environmental variables[J]. Earth-Science Reviews, 2019, 191: 224-262. doi: 10.1016/j.earscirev.2019.02.021 -



 下载:
下载: