-
黄河是我国第二大长河,全长5 464 km,流经青海、山东等9省区,是我国重要的生态安全屏障。黄河流域是人口活动和经济发展的重要区域。2021年,国务院将黄河流域的生态保护与高质量发展作为国家重要发展战略。重金属污染物进入水环境中,其中少部分重金属以溶解态形式存在于水体中,大部分则通过与水体中悬浮物作用,以不同形态存在于沉积物中[1],因此,沉积物既是重金属污染的汇,又成为了一个重要的污染源[2]。当水体环境发生变化,沉积物中以较强迁移形态存在的重金属可能会再度被释放,不仅会引发水体二次污染[3],同时也会通过食物链累积或其他暴露途径危害水生生态系统,进而威胁人类健康[4-5]。因此,针对沉积物中重金属的因赋存形态不同从而造成的生态风险与人类健康风险进行分析评价,对深入了解黄河流域重金属污染现状具有重要意义。
沉积物中重金属形态的风险评价主要包括生态风险和健康风险评价两大类。评价方法多基于重金属总量[6-8],这些方法一定程度上能反映该地区的重金属富集程度。但随着研究的深入,发现沉积物重金属的迁移释放能力和生物可利用性与其在沉积物中的赋存形态密切相关[9]。基于重金属形态的重金属风险评价标准[10-11] (Risk assessment code,RAC)、次生相与原生相分布比值[12]等生态风险评价方法可用以描述重金属的迁移能力大小与生物可利用性强弱,从而评估重金属对生态环境造成的危害。结合健康风险评价,可对人体因长期暴露于污染环境中所受到的损害进行定量计算。EMENIKE等[7]对干湿季的尼日利亚Atuwara河沉积物中重金属进行健康风险评价,结果显示2个季节中儿童经过口摄入As、Cd、Cr和Ni的非致癌风险均超过安全限值。WOJCIECHOWSKA等[5]对波兰北部两条河流的沉积物重金属进行非致癌健康风险分析发现,在皮肤接触暴露途径中Cr的非致癌健康风险值最高,但未超过人体可接受范围。LI等[13]在研究湘江流域表层沉积物样品时发现,S4和S5站点Pb对成人和儿童有潜在的非致癌健康风险。我国健康风险评价方法起步较晚,有关黄河流域重金属健康风险研究多集中于水体和灌溉农田土壤[14-15],对沉积物的健康风险评价较少。沉积物中重金属的残渣态主要存在于原生矿和次生矿的矿物晶格中,迁移性弱,对人体危害性小,若直接使用重金属总量指标进行评价,易造成风险值高于实际风险值的情况[16]。而针对黄河沉积物的可利用态重金属含量进行健康风险评估,能更客观地反映沉积物中重金属存在的健康风险。因此,将生态风险和健康风险评价相结合,以重金属不同赋存形态的含量为依据,定性定量的评估重金属污染对生态和人体造成的风险,可降低单一评价方式所产生的遗漏或误判的影响[17],从而对黄河干流表层沉积物中重金属污染进行综合评价。
本研究在黄河干流全流域内进行沉积物样品采集,重点分析表层沉积物样品中重金属的赋存形态及空间分布情况,通过计算重金属风险评价标准、次生相与原生相分布比值以及健康风险指数,对黄河干流沉积物中重金属各赋存形态的分布、生态风险及对人类对重金属暴露风险进行综合评估,为黄河流域重金属污染防治提供参考。
-
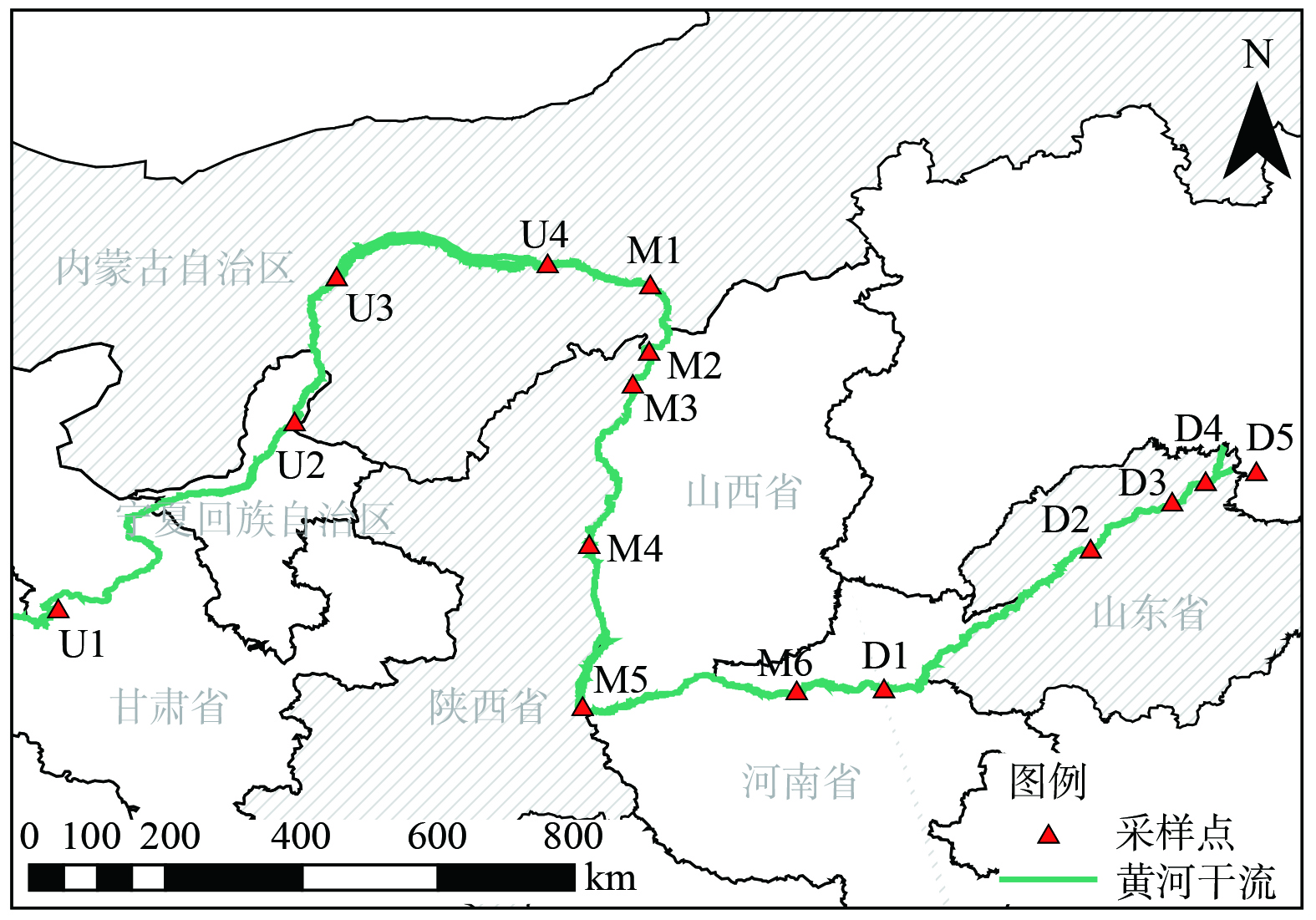
2020年9月至11月,在黄河干流内均匀采集15个表层沉积物样品,部分采样点受各河段工农业发展、大型工程建设和迁建政策等人类活动影响。具体采样点位置分布如图1所示,采样点名称和地理位置如表1所示。其中,U1~U4位于上游、M1~M6位于中游、D1~D5位于下游。表层沉积物使用彼得逊采泥器采集,采集深度均为0~20 cm,样品封存后及时运回实验室保存,取适量样品冷冻干燥24 h至恒重,用研钵研磨过150目尼龙筛备用。
-
取0.25 g处理好的沉积物,按照沉积物金属元素总量消解法进行微波消解,消解液使用1% (质量分数) 硝酸定容,再用0.22 μm聚醚飒 (Polyethersulfone,PES) 滤膜过滤后待测。沉积物重金属的赋存形态提取使用改进的BCR方法[18],提取形态为弱酸态 (F1) 、可还原态 (F2) 、可氧化态 (F3) 、残渣态 (F4) 4种。具体步骤为参考文献[18-20]。
1) 弱酸态 (F1) 。取1.00 g样品,加20 mL醋酸溶液 (0.11 mol·L−1) ,摇床振荡16 h,离心10 min (4 000 r·min−1) ,取上清液加1.5 mL的浓HNO3,摇匀后定容。2) 可还原态 (F2) 。向F1的残渣中加入20 mL盐酸羟胺溶液 (pH=1.5,浓度为0.5 mol·L−1),振荡16 h,离心、转移步骤同F1。3) 可氧化态 (F3) 。向F2的残渣中加5 mL的30% (质量分数) 双氧水 (pH=2~3) ,静置1 h后,在85 ℃水浴条件下消解,再次加入5 mL的30% (质量分数) 双氧水重复在85 ℃水浴条件下消解,取出加入1.0 mol·L−1的乙酸铵溶液25 mL (pH=2) ,振荡16 h,离心、转移步骤同F1。4) 残渣态 (F4) 。同沉积物中重金属总质量分数处理方法一致,使用HF-HClO4微波消解后待测。重金属的总质量与各形态质量分数均采用电感耦合等离子体质谱仪 (ICP-MS) 检测,采用内标法定量分析。实验过程中使用水系沉积物标准物质GBW07309 (GSD-9) 做全程质量控制。BCR提取的赋存形态质量分数之和与沉积物金属总质量相比,回收率为80%~120%。
-
1) 重金属风险评价标准 (Risk assessment code,RAC) 。重金属风险评价标准指弱酸态F1占总质量的百分比,用以评价重金属迁移性和生物活性的大小[19]。RAC值越大,重金属的迁移性越强,生物活性越高,风险值越大;反之则越弱。RAC<1%时,沉积物中重金属对水环境无风险;1%≤RAC≤10%时,低风险;11%≤RAC≤30%时,中等风险;31%≤RAC≤50%时,高风险;RAC>50%,极高风险。
2) 次生相与原生相分布比值法。沉积物中原生矿物称为原生相,即本研究中的残渣态,原生矿物风化后产物和外来物质称为次生相,即本研究中的可利用态 (弱酸溶态、可氧化态与可还原态含量总和) [12]。计算公式如式 (1) 所示。
式中:Msec为沉积物次生相的重金属质量分数,mg·kg−1;Mprim为沉积物原生相的重金属含量质量分数,mg·kg−1。比值KRSP可用以表述该地区重金属污染现状。KRSP<100%,无污染;100%≤ KRSP<200%,轻度污染;200% ≤KRSP<300%,中度污染;KRSP≥300%,重度污染。
3) 健康风险评定方法。依据美国环境总署(U.S. Environmental Protection Agency, EPA)公布的土壤健康风险评价模型,对黄河沉积物中重金属可利用态含量对人体造成的危害进行健康风险评估。将重金属分为致癌污染物 (As、Cd、Cr、Ni) 和非致癌污染物 (Cu、V、Zn、Pb) 。一般认为,致癌污染物也会产生非致癌风险,故对9种重金属进行非致癌风险评价,对As、Cd、Cr、Ni这4种重金属进行致癌风险评价。沉积物中重金属元素一般通过口摄入、呼吸摄入和皮肤接触3种方式进入人体内,计算公式如[21]公式(2)~(4),其中C为不同河段沉积物中重金属可利用态含量,其余各参数值见表2。重金属的非致癌健康风险评估模型如公式(5)~(6)。
式中:RfD为各重金属的参考剂量,mg·(kg·d)−1,具体参数如表3所示,HQ为危险商,HI是总的非致癌健康风险值。当HQ<1或HI<1时,健康风险值较小;当HQ>1或HI>1时,则存在严重的非致癌风险。
重金属的致癌健康风险评估模型如式 (7) 和 (8) 所示。
式中:CSF为各重金属的参考剂量,具体参数如表3所示;CR是重金属致癌风险的概率;TCR是总的致癌健康风险值,是3种途径致癌风险概率之和。以EPA提出的人体接受水平10−6~10−4为标准,当CR<10−6时,致癌风险可忽略,当CR>10−4时,存在较强的可致癌风险。
-
黄河表层流域沉积物中不同重金属的总量与赋存形态空间分布如图2所示。其中,弱酸态 (F1) 、可还原态 (F2) 和可氧化态 (F3) 的组分是可提取的,也被称为可利用态,具有一定的潜在风险。按照F1、F2、F3的顺序,不同赋存形态的迁移性和生物可利用性逐渐加强,F1对外界环境变化最为敏感[24]。残渣态 (F4) 重金属形态稳定,一般条件下难以进行迁移转化,生物可利用性最弱[25]。
沉积物中Cd的F1和F2提取态占比较大,平均值分别为25.2%和16.98%,这与2008年黄河水系沉积物调查结果相似[26]。此外,贵州草海[3]、长江河口[20]、恒河[10]等流域表层沉积物中Cd的可利用态含量均较高。Cd总质量分数在黄河干流呈现先增长再下降趋势,平均质量分数为0.24 mg·kg−1,上游、中游和下游可利用态质量分数的平均值分别为0.11、0.13和0.06 mg·kg−1,可利用态质量分数平均占比从上游向下游逐渐加大,在M6点位达到最大百分比82.81%,D2、M2点位可利用态占比也较高,分别为79.65%和75.6%。这可能与农业、电池电气制造工业或交通污染相关[27-28]。除外来污染源影响外,水中Cd离子也容易吸附在沉积物的细小颗粒表面,易和Ca2+、Mg2+等离子发生替代反应,从而和碳酸盐形成金属结合物[29]。
除了Cd外,其余重金属存在形态均以残渣态F4为主。Cr、V、Ni的最高值分别为304.07 mg·kg−1、485.42 mg·kg−1、51.02 mg·kg−1,赋存形态中F4态占比极高,在整个流域中的平均占比分别达到98.8%、97.02%和94.15%。可利用态含量的平均值均为上中游大于下游,可利用态占比在各采样点分布均匀,且均在M6处达到最大占比,分别为3.52%、9.4%和13.39%。
Pb、Zn、Cu、Co的F4态平均占比为78.07%~91.41%,可利用态以F2态为主。Pb总质量分数在M3点位达到最大值 (44.67 mg·kg−1) ,该点位可利用态占比最低 (7.79%) 。在中游的可利用态平均质量分数 (8.62 mg·kg−1) 明显高于上游和下游地区 (4.76和3.68 mg·kg−1) ,可利用态占比在M6点位达到最大值66.16% (F2占比达41.28%) ,该点位的Pb总质量分数也较高 (41.18 mg·kg−1) ,其余点位可利用态均小于残渣态。Pb的F2态占比较高可能与黄河流域pH较高,碳酸钙离子较多有关,从而促使Pb与固体表面离子进行络合作用[26],在印度恒河[10]沉积物中也有类似报道。也可能与上游内蒙古地区的钢铁工业和中游河南地区发达的农业和煤矿业相关[28]。Zn的总质量分数在M5达到最大值180.51 mg·kg−1,在上中游的可利用态平均质量分数分别为16.40和15.66 mg·kg−1,高于下游地区11.32 mg·kg−1。Zn的可利用态百分比在上中游分布较为均匀,平均值为14.96%,下游可利用态百分比明显升高,平均值达到25.18%。Cu和Co的F4态占比较高,分别为90.56%和91.51%,Cu的总质量分数在上游高于中下游,各点位的可利用态占都较低,均不超过15%,且分布比较均匀;Co的总质量分数在上中游高于下游流域,M5处达到最高值 (31.72 mg·kg−1) ,可利用态质量分数与占比在各流域分布较为均匀,可利用态占比在M6达到最大值 (17.58%) 。
As总质量分数在下游高于上中游,在D3点位到达最高值22.52 mg·kg−1,在上中游可利用态质量分数平均值分别为1.76和1.92 mg·kg−1,高于下游的1.05 mg·kg−1,上中游的可利用态占比 (18.35%和18.74%) 也高于下游 (10.30%) ,以F3态为主 (平均百分比为8.06%) ,在中游M4、M2、M6点位占比较高,分别为36.01%、24.2%和21.01%。As常用于农药、杀虫剂中,可能与上中游发达的农业相关[28]。
沉积物中重金属在不同采样点的形态分布情况表明Cd的元素性质不稳定,易发生迁移。同时发现Cd、Cr、V、Ni、Co和Pb的可利用态所占质量分数均在M6点位达到最大值,这表明该点位的潜在风险较高。
-
1) 重金属迁移能力评价。黄河表层沉积物中重金属的RAC如表4所示。重金属的迁移活性排序为Cd> Zn>As>Co>Cu>Ni>Pb>V>Cr。其中,Cd的RAC值最高,平均值为24.4%,下游的平均值最大为33.4%,在D2点位值达到最大 (51.33%) ,具有极高风险性。上游和中游分别为20.1%和21.77%,在U2、M2、M6、D1、D3这5个点位中具有高风险性,潜在生物毒害作用较强。Cr、V在各采样点中迁移系数均小于1%,几乎没有迁移风险,主要由于这2种元素是主要的成岩元素,多源于地表径流所输送的陆源碎屑物质[30]。As、Cu、Ni、Pb、Zn、Co在各采样点均为低风险至无风险,迁移性和生物活性都比较低,故应重点关注Cd在黄河流域内的潜在危害性。
2) 重金属污染水平评价。黄河表层沉积物中重金属的KRSP值如图3所示。Cd的KRSP值最高,污染程度最重,中游和下游的平均值分别为155.4%和170.6%,属于轻度污染。其中,在M2、M6、D2点位KRSP值大于300%,为重度污染;在D1点位为中度污染;其余点位为轻度至无污染。Pb自上而下在各河段的KRSP平均值分别为24.7%、50.15%和27.08%,均为低风险,仅在M6点位的KRSP值分别为195.54%,属于轻度污染,其余点位无污染。结合该点位Pb的形态分布特征可知,Pb对铁锰氧化物具有较强的亲和性,可重新释放到孔隙水中,存在潜在的生态风险[18,31]。其余重金属As、Cr、Cu、Ni、Zn、Co和V在各点位的KRSP值均小于100%,无外来污染。
结合RAC值和KRSP值发现黄河干流全流域内沉积物重金属中Cd的生态风险最高,其次为Pb。一方面是与Cd和Pb金属元素自身活性高、易发生溶解迁移有关;另一方面可能与外来污染源输入相关,这与前述形态分布特征结论一致。As、Cr、Cu、Ni、Zn、Co和V元素在黄河流域内无明显生态风险。结合表层沉积物重金属在不同采样点的形态分布情况分析可知,Cr、Ni、V元素F4态占比大,表明这3种元素广泛存在于矿物晶格之中、不易析出,其来源可能为原生地质环境,外来污染源较少,在伊朗里海南部也有类似报道[1]。其余元素在部分点位虽有外来源污染,但占比较少,故可利用态占比较低、迁移性弱,造成的生态风险较低。此外,Cd、Pb等多个重金属在M6点位的生态风险较高,这表明该点位具有一定的潜在生态危害,该采样点附近有农田分布、农业活动频繁,对黄河表层沉积物造成了影响。
-
1) 重金属元素非致癌健康风险评价。黄河全流域各采样点重金属可利用态的非致癌健康风险如表5所示,8种重金属在各点位对儿童和成人造成的健康风险值HI均小于1,属人体可接受范围。成人非致癌健康风险值中,Cd、Cr以口摄入和皮肤吸收为主要风险途径,其中HQ口占HI比重分别为71.47%、82.31%,HQ皮肤占HI比重分别为28.52%和16.42%。其余重金属的HQ口所占HI比重为97.4%~99.77%,口摄入为主要暴露途径。儿童非致癌健康风险值中,Cd和Cr的HQ皮肤占HI比重分别为21.87%和12.25%,以口摄入和皮肤吸收为主要风险途径,其余重金属的HQ口所占HI比重范围为88.29%~99.92%,口摄入为主要途径。V仅有口摄入参考剂量。
3种暴露途径对成人和儿童的总HI值范围为6.14×10−3~3.46×10−2、0.06~0.32,中游HI值 (1.42×10−2和0.13) 高于上下游 (1.33×10−2和0.12、7.68×10−3和0.07) ,均在M6点位达到最大值,儿童的风险总值是成人的7.61~9.25倍,其中M6点位的儿童总HI值(0.32)最高,应重点关注。在成人和儿童的总HI值中As的贡献率均为最高,分别达到了61.28%和62.71%;其次是Pb,贡献率为21.23%和20.27%;再者是V,贡献率为8.16%和7.95%,其余重金属总贡献率不超过10%,排序为Cr、Cd、Ni、Cu、Zn。As的健康风险值最高,这与近年来黄河干流沉积物中As总含量高于中国水系沉积物元素背景平均值的结论相符[28]。Pb因其浓度较高、RfD值低,比其他元素具有更高的非致癌风险[32]。Cd的生物活性较高,但由于沉积物样品中的可利用态质量分数较低,对人体的健康风险值较低。而V的生物可利用性较低,但其儿童和成人的健康风险值却均高于Cd,当前沉积物研究中对V的关注度较低,但其具有的非致癌健康风险可能超出人们预期[33]。
2) 重金属元素致癌健康风险评价。黄河全流域各采样点重金属可利用态的致癌健康风险如表6所示,4种重金属在对儿童和成人造成的致癌健康风险值TCR均未超过10−4,处于人体可接受范围。As、Cd、Cr对儿童和成人的致癌健康风险值均为CR口>CR皮肤>CR呼吸,且CR口占TCR比重均超过98%,口摄入为主要致癌因子摄入途径。Ni仅有呼吸摄入参考剂量。
3种暴露途径对成人和儿童的总TCR值范围为6.73×10−7~3.77×10−6、1.56×10−6~8.76×10−6,上游TCR值 (1.75×10−6和4.07×10−6) 高于中下游 (1.7×10−6和3.95×10−6、9.67×10−7和2.25×10−6) ,且均在M6点位达到最大值,儿童的风险总值是成人风险值的2.32倍。此外,M6点位的儿童致癌健康风险总值最高(8.76×10−6),虽在可接受范围内,但也应采取相应预防措施。在成人和儿童总TCR值中As的贡献率最大,分别达到了75.91%和75.98%,其次为Cr(18.28%与18.19%)、Cd(5.81%与5.83%)、Ni(0.01%与0%)。
综上所述,黄河流域表层沉积物中重金属对人体的致癌和非致癌健康风险均较低,属于可控范围。但本研究中健康风险评价模型使用参数为EPA推荐参数模型,未实际考虑到黄河流域周边居民的健康参数,未来还需应用具体参数来完善中国境内不同区域的沉积物健康风险评价。
-
1) Cd污染防控。本研究发现黄河干流表层沉积物重金属中Cd造成的生态风险最高,Cd主要由农业源和工业源产生[29],应控制黄河上游内蒙古地区钢铁、稀土、电池电气等行业废水废气排放量,积极引导中游河南地区农业科学化发展。同时,应在黄河沿岸种植重金属超积累植物,辅助以化学、微生物等措施[34],减少Cd在沉积物中的含量,并加强对沉积物中重金属污染的监管,设置配套监测防控措施,增强管控的可操作性[35]。
2) 农业源污染防控。本研究发现黄河干流尤其是中游地区因农业活动频繁导致Cd、Pb等重金属生态风险较高,对此建议:建立生态农业,提高农民素质,根据农作物生长情况科学施加化肥农药,加强农业活动的科学管理;采取相应工程措施,在黄河流域沿岸建立农田缓冲带[36],加强对畜禽粪便、农业灌溉水、生活污水的综合治理等,从源头减少农业污染源危害。
3) 其他涉及人群健康问题的重金属。黄河干流表层沉积物中重金属造成的人体健康风险整体属可控范围,治理措施应以预防为主。应重点监察中游部分地区居民尤其是儿童的饮食健康问题,重点关注由As和Pb等重金属引发的地方性疾病[37]。建立科学的评价方法,将健康风险评价与其他沉积物评价相结合,以更全面评价沉积物中重金属对人体和生态环境造成的危害[8]。
-
1) 黄河流域沉积物重金属中Cd的弱酸态F1和可还原态F2占比较高,其余重金属均以残渣态F4为主。其中Cr、V、Ni、Cu的可利用态占比极少;Co、Pb、Zn的可利用态中以可还原态F2为主,As以可氧化态F3为主。2) 结合重金属风险评价标准和次生相与原生相分布比值分析,发现整个黄河流域内Cd的生态风险最高,污染程度与潜在危害性最大。Cd和Pb等多个重金属在M6点位迁移性较高,表明该点位具有一定的潜在生态危害。3) 黄河流域沉积物重金属对周围居民的致癌和非致癌健康风险总值均属于人体可接受范围,且均在M6点位达到最大值。整体表现为儿童风险值大于成人,并以口摄入为主要风险源,总体上健康风险属于可控范围。
黄河干流表层沉积物中重金属形态分析与风险评价
Morphological analysis and risk assessment of heavy metals in surface sediments of the Yellow River mainstream
-
摘要: 对黄河全流域表层沉积物样品中重金属元素 (As、Cd、Cr、Cu、Ni、Pb、Zn、V、Co) 的赋存形态进行分析,发现Cd的可利用态占比较高,其余重金属以残渣态为主。基于可利用态重金属含量计算重金属风险评价标准、次生相和原生相分布比值,从而对表层沉积物中重金属的生态风险进行评估。结果表明,整个流域中Cd的生态风险最高。此外,Cd和Pb等重金属在M6点位迁移性较高,存在一定的生态风险。对可利用态重金属进行人体健康风险评价,发现M6点位儿童的致癌 (8.76×10−6) 和非致癌风险总值 (0.32) 最高。成人与儿童非致癌健康风险总值中As的贡献率最大 (61.28%和62.71%) ,致癌健康风险总值中As的贡献率也最大 (75.91%和75.98%) ,但总体均未超过美国环境总署推荐的人体最大可接受范围。本研究可为识别黄河干流表层沉积物中重金属风险及制定相应污染防控策略提供参考。Abstract: In the present work, the forms of heavy metals (As, Cd, Cr, Cu, Ni, Pb, Zn, V, Co) that appeared in the surface sediment of the Yellow River were analyzed. The results demonstrated that the available forms of Cd accounted for a relatively high proportion, whereas other heavy metals mainly appeared in the residual form. In addition, we evaluated the potential ecological risks of heavy metals in surface sediments by calculating of the Risk Assessment Code for heavy metals and the distribution ratio of the secondary phase and primary phase. Results showed that the ecological risk of Cd was the highest in the whole basin. Moreover, the metals such as Cd and Pb had higher migration at the M6 site, which posed certain ecological risks to the relevant river basin. On the other hand, the human health risk assessment of the available heavy metals demonstrated that the carcinogenic (8.76×10−6) and non-carcinogenic risk (0.32) of Children at M6 was the highest. The contribution rate of As in the total non-carcinogenic health risk of adults and children was the highest (61.28% and 62.71%), and the contribution rate of As in the total carcinogenic health risk was also the highest (75.91% and 75.98%). However, those values did not exceed the maximum acceptable range of humans recommended by the U.S. Environmental Protection Agency. The results of this study can provide a reference for identifying the risk of heavy metals in the surface sediment of the Yellow River and formulating corresponding pollution remediation strategies.
-
Key words:
- Yellow River mainstream /
- surface sediment /
- heavy metals /
- existing form /
- risk assessment
-
目前全球染料年产量超过700×104 t,染料品种已经超过10×104余种,常用染料有2 000种以上,而且每年人工合成的新型染料也层出不穷,各地的江河湖泊都受到不同程度的污染[1-2]。而且这些染料大多为酚类化合物、苯类化合物[3],其结构复杂、难以生物降解、对生态环境危害极大[4-5]。因此,处理有机废水中的染料大分子是当前必须解决的热点问题。目前常用于有机废水治理的方法主要有物理吸附法、化学法、生物处理法、膜分离技术等[6-7]。但是这些方法往往对系统条件要求苛刻,成本和能耗高,需要二次维护[8-9]。与上述处理方法相比,光催化技术具有操作简单、成本低廉、循环性好等优点[10-11]。
g-C3N4作为一种通过π-π共轭形成的可见光响应型催化剂,通过范德华力作用堆砌形成二维层状结构,与石墨烯的层状结构类似,其具有优异的光稳定性和热稳定性[12]、良好的生物相容性、合适的能带结构以及优异的光电转化性能,常用于光催化分解水制氢[13-15]、二氧化碳还原[16-17]、有机污染物降解[18-19]等。然而,g-C3N4也有不可避免的缺陷,如比表面积小导致对有机污染物的吸附性能差[20];光生电子-空穴对复合率高导致催化活性差等,严重限制了其对有机污染物的降解性能[21-22]。目前,有研究者通过制备三维多孔氮化碳改善了上述问题。LIU等[23]以三聚氰酸-三聚氰胺超分子和离子液体分别做为前体和模板,合成了三维多孔超薄g-C3N4纳米片。其中,3D多孔结构增大了g-C3N4的比表面积,暴露了更多的活性位点,超薄结构的纳米片降低了载流子传输距离,抑制了载流子的复合率。WANG等[24]在软模板P-123存在下对超分子前驱体进行水热处理,制备出由空心气泡组成的三维g-C3N4催化剂。硬模板法[25]在控制造孔孔径大小和孔径分布上具有明显优势,但脱除模板的过程中要用到强酸或强碱进行处理,容易使氮化碳的—N—、═NH和—NH2官能团发生质子化作用,最终破坏其缩聚结构,且模板脱除过程产生的废酸、废碱过多[26-27]。软模板法可选择大多数表面活性剂以及低沸点分子充当模板,但是实验过程中需要调控的因素很多,生成的孔不如硬模板法整齐,并且表面活性剂可能不随高温完全分解从而残留于样品表面[28]。与上述方法相比,NH4Cl作为气体模板辅助造孔,无需在后续过程中去除模板,实验操作步骤更加简便,且不容易改变g-C3N4的基本结构。此外,以NH4Cl为模板辅助制备多孔g-C3N4不仅有利于对污染物的吸附[29],还可在煅烧前驱体的过程中促进CN−的生成,进而抑制光生电子空穴对的复合,提高对有机污染物的降解性能。
本研究采用气体模板NH4Cl辅助制备出多孔g-C3N4,通过XRD、FT-IR、UV-vis和XPS等表征研究样品的化学结构和晶相结构,通过SEM和TEM表征样品的表面形貌和微观结构,通过光催化降解水中RhB评价样品的光催化性能和循环性能,利用荧光光谱仪、瞬态荧光光谱仪和电化学工作站研究光生电子与空穴的复合和迁移状况,最后通过自由基捕获实验和高分辨质谱仪测试分析其光催化降解机理,旨在为开发新型光催化剂和建立RhB的降解方法提供参考。
1. 材料与方法
1.1 实验原料
实验所用的药品均为分析级试剂,使用前无需纯化。三聚氰胺和RhB购自天津科密欧科技有限公司,NH4Cl购自上海麦克林生化科技有限公司,对苯醌购自上海麦克林生化科技有限公司,三乙醇胺购自天津市大茂化学试剂公司,无水乙醇和异丙醇购自天津富宇精细化工有限公司,去离子水由超纯水仪处理所得。
1.2 实验仪器
马弗炉(KSL-1400X-A1,合肥科晶材料技术有限公司),X射线衍射仪(D2 PHASER,德国Bruker公司),X射线光电子衍射仪(ESCALAB 250XI,美国Thermo Fisher Scientific Inc公司),场发射扫描电镜(SU5000,日本Hitachi公司),透射电子显微镜(FEI Tecnai G2 F20 S-TWIN,美国FEI公司),紫外-可见分光光度计(UV-2600,日本岛津公司),傅里叶红外光谱仪(INVENIO,德国Bruker公司),BET比表面积测试仪(Autosorb-IQ-II,陕西盖卓电子科技有限公司),荧光光谱仪(FS5,英国爱丁堡公司),电化学工作站(CHI600E,上海辰华仪器有限公司),氙灯光源(CEL-HXF300-T3,北京中教金源有限公司),总有机碳分析仪(vario TOC cube,Elemental仪器公司),高分辨质谱仪(Thermo Scientific Q Exactive,美国Thermo Scientific公司)。
1.3 实验方法
1) g-C3N4的制备。以三聚氰胺为前驱体,通过高温煅烧法制备g-C3N4。取1.5 g三聚氰胺,用锡箔纸包裹后,置于有盖坩埚中,在马弗炉以550 ℃煅烧3 h。自然冷却所得黄色即为g-C3N4,研磨后进行光催化性能测试。
2) 多孔g-C3N4的制备。采用高温煅烧三聚氰胺和NH4Cl混合物的方法制备多孔g-C3N4。将1.5 g三聚氰胺分别与相应质量(0.675、0.75、0.825、0.9、0.975 g)的NH4Cl溶于50 mL去离子水中,磁力搅拌4 h,放入70 ℃烘箱中,蒸干水分。随后用锡箔纸包裹后,放入有盖的坩埚内,在马弗炉以550 ℃煅烧3 h,自然冷却所得黄色固体即为x%-PCN(x%表示前驱体中NH4Cl的质量分数),研磨后进行光催化性能测试。
1.4 表征和性能测试
1) 各项表征和测试。XRD测试:以Cu Kα为辐射源,扫描范围为2θ=5°~80°,扫描速度为2(°)·min−1。FT-IR测试:样品与KBr以1:100质量比混合研磨,压成半透明薄片测样,波数为400~4 000 cm−1。SEM测试:取少量样品贴于黑色导电胶上,真空喷金后测样。TEM测试:将样品溶于无水乙醇,超声混匀后滴在铜网上,装样测试。BET测试:样品以150 ℃脱气6 h。UV-vis测试:采用紫外-可见分光光度计,扫描波长为200~800 nm。PL测试:以波长为385 nm的激发光测量样品波长为390~640 nm的发射光谱。光电流-阻抗测试:采用三电极体系,0.1 g催化剂溶于10 mL溶剂(V水∶V无水乙醇=9∶1),超声后取上清液涂膜于FTO玻璃上,以此作为工作电极,参比电极为饱和甘汞电极,铂片电极为对电极,电解液为0.5 mol·L−1的Na2SO4溶液。高分辨质谱:取1.5 mL降解后RhB液体,甲醇为溶剂,EIS为离子源。
2) 催化剂降解性能测试。取0.1 g催化剂,加入100 mL质量浓度为30 mg·L−1的RhB溶液中,在黒暗环境下磁力搅拌20 min,以达到吸附-脱附平衡。随后用300 W氙灯模拟太阳光照射,每隔10 min取5 mL溶液,离心后取上清液,用UV-vis分光光度计测试吸光度。将使用过后的催化剂用水和乙醇洗至中性,烘干后按照上述步骤重复4次,以考察催化剂的稳定性。
2. 结果与讨论
2.1 催化剂表征
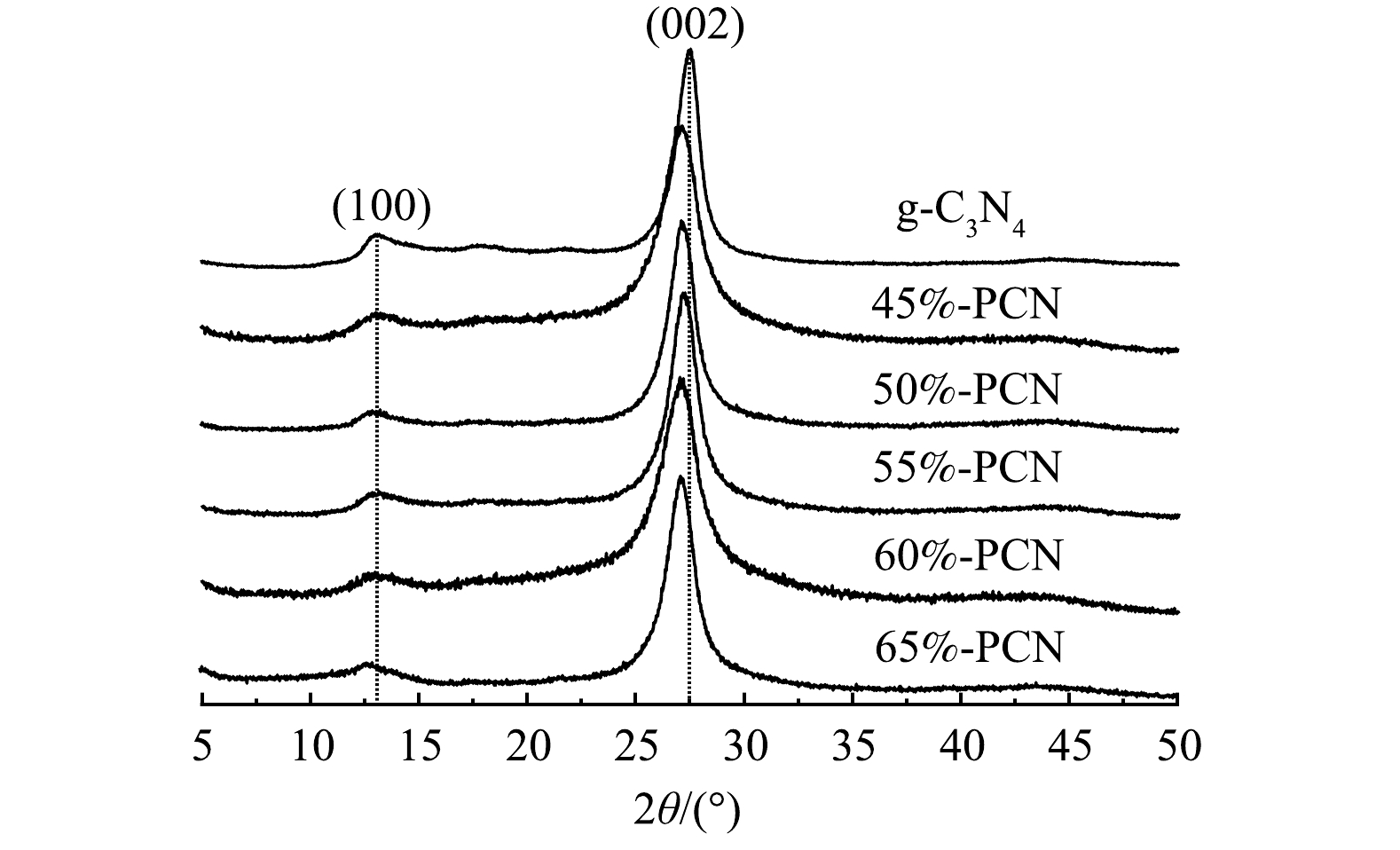
1) XRD分析。由图1可以看出,g-C3N4在13.5°和27.5°处有2个特征衍射峰,13.5°处的峰是面内三嗪环之间相互连接的特征峰,对应g-C3N4的(100)晶面,27.5°处的峰是环状芳香物层与层之间的堆积特征峰,对应g-C3N4的(002)晶面。与g-C3N4相比,PCN的2个特征峰均未发生明显改变,说明以气体模板法辅助制备PCN没有改变g-C3N4的晶相结构。此外,55%-PCN与g-C3N4相比,27.5°处的峰向左偏移至27.16°,根据布拉格公式(2dsinθ=nλ)[30]计算g-C3N4和55%-PCN的晶面层间距,分别为0.324 nm和0.329 nm,说明层间距变大。这可能是由于,三聚氰胺在高温下团聚脱氨的过程中,NH4Cl同时受热分解为NH3和HCl气体,导致生成的g-C3N4层与层之间的堆积作用变弱[31]。以上分析表明,气体模板的加入可以使g-C3N4片层与片层之间分离开来,从而进一步影响样品的性能。
2) 形貌分析。由图2(a)和图2(b)可以观察到g-C3N4整齐的片层堆叠,由图2(e)也可以观察到其表面光滑完整的大块结构。由图2(c)可以看出,55%-PCN的形貌与g-C3N4相比发生很大的改变,大片层破裂为小碎片,并且由图2(d)也可以看到样品表面产生很多孔径为50~100 nm的介孔。由图2(f)也可以看出孔的生成。
3) FT-IR分析。如图3所示,在g-C3N4的FT-IR光谱中,3 000~3 500 cm−1的宽峰为前驱体中未聚合的氨基(—NH2或═NH)的伸缩振动峰,1 200~1 640 cm−1对应于三嗪环间C—N和C═N键的特征峰,位于810 cm−1附近的吸收峰对应三嗪环的伸缩振动。与g-C3N4相比,PCN在1 200~1 600 cm−1和810 cm−1处的特征峰没有发生明显的变化,表明以NH4Cl为模板并未破坏g-C3N4的主体结构,在3 000~3 500 cm−1处的吸收峰变宽,可能是NH4Cl分解时的氨基与g-C3N4边缘位置未聚合的氨基或羟基结合,导致吸收范围变宽。值得注意的是,PCN在2 173 cm−1处出现1个明显的吸收峰,此为—C≡N的特征吸收峰[32]。并且随着前驱体中NH4Cl添加量的增多,峰强度越强,说明改性后的多孔结构有利于氰基的形成,使g-C3N4的面内形成更多的孔道结构。
4) UV-vis表征。如图4(a)所示,g-C3N4在波长小于470 nm处的蓝紫光和紫外光区吸收较强,可见光区的吸收较弱。55%-PCN在紫外光区和可见光区的吸收明显增强。此外,禁带宽度可利用UV-vis光谱数据、按照Kubelka-Munk函数由式(1)计算获得。
αhν=A(hν−Eg)1/2 (1) 式中:α为吸光度;h代表普朗克常数;ν为频率;Eg为禁带宽度;A为常数。以(αhν)2为纵坐标,hν为横坐标作图,对所得曲线取切线,切线与横坐标的交点即为Eg,即所对应的样品的禁带宽度[33]。由图4(b)可以看出,55%-PCN的禁带宽度为2.73 eV,与g-C3N4禁带宽度(2.78 eV)相似。这说明改性后的PCN具有较强光吸收性能且带隙宽度变化不大。
5) XPS分析。由图5(a)可以看出,g-C3N4和55%-PCN的C1s、N1s、O1s峰均出现在285、400、520 eV左右,表明二者的元素组成一致。在图5(b)中,284.8、286.6、288.3 eV的3个峰分别是g-C3N4的C—C键、C—O键和N═C—N键的特征峰。这表明,以NH4Cl为模板,只在g-C3N4中产生了较多的孔道结构,没有影响到C的键合状态。在图5(c)中,g-C3N4和55%-PCN在398.7、399.5、401.1 eV处的3个峰,分别对应三嗪环内C═N—C键、环与环之间的H—N—(C)3键和末端氨基上的C—N—H键,表明N的键合状态也未受到气体模板的影响。由图5(d)可以看出,g-C3N4和55%-PCN的价带电位分别为+1.14 eV和+0.88 eV。采用文献中的方法[34]计算出g-C3N4和55%-PCN的导带电位,分别为−1.64 eV和−1.85 eV。这表明多孔结构不仅有利于提高g-C3N4的光吸收性能,还使导带上电子的还原电势更负。
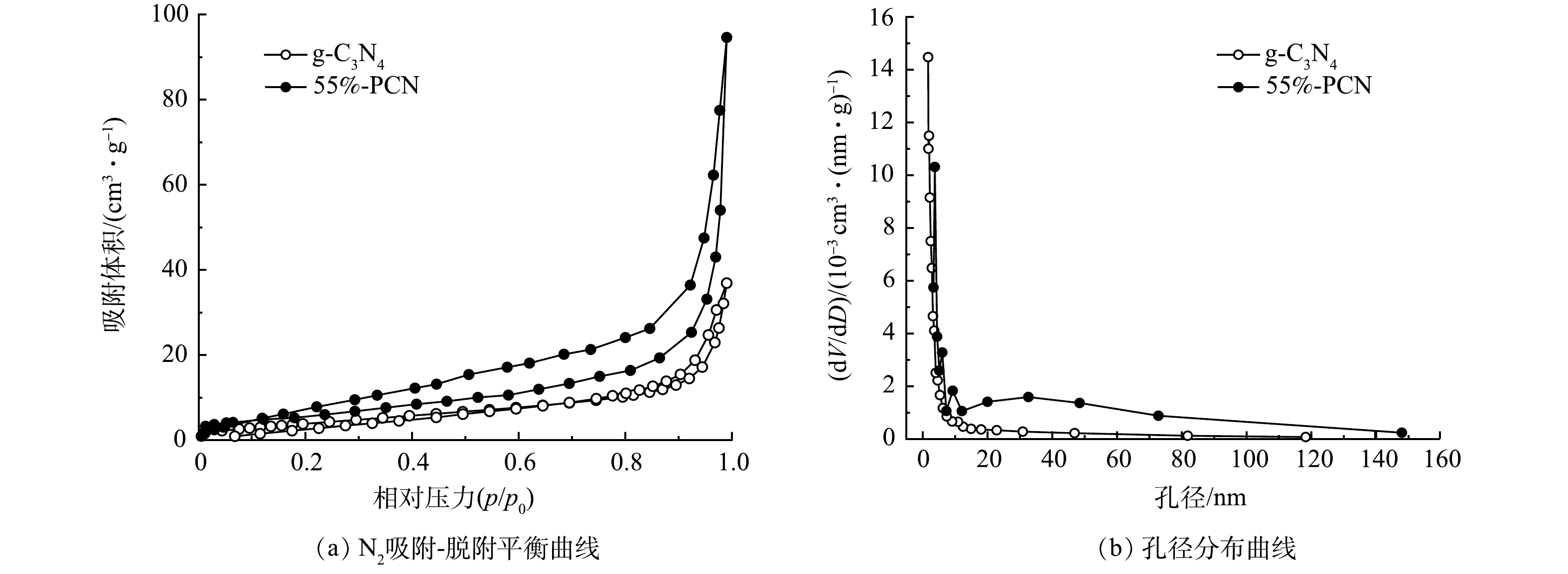
6) BET分析。如图6(a)所示,二者的曲线趋势为Ⅳ型等温曲线,表明g-C3N4和55%-PCN均为中孔材料。另外,测试结果显示,55%-PCN的比表面积(28.548 m2·g−1)与g-C3N4(13.878 m2·g−1)相比有所提高,55%-PCN的孔体积(0.143 cm3·g−1)与g-C3N4(0.046 cm3·g−1)相比也有所提高。这表明PCN的表面性能得到了改善。由图6(b)可以看出:g-C3N4的孔径集中分布于5 nm左右;55%-PCN的孔径分布比较宽泛,增加了10 nm左右和10~80 nm孔道结构。这表明以NH4Cl为模板可增加g-C3N4的孔道结构,有利于提高催化剂对有机污染物的吸附性能。
2.2 性能分析
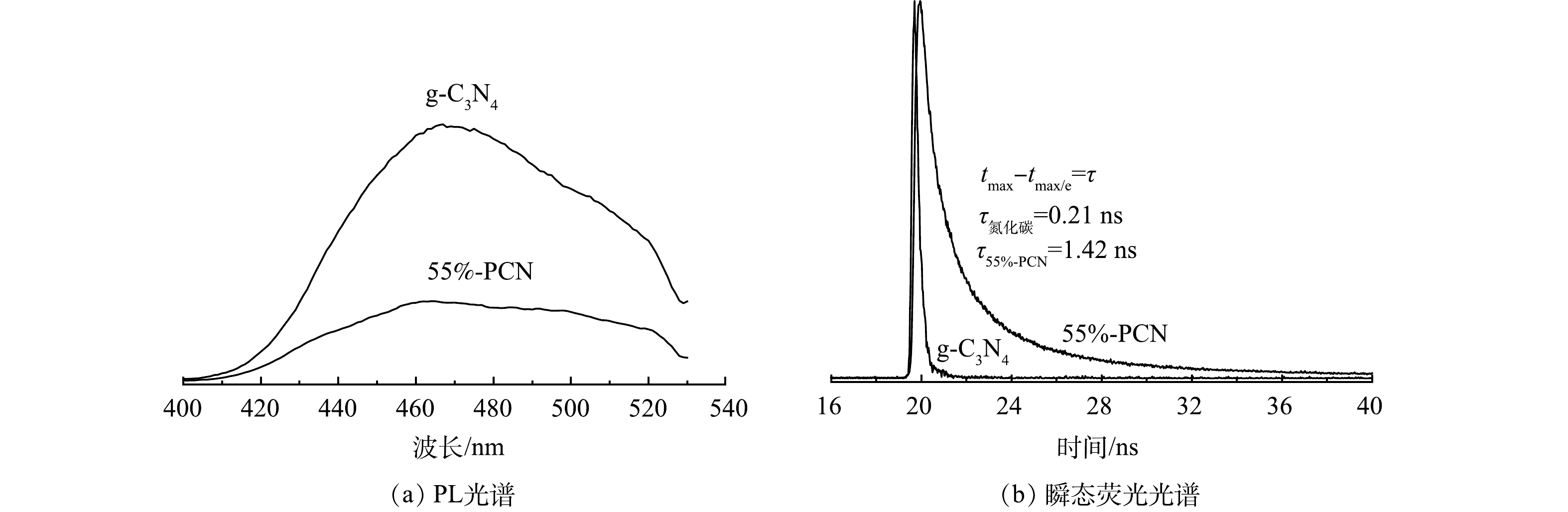
1) 光致发光(PL)光谱和瞬态荧光光谱分析。PL峰强度越强表明光生电子空穴对的复合率越高。由图7(a)可以看出,55%-PCN的发射峰强度较g-C3N4明显降低,表明光生电子空穴对的复合率受到一定程度的限制,有利于光催化性能的提升。图7(b)是g-C3N4和55%-PCN的瞬态荧光光谱图。当荧光强度衰减到最大值的1/e时所用的时间为荧光寿命,即光生电子的平均寿命,其寿命越长,越有利于光催化性能的提升。可以看出,55%-PCN的平均寿命为1.42 ns,接近g-C3N4的7倍(0.21 ns),表明55%-PCN中载流子具有较长的寿命来参与光催化反应。氰基是一种常见的吸电子基团,可以更好地使55%-PCN表面的光生电子和空穴分离[32],提升载流子的寿命,最终影响其光催化性能。
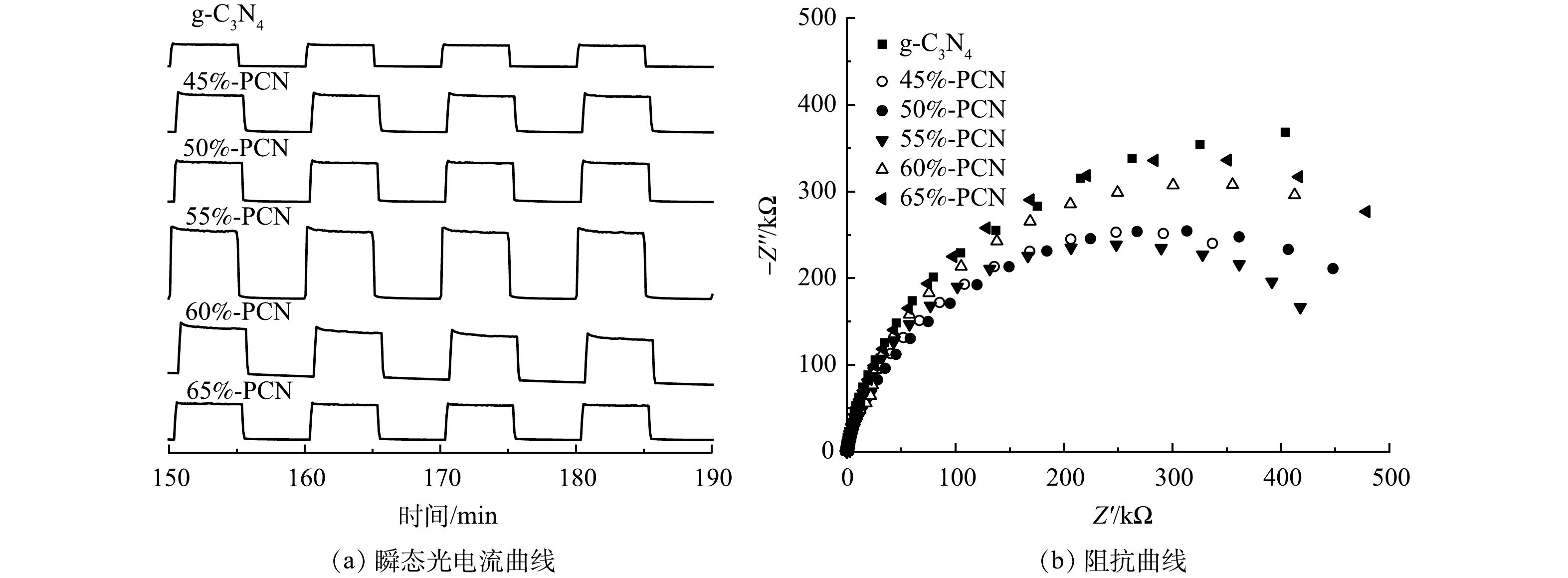
2) 光电性能。虽然通过PCN的制备可以抑制光生电子空穴对的复合,但光生电子-空穴对参与到光催化反应的数量尚不清楚。采用瞬态光电流强度和电化学阻抗谱研究光生电子的迁移效率和迁移阻力,结果如图8所示。在图8(a)中,光电流强度越大,表示催化剂中的激发电子向导电玻璃表面的迁移效率越高,越有利于光催化性能的提升,PCN-55%的光电流强度最大,是g-C3N4的2.5倍,表明其电子迁移效率最高。电化学阻抗谱的圆弧半径越小,电阻越小,电荷转移效率更高效。由图8(b)同样可以看出,55%-PCN的电子迁移阻力最小,可提高光生电子向催化剂表面的迁移效率。综合以上分析,55%-PCN样品中的电子迁移阻力较小,有利于激发电子的迁移。
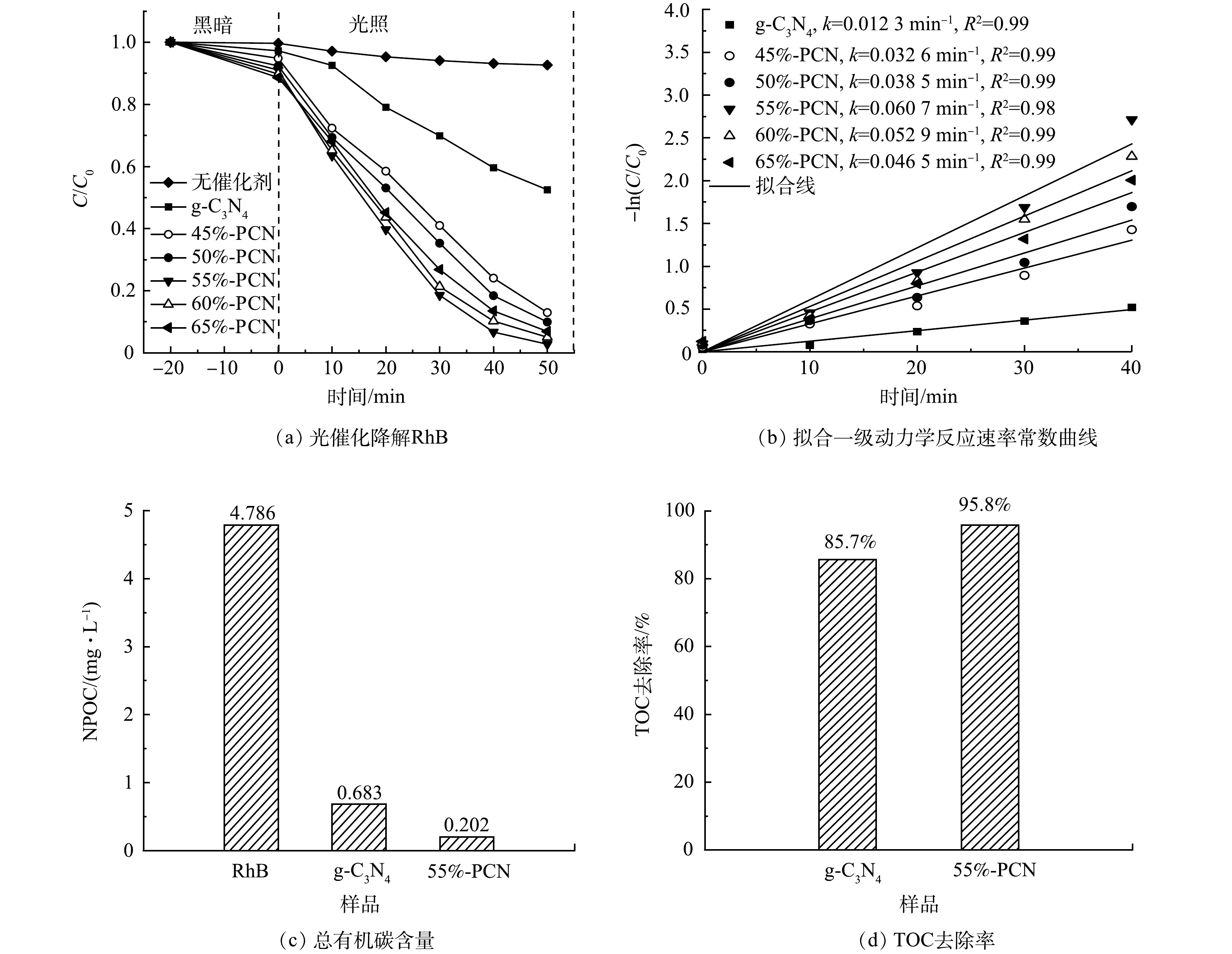
3) 光催化降解罗丹明B性能。在图9(a)中,−20~0 min表示催化剂在黑暗环境下对RhB的吸附过程,0~50 min表示光照下光催化降解RhB的过程。可以看出,不加催化剂时,RhB在光照50 min后的自去除率只有7.4%,g-C3N4的暗吸附率为2.8%,而45%-PCN、50%-PCN、55%-PCN、60%-PCN和65%-PCN的暗吸附率分别为5.2%、7.7%、8.9%、10.3%、11.5%。这表明,PCN中的孔道随气体模板NH4Cl的增加而增多,同时对RhB的吸附性能也越强。55%-PCN在50 min内即可将RhB完全降解,而在相同时间内g-C3N4的降解率只有50%左右。
为了更直观地比较样品在光照下降解RhB溶液的光催化性能,可根据拟合伪一级动力模型[35]计算反应的表观速率常数。光催化降解RhB的伪一级动力学速率常数和降解率关系如式(2)所示。
lnCC0=−kt (2) 式中:k为表观速率常数,min−1;C0和C分别为RhB的初始质量浓度和光照时间t时的质量浓度,mg·L−1。由于0~40 min的降解数据更符合伪一级动力学方程,故选择此范围数据,根据文献中的方法[32]作图。以ln(C0/C)为纵坐标,t为横坐标做图,斜率为k,计算所得的k值标记于图9(b)中。g-C3N4的k值为1.23×10−2 min−1,55%-PCN的k值最大(6.07×10−2 min−1),是g-C3N4的5倍。
根据有机碳含量计算g-C3N4和55%-PCN降解RhB的TOC去除率,g-C3N4为85.7%,55%-PCN为95.8%(图9(c)和图9(d)),所以RhB有机物大分子基本被全部分解为无机物小分子。55%-PCN与g-C3N4相比,去除率升高,说明其可以更好地将RhB大分子吸附并降解。
2.3 催化剂稳定性分析
以上研究表明,55%-PCN具有对RhB优异的吸附性能和降解性能,但催化剂的稳定性是限制其能否工业化应用的又一关键指标。由图10(a)可以看出,55%-PCN在相同循环时间内重复使用4次的降解率分别为97.4%、95.4%、93.6%、92.7%,对水中RhB的降解率未发生明显变化。由图10(b)可以看出,55%-PCN使用前后的XRD图谱出峰位置不变,说明反应前后样品的结构和化学组成也没有发生改变。以上均表明55%-PCN具有稳定的光催化活性。
2.4 光催化机理分析
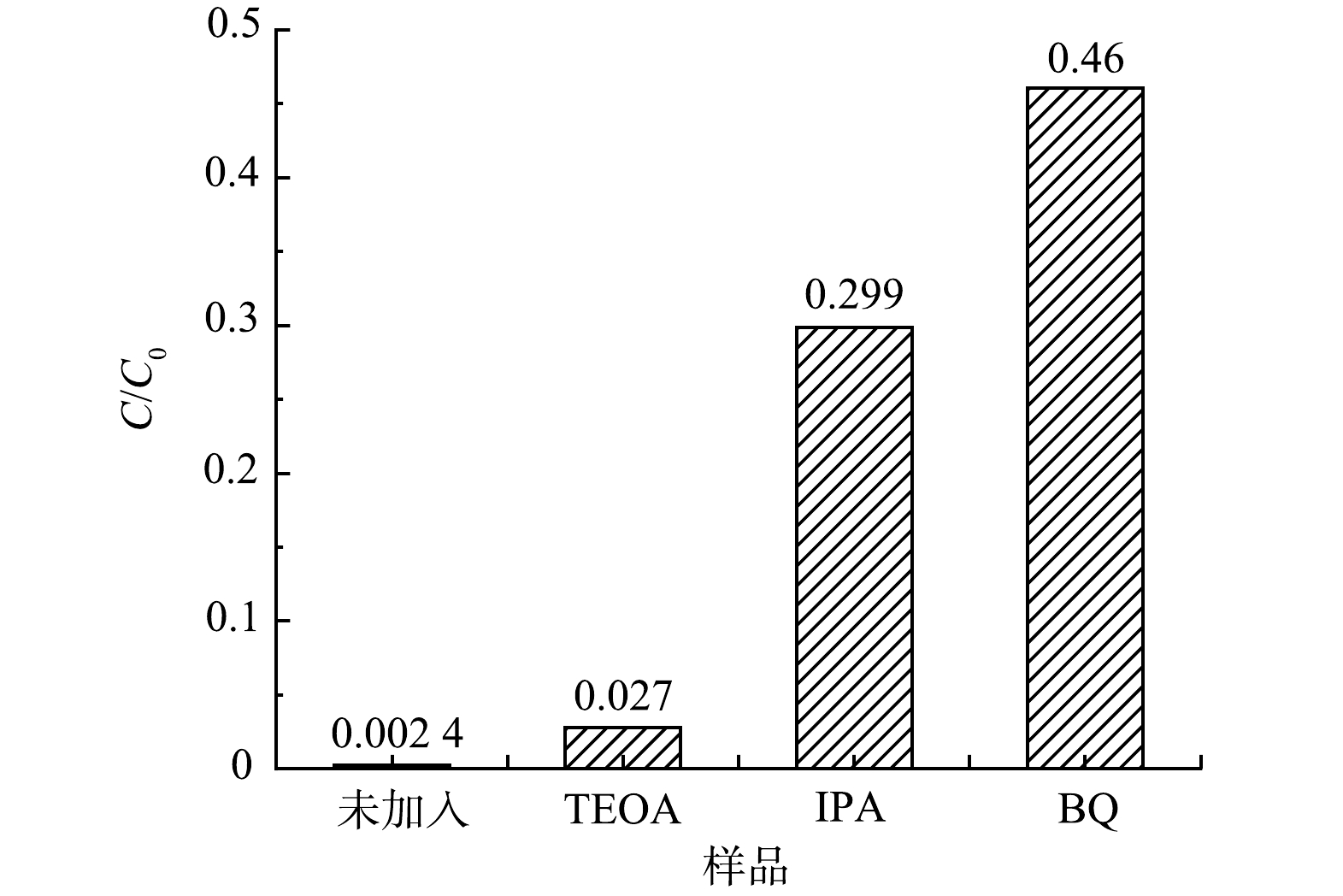
为了研究55%-PCN光催化降解RhB过程中的主要物种,分别用三乙醇胺(TEOA)、苯醌(BQ)和异丙醇(IPA)作为光催化降解体系中空穴(h+)、超氧自由基(·O2−)、羟基自由基(·OH)的捕获剂[36]来进行实验,结果如图11所示。当加入TEOA后,降解率未发生明显变化,即h+被捕获后催化活性变化不大,表明h+不是RhB降解的主要活性物种;在降解体系中加入IPA后,降解率下降明显,说明·OH对RhB的降解具有一定的促进作用;当加入BQ后,光降解效率明显下降,光催化活性被抑制的最明显,表明·O2−是RhB降解时最主要的活性物种。基于以上分析,在RhB降解时,最主要的活性物种是·O2−,其次是·OH,h+的活性可忽略不计。
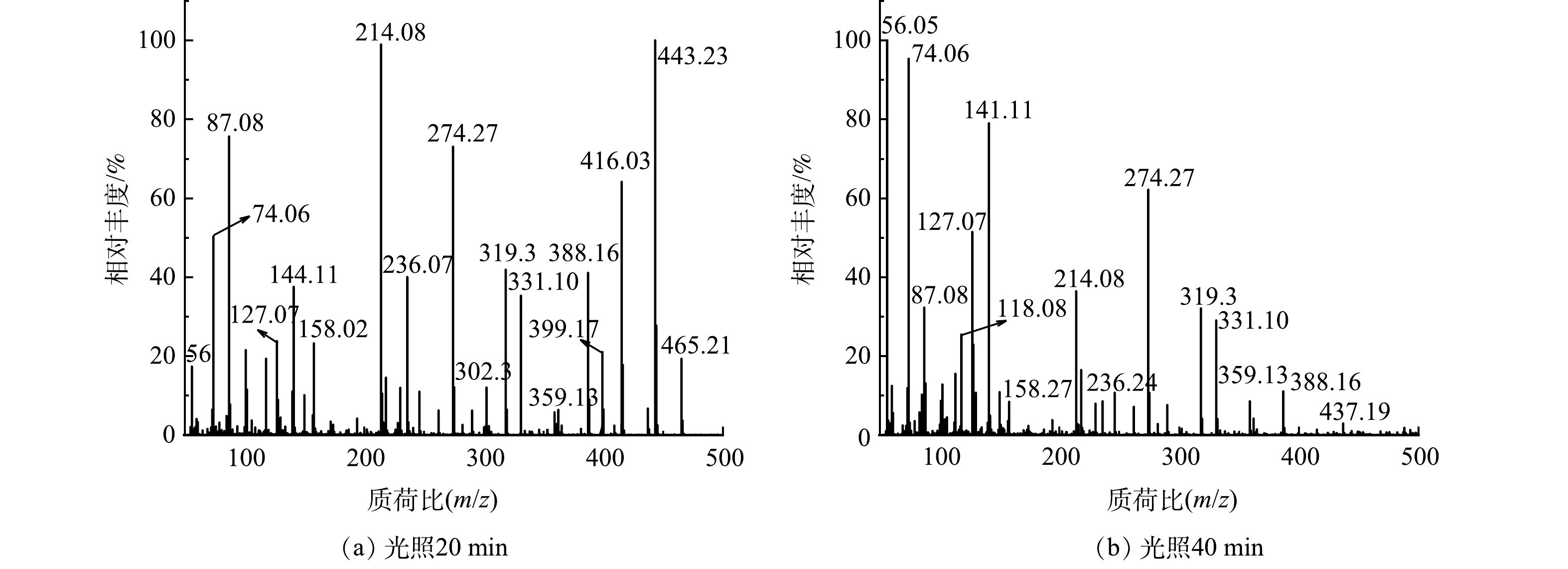
本研究对降解后RhB溶液进行高分辨质谱测试,以探究55%-PCN光催化降解RhB的具体过程。在图12(a)中,m/z=444表示RhB的阳离子峰;m/z=416、388、359、331表示RhB脱去1、2、3、4个乙基的分子离子峰;m/z=399表示RhB脱去1个羧基的离子峰;m/z=302可能是脱去4个乙基和1个羧基后被1个·OH羟基化所得产物的离子峰;m/z=319可能是脱去4个乙基和1个羧基后被2个·OH羟基化获得产物的离子峰[37];推测其余离子峰也是各个大分子不断被·OH多次氧化后的产物。由图12(b)可以看出,m/z>150的各处离子峰强度都有一定程度上的降低,而m/z<150的各个离子峰强度明显升高。这说明55%-PCN光催化降解RhB的过程是一个随着光照时间的升高,RhB开始脱乙基和羧基,同时·OH不断进攻苯环使其断裂、氧化,最终经过多次氧化反应生成各个小分子的过程。
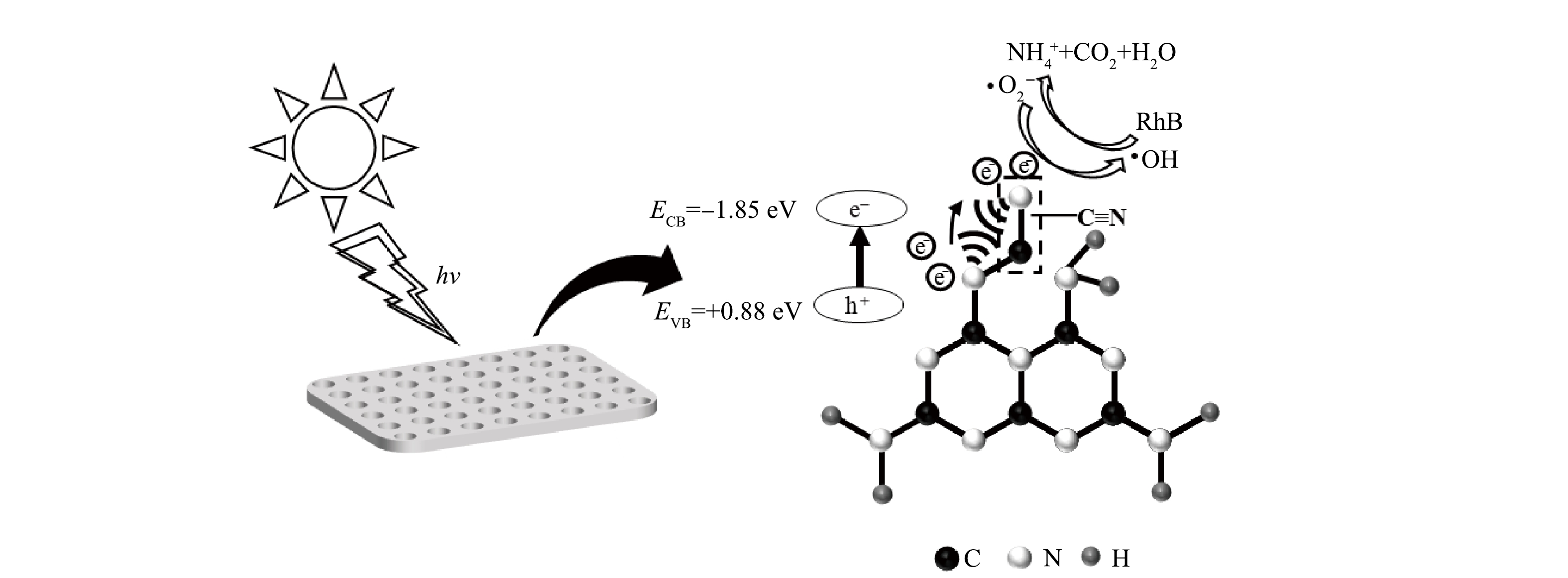
基于以上结果,推测55%-PCN光催化降解RhB的机理如图13所示。可以看出55%-PCN的价带主要由N原子的N2p轨道构成[32,38]。在光照射下,N原子上的电子充当电子供体被激发到导带生成光生e−,价带上留下大量h+(式(3))。导带上e−的还原电势较E(O2/·O2−)=−0.046 eV更负,与水中溶解的O2反应生成·O2−(式(4)),超氧自由基进一步反应生成过氧氢根(HOO·)和过氧化氢(H2O2)(式(5)和式(6)),接下来继续又被还原成具有强氧化性的·OH[32](式(7))。55%-PCN的孔结构给RhB的降解反应提供了更多边缘反应位点,RhB在脱乙基和脱羧基过程中不断与·OH接触,发生羟基化氧化反应。另外,氰基是常见的吸电子基团,常被用作电子受体[39]。当g-C3N4的结构中存在氰基时,氰基与相邻的N原子之间会形成局部分子内供体-受体(D-A)体系。D-A体系可以有效转移分子内的电荷,使光生e−和h+分离开来,从而降低载流子重组率[40]。故55%-PCN中的氰基的引入进一步给光催化降解RhB提供更多的活性位点,最终使RhB被氧化为NH4+、CO2、H2O等小分子。
PCN+hν→h++e− (3) e−+O2→·O−2 (4) ·O−2+H+→HOO⋅ (5) e−+HOO⋅→H2O2 (6) e−+H2O2→⋅OH (7) 3. 结论
1) 气体模板NH4Cl的引入可以在不破坏g-C3N4基本结构的基础上制备PCN,表面介孔数量增多,大大增加其比表面积和孔体积,给后续反应提供更多的活性位点。同时有利于提高吸光性能,经过测试其可见光吸收范围相比g-C3N4变宽。
2) 当前驱体中NH4Cl添加量为55%时所制备样品降解性能最佳。55%-PCN在50 min内对RhB的降解率为98%,伪一级动力学速率常数为6.07×10−2 min−1,是g-C3N4的5倍;并且其对RhB的TOC去除率比g-C3N4高,说明其可以更好地将RhB大分子吸附并降解。
3) 自由基捕获实验表明,在RhB降解时,·O2−和·OH参与了反应,在反应中,·O2−为最主要的活性物种。吸电子基团氰基与相邻的N原子之间会形成局部分子内D-A体系,使光生电子和空穴更好地分离,增加载流子寿命。55%-PCN的孔结构以及氰基的引入,均给RhB的降解反应提供了更多反应活性位点,在脱乙基和羧基过程中不断与·OH发生氧化反应,最终产物为NH4+、CO2、H2O等小分子。
-
表 1 采样点名称与地理位置
Table 1. Sample point name and geographical location
编号 采样点名称 地理坐标 U1 刘家峡 35°56′13.22″N,103°20′51.06″E U2 银川 38°21′35.93″N,106°24′52.24″E U3 三盛公 40°18′34.88″N,107°1′49.9″E U4 画匠营子 40°31′52.55″N,109°55′28.49″E M1 神泉 40°11′11.62″N,111°12′45.33″E M2 河曲 39°21′10.27″N,111°10′57.27″E M3 府谷 38°57′47.06″N,110°59′30.3″E M4 永和 36°50′10.12″N,110°24′59.61″E M5 潼关 34°36′36.03″N,110°17′16.91″E M6 七里铺 34°51′33.08″N,113°5′32.42″E D1 封丘浮桥 34°54′21.41″N,114°16′19.67″E D2 泺口 36°43′31.8″N,116°59′18.74″E D3 滨州黄河浮桥 37°20′25.19″N,118°3′35.09″E D4 胜利 37°36′17.5″N,118°31′48.51″E D5 入海口浮桥 37°45′35.42″N,119°9′53.51″E 表 2 人体健康风险评价模型参数[6]
Table 2. Parameters of human health risk assessment model
参数 物理意义 单位 取值 成人 儿童 BW 体重 kg 70 15 CF 单位转化因子 kg·mg−1 10−6 10−6 IR1 土壤颗粒摄入量 mg·d−1 100 200 IR2 呼吸频率 mg·d−1 20 7.65 ED 土壤暴露持续时间 a 24 6 EF 土壤暴露频率 d·a−1 350 350 SA 暴露皮肤面积 cm2 5 700 2 800 AF 皮肤的粘附系数 mg·cm−1·d−1 7×10−2 2×10−1 ABS 皮肤吸收因子 无量纲 1×10−3 1×10−3 PEF 灰尘排放因子 m3·kg−1 1.36×10−9 1.36×10−9 AT 平均总暴露时间 d ED×365 (非致癌) ED×365 (非致癌) 70×365 (致癌) 70×365 (致癌) 表 3 重金属参考剂量与致癌斜率因子[6, 15, 22-23]
Table 3. Reference values and carcinogenic slope factors of heavy metals
暴露途径 RfD/(mg·(kg·d)−1) CSF/(kg·(d·mg)−1) 口 呼吸 皮肤 口 呼吸 皮肤 As 3.00×10−4 3.01×10−4 1.23×10−4 1.50 1.50×101 3.66 Cd 1.00×10−3 1.00×10−3 1.00×10−5 1.8 6.30 3.80×10−1 Cr 3.00×10−3 2.86×10−5 6.00×10−5 5.00×10−1 4.20×101 1.00×10−3 Cu 4.00×10−2 4.02×10−2 1.20×10−2 / / / Ni 2.00×10−2 2.01×10−2 5.40×10−3 / 8.40×10−1 / Pb 3.50×10−3 3.52×10−3 5.25×10−4 / / / Zn 3.00×10−1 3.00×10−1 6.00×10−2 / / / V 5.00×10−3 / / / / / 表 4 表层沉积物中重金属RAC值
Table 4. RAC values of heavy metals in surface sediments
点位 As Cd Cr Cu Ni Pb Zn V Co U1 L M N N L L L N L U2 L H N L L L L N L U3 L M N N N N L N L U4 L M N N N N L N N M1 L M N L N N L N N M2 L H N N L N N N L M3 L M N L N N N N N M4 L M N N N N N N L M5 N L N N N N N N N M6 L H N L L N L N L D1 L H N L L L L N L D2 N VH N L N L L N L D3 N H N L N N L N N D4 L M N N N N L N N D5 N M N L N N L N L 注:N-没有风险; L-低风险; M-中等风险; H-高风险; VH-极高风险。 表 5 重金属非致癌健康风险平均值
Table 5. Average non-carcinogenic health risk of heavy metals
重金属与数据名称 口 皮肤 呼吸 HI 成人 儿童 成人 儿童 成人 儿童 成人 儿童 As 7.16×10−3 6.68×10−2 6.97×10−5 4.56×10−4 1.05×10−6 1.87×10−6 7.23×10−3 6.73×10−2 Cd 1.38×10−4 1.29×10−3 5.51×10−5 3.61×10−4 2.03×10−8 3.63×10−8 1.93×10−4 1.65×10−3 Cr 5.16×10−4 4.82×10−3 1.03×10−4 6.76×10−4 7.97×10−6 1.42×10−5 6.28×10−4 5.51×10−3 Cu 7.41×10−5 6.92×10−4 9.86×10−7 6.46×10−6 1.08×10−8 1.94×10−8 7.51×10−5 6.98×10−4 Ni 1.29×10−4 1.20×10−3 1.90×10−6 1.24×10−5 1.88×10−8 3.36×10−8 1.31×10−4 1.21×10−3 Pb 2.33×10−3 2.17×10−2 6.19×10−5 4.05×10−4 3.40×10−7 6.07×10−7 2.39×10−3 2.21×10−2 Zn 6.58×10−5 6.14×10−4 1.31×10−6 8.60×10−6 9.68×10−9 1.73×10−8 6.71×10−5 6.23×10−4 V 9.14×10−4 8.53×10−3 / / / / 9.14×10−4 8.53×10−3 总HI 1.18×10−2 1.07×10−1 表 6 重金属致癌健康风险平均值
Table 6. Average carcinogenic health risk of heavy metals
口 皮肤 呼吸 TCR 成人 儿童 成人 儿童 成人 儿童 成人 儿童 As 1.10×10−6 2.58×10−6 1.07×10−8 1.76×10−8 1.62×10−9 7.25×10−10 1.12×10−6 2.59×10−6 Cd 8.53×10−8 1.99×10−7 7.18×10−11 1.18×10−10 4.39×10−11 1.96×10−11 8.54×10−8 1.99×10−7 Cr 2.66×10−7 6.20×10−7 2.12×10−12 3.47×10−12 3.28×10−9 1.46×10−9 2.69×10−7 6.21×10−7 Ni / / / / 1.09×10−10 4.86×10−11 1.09×10−10 4.86×10−11 总TCR 1.47×10−6 3.42×10−6 -
[1] BAHADOR A K, FEIZNIA S, ALEALI M, et al. Impact of river sediments on contamination of shallow marine deposits in the South part Caspian Sea, Iran[J]. International Journal of Environmental Science and Technology, 2021, 18(11): 3503-3514. doi: 10.1007/s13762-021-03358-3 [2] AHN J M, KIM S, Kim Y S. Selection of priority management of rivers by assessing heavy metal pollution and ecological risk of surface sediments[J]. Environ Geochem Health, 2020, 42(6): 1657-1669. doi: 10.1007/s10653-019-00284-9 [3] LIN S, LIU X, ZHANG Z, et al. Speciation characteristics and ecological risk assessment of heavy metals in sediments from Caohai Lake, Guizhou Province[J]. Stochastic Environmental Research and Risk Assessment, 2022, 36(11): 3929-3944. doi: 10.1007/s00477-022-02236-9 [4] LI M Y, ZHANG Q G, SUN X J, et al. Heavy metals in surface sediments in the trans-Himalayan Koshi river catchment: Distribution, source identification and pollution assessment[J]. Chemosphere, 2019, 244(4): 125410. [5] WOJCIECHOWSKA E, NAWROT N, WALKUSZ-MIOTK J, et al. Heavy metals in Sediments of Urban Streams: Contamination and Health Risk Assessment of influencing factors[J]. Sustainability, 2019, 11(3): 563. doi: 10.3390/su11030563 [6] 朱成斌, 胡菁, 龙云川, 等. 贵州草海沉积物重金属元素分布特征及健康风险评价[J]. 环境科学学报, 2021, 41(6): 2212-2221. doi: 10.13671/j.hjkxxb.2020.0455 [7] EMENIKE P C, TENEBE I T, NERIS J B, et al. An integrated assessment of land-use change impact, seasonal variation of pollution indices and human health risk of selected toxic elements in sediments of River Atuwara, Nigeria[J]. Environmental Pollution, 2020, 265: 114795. doi: 10.1016/j.envpol.2020.114795 [8] 潘辉, 郑开基, 游巍斌, 等. 不同起源秋茄林湿地沉积物重金属污染与健康风险评价[J]. 广西植物, 2022, 42(3): 470-478. doi: 10.11931/guihaia.gxzw202104057 [9] AL-MUR B A. Geochemical fractionation of heavy metals in sediments of the Red Sea, Saudi Arabia[J]. Oceanologia, 2019, 62(1): 31-44. [10] KAVITAVERM, PANDEY J. Heavy metal accumulation in surface sediments of the Ganga River (India): speciation, fractionation, toxicity, and risk assessment[J]. Environmental Monitoring Assessment, 2019, 191(7): 414. doi: 10.1007/s10661-019-7552-7 [11] GUSIATIN Z M, KULIKOWSKA D. The usability of the IR, RAC and MRI indices of heavy metal distribution to assess the environmental quality of sewage sludge composts[J]. Waste Management, 2014, 34(7): 1227-1236. doi: 10.1016/j.wasman.2014.04.005 [12] LI J, ZHAO A, XUAN H, et al. Speciation Distribution Characteristic and Ecological Risk of Heavy Metals in Surface Sediments of Cascading Hydropower Dams in Lancang River[J]. Water, 2022, 14(20): 3248. doi: 10.3390/w14203248 [13] LI H, CHAI L Y, YANG A H, et al. Systematic Assessment of Health Risk from metals in Surface Sediment of the Xiangjiang river, China[J]. International Journal of Environmental Research and Public Health, 2020, 17(5): 1677. doi: 10.3390/ijerph17051677 [14] ZHAO Q, DING S, GENG Z, et al. Concentration, Health Risk, and Hydrological Forcing of Heavy Metals in Surface Water Following Water-Sediment Regulation of the Xiaolangdi Dam in the Yellow River[J]. International Journal of Environmental Research and Public Health, 2022, 19(9): 5713. doi: 10.3390/ijerph19095713 [15] SHEN W, HU Y, ZHANG J, et al. Spatial distribution and human health risk assessment of soil heavy metals based on sequential Gaussian simulation and positive matrix factorization model: A case study in irrigation area of the Yellow River[J]. Ecotoxicology and Environmental Safety, 2021, 225: 112752. doi: 10.1016/j.ecoenv.2021.112752 [16] 王蕊, 陈明, 陈楠, 等. 基于总量及形态的土壤重金属生态风险评价对比: 以龙岩市适中镇为例[J]. 环境科学, 2017, 38(10): 4348-4359. [17] 周亚龙, 郭志娟, 王成文, 等. 云南省镇雄县土壤重金属污染及潜在生态风险评估[J]. 物探与化探, 2019, 43(6): 1358-1366. [18] NEMATI K, BAKAR N K A, ABAS M R, et al. Speciation of heavy metals by modified BCR sequential extraction procedure in different depths of sediments from Sungai Buloh, Selangor, Malaysia[J]. Journal of Hazardous Materials, 2011, 192(1): 402-410. [19] LIANG B C, QIAN X, PENG S, et al. Speciation Variation and Comprehensive Risk Assessment of Metal(loid)s in Surface sediments of Intertidal Zones[J]. International Journal of Environmental Research and Public Health, 2018, 15(10): 2125. doi: 10.3390/ijerph15102125 [20] HE X, LI F L, DOMINECH S, et al. Heavy metals of surface sediments in the Changjiang (Yangtze River) Estuary: Distribution, speciation and environmental risks[J]. Journal of Geochemical Exploration, 2019, 198: 18-28. doi: 10.1016/j.gexplo.2018.12.015 [21] ADEDEJI O H, OLAYINKA O O, TOPE-AJAYI O O. Spatial Distribution and Health Risk Assessment of Soil Pollution by Heavy Metals in Ijebu-Ode, Nigeria[J]. Journal of Health and Pollution, 2019, 9(22): 190601. doi: 10.5696/2156-9614-9.22.190601 [22] 李嘉蕊. 基于土壤-作物-人体系统的耕地重金属污染评价和健康风险评估[D]. 杭州: 浙江大学, 2019. [23] 杨学福. 渭河陕西段重金属的污染特征及风险研究[D]. 西安: 西安建筑科技大学, 2015. [24] SUN C Y, ZHANG Z X, CAO H N, et al. Concentrations, speciation, and ecological risk of heavy metals in the sediment of the Songhua river in an urban area with petrochemical industries[J]. Chemosphere, 2019, 219(3): 538-545. [25] 林承奇, 胡恭任, 于瑞莲, 等. 九龙江表层沉积物重金属赋存形态及生态风险[J]. 环境科学, 2017, 38(3): 1002-1009. doi: 10.13227/j.hjkx.201607087 [26] 袁浩, 王雨春, 顾尚义, 等. 黄河水系沉积物重金属赋存形态及污染特征[J]. 生态学杂志, 2008, 27(11): 1966-1971. doi: 10.13292/j.1000-4890.2008.0355 [27] 庞阔, 李敏, 刘璐, 等. 基于蒙特卡洛模拟与PMF模型的黄河流域沉积物重金属污染评价及源解析[J]. 环境科学, 2022, 43(8): 4008-4017. [28] XIE F Y, YU M C, YUAN Q K, et al. Spatial distribution, pollution assessment, and source identification of heavy metals in the yellow river[J]. Journal of Hazardous Materials, 2022, 436: 129309. doi: 10.1016/j.jhazmat.2022.129309 [29] 燕婷, 刘恩峰, 张恩楼, 等. 抚仙湖沉积物重金属时空变化与人为污染评价[J]. 湖泊科学, 2016, 28(1): 50-58. doi: 10.18307/2016.0106 [30] LU Q Q, BAI J H, GAO Z Q, et al. Spatial and seasonal distribution and risk assessments for metals in a tamarix chinensis wetland, China[J]. Wetlands, 2014, 36(11): 125-136. [31] LIU G N, WAN J, ZHANG E X, et al. Heavy metal speciation and risk assessment in dry land and paddy soils near mining areas at Southern China[J]. Environmental Science and Pollution Ressearch, 2016, 23(9): 8709-8720. doi: 10.1007/s11356-016-6114-6 [32] PAN L B, FANG G L, WANG Y, et al. Potentially toxic element pollution levels and risk assessment of soils and sediments in the upstream river, Miyun Reservoir, China[J]. International Journal of Environmental Research and Public Health, 2018, 15(11): 2364. doi: 10.3390/ijerph15112364 [33] RINKLEBE J, ANTONIADIS V, SHAHEEN S M, et al. Health risk assessment of potentially toxic elements in soils along the Central Elbe River, Germany[J]. Environment International, 2019, 126: 76-88. doi: 10.1016/j.envint.2019.02.011 [34] 张佳森. Cd污染土壤暴露风险评估及污染治理现状[J]. 农业与技术, 2021, 41(12): 96-99. doi: 10.19754/j.nyyjs.20210630024 [35] 王海珍, 谢浩然, 俞昊良, 等. 关注沉积物污染“隐疾”, 维护黄河环境健康[J]. 水利发展研究. 2021, 21(5): 49-51. [36] 李俊红, 田文仲, 张洁, 等. 黄河流域农业生态资源高效利用途径与对策[J]. 耕作与栽培. 2022, 42(5): 138-140. [37] 康国华, 张鹏岩, 李颜颜, 等. 黄河下游开封段引黄灌区小麦中重金属污染特征及健康风险评价[J]. 环境科学, 2018, 39(8): 3917-3926. doi: 10.13227/j.hjkx.201709198 -






 下载:
下载: