-
近年来,餐厨垃圾的产量急剧增加[1],据统计,中国每年产生的餐厨垃圾超过6 000×104 t[2]。在餐厨垃圾的处理过程中会产生大量的餐厨废水,而餐厨废水的无害化和资源化处理受到广泛关注。厌氧消化技术可以将餐厨废水中的有机质转化为沼气,实现能源的回收与利用[3]。然而,厌氧消化产生的沼气中含有40%~60%的不可燃气体CO2,降低了沼气的热值。有研究表明,提纯后的沼气(CH4>90%)可用作车辆燃料或作为天然气替代能源[4]。目前,沼气提纯方法可以分为物理法、化学法和生物法等。沼气生物提纯作为一种新型处理技术越来越受到重视,该技术利用嗜氢产甲烷菌的新陈代谢作用将CO2和H2转化为CH4,而不是将CO2从体系中分离或吸收,可减少CO2排放,故具有低能耗、无二次污染等特点[5-6]。
根据供氢方式的不同,沼气生物提纯技术可分为原位提纯和异位提纯。原位沼气提纯中H2直接注入厌氧消化体系中,在微生物作用下H2和CO2转化为CH4,装置简单易操作,但氢分压的增加及混合剪切力的增强可能会降低产甲烷菌的性能,导致有机酸积累,降低反应效率[7]。异位生物提纯中厌氧消化和沼气提纯在2个独立体系内进行,厌氧消化产生的沼气通入提纯体系内,嗜氢产甲烷菌在H2的作用下提纯沼气,具有较高稳定性和灵活性[8,9]。然而,H2的气液传质效率成为沼气提纯的主要限制因素[10]。如何提高H2的溶解度是解决低H2传质速率的关键。纳米零价铁(nano zero-valent iron, nZVI)在厌氧条件下可以与水反应生成H2(式(1)),该过程中H2从容器底部析出,可以加大气液接触面积。DONG等[11]的研究表明,nZVI溶解产生H2可以提高CO2的甲烷化。此外,气体传递系数的提高可以提升H2气-液传质速率(式(2))[12]。有研究[13]表明,气体循环可有效增加气体传递系数,提高H2利用率和CH4含量。KARIM等[14]利用气体循环提高了牛粪厌氧体系中CH4的产量。ZHAO等[13]在气体循环条件下对污泥进行半连续厌氧消化处理,与无气体循环相比,CH4含量提高了14%~15%。但关于nZVI供氢的异位生物提纯与气体循环相结合的研究报道还较少。
式中:Rt表示H2传质速率,mol·(L·h)−1;kLa表示线性气体传递系数,h−1;H2gTh表示气相中H2浓度,mol·L−1;H2l表示液相中H2浓度,mol·L−1。
本研究通过厌氧消化处理餐厨废水,采用异位生物提纯方法提高CH4含量。在实验过程中,利用nZVI在厌氧体系下析氢为沼气提纯体系提供H2,同时设计单向式、往复式、循环式3种气体循环方式,分析了不同气体循环方式下沼气异位生物提纯效果,以期获得最佳的运行方式。
-
厌氧消化的底物为餐厨废水,取自无锡市某餐厨垃圾处理厂。厌氧颗粒污泥取自无锡市某食品厂的厌氧消化池。原始的餐厨废水和接种污泥的性质如表1所示。nZVI (直径50 nm,纯度99.9%)购自宁波金雷纳米材料科技有限公司。
-
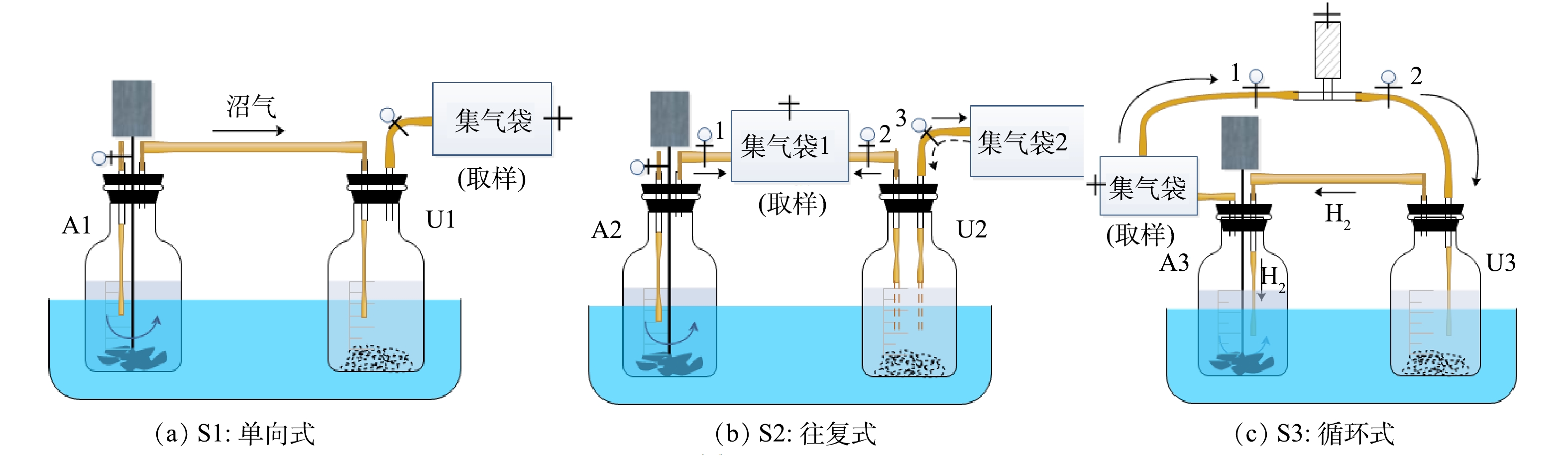
本研究设置了单向式、往复式和循环式3种实验。每种方式均采用异位生物提纯法,由厌氧消化体系(图1,A1、A2、A3)和沼气提纯体系(图1,U1、U2、U3)2个体系构成。其中,前一体系用于餐厨废水厌氧消化处理,产生沼气;后一体系用于沼气生物提纯,nZVI提供H2。在前期研究基础上,将收集的餐厨废水经离心去除固体物质后稀释10倍使用,厌氧消化体系中底物和接种物按COD底物:VS接种物(质量比)为1.2∶1在500 mL血清瓶内接种[15]。将nZVI和厌氧颗粒污泥投加到沼气生物提纯体系中,根据文献报道[11]和前期实验,选择nZVI的质量浓度为6 g·L−1,该体系不添加其他底物,实验设计参数如表2所示。实验前向所有反应瓶内通5 min氮气以维持厌氧环境,采用2 mol·L−1 NaOH或HCl将厌氧-沼气提纯反应瓶内初始pH调至7.00[15],在(36±1) ℃下反应,反应过程中对厌氧消化体系采用间歇式搅拌,间隔时间为2 h,搅拌转速为60 r·min−1。实验的前3 d为厌氧消化产沼气,从第4天开始启动沼气循环操作,每天循环2次,每次循环持续1 h,具体操作方式如下文所述。
实验S1为单向式。在A1内进行餐厨废水厌氧消化处理,产生的沼气(含CO2)通入U1体系,在U1内利用nZVI供氢实现沼气生物提纯。
实验S2为往复式。在最初3 d内,打开阀门1和2,关闭阀门3,在集气袋1内收集A2产生的沼气(含CO2)以及U2中nZVI产生的H2。第4天启动气体循环,做气体循环处理时,关闭阀门1,打开阀门2和3,以往复方式循环集气袋1中收集的气体。往复循环时先将U2反应瓶内混合物摇匀,再将U2反应瓶倾斜,使阀门2连接的气管进入到U2反应瓶液面以下(图1-U2中虚线气管),集气袋1内气体全部通入U2,经微生物利用后进入集气袋2。然后将阀门3连接的气管进入到U2反应瓶液面以下(图1-U2中虚线气管),集气袋2内气体全部通入U2,经微生物利用后进入气袋1。重复上述操作持续1 h,每天2次。不做气体循环处理时,打开阀门1和2,关闭阀门3,在集气袋1内收集A2和U2产生的气体。
实验S3为循环式。在最初的3 d内,关闭阀门1和2,U3中nZVI产生的H2先进入A3体系,经微生物利用后与A3中产生的沼气混合进入集气袋。第4天启动气体循环,打开阀门1和2,将集气袋内的气体依次通入U3、A3,形成U3-A3-集气袋-U3闭环沼气循环,重复上述操作持续1 h,每天2次。
-
TS、VS、MLSS、MLVSS、COD测定根据《国家水和废水监测分析方法》[16]。pH采用pH计测定,ORP采用氧化还原电位仪测定,富氢值(HE)采用富氢电极测定,C、N、H采用元素分析仪测定。VFAs浓度采用气相色谱仪(日本岛津 GC-2010PLUS)测定,以高纯氮为载气,检测器采用氢火焰离子化检测器(FID),温度设置为250 ℃;分析柱为peg-20m色谱柱,柱温设置为70 ℃;进样口温度为250 ℃。气体(H2、CH4和CO2)采用气相色谱仪(GC-2014,日本岛津公司)测定,热导检测器(TCD)及TDX-1色谱柱,柱温,进样口温度和检测器温度分别为100、180和180 ℃,载气为氩气[17]。根据GOEL[18]等方法测定蛋白酶和脱氢酶的活性,按照DU等[19]方法测定乙酸激酶活性,通过分光光度法测定辅酶F420活性[20]。
-
各反应体系结束后采集污泥样品,使用PowerSoil试剂盒从样品中提取DNA,再进行聚合酶链反应(PCR)扩增。细菌的引物为341F (5′-CCTACGGGGNGGCWGCAG-3′)和805R (5′-GACTAChVGGTATCTACC-3′)。古菌第1轮引物为340F (5′-CCCTayGGGYGCASCAG-3′)和1000R (5′-GGCCATGCACYWCYTCTC-3′),第二轮引物为349F (5′-GYGCASCAGKCGMGAAW-3′)和806R (5′-GGACTACVSGGGTATCTAAT-3′),测序平台为Illumina MiSeq。
-
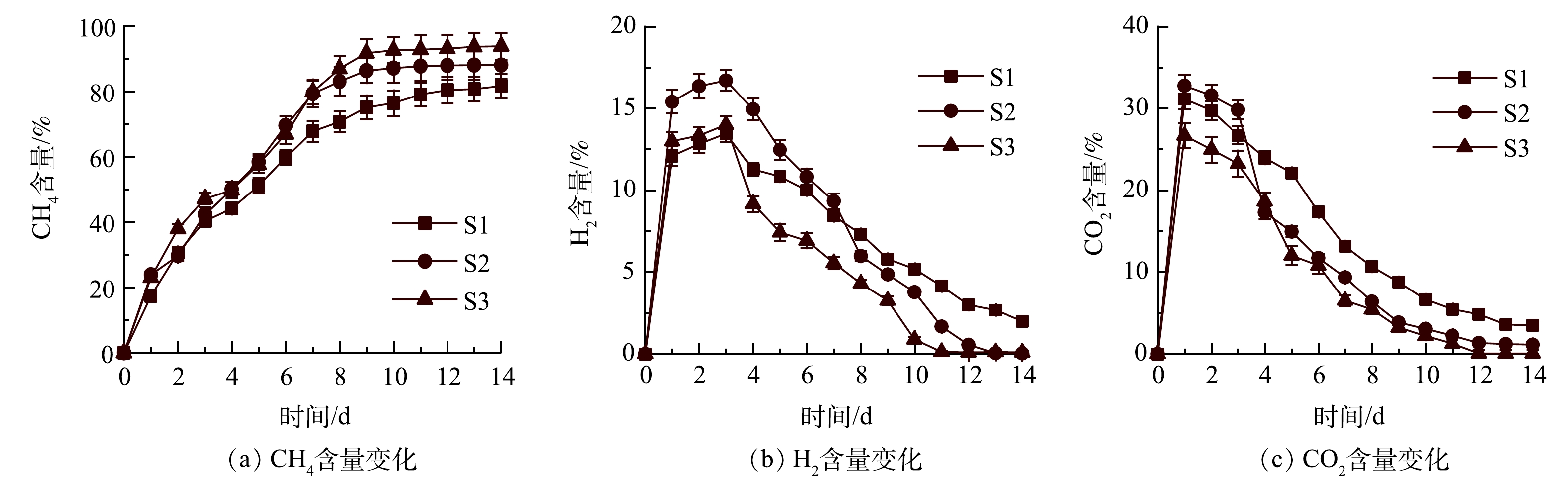
如图2(a)所示,前3 d没有启动气体循环,S1、S2、S3的CH4含量均呈现上升的趋势。启动循环后,与S1相比,S2和S3的CH4含量在4~10 d内迅速增加。S1、S2、S3的CH4含量在第10天分别达到76.46%、87.15%、92.63%,在提纯过程中的最大CH4含量分别为81.69%、88.12%、93.87%。有研究表明,未经提纯的沼气中CH4含量约为60%[21-22]。本实验中经异位生物提纯后CH4含量显著提高(P<0.05),与单向式相比,往复式和循环式气体循环后CH4含量分别提高了6.43%和12.18%。
由图2(b)可以看出,由于nZVI腐蚀析氢和沼气的产生,S1、S2和S3的H2含量在第3天达到最大值,即13.46%、16.70%、14.00%,且S1和S3中的H2含量显著低于S2(P<0.05)。这主要是因为:S1和S3体系首先启动了异位生物提纯,H2的产生与消耗同时进行;而S2产生的H2在前3 d内直接进入集气袋内不参与沼气提纯。在启动气体循环后,H2被反复注入体系并被微生物利用,在反应结束时几乎检测不到H2,CH4含量也随着H2循环次数的增加而提高。此外,H2的再循环也为厌氧消化体系提供更多的底物,促进了有机物的水解,生物提纯体系中nZVI与水产生H2的同时还生成Fe2+,Fe2+可以与S2-结合,减少气体循环过程中H2S的累积,从而避免H2S对产甲烷菌的抑制[23]。
图2(c)为CO2含量的变化情况。与H2变化相似,不同的是启动气体循环后,CO2的降解速率高于H2。这主要是由于CO2在水中有较高的溶解性[24]。含有H2和CO2的气体循环可增加H2和CO2的溶解,并提高厌氧消化体系内气-液-固相的接触时间,这有利于CH4的产生[13]。LATHA等[24]的研究表明,由于CO2的酸化性,间歇式气体循环可以促进酸碱平衡。在本实验中,nZVI在水中的溶解会产生OH−,提高系统的pH,这对产甲烷微生物产生不利影响,但CO2再循环可以维持体系pH稳定。
图3为累积沼气和CH4产量情况。结果表明,S1、S2、S3反应14 d后的累积沼气(CH4)产量分别为70.57 (57.65)、96.60 (85.12)、167.44 (157.18) mL·g−1。与S1和S2相比,S3体系内沼气和甲烷产量均显著提高(P<0.05)。这与ZHAO等[13]的研究结果一致。
据报道,气体循环可以提高厌氧消化体系内产甲烷菌对底物的利用率[25]。由于S3中的气体在厌氧消化和沼气提纯2个体系中进行循环,两体系的微生物可以将H2和CO2转化为CH4,从而提高S3中的甲烷产量。而S1未进行气体循环,S2的气体仅在沼气提纯体系中进行循环,因此,相对于S3,S1、S2的H2和CO2利用率更低。
-
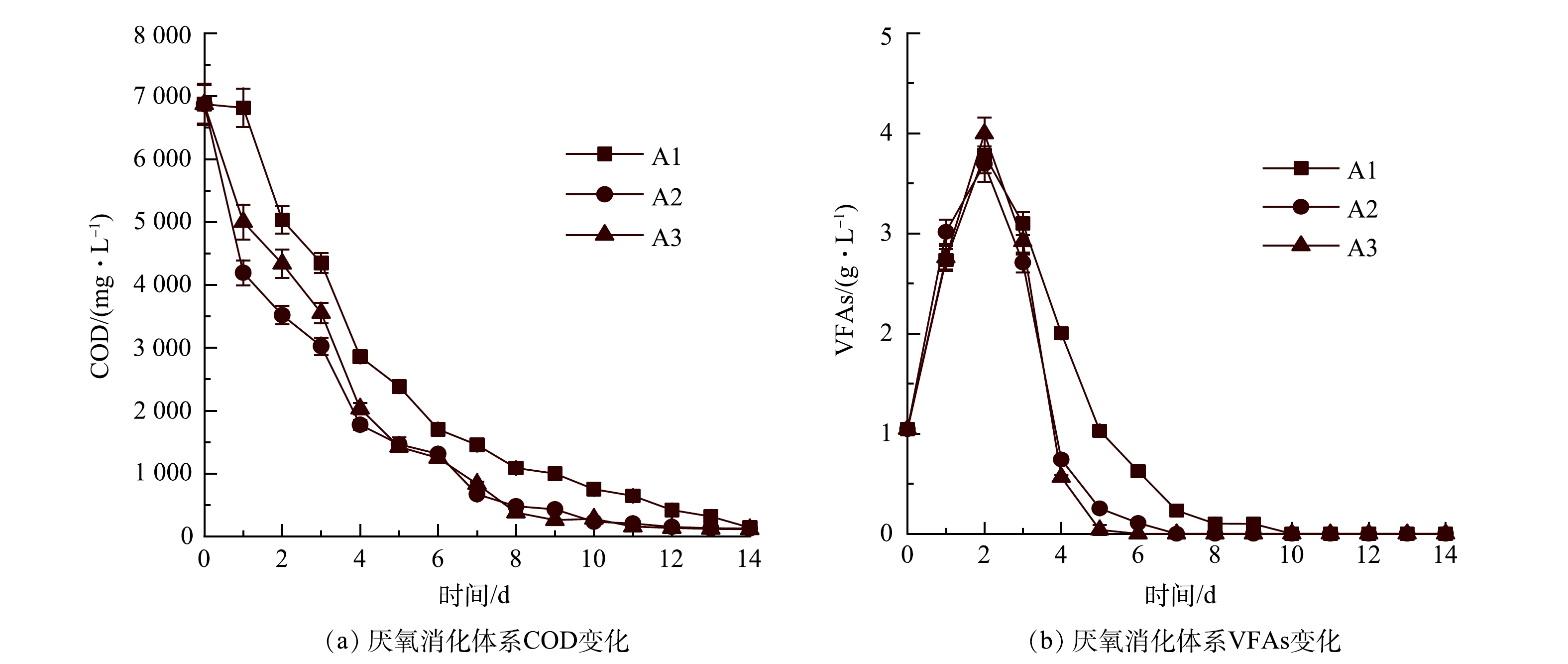
沼气/CH4产量与厌氧反应体系中COD和VFAs的降解相关[26]。如图4(a)所示,A1、A2和A3的COD值分别从第4天的2 856、1 776、2 032 mg·L−1下降到第14天的140、125、115 mg·L−1,A2和A3的COD降解速率高于A1。这一结果表明,气体循环有利于促进餐厨废水中有机物的降解。WEI等[27]认为,外源H2不仅可以将CO2转化为CH4,还可以促进有机物降解。气体循环可以提高有机物的产CH4率,这也是S2和S3体系中CH4产量增加的原因之一。
由图4(b)可以看出,A1、A2、A3的最大VFAs质量浓度(第2天)分别为3.78、3.70、3.99 g·L−1,此后VFAs逐渐下降直到反应结束。3个厌氧消化体系均未出现酸化现象,但VFAs的降解率是否与有气体循环有关。在第4天开始对S2和S3启动气体循环后,A2和A3中VFAs的降解速率明显高于A1(P<0.05)。A2和A3系统中的VFAs分别在第6天和第7天完全降解,而A1系统VFAs降解至0的时间(第10天)相对滞后。由此可知,气体循环可提高厌氧微生物的降解性能。
-
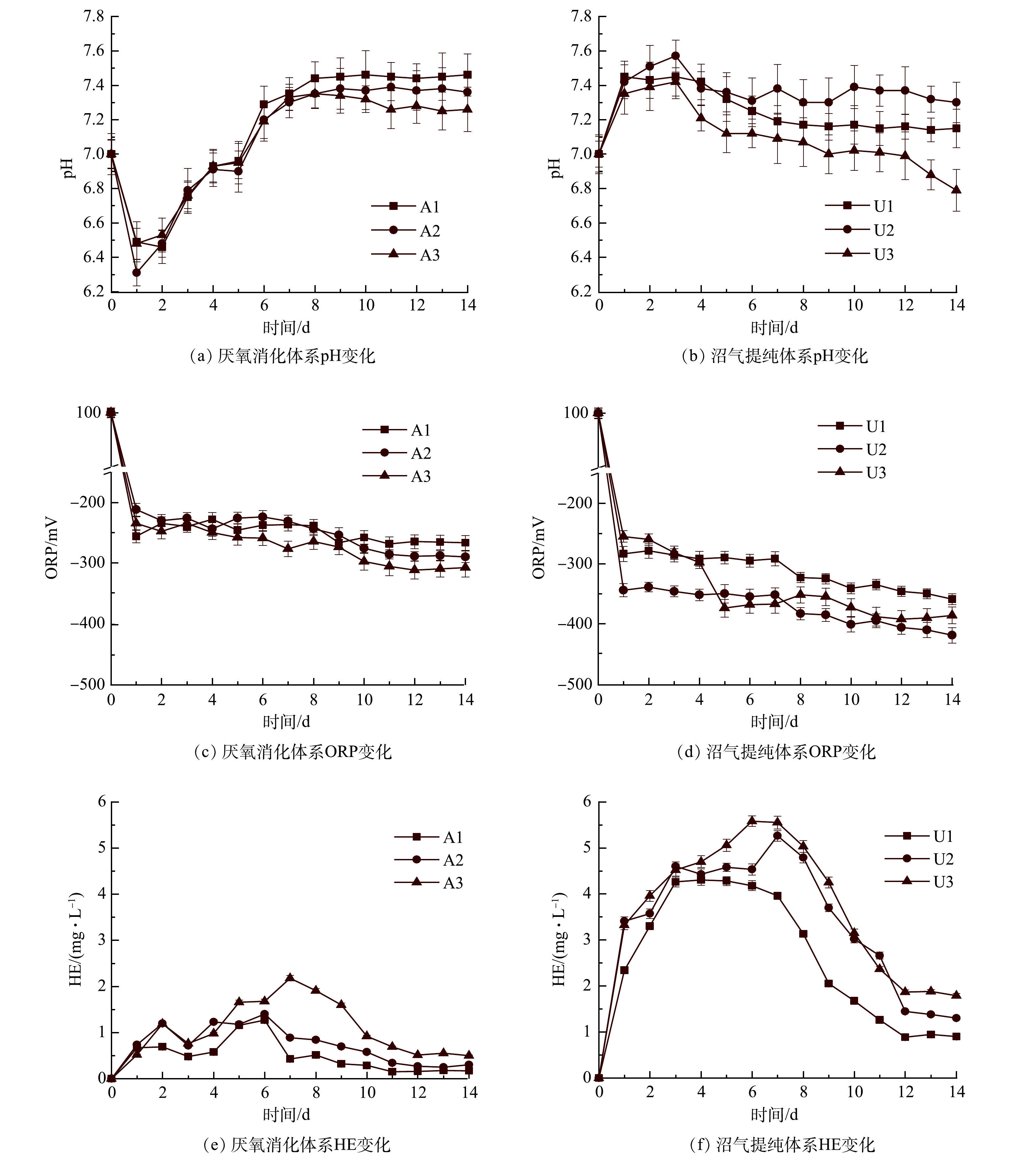
由图5(a)可看出,A1、A2、A3中的pH在厌氧消化开始时由7.00迅速下降到6.75、6.79、6.76,然后上升直至反应结束。这是由于厌氧消化过程中快速水解和酸化导致VFAs积累,随着VFAs的消耗,pH逐渐升高。整个过程中A1、A2、A3的最高pH分别为7.46、7.39、7.35。与A1相比,由于气体循环,A2和A3在稳定阶段更容易维持中性pH。这种现象在沼气提纯体系中较明显。在U2和U3中由于nZVI溶于水产生OH−,pH在前3 d逐渐升高(图5(b)),这对产甲烷菌活性和nZVI释氢均有不利影响。启动气体循环后,pH逐渐恢复到产甲烷菌的最适范围(6.5~7.5)。LI等[28]认为,通过气体循环将CO2多次溶解到沼气提纯液相中,可中和nZVI产生的OH−以维持体系pH稳定,为产甲烷菌提供最佳环境。在U1体系中,从第1天开始,pH没有显著提高(P>0.05)。这是由于沼气异位生物提纯过程中来自A1的CO2不断进入U1,因而中和U1中nZVI产生的OH−。
ORP可以反映厌氧消化过程中细胞代谢活动的氧化还原平衡和电子转移[29]。nZVI作为一种还原剂,可以保持厌氧系统中较低的ORP。产甲烷菌中的多种酶能适应较低的ORP环境,防止酶被氧化而失去活性[30]。由图5(c)和(d)可以看出,含有nZVI的沼气提纯体系ORP显著低于厌氧消化体系 (P<0.05)。XU等[31]的研究表明,体系ORP的降低是nZVI提高CH4产量的重要因素。此外,U2和U3系统的ORP低于U1,这可能也是S2和S3沼气产量增加的原因之一。
富氢值(HE)表示液相中的氢含量(图5(e,f))。与厌氧消化体系相比,沼气提纯体系内HE由0.15~2.18 mg·L−1(A1、A2、A3)增加到0.89~5.58 mg·L−1 (U1、U2、U3)。这表明厌氧条件下nZVI的析氢将大幅度增加液相内的H2含量,HE的增加可以提高H2的传质效率,促进厌氧微生物将更多的H2和CO2转化为CH4。此外,气体循环促进了更多H2和CO2在液相中的溶解,因而加速了微生物对H2和CO2的利用。
-
表3为反应结束后各体系酶活情况。A1、A2、A3中,碱性蛋白酶活性分别为17.67、62.66、67.48 nmol·(min·g)−1(以VS计),乙酸激酶活性分别为74.91、79.07、91.55 nmol·(min·g)−1,较初始污泥均有所提高。A1、A2、A3、U1、U2、U3中,脱氢酶的活性分别为10.40、15.16、29.29、30.34、31.23、31.10 μg·(min·g)−1,较初始污泥显著提高(P<0.05),且沼气提纯体系比厌氧发酵体系高。这是因为nZVI可以提供较低的ORP条件(图5(d)),脱氢酶在该条件下能保持较高活性,有利于微生物高效利用H2和CO2,从而提高甲烷产率[32]。辅酶F420是一种产甲烷菌酶,主要参与CH4的生成过程。U1、U2、U3中辅酶F420活性较原始污泥分别提高了84.85%、124.24%,127.73%,说明气体循环提高了辅酶F420的活性,尤其是生物提纯体系。nZVI溶解产生的Fe2+也可以提高沼气提纯体系内相关酶的活性,这对提高有机物的产CH4率具有促进作用[23]。
-
图6(a)为反应结束后各体系中细菌群落在门水平上的变化。初始污泥中丰度最大的是Chloroflexi(14.36%),其次是Actinobacteria(8.53%)。经过厌氧消化和沼气提纯后,微生物结构发生了较大变化。样品中的优势菌主要由Chloroflexi、Firmicutes、Proteobacteria、Bacteroidetes、Actinobacteria组成。在厌氧消化体系内(A1、A2、A3),Chloroflexi较初始污泥增加了5%~10%,Chloroflexi是厌氧消化的常见菌群,对餐厨废水中的多糖和单糖均具有降解能力,并能够产生乙酸为产甲烷菌提供底物[33]。LI等[34]的研究表明,Chloroflexi参与水解发酵过程,有利于促进厌氧消化的进程。Firmicutes提高了10.5%~14.4%,Firmicutes可以分泌多种胞外酶降解大分子底物,如蛋白质和脂类。因此,Firmicutes相对丰度的提高加速了难降解有机物的降解,为产甲烷菌提供营养[35]。Proteobacteria增加了2%左右,Proteobacteria的类型比较复杂,其含有的多种类型细菌不仅能利用葡萄糖、丙酸和丁酸等小分子化合物,而且会在酸化过程中产生乙酸为产甲烷菌提供底物[36]。Bacteroidetes和Actinobacteria的相对丰度增加,Bacteroidetes和Actinobacteria是厌氧消化过程主要的产酸菌,对复杂的碳水化合物具有降解作用,其相对丰度的增加也会导致VFAs 浓度的提高。这与图4(b)的结果一致。沼气提纯体系内(U1、U2、U3)由于没有餐厨废水作为底物,参与水解发酵过程的微生物没有显著变化,但与U1相比,U2和U3的5种优势菌相对丰度均有所增加。这说明气体循环可以提供H2和CO2,改善微生物群落结构。
图6(b)为反应结束后各体系污泥中古菌群落在属水平上的变化。优势菌是Methanothrix、Methanobacterium、Methanolinea、Methanomethylovorans。其中,Methanothrix属于乙酸型产甲烷菌,Methanobacterium和Methanolinea属于氢营养型产甲烷菌,Methanomethylovorans属于甲基型产甲烷菌。与原始接种污泥相比,Methanothrix在厌氧消化体系内变化不大,但在沼气提纯体系降低了2%~6%,Methanomethylovorans在两体系内均有不同程度降低。然而,与初始污泥相比,Methanobacterium和Methanolinea由初始污泥的28%提高到38%~51%。此外,与厌氧消化体系 (A1、A2、A3)相比,沼气提纯体系内(U1、U2、U3) Methanobacterium和Methanolinea的相对丰度较大。这表明nZVI供氢的沼气生物提纯能促进微生物向氢营养型产甲烷菌演替。LI等[34]认为,Methanobacterium可以利用H2和CO2转化为CH4。而与U1相比,U2和U3中2种氢营养型产甲烷菌的相对丰度值最高。这表明气体循环可以促进氢营养型产甲烷菌的富集,从而加快H2和CO2向CH4的转化。
-
1)对餐厨废水厌氧消化产生的沼气进行基于nZVI供氢的异位生物提纯,能有效提高CH4含量和产量。
2)单向式、往复式、循环式3种气体循环方式的最终CH4含量分别为81.69%、88.12%、93.87%,CH4产量分别为57.65、85.12、157.18 mL·g−1,其中循环式为最佳方式。
3) nZVI可降低沼气提纯体系内ORP;nZVI供氢与气体循环相结合,可以提高H2的气-液传质效率;CO2再循环有利于维持体系酸碱平衡,优化厌氧消化环境,在异位提纯基础上提高CH4含量和产量。
4) nZVI供氢的异位生物提纯和气体循环提高了脱氢酶和辅酶F420的相对活性,促进了微生物向氢营养型产甲烷菌的演替。其中,Methanobacterium和Methanolinea由初始污泥的28%提高到38%~51%。
气体循环方式对餐厨废水厌氧消化沼气生物提纯的影响
Effects of gas recirculation mode on biogas biological upgrading by anaerobic digestion of kitchen wastewater
-
摘要: 本研究对餐厨废水进行厌氧消化处理,并利用纳米零价铁供氢及嗜氢产甲烷菌的代谢作用来提高CH4含量,以实现沼气异位生物提纯。实验中比较了单向式、往复式、循环式3种气体循环方式对厌氧消化-沼气提纯耦合系统的影响。结果表明:3种气体循环方式均可提高CH4含量,其中循环式可获得最大甲烷含量为93.87%,累积沼气(CH4)产量为167.44 (157.18) mL·g−1(以VS计);纳米零价铁可降低沼气提纯体系内ORP,气体循环促进了COD和VFAs的降解,CO2循环有利于维持体系内酸碱平衡,富氢值表明H2传质效率显著提高。微生物群落结构分析结果表明,产甲烷菌类型已向氢营养型产甲烷菌演替,Methanobacterium和Methanolinea相对丰度最大。以上研究结果表明,基于纳米零价铁供氢的沼气异位提纯和气体循环可以提升厌氧消化性能,提高CH4含量。Abstract: In this study, the anaerobic digestion was used to treat the kitchen wastewater, and the CH4 content increased through the combined way of hydrogen supplied from nano zero-valent iron (nZVI) dissolution and metabolism effect of hydrogenotrophic methanogens, the ex-situ biological upgrading of biogas was achieved. The effect of three gas recirculation modes named one-direction-flow, reciprocating-flow and circulating-flow on the anaerobic digestion-biogas biological upgrading systems were compared in this experiment. The results showed that all three gas recirculation modes could increase CH4 content, of which circulating-flow mode could produce the maximum methane content of 93.87%, the corresponding cumulative biogas (CH4) yield was 167.44 (157.18) mL·g−1 (VS basis). nZVI addition could decrease the ORP in biogas upgrading system, gas recirculation promoted the degradation of COD and VFAs, CO2 recirculation maintained the balance of acid-base, the value of hydrogen enrichment indicated that the mass transfer efficiency of H2 increased significantly. The microbial community analysis showed that the methanogenic microorganisms transformed to hydrogenotrophic methanogens, in which the highest relative abundances were Methanobacterium and Methanolinea. The above results indicated that based on the hydrogen supply by nZVI method, the biogas ex-situ biological upgrading and gas recirculation could improve the anaerobic digestion performance and CH4 content.
-
表 1 餐厨废水和接种污泥的主要性质
Table 1. Characterizations of the kitchen wastewater and inoculated sludge
样品 pH TS /% VS /% MLSS /(g·L−1) MLVSS /(g·L−1) C/N C/H SCOD/(g·L−1) TCOD/(g·L−1) 餐厨废水 4.01±0.05 — — 30.32±1.51 27.92±1.16 11.68±0.21 5.66±0.08 64.32±0.58 80.03±0.74 接种污泥 6.83±0.12 13.97±0.12 12.88±0.11 — — 7.02±0.14 7.50±0.11 — — 注:pH为酸碱度;TS为总固体;VS为挥发性固体;MLSS为混合液悬浮固体浓度;MLVSS为混合液挥发性悬浮固体浓度;C/N为碳氮比;C/H为碳氢比;SCOD为溶解性化学需氧量;TCOD为总化学需氧量。 表 2 厌氧消化体系和沼气提纯体系的实验设计参数
Table 2. Experimental design parameters of the anaerobic digestion systems and biogas upgrading systems
反应体系 工作体积/mL 接种物/(g·L−1) pH VFAs/(g·L−1) SCOD/(g·L−1) TCOD/(g·L−1) ORP/mV nZVI/(g·L−1) 厌氧消化体系 400 8.05±0.02 7.00±0.08 1.04±0.08 6.87±0.21 10.33±0.5 100±4 — 沼气提纯体系 400 25.76±0.30 7.00±0.10 — — — 100±5 6 注:VFAs为挥发性脂肪酸;ORP为氧化还原电位。 表 3 不同气体循环方式对酶活的影响
Table 3. Effects of different gas recirculation types on enzyme activity
反应组 蛋白酶/nmol·(min·g)−1 乙酸激酶/nmol·(min·g)−1 脱氢酶/μg·(min·g)−1 F420辅酶/μg·g−1 初始污泥 9.64±0.12 66.58±1.21 8.16±0.22 0.033±0.002 A1 17.67±0.25 74.91±1.32 10.40±0.23 0.053±0.003 A2 62.66±1.08 79.07±1.16 15.16±0.36 0.059±0.003 A3 67.48±0.79 91.55±1.03 29.29±0.63 0.067±0.004 U1 — — 30.34±0.58 0.061±0.003 U2 — — 31.23±0.64 0.074±0.004 U3 — — 31.10±0.77 0.090±0.005 -
[1] WANG Q, FENG K, LI H. Nano iron materials enhance food waste fermentation[J]. Bioresource Technology, 2020, 315: 123804. doi: 10.1016/j.biortech.2020.123804 [2] TONG Y J, ZUO C J, DING W L, et al. Sulfonic nanohydrogelled surface-modified microporous polyvinylidene fluoride membrane with excellent antifouling performance for treating water-oil separation of kitchen wastewater[J]. Journal of Membrane Science, 2021, 628: 119113. doi: 10.1016/j.memsci.2021.119113 [3] 郑晓伟, 李兵, 李益, 等. 接种比对餐厨垃圾干式厌氧发酵启动的影响[J]. 环境工程学报, 2014, 8(3): 1157-1162. [4] DENG L Y, HAGG M B. Techno-economic evaluation of biogas upgrading process using CO2 facilitated transport membrane[J]. International Journal of Greenhouse Gas Control, 2010, 4(4): 638-646. doi: 10.1016/j.ijggc.2009.12.013 [5] LUO G, ANGELIDAKI I. Hollow fiber membrane based H2 diffusion for efficient in situ biogas upgrading in an anaerobic reactor[J]. Applied Microbiology and Biotechnology, 2013, 97(8): 3739-3744. doi: 10.1007/s00253-013-4811-3 [6] ROY S, SCHIEVANO A, PANT D. Electro-stimulated microbial factory for value added product synthesis[J]. Bioresource Technology, 2016, 213: 129-139. doi: 10.1016/j.biortech.2016.03.052 [7] AGNEESSENS L M, OTTOSEN L D M, VOIGT N V, et al. In-situ biogas upgrading with pulse H2 additions: The relevance of methanogen adaption and inorganic carbon level[J]. Bioresource Technology, 2017, 233: 256-263. doi: 10.1016/j.biortech.2017.02.016 [8] 汤晴, 徐锦, 徐利锋, 等. 餐厨垃圾厌氧产沼气及沼气异位生物提纯通气比分析[J]. 环境工程学报, 2019, 13(11): 2701-2710. doi: 10.12030/j.cjee.201901172 [9] KOUGIAS P G, TREU L, BENAVENTE D P, et al. Ex-situ biogas upgrading and enhancement in different reactor systems[J]. Bioresource Technology, 2017, 225: 429-437. doi: 10.1016/j.biortech.2016.11.124 [10] BASSANI I, KOUGIAS P G, TREU L, et al. Biogas upgrading via hydrogenotrophic methanogenesis in two-stage continuous stirred tank reactors at mesophilic and thermophilic conditions[J]. Environmental Science & Technology, 2015, 49(20): 12585-12593. [11] DONG D, ALETA P, ZHAO X, et al. Effects of nanoscale zero valent iron (nZVI) concentration on the biochemical conversion of gaseous carbon dioxide (CO2) into methane (CH4)[J]. Bioresource Technology, 2019, 275: 314-320. doi: 10.1016/j.biortech.2018.12.075 [12] LAI C Y, ZHOU L J, YUAN Z G, et al. Hydrogen-driven microbial biogas upgrading: Advances, challenges and solutions[J]. Water Research, 2021, 197: 117120. doi: 10.1016/j.watres.2021.117120 [13] ZHAO J M, HOU T T, LEI Z F, et al. Effect of biogas recirculation strategy on biogas upgrading and process stability of anaerobic digestion of sewage sludge under slightly alkaline condition[J]. Bioresource Technology, 2020, 308: 123293. doi: 10.1016/j.biortech.2020.123293 [14] KARIM K, HOFFMANN R, KLASSON K T, et al. Anaerobic digestion of animal waste: Effect of mode of mixing[J]. Water Research, 2005, 39(15): 3597-3606. doi: 10.1016/j.watres.2005.06.019 [15] ZHANG J J, ZHAO M X, LI C, et al. Evaluation the impact of polystyrene micro and nanoplastics on the methane generation by anaerobic digestion[J]. Ecotoxicology and Environmental Safety, 2020, 205: 111095. doi: 10.1016/j.ecoenv.2020.111095 [16] 国家环境保护总局. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 2002. [17] 高树梅. 餐厨垃圾厌氧消化过程中氨氮耐受响应机制研究[D]. 无锡: 江南大学, 2015. [18] GOEL R, MINO T, SATOH H, et al. Enzyme activities under anaerobic and aerobic conditions inactivated sludge sequencing batch reactor[J]. Water Research, 1998, 32(7): 2081-2088. doi: 10.1016/S0043-1354(97)00425-9 [19] DU W J, HUANG X D, ZHANG J M, et al. Enhancing methane production from anaerobic digestion of waste activated sludge with addition of sodium lauroyl sarcosinate[J]. Bioresource Technology, 2021, 336: 125321. doi: 10.1016/j.biortech.2021.125321 [20] DELAFONTAINE M J, NAVEAU H P, NYNS E J. Fluorimetric monitoring of methanogenesis in anaerobic digesters[J]. Biotechnology Letters, 1979, 1(2): 71-74. doi: 10.1007/BF01398311 [21] 廖家林, 赵明星, 黄振兴, 等. 油脂降解及其对餐厨废水厌氧发酵性能影响[J]. 食品与生物技术学报, 2013, 32(8): 803-808. [22] 姜萌萌, 林敏, 郑晓宇, 等. 高温厌氧膜生物反应器处理餐厨废水的启动[J]. 中国环境科学, 2020, 40(12): 5318-5324. doi: 10.3969/j.issn.1000-6923.2020.12.025 [23] ZHOU J, YOU X G, NIU B W, et al. Enhancement of methanogenic activity in anaerobic digestion of high solids sludge by nano zero-valent iron[J]. Science of the Total Environment, 2020, 703: 135532. doi: 10.1016/j.scitotenv.2019.135532 [24] LATHA K, VELRAJ R, SHANMUGAM P, et al. Mixing strategies of high solids anaerobic co-digestion using food waste with sewage sludge for enhanced biogas production[J]. Journal of Cleaner Production, 2019, 210: 388-400. doi: 10.1016/j.jclepro.2018.10.219 [25] SUVAJITTANONT W, CHAIPRASERT P. Potential of biogas recirculation to enhance biomass accumulation on supporting media[J]. Bioresource Technology, 2003, 88(2): 157-162. doi: 10.1016/S0960-8524(02)00278-X [26] ZHANG W L, XING W L, LI R D. Real-time recovery strategies for volatile fatty acid-inhibited anaerobic digestion of food waste for methane production[J]. Bioresource Technology, 2018, 265: 82-92. doi: 10.1016/j.biortech.2018.05.098 [27] WEI J, HAO X D, VAN LOOSDRECHT M C M, et al. Feasibility analysis of anaerobic digestion of excess sludge enhanced by iron: A review[J]. Renewable & Sustainable Energy Reviews, 2018, 89: 16-26. [28] LI Y Y, QIAO W. Transformations and impacts of ammonia and hydrogen sulfide in anaerobic reactors[M]. Anaerobic Biotechnology: Environmental Protection and Resource Recovery, 2015. [29] LIU C G, XUE C, LIN Y H, et al. Redox potential control and applications in microaerobic and anaerobic fermentations[J]. Biotechnology Advances, 2013, 31(2): 257-265. doi: 10.1016/j.biotechadv.2012.11.005 [30] 张冰. 污泥中产甲烷细菌多样性及产甲烷效能的优化研究[D]. 哈尔滨: 东北林业大学, 2014. [31] XU R, XU S N, ZHANG L, et al. Impact of zero valent iron on blackwater anaerobic digestion[J]. Bioresource Technology, 2019, 285: 121351. doi: 10.1016/j.biortech.2019.121351 [32] MENG X S, ZHANG Y B, LI Q, et al. Adding Fe-0 powder to enhance the anaerobic conversion of propionate to acetate[J]. Biochemical Engineering Journal, 2013, 73: 80-85. doi: 10.1016/j.bej.2013.02.004 [33] RIVIERE D, DESVIGNES V, PELLETIER E, et al. Towards the definition of a core of microorganisms involved in anaerobic digestion of sludge[J]. Isme Journal, 2009, 3(6): 700-714. doi: 10.1038/ismej.2009.2 [34] LI P C, LIU Z Y, ZHAO M X, et al. Evaluation of biogas performance and process stability from food, kitchen, and fruit/vegetable waste by mono-, co-, and tridigestion[J]. Energy & Fuels, 2020, 34(10): 12734-12742. [35] ZHAO X L, LIU J H, LIU J J, et al. Effect of ensiling and silage additives on biogas production and microbial community dynamics during anaerobic digestion of switchgrass[J]. Bioresource Technology, 2017, 241: 349-359. doi: 10.1016/j.biortech.2017.03.183 [36] ARIESYADY H D, ITO T, OKABE S. Functional bacterial and archaeal community structures of major trophic groups in a full-scale anaerobic sludge digester[J]. Water Research, 2007, 41(7): 1554-1568. doi: 10.1016/j.watres.2006.12.036 -




 下载:
下载: