-
植物药在世界范围内应用广泛。在发展中国家,约80%的患者依靠植物药进行治疗或保健[1]。近年来,在治疗慢性病及预防特定疾病等方面,一系列的植物药类补充药物及食物产品被广泛使用,植物药市场进一步扩大。然而,植物药的大规模应用及推广,却因重金属、霉菌毒素、农药残留、多环芳烃和熏蒸剂的污染等原因而受阻[2]。其中,重金属污染问题是阻碍植物药出口及推广应用上的最大障碍之一。植物药中的重金属(通常包括铜(Cu)、铅(Pb)、砷(As)、镉(Cd)和汞(Hg)5种元素)有多种来源,包括生长土壤、灌溉用水、大气及生产加工环节等。
重金属是常见的环境污染物,其生物毒性较强。植物药中的重金属主要通过药物口服和注射途径进入人体[3]。人体摄入过量的重金属会引发各种健康问题,较常见且具有严重危害性的重金属元素包括Hg、Pb、Cd、As 4种。摄入过量的Hg后人体会产生头疼、运动失调等神经系统失常的症状,Hg甚至会对脑组织产生损害[4];摄入过量Pb会影响人的记忆功能和消化功能;摄入过量的Cd会导致人体肾功能及生殖功能的紊乱,还会诱发骨质疏松等疾病;摄入过量As会对人体的肾脏、肌肉、神经、血液、免疫系统等多种组织、系统和器官产生不利影响[5]。因摄入植物药而诱发重金属中毒的案例曾被报道[6-8]。总之,植物药的重金属污染问题具有较高的健康风险,亟需引起关注。
基于前述原因,本文对世界范围内的植物药重金属污染状况进行了分析,对植物药的各生产环节中重金属污染的来源进行了溯源,并提出了针对全链条生产过程的植物药重金属管控措施,以期为系统、可行地降低植物药重金属的健康风险提供参考。
-
为保证植物药的安全性,一些国家、地区及国际组织制定了植物药重金属的限量标准,并据此对使用或进出口的植物药进行管理(见表1)。其中,Hg、Cd、Pb、As 4种重金属的健康风险最高,在大多数标准中都被限定[4-6]。仅中国、澳大利亚、新加坡和中国澳门4个国家或地区对Cu元素的含量进行了限制,限值为10 ~ 150 mg·kg−1。而Cu是人体生长发育的必需元素,相对其他4种重金属元素危害较小,但由于部分植物药在种植环节中使用了含Cu的农药,故也需对其进行限制[9]。
2015年版《中国药典》严格规定了Cu、Pb、As、Cd和Hg 5种重金属的限量标准分别为20、5、2、0.3和0.2 mg·kg−1。这一标准是较为严格的,仅德国、英国及美国加利福尼亚州等国家或地区的部分重金属限量标准要求严于中国。2020年版《中国药典》放松了对Cd的限量要求,从2015版的不超过0.3 mg·kg−1放宽至不超过1 mg·kg−1。制定中药重金属限量标准时,需同时考虑毒理学、重金属形态及生物可及性、健康风险评估暴露模型及参数、中药植物的加工及服用方法等,因此,现有中药重金属限量标准仍有较大的修正空间[9]。李璇[14]依据世界卫生组织(World Health Organization,WHO)提出的每周耐受摄入量参考值,采用美国环保署(United States Environmental Protection Agency,USEPA)的目标危害系数(target hazard quotient, THQ)法得出,植物药中Cd含量不高于1.5 mg·kg−1,便可以不对人体健康产生危害。郭兰萍等[15]指出,如果植物药中Cd的限量标准定为0.3 mg·kg−1,我国生产的植物药中Cd超标率高达28.5%。如果重金属限量标准要求过于严格,尽管可保证植物药的安全性,但更会阻碍部分易富集重金属的植物药及其相关产品的出口及推广[14],故过于苛刻的植物药重金属限量标准不利于中医药行业的发展。因此,根据中药有害残留物限量制定指导原则,经由系统的毒理学和健康风险评估研究,2020年版《中国药典》对Cd的限量标准做了修订,这也为提高中药出口和安全利用提供了技术支撑和科学依据。
-
植物药残留的重金属及其带来的健康风险虽然受到了较多关注,但目前还没有涉及对世界范围内的植物药重金属污染的全面评价。本文以Web of Science核心数据库和中国知网(CNKI)数据库作为数据来源,在Web of Science中以主题“Chinese herb or Chinese medicine or herbal medicine” +“heavy metal”进行检索,时间跨度为1999—2020年;在CNKI数据库中以主题“中药”+“重金属”进行检索,时间跨度为2003—2020年。从检索到的文献中提取植物药重金属含量的相关数据,共获取1 665条相关数据。其中,每条数据代表一种植物药中所含的5种重金属元素(Cu、Hg、As、Pb、Cd)中的一项或多项。883条数据来自CNKI数据库中的中文文献,716条数据来自Web of Science数据库中的英文文献。将所有文献中114条关于我国国内生产的植物药数据作为我国植物药重金属含量的样本;剔除英文文献中114条我国植物药数据后作为国外植物药重金属含量的样本。以2020年版《中国药典》发布的植物药重金属限量标准为依据,若植物药的某种重金属含量高于限量标准,则定义该植物药这种重金属含量超标;若植物药的5种重金属含量均达标,则视为合格,否则视为该植物药重金属含量超标。
-
总结文献中梳理出的植物药重金属Cd、Cu、Pb、As和Hg的超标情况,结果见表2。在中国的植物药数据中,有24.07%的植物药重金属含量超标,其中的26.67%(占总数的6.42%)的植物药中有多种重金属同时超标。在国外的植物药数据中,24.58%的植物药重金属含量超标,其中28.40%(占总数的6.98%)的植物药有多种重金属含量同时超标。上述数据表明,国内外的植物药重金属超标情况均较为严重,超过20%的植物药不能满足2020年版《中国药典》的标准;而中国的整体植物药重金属超标率和多种重金属超标率略低于国外平均水平,这可能与中国严格的植物药重金属限量标准有关。由表2可知,我国植物药重金属元素按超标率由高到低依次为Pb、As、Hg、Cd、Cu,其超标率分别为11.71%、10.09%、8.13%、5.28%、5.08%;而国外植物药重金属元素按超标率由高到低依次是Hg、As、Pb、Cd、Cu,其超标率分别为32.35%、14.48%、9.93%、9.29%、4.83%。Pb、As、Hg这3种重金属的超标率较高,这一点国内外的数据是一致的。因此,植物药中这3种重金属元素的监测及健康风险评估应受到更多关注。
-
对从CNKI数据库提取的数据做进一步分析,将在文献中提及次数不小于3的植物药数据提取出,并对其Cu、Pb、Cd、Hg、As及重金属(意味着上述5种重金属的一种或多种)的超标率进行分析,得到如图1所示的热图。
将重金属超标率> 25%的植物药定义为受到严重污染的植物药(见图1)。受到严重污染的植物药包括丹参、两面针、甘草、水茄根、葛根、山豆根、山植、天麻、夏枯草、羊耳菊、桔梗、金银花、当归、怀牛膝、薏苡仁、姜黄、沙棘、决明子、黄连、淫羊藿、川芎、钩藤和蔓荆子。有研究表明,禾本科及豆科植物可用于土壤修复,其中,豆科植物的根系有着较强的重金属固定能力[16],且较易与根瘤菌结合,故常被用于修复重金属污染的土壤[17];而禾本科植物对高重金属土壤的适应能力较强[18]。因此,如图1所示,豆科的决明子、葛根和甘草,以及禾本科的薏苡仁都属于严重污染的植物药。淫羊藿、蔓荆子、川芎、天麻、山豆根的Cu超标率较高;蔓荆子、钩藤、川芎、两面针、夏枯草、姜黄、沙棘的Pb超标率较高;决明子、姜黄的As超标率较高;蔓荆子、川芎、决明子的Cd超标率较高;蔓荆子、决明子、黄连、山植、怀牛膝、沙棘的Hg超标率较高。部分植物药对特定重金属元素有一定的富集作用,而之前的研究也部分证明了这一结论。例如:川芎可富集土壤中的Cd元素[19-20],且对Pb元素具有一定的富集能力[21];钩藤在生长时富集Cu,若在林地生长还可大量富集Pb[22];两面针有一定Pb富集的能力[23];姜黄具有富集Pb、Cd和Cu的能力[24],且其As含量与土壤As含量密切相关[25];沙棘可富集Pb[26];黄连中的Cd含量会随土壤Cd含量增加而快速增加[27];金银花[28]和浙贝母[29]是易于富集Cd的植物药;滇重楼对Cu、Cd、As、Hg均有一定的富集能力[30]。
植物药重金属超标率较高的原因很可能与它们易于富集吸收重金属的生理特性有关。植物药种类不同,对土壤中重金属元素的富集程度也不同。贾薇[31]的研究表明,砂仁中Cu、Hg、As、Pb、Cd 5种重金属的含量与种植土壤中重金属含量均无相关性;而佛手的Cu,巴戟天的Cu、Hg、As、Cd,穿心莲的Cu、As、Cd,广藿香的Cu、Cd、As含量均与种植土壤中对应重金属元素含量呈现出相关性。而田伟等[32]的研究表明,黄芪中的Cu、Cd、As、Hg、Pb含量均与土壤中重金属含量有相关性。
不同的重金属元素在植物药种间分布亦有较大区别。由图1可知,植物药的As超标现象较轻,且主要集中在姜黄、决明子、薏苡仁、荷叶等几种植物药中;而相反地,Cu、Pb、Cd的超标现象则较为普遍,在多个植物药品类中均有出现;植物药的Hg超标现象较严重,包括决明子、当归、薏苡仁、黄连、怀牛膝、荷叶、沙棘、金银花、葛根、丹参、佛手、白芷、板蓝根、蔓荆子等多个品类均有Hg超标的现象。总体看来,植物药中Pb、Cu和Hg的超标情况较普遍,应关注其健康风险。
-
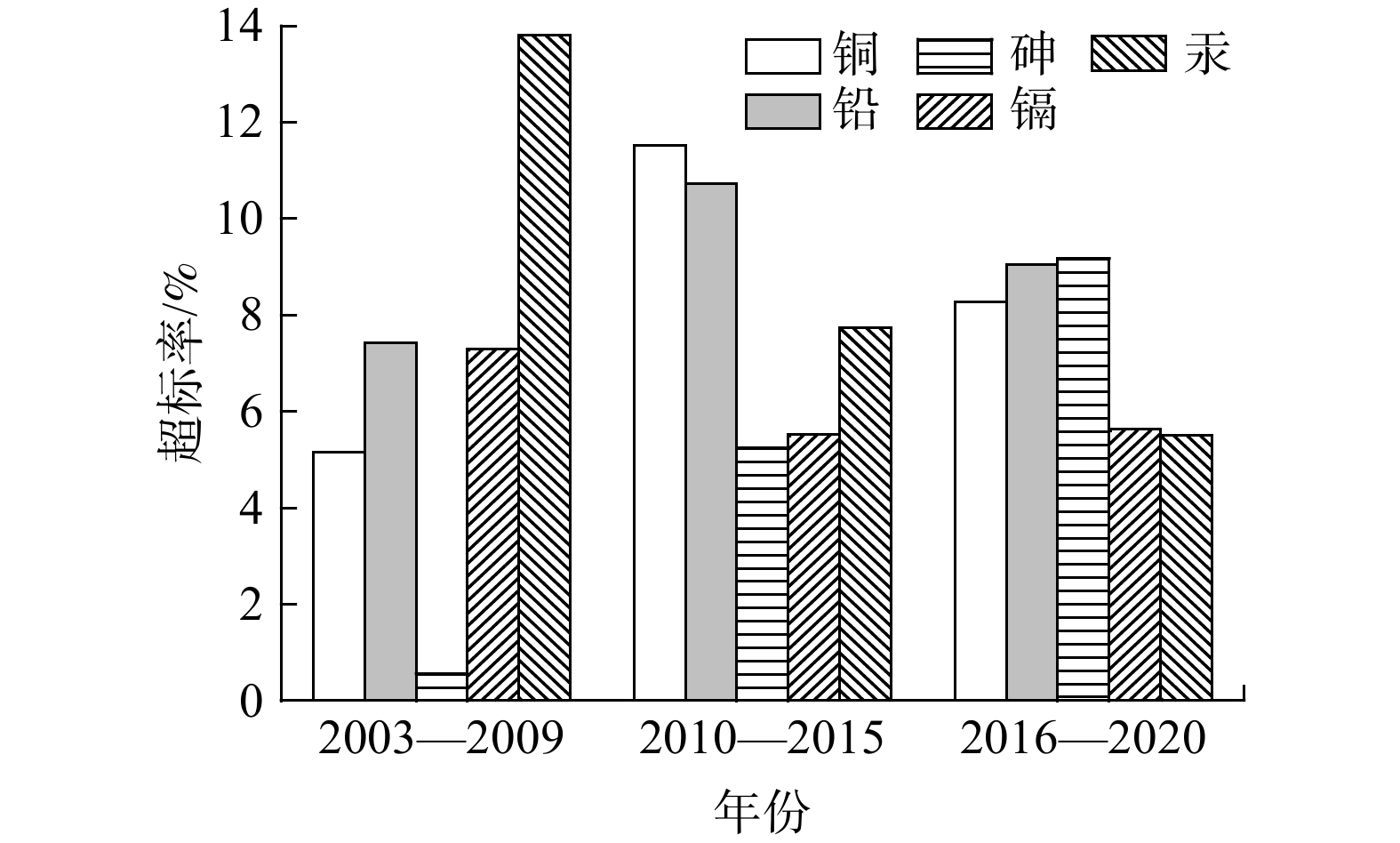
将CNKI数据库获取的数据按照2003—2009年、2010—2015年、2016—2020年分成3组,分析植物药的重金属超标率随时间的变化趋势,结果如图2所示。
由图2可知,植物药Cu和Pb超标率的变化趋势较为一致,均在2010—2015年间达到顶峰,并随后降低;As的超标率则是逐年上升;Cd的超标率在2010年前后大幅降低,并随后保持稳定;Hg的超标率逐年下降。这些变化趋势是有迹可循的。一般来说,农田中的各种重金属来源虽不单一,但每种重金属元素均有其主要来源。大气沉降是土壤中多数重金属(除Cu以外)的重要来源[33],而土壤中Cu主要来自禽畜粪便肥料和农药的使用。Cd的重要来源也包括禽畜粪便[34],此外工业废物的排放、农药及化肥的使用也会增加土壤中Cd的污染程度[35]。特别是肥料的使用量与Cd的污染程度呈正相关关系[36]。在各种肥料中,禽畜粪便和磷肥与Cd的污染相关性最强[37]。Pb主要来自工业废物与汽车尾气,但随着无Pb汽油的推广与使用,工业源Pb已成为土壤污染的主要来源[38]。Hg的主要来源则是工业三废[39]。土壤中As主要来自含硫矿物开采、金属冶炼及煤炭燃烧,此外土壤中背景值As的含量会因母质的不同而有所差异[33]。
在我国的农业现代化发展进程中,多种新型肥料已替代了传统粪便肥,从而减少了粪便肥料中的Cu进入土壤中[34]。为增加粮食产量,增加施用农药等方式曾被广泛尝试。然而,进入21世纪,农药带来的健康风险日益被重视,高毒性农药逐渐被取缔,农药使用量减少了很多。如2015年以来,农业部开展化肥、农药使用量零增长行动,并出台了《农药管理条例》,导致我国的农药使用量开始逐渐下降[40]。这与图2中我国植物药中Cu的超标率在2010—2015年间达到顶峰,并随后降低的趋势是相一致的。
在我国的农业生产实现机械化的进程中,随着Cd含量较高的粪便肥料逐渐被化肥取代,土壤Cd污染程度也随之降低。同时,由于我国化肥使用量2013年以后一直在降低,氮肥从2013年、磷肥从2015年、钾肥从2017年起使用量逐渐减少[41],其中磷肥与Cd污染相关性较强[37],因此,未来土壤Cd污染会逐渐减轻,我国植物药的Cd超标率也会随之降低。
在工业生产方面,由于我国加强了监督力度,偷排乱排现象减少,工业三废排放数量逐步减少,土壤Pb污染和Hg污染也随之逐步减轻[42],故我国植物药的Hg超标率逐年降低。但同时,随着我国汽车产业的发展,交通运输业逐渐发达,带来了尾气排放及轮胎、发动机磨损等交通源污染的增多,使得Pb的排放量逐渐增加。在二者共同作用下,我国植物药Pb的超标率在2010—2015年间达到顶峰,并随后降低。这也与图2中Pb的变化趋势一致。
As元素多伴生在硫化物矿藏中,含硫矿物的开采、金属的冶炼,以及煤炭的燃烧都会带来土壤的As污染。此外,As也可能随着农业活动和工业活动进入土壤中[33],这也使得植物药的As超标率逐年上升。
-
将从CNKI数据库中获取的数据按植物药的产地进行分组,将某一种或某几种重金属元素含量超过2020年版《中国药典》限量标准的植物药视为重金属超标的植物药,然后分别统计各省市区种植产出植物药的Cu、Pb、As、Cd、Hg超标率及重金属(意味着上述5种重金属的一种或多种)超标率(见表3)。
由于黑龙江省、吉林省、辽宁省、西藏自治区、青海省、海南省、北京市、天津市、上海市和山西省的相关数据较少,这些省市区不列入统计表格。由表3可知,各省市区间的植物药重金属污染状况差别很大,主要超标的重金属种类及各重金属元素的超标率差别也很大。福建省、贵州省、宁夏回族自治区、陕西省、四川省、浙江省、广西壮族自治区是植物药Cu超标最严重的省区。在排除因数据不足可能导致结果误差较大的福建省、江西省、内蒙古自治区3个省区后,甘肃省、广西壮族自治区、云南省、贵州省、广东省、浙江省、四川省、安徽省是植物药Pb超标最严重的省区;植物药As超标最严重的省区包括西部的陕西省和甘肃省,华南的广东省和广西壮族自治区,西南的四川省,以及东部的浙江省和安徽省;甘肃省、福建省、浙江省、陕西省、江苏省是药材Cd超标率比较高的省份;陕西省、福建省、河南省、安徽省是植物药Hg超标问题最严重的省份。综上所述,植物药重金属超标率较高的省区为陕西省、广西壮族自治区和浙江省,而这3个省区也是我国《重金属污染综合防治“十二五”规划》中的重金属污染防治重点省份。
特定省(自治区)的植物药重金属超标率较高,与当地的土壤重金属背景值高、工矿业发展状况具有一定的关联性。根据现有研究,广东省、广西壮族自治区的土壤As背景值较高,浙江省的土壤Pb背景值较高,福建、湖南省的土壤Hg背景值较高[43],这些产地植物药的相应重金属污染亦较为严重。浙江省是我国民营经济较发达的区域之一,工业的快速发展及生活废物的大量产生导致其土壤污染较严重[44];陕西省和广西壮族自治区的矿产丰富,且重工业发达,是两省区植物药重金属污染较严重的主要原因。
-
植物药的重金属来源较为复杂,但来源可以分为3类:植物药在生长环境中累积、植物药在加工过程中人为添加,以及加工和运输贮存过程中误引入[45]。因此,依据植物药的全链条生产过程,将重金属的来源划分为种植、加工炮制、运输及贮存3个环节。
-
在种植环节中,植物药的重金属来源可划分为空气、水和土壤3个部分。其中,土壤作为植物药生长的主要场地,也是其重金属的主要来源;而在特定土壤环境下,部分类型的植物会富集特定重金属元素,个别情况下还是超累积植物(hyperaccumulator)。植物在其生长过程中从土壤吸收并积累了大量重金属元素,如茄科植物白花球果蔓陀罗对Ni和Co有富集作用[46],金银花可从土壤中富集Cd[28]。土壤中的重金属有2种来源:一是天然来源,土壤中重金属元素的天然含量取决于成土母质[47],这一部分主要源于天然状态下含硫矿石的风化侵蚀作用及水流作用,并包含火山活动向土壤引入的重金属元素[48];二是人工来源,包括各类工业、矿业、交通、污废处理、人工施加化肥农药等来源[49]。在水源方面,采用污水灌溉,或使用未经处理的受重金属污染的水源灌溉,会引入一定的重金属元素[50],这也是植物药中重金属的一大来源。矿业及工业活动排放的烟尘中的重金属沉降及汽车尾气排放的重金属[44],会通过污染种植产区的土壤和水源间接导致植物药的重金属污染,也会通过植物药叶面污染的方式直接导致植物药的重金属污染。
-
在加工炮制过程中,存在炮制后植物药中重金属含量增加的情况,一般是由2个原因引起。一是由于使用含重金属的炮制辅料[51],或人为添加含重金属元素的组分[46];二是由于部分容器中含有重金属元素。目前,常用的炮制辅料有数种,包括米、盐、酒、醋、麸皮等[52],而劣质麸皮中重金属Cu的含量较高[53],劣质盐中则可能出现Hg、Pb、Cd等重金属含量较高的情况[54]。因此,炮制过程中一定要注意炮制辅料的质量,从而对其重金属的含量进行质控。在加工过程中,也有很多种植物药需要添加额外的矿物药,中药配方中有大概572种需添加矿物药的处方[45]。例如,经常添加的朱砂、雄黄等矿物药中通常就含有较多的重金属元素。
-
在植物药运输及保存过程中,为防止其发霉变质,经常会使用熏蒸剂对植物药类产品进行处理[31],但部分熏蒸剂含有重金属元素,故在贮存过程中,植物药重金属含量也可能有所增加。因此,为保证在运输及贮存环节不引入重金属,应提高仓库管理条件,避免大量使用熏蒸剂。
-
为了提高植物药的安全性,WHO于2003年提出了药用植物种植和采摘方法的相关规范(Good Agricultural and Collection Practices (GACP) for Medicinal Plants),以及生产加工过程中的相关规范(Good Manufacturing Practices (GMP))。各国家或地区也据此制定了对应的生产、供应[45]及质检规范,如生产端需推进植物药的规范化种植和加工(GACP和GMP);市场供应端需建立完整有效的植物药鉴证体系(Good Plant Authentication and Identification Practice ,GPAIP);质检端需保证所有检测过程严格遵守实验室操作规范(Good Laboratory Practice ,GLP)[55]。但是,要从根本上解决中药材重金属的污染问题,需要依据重金属来源的复杂性从植物药种植加工保存的全链条过程进行改进。
-
种植环节既是植物药吸收重金属的主要环节,也是最适合控制植物药重金属含量的环节。植物对土壤中重金属的吸收特性取决于重金属在土壤中的存在形态,而重金属元素在土壤中有多种存在形态,包括可交换态、结合态及残渣态。对植物而言,有效态重金属为可吸收利用并产生直接或者潜在毒害作用的重金属成分[56]。按照Tessier连续提取法,土壤中的重金属可划分为可交换态、碳酸盐结合态、铁锰氧化物结合态、有机质结合态及残渣态。这5种形态的生物可给性依次降低[56],因此,将土壤中的重金属元素尽可能转化为生物可利用性较低的形态,也有利于减少植物药对土壤中重金属的吸收。
土壤的物理化学性质,包括土壤pH、有机质的成分及含量、土壤质地、土壤中某些元素的含量,以及土壤微生物等均会对重金属的存在形态产生影响。比如,有研究指出,半夏的重金属含量会随着土壤中重金属含量增加而增加,但并非正相关关系。这是由于半夏对重金属元素的富集还与其他因素有关,包括pH、有机质含量、半夏的吸收特性等[57]。土壤的pH降低,会导致离子形态的重金属比例增大,使重金属的生物可利用性提高,植物药也会因此更易吸收富集重金属[19]。土壤中有机质的含量也会对重金属的吸收产生一定的影响[58],土壤中大量存在的腐殖质和胡敏酸可与重金属元素形成稳定的化合物,从而降低重金属元素的活性,因此,土壤中的腐殖质和胡敏酸都会减少植物对重金属元素的吸收和富集[59]。土壤中其他元素的含量也会对重金属的吸收起到抑制或促进作用。例如,硒含量的提高会抑制水稻对Cd元素的吸收[60],这可能与铁离子膜的保护作用有关;锌含量的提高,会抑制多种植物药对Cd元素的吸收[61]。由此可见,如果能在种植环节中对影响植物药对重金属吸收的因素进行选择性的控制,可大幅度地降低植物药重金属带来的健康风险。
在种植环节中,常被用来减少中药植物对重金属累积的方法有2种。一是合理选择种植地,避免在重污染类型工厂附近种植植物药,这样可有助于减轻植物药的重金属污染[62];二是采用适当的土壤修复方法,可通过稳定土壤中的重金属来减少药用植物对重金属的吸收,即降低土壤重金属元素的有效性。表4列举了目前常用的土壤重金属有效性减控措施。例如,使用KH2PO4-NaOH土壤改良剂,可通过提高土壤的pH,减少川穹对Cd的吸收[19];在苍耳子种植的土壤中添加丛枝菌根真菌(arbuscular mycorrhiza fungus, AMF),可在保证对苍耳子的生长影响较小的前提下,减少土壤中有效态的Pb,从而达到减少苍耳子中Pb含量的目的[63];在瞿麦种植土壤上加种三叶草,可有效减少瞿麦对Pb的吸收[64];改进灌溉方式等种植技术,可改善土壤的氧化还原态、pH等性质,可对减少药用植物对土壤中重金属的吸收起到积极作用[65]。此外,通过改进施肥措施,使用对土壤肥力有较大提升的有机肥或药渣肥等代替较为传统的粪便,可减少土壤中重金属元素的引入[66];选用或培育对重金属有较强的拮抗效应的药用植物品种,可最终减少药用植物对重金属的吸收累积[65]。
-
加工炮制环节是中药的重要处理环节,通常分为3个步骤:净制、切制和炮制。净制过程去除了植物药的非药用部分及杂质、霉变部位;切制过程将药材切成特定的形状,是炮制过程的前期步骤;炮制过程则是通过炒、炙、煅、蒸、煮、发酵、制霜等方法,使药材本身发生一定的物理或化学变化[10]。
从CNKI数据库的文献中收集到了共246条关于炮制后药材的Cd、Cu、Pb、As、Hg 5种重金属含量的数据,以2020版《中国药典》的重金属限量标准作为依据,其重金属超标率如表5所示。
根据统计分析结果,炮制后药品的Cu、Pb、Cd、Hg、As的超标率分别为2.95%、2.45%、3.31%、0.84%、4.49%,超标率均小于5%,远低于植物药的重金属超标率。因此,适宜的炮制加工方法可有效降低植物药中的重金属含量,从而在一定程度上解决植物药重金属超标的问题。
炮制过程涉及高温、辅料处理、液体(如水、酒精、醋等)浸泡、蒸煮,以及其他化学物质(如食盐)的浸渍[54]。在这些过程中,部分重金属元素的含量会大大降低,如食盐会改变植物药中重金属元素的浸出特性[54];炮制辅料会与植物药中的重金属发生物质交换[53]。此外,部分As元素会溶于水,部分Hg元素及Pb元素会在高温过程中挥发。炮制过程因使用的溶剂种类[56]、加热方式等的改进而有效降低植物药的重金属含量。例如,蒸煮比热水浸泡更有助于重金属元素的溶出[67];相比盐制法,清炒法和烘制法可有效减少植物药重金属的含量[68]。张寒等[68]的研究结果表明,采取清炒、烘制方式处理杜仲,对去除杜仲中的Pb、Hg、Cd 3种重金属效果较好,经处理后3种重金属元素会有2.25%~26.21%的减少,其中清炒可降低19.50%的Pb,烘制可减少26.21%的Cd。袁珂等[69]采用特定炮制方法处理厚朴、元胡、山茱萸后,植物药的重金属含量有不同程度的减少。其中,使用醋烘法处理元胡可使Pb含量降低93%,从8.51 mg·kg−1降低至0.53 mg·kg−1;同时,As、Cd、Cu的含量也分别可降低70.0%、23.5%、10.3%;使用姜煮法炮制厚朴,可去除75.0%的As、8.8%的Cd和3.9%的Pb;使用酒润法处理山茱萸,可去除87.9%的As、22.4%的Pb、9.1%的Cd和6.2%的Cu。目前,新的炮制加工技术,包括不溶性聚天冬氨酸聚合物吸附[70]、超临界 CO2配合萃取[71]、电吸附法[72]、大孔树脂吸附和膜分离[73]等技术,可降低植物药中多种重金属元素的含量。但同时,也有一部分药材出现了炮制后重金属含量明显增加的现象。例如,何首乌、白芍、川乌、当归4种植物药经过炮制后,出现了重金属含量增加的情况[74]。因此,炮制过程中需格外注意使用的辅料、器具及器皿,以防在加工过程中引入重金属。
-
1)对Web of Science和CNKI 2个数据库中植物药重金属含量相关文献的分析发现,国外的植物药重金属污染情况比我国严重。这些重金属来自植物药种植、加工炮制和运输贮存各个环节,其中种植环境是植物药重金属的最主要来源。
2)我国植物药重金属污染最严重的区域主要集中在工业或采矿业比较发达的西北和东南区域,这也说明植物药重金属污染与当地的土壤、大气和水环境质量密切相关。自2010年开始,我国植物药的重金属(As除外)超标率均开始下降,这说明我国近年来开展的一系列环境治理行动和农业发展措施已从中药植物的生长源头有效地控制了重金属污染。植物药的加工炮制和运输贮存环节的管控也会有效降低植物药的重金属含量。
3)植物药含有的重金属具有一定的健康风险。从植物药生产全链条全方位对其重金属来源进行管控,是降低植物药重金属健康风险的有效方法。这一问题的解决需要从多个角度同时进行。一是植物药的规范化种植和加工,推进GACP和GMP的执行;二是市场供应端需注意鉴别植物药的质量,做到GPAIP;三是进行严格的质检,检测过程需严格遵守GLP。
植物药重金属污染状况及全链条生产过程污染的溯源与管控
Pollution status of heavy metals in herbal medicine and their traceability & control in the whole chain production process
-
摘要: 植物药所含的重金属具有一定的健康风险,但目前缺少对植物药重金属污染状况、溯源及管控的系统研究。总结了世界范围内对植物药重金属的限量标准,依据《中国药典》2020年版的相关要求,基于Web of Science及中国知网(CNKI)数据库中获取的相关文献对国内外植物药的重金属含量进行了分析,结果表明:国外植物药重金属超标情况较严重,超标率达24.58%,我国植物药的重金属超标率也有24.07%;铅(Pb)、砷(As)、汞(Hg)这3种重金属的超标率较高。在时间维度上看,我国植物药中砷(As)超标历年来逐渐加重,而Hg超标历年来逐渐减轻,Cu、Pb超标率在2010—2015年达到峰值并开始减轻,镉(Cd)超标率自2010年以来无明显变化。在地理分布上,我国植物药重金属超标最严重的区域为西北区域,其次是东南区域。植物药的生产环节划分为种植、加工炮制、运输贮存3个环节。根据植物药重金属元素的来源,提出了针对全链条生产过程的植物药重金属管控措施,以期为系统、可行地降低植物药重金属的健康风险提供参考。Abstract: Heavy metals in herbal medicine have health risks, but currently systematic studies are lacking on their pollution status, source traceability and control. This paper summarizes the limit standards for heavy metals in herbal medicine in the world. According to the requirements of the Chinese Pharmacopoeia (2020 Version), the pollution status of heavy metals in herbal medicine is analyzed based on the relevant data obtained from the databases of Web of Science and CNKI. The results showed that the pollution in foreign countries is more serious than that in China, with a rate of 24.58% and 24.07% exceeding the standard, respectively. Lead, aresnic, and mercury are the most commonly found heavy metals in foreign countries and in China. In terms of time scale, the exceeding-standard rate of arsenic in Chinese herbal medicine has gradually increased over time, and that of mercury has gradually reduced. The exceeding-standard rates of copper and lead reached peaks in 2010—2015 and decreased afterwards; that of cadmium has not significantly changed since 2010. In terms of geographical distribution, northwest region is the area with the most serious heavy metal pollution in herbal medicine in China, followed by the southeast region. The whole chain production process of herbal medicine includes planting, processing and transportation-storage. Its source traceability and control measures was pointed out to provide the systematic and practicable strategies for reducing the health risks of heavy metals in herbal medicine.
-
河流自净是一个涉及物理、化学和生物的复杂过程,是河流在一定空间内恢复其洁净状态的现象[1-2]。河流自净能力的恢复是城市生态环境建设和景观保护的重要环节,而目前城市内河流普遍采用“三面光”的梯形硬质化渠道,河水流速快,沉降性能低,改变了原有自然生态本底和水文特征,削弱了河流的自净能力。目前,河流只监测基本的水文参数和水质参数,同时,监测河流健康状况的方法对监测员的技术要求高且不能做到在线实时监测。因此,迫切需要一种在线监测河流水质参数和自净能力的方法。
荧光和紫外光谱技术因其具有灵敏度高、用量少、测量简单、不消耗化学试剂等优点[3],近年来,被广泛应用于河流、湖泊、海洋等自然水体中污染物的监测[4-5]以及污水处理厂的过程控制[6-7]、工业废水中特定污染物的鉴别[8-9]。三维激发发射矩阵(3D-EEM)光谱,被称为“荧光指纹”,被广泛应用于检测废水、表征河流中溶解性有机物(DOM)[10]。紫外可见光谱分析中特定波长254 nm处的吸光度值(UV254)可作为总有机碳(TOC)和溶解性有机碳(DOC)的替代参数[11-12]。河流净化过程包括稀释、沉淀、曝气等多种化学与生物机制,可以采用数学模型进行评价[13],KARRASCH等[14]从浮游微生物的胞外酶角度分析得出,工业废水使微生物耐受性增强,降解能力提高,赵长森等[15]采用生物学指数与水生物指示环境结合的方法评价水样污染程度、生态系统稳定性与河流及水库的健康程度。
河流水质与自净能力的传统测定方法及参数选取较为复杂,而从河流微生物的生理状态的角度分析河流的自净能力鲜有研究。本研究将人工净化与河流自净功能的协同作用发挥出来,以渭河流域西安段的河流及污水处理厂为考察对象,采用三维荧光光谱、紫外光谱联用呼吸图谱的方法,考察了不同性质的河流及污水处理厂各处理单元中微生物与有机物之间的作用关系,探讨了光谱法与呼吸图谱法联用表征河流状态及自净能力的可行性,以期得到河流水质和健康状况的综合评判方法。
1. 材料与方法
1.1 实验原料
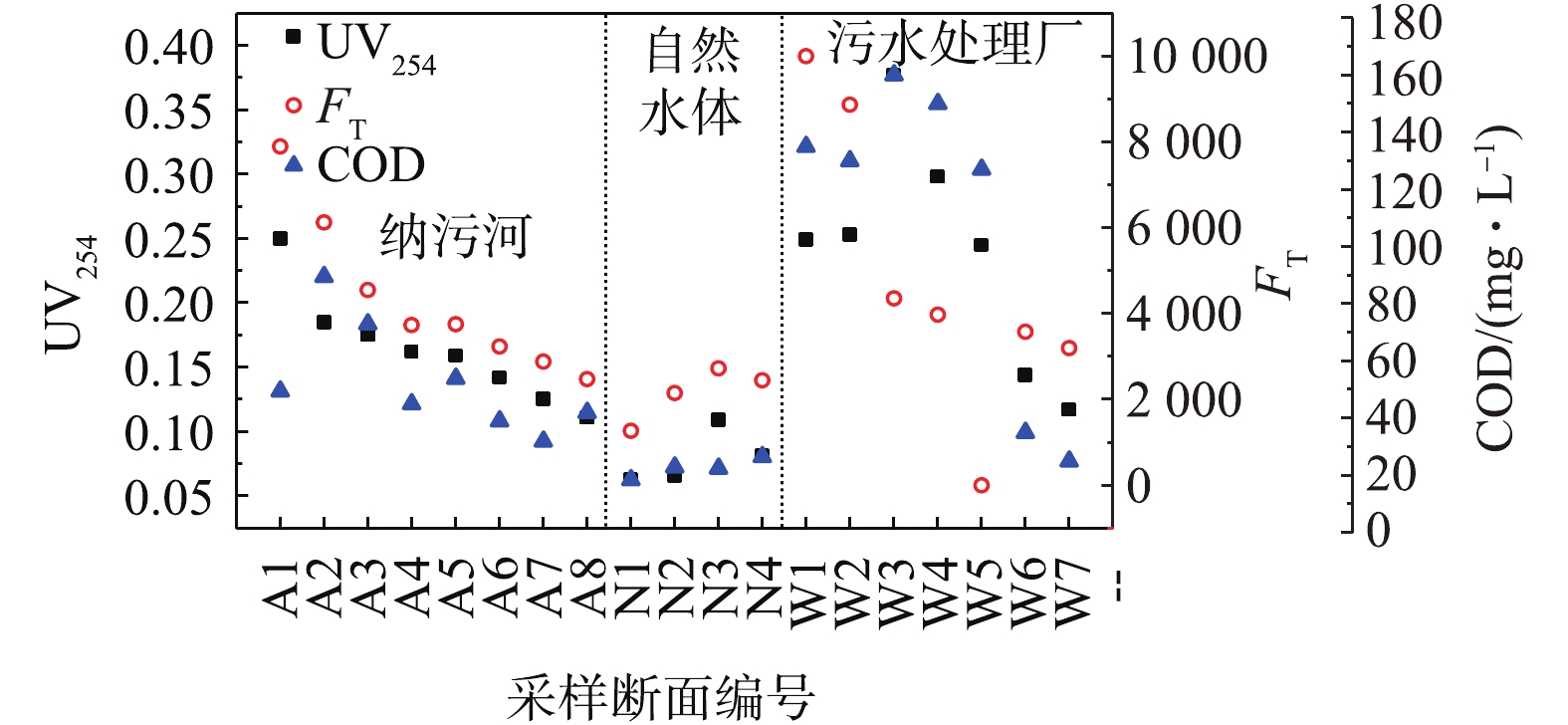
2018年4—6月,对陕西省西安市境内的河流进行采样,包括皂河(A1~A6)、太平河(A7)、灞河(A8)3条纳污河,泾河(N1)、渭河(N2~N4)2条天然水体。为了对比自然净化和人工净化的异同,按照工艺处理单元顺序,对污水处理厂WWTP1分别采样,W1~W7分别为进水(格栅后端)、曝气沉砂池、氧化沟泥水混合物、氧化沟沉淀30 min后的上清液、氧化沟沉淀2 h后的上清液终沉池出水和最终排水。其中,通过收集氧化沟不同沉淀时间的上清液,可模拟得到终沉池沉淀过程中的样品。
在渭河的众多支流中,皂河、太平河和灞河属于“三面光”设计类型的渠道式城市纳污河,其中,皂河[16]具有最大的泄洪和纳污能力,全长35.8 km,集水面积283 km2,接纳西安市城区60%的生活污水、工业废水及3个污水处理厂的出水。太平河属于皂河的支流,接纳西安市西部的污废水。灞河[17]接纳西安市东部的污废水,在流入渭河前设有人工湿地。泾河是渭河最大的支流,接纳陕西北部的污废水。
1.2 样品预处理
采用有机玻璃采样器于水下0.5 m处收集得到样品,将水引到无菌聚乙烯瓶中,然后通过冰袋运输至实验室,放入冰箱4 °C冷藏保存,分析前,将水样自然升温至25 °C,将收集的样品混合均匀,量取300 mL进行呼吸图谱的测定,另外100 mL水样通过0.45 µm滤膜过滤,以除去大尺寸的悬浮固体,用于光谱测定。所有样品的检测分析均在采样结束后2~3 d内完成。
1.3 实验方法
采用日立F-7000型荧光分光光度计进行三维荧光光谱检测。检测条件为:采用氙弧灯为激发光源,激发波长Ex=200~400 nm,发射波长Em=200~600 nm,狭缝宽度与扫描间隔均为5 nm,扫描速度为2 000 nm·min−1,响应时间为0.5 s,灵敏度为中等,光倍增管电压为700 V,采用超纯水(18.3 Ω)作为空白水样,以消除水的拉曼散射。采用752N紫外分光度计于波长254 nm处测量UV254。
呼吸图谱采用序批式呼吸计量法[18],于西安绿标水环境公司提供的BM300分析平台进行测定,分别获得现场呼吸速率OURS、内源呼吸速率OURe和总呼吸速率OURT。
2. 结果与讨论
2.1 3类水体的水质参数和光谱特征参数的空间分布特征
根据污染物负荷及断面功能属性将全部采样断面分为3类:纳污河(A1~A8);自然水体(N1~N4);污水处理厂(W1~W7)。
代表性断面的三维荧光图谱见图1。根据CHEN等[19]的三维荧光矩阵图五区划分法,识别出上述3类断面的5个特征峰(图1(b)),分别为类色氨酸T峰(Ex/Em=275 nm/340 nm)、类酪氨酸S峰(Ex/Em=225 nm/340 nm)、腐殖质C峰(Ex/Em=(310~320) nm /(380~410) nm)、富里酸A峰(Ex/Em=(240~260) nm/(380~400) nm),3类水样表现出峰位置及荧光强度的差异。纳污河自上游至下游各峰的最大荧光强度呈下降趋势,皂河源头及上游、污水厂进水有机物含量极高,且类蛋白峰在水样中占优势,类腐殖酸荧光强度相对较低,这是由于这些断面是河流接纳污水的源头,有机污染程度高,微生物含量高;而皂河下游、渭河、污水厂二沉池及出水中类腐殖酸占优势,这是因为这些断面经过污水厂的强化生物作用及河流自净作用后,有机物含量小,微生物繁殖速率慢,这与HENDERSON等[20]的描述一致,T峰反映的是不稳定易降解有机物,在废水中占主导地位,与废水微生物活性相关,与BOD之间的相关性较强,腐殖质C峰、富里酸A峰为难降解有机物,在天然水中占优势。
如图2所示,以传统水质参数COD值作为参照,可以看到UV254,FT与COD变化趋势基本一致,其中FT代表T峰的最大荧光强度。纳污河自上游至下游污染程度逐渐降低,自然水体污染程度低且稳定,污水处理厂水样的COD和UV254值从进水至出水在氧化沟工艺阶段出现极大值,而FT在进水出现极大值,FT与BOD呈显著正相关性,这表示可生物降解的有机物,FT可用于监测污水处理厂工艺处理过程中有机物的去除效果。
如表1所示,FT和FC分别代表T峰和C峰的最大荧光强度,在皂河源头A1流入渭河N4的过程中,FT与FC逐渐减小,对应的污染物的去除率分别为69.0%、49.2%,而污水处理厂从进水W1至出水W7过程中,T峰与C峰对应的污染物去除率分别为68.0%、33.0%,河流与污水厂的T峰去除率基本相同,河流中微生物去除难降解有机物的能力高于污水处理厂,这说明河流中微生物群落与污水处理厂有所不同,且河流微生物更容易降解难降解有机物。
表 1 3类水体的不同断面的水质、光谱及呼吸图谱特征参数Table 1. Characteristic parameters of water quality, spectra and respirogram of different sections of three types of water bodies水样类型 采样断面编号 COD/(mg·L−1) 光谱特征参数 呼吸图谱特征参数/(mg·(L·h)−1) UV254 FT FC HIX BIX OURS OURe OURen OURT 纳污河 A1 120.20 0.25 7 893 3 710 0.49 0.94 6.21 2.04 1.59 10.27 A2 89.50 0.19 6 122 2 967 0.58 0.99 2.43 0.87 0.72 4.53 A3 73.00 0.18 4 547 2 884 0.61 0.97 2.99 0.91 0.74 6.50 A4 45.00 0.16 3 735 2 732 0.68 0.94 1.46 0.62 1.87 3.05 A5 54.00 0.16 3 756 2 715 0.67 1.00 0.65 0.32 0.29 1.50 A6 39.00 0.14 3 232 2 285 0.67 1.04 1.84 0.88 0.84 5.54 A7 32.00 0.13 2 885 2 416 0.68 1.00 0.88 0.50 0.51 3.07 A8 25.00 0.11 2 474 1 607 0.64 0.97 1.70 0.31 0.47 4.81 自然水体 N1 18.50 0.06 1 267 785 0.63 0.93 1.20 0.49 0.44 5.10 N2 23.00 0.07 2 153 1 297 0.50 1.05 0.51 0.88 0.81 4.23 N3 22.50 0.11 2 722 1 809 0.64 1.08 0.39 0.58 0.60 2.25 N4 26.50 0.08 2 448 1 883 0.55 1.03 1.03 0.70 0.76 5.82 污水处理厂 W1 132.00 0.25 9 999 4 047 0.46 0.95 4.85 1.49 1.41 6.26 W2 127.00 0.25 8 868 4 050 0.46 0.96 4.18 1.21 1.07 8.56 W3 161.00 0.38 4 885 4 006 0.72 1.01 21.01 3.58 25.84 24.43 W4 145.00 0.3 3 973 3 259 0.68 0.96 3.97 1.39 14.20 16.81 W5 123.00 0.25 3 654 4 669 0.73 0.95 0.77 0.87 0.98 2.59 W6 32.00 0.14 3 574 2 782 0.68 1.03 2.48 0.67 0.64 8.22 W7 22.50 0.12 3 200 2 712 0.71 1.00 1.91 0.86 0.88 8.81 皂河源头A1的腐殖化指数HIXb[21]较小(表1),这说明DOM较不稳定,易于生物降解;河流断面A4~A8、N1、N3的HIXb要高于其他断面,同时这些断面的FT较小,其中A4、A5、A7、N3均为接纳污水处理厂排放水的河流断面,可见污水厂排放水中DOM腐殖化程度更高,DOM更稳定,易生物降解的物质较少,A6、A8、N1断面的水质较好,难降解物质占优势;而污水厂进入生化处理阶段后的断面A3~A7的HIXb高于河流,且没有明显的下降趋势,这说明污水厂的微生物对去除难降解物质的能力匮乏,从DOM的腐殖化程度的角度分析证实了上述结论。
本研究的全部断面的自生源指数BIX[22]为0.93~1.08,差异较小,DOM具有较强的自生源特征,是生物细菌活动产生的。
2.2 3类水体呼吸图谱参数的空间分布特征
总呼吸速率OURT反映的是基质不受限制条件下微生物最大的呼吸速率,其值越高,说明微生物的降解有机物的潜能越高。微生物的现场呼吸速率OURS反映的是采样时水样中微生物的现场活性,OURs越高,说明微生物数量及活性较高。纳污河的OURs普遍比自然水体高(表1),说明纳污河中微生物数量大且活性较高,其接纳了大量人类活动产生的生活污水,含大量类蛋白、脂肪等有机物,致使微生物大量繁殖,而纳污河断面中A5和A7由于接纳了污水厂出水,有机物浓度被稀释,微生物现场活性较弱;污水厂的W3点为氧化沟泥水混合物,其OURS极高,这与污水厂生物处理阶段活性污泥含量高的结果一致,此阶段微生物大量繁殖,降解有机物的速率极高,与自然净化的慢速过程形成对比。
2.3 呼吸图谱与光谱联用判定河流污染状态与自净能力
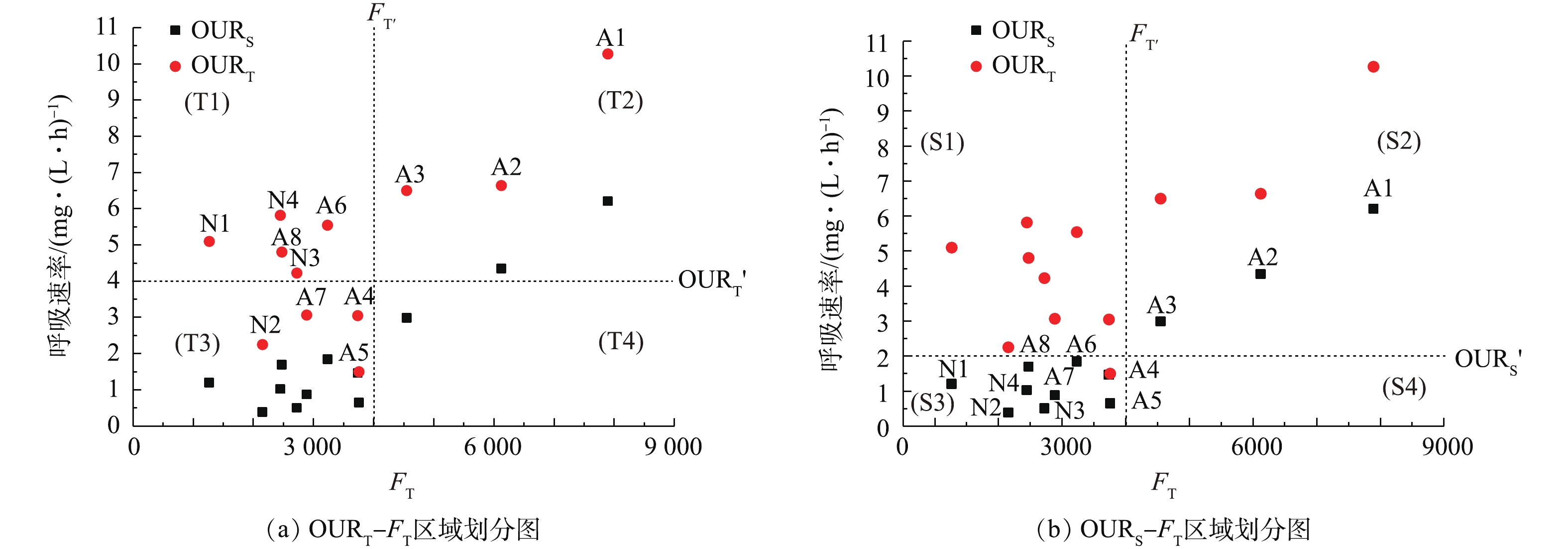
通过OUR=OURT′、FT= FT′,将OURT-FT(图3(a))平面划分为4个区域(T1~T4);通过OUR= OURS′、FT= FT′,将OURS-FT(图3(b))平面划分为4个区域(S1~S4)。其中,OURT′、OURS′、FT′的定量根据河流接纳的水样性质的不同而有所不同。
T1表示OURT> OURT′、FT<FT′,为超量潜在自净能力区域,包含断面A6、A8、N1、N2、N4,这说明断面污染程度较低,但微生物的潜在降解能力较高,自净能力较高,此时河流进入自净过程的后续阶段。同时,这种生物活性的改善可能归因于外部环境条件的改善,如更好的供氧,因为生物活性比需要降解的污染物更充分,这表明水生生态系统的健康。T2表示OURT> OURT′、FT>FT′,为受污染区域,包含断面A1~A3,这说明河流受到严重有机污染,虽然微生物活性极强且大量繁殖,但有机物处于超饱和状态,可能超过了微生物的降解能力与河流自净容量,一段时间后,会形成黑臭水样。T3表示OURT< OURT′、FT<FT′,为人工净化完成区域,包含断面A4、A5、A7、N3,这些断面接纳污水厂出水,污染物被稀释,虽然水样表观上恢复了原本干净的状态,但仍含有较多复杂不易降解的有机物,须汇入河流,经微生物长期降解才能恢复水样原本健康的状态。T4表示OURT< OURT′、FT>FT′,为无法判定区域,本研究无断面出现此情况,污染程度大而微生物呼吸速率小的情况出现的概率非常小,也不符合自净理论。
S1表示OURS> OURS′、FT<FT′,为无法判定区域,本研究中无断面出现在此区域,同时,有机物含量小而微生物现场耗氧速率较强的情况出现的概率非常小,也不符合自净理论;S2表示OURS> OURS′、FT>FT′,为受污染区域,包含断面A1~A3,与上述T2区域描述基本一致;S3表示OURS< OURS′、FT<FT′,为受基质限制的区域,包含除A1~A3以外的其他断面,说明微生物现场活性受基质限制而无法生存;S4表示OURS< OURS′、FT>FT′,为无法判定区域,说明有机物含量大而微生物现场耗氧速率较弱的情况出现的概率也非常小,同样不符合自净理论。
综上,结合2种不同的区域划分方法,可以判定河流的状态和自净能力:A1~A3为受污染断面,污染程度可能超过了自净容量;A4、A5、A7和N3为人工净化完成的断面,仍有大量难降解有机物须经过水样自净完成净化过程;A6、A8、N1、N2和N4为进行到水样自净过程的后续阶段的断面,生物活性受基质含量限制,但微生物具有超量潜在自净能力,可能归因于外部环境的改善,如溶解氧的升高或更适宜微生物生存的温度。
3. 结论
1) 3类水样(纳污河、自然水体与污水处理厂各处理单元)表现出不同的荧光强度与荧光特征值,纳污河及污水处理厂前处理单元普遍类蛋白最大荧光强度高于自然水体,自然水体及污水处理厂后处理单元的DOM的腐殖化程度高于纳污河,类蛋白最大荧光强度可用于区分水体类型及判定有机污染程度,腐殖化程度可用于判定DOM的难易降解程度。
2)类蛋白T峰(Ex/Em=275 nm/340 nm)的最大荧光强度FT可作为反映污水处理过程中有机污染程度及微生物量的指标,纳污河自上游至下游、污水厂自进水至出水的FT逐渐减小,河流微生物群落与污水处理厂的活性污泥有所不同,纳污河微生物去除难降解有机物(C峰)的能力高于活性污泥。
3) OURS通常用于表征微生物现场活性,OURT用于表征微生物降解有机物的潜能,自然水体的有机污染程度及微生物现场活性均较低,纳污河与污水处理厂生物处理单元的微生物现场活性与潜能颇高,微生物呼吸速率与水体有机污染程度密切相关。
4)采用呼吸图谱与紫外光谱、三维荧光光谱联用,以OURS-FT,OURT-FT这2种区域划分方式为依据,研究了河流微生物与有机污染之间的作用关系,建立了判定河流的污染状态和自净能力的定量指标,为城镇两极分化条件下的河流生态管理提供参考。
-
表 1 各国或地区、国际组织规定的植物药重金属含量限定标准
Table 1. Summary of the limit standards of heavy metal content in herbal medicines in different countries or regions
国家、地区或国际组织 重金属限量标准/(mg·kg−1) 参考文献 Cu Pb As Cd Hg 中国 20 5 2 1 0.2 [10] 印度 − 10 3 0.3 1 [11] 日本 − 20 5 − − [11] 马来西亚 10 10 5 0.3 0.5 [11] 新加坡 150 20 5 − 0.5 [11] 韩国 − 5 3 0.3 0.2 [11] 泰国 − 10 4 0.3 − [11] 越南 − 10 4 1 0.5 [11] 英国 − 5 5 1 0.1 [11] 美国 − 5 2 0.5 0.2 [12] 德国 − 5 − 0.2 0.1 [11] 澳大利亚 − 5 − 1 0.1 [11] 中国香港 − 5 2 1 0.2 [11] 中国澳门 150 20 5 − 0.5 [11] 美国加利福尼亚州 − 0.5 10 4.1 − [11] 世界卫生组织 − 10 − 0.3 − [11] 欧盟 − 5 − 1 0.1 [11, 13] ISO国际标准化组织 − 10 4 2 3 [11] 表 2 国内外植物药重金属超标情况
Table 2. Summary of excessive heavy metals in Chinese and foreign herbal medicine
重金属种类 我国植物药 国外植物药 植物药数量 超标的数量 超标比例/% 植物药数量 超标的数量 超标比例/% Cu 886 45 5.08 497 24 4.83 Pb 615 72 11.71 413 41 9.93 As 971 98 10.09 518 75 14.48 Cd 814 43 5.28 226 21 9.29 Hg 775 63 8.13 238 77 32.35 总数 9971) 2402)(644)) 24.073)(6.425)) 6021) 1482)(424)) 24.583)(6.985)) 注:1)代表通过文献检索获取到植物药重金属含量数据的数量;2)代表1种或多种重金属超标的植物药数量;3)代表植物药1种或多种重金属含量超标的比例;4)代表多种重金属超标的植物药数量;5)代表植物药多种重金属含量同时超标的比例。 表 3 我国各省植物药Cu、Pb、As、Cd、Hg的超标率统计表
Table 3. Statistics of the exceeding rates of copper, lead, arsenic, cadmium and mercury in Chinese herbal medicines
省市区 Cu超标率/% Pb超标率/% As超标率/% Cd超标率/% Hg超标率/% 陕西省 13.16 8.00 25.00 15.22 40.00 福建省 28.57 38.46 0.00 16.67 38.46 河南省 8.11 0 0.00 2.17 25.00 甘肃省 16.67 33.33 50.00 20.00 22.22 江西省 0 0 20.00 25.00 20.00 安徽省 2.94 9.62 4.17 6.25 16.67 湖北省 25.00 0 0 0 14.29 湖南省 0 9.09 0 0 11.11 四川省 12.68 9.91 9.80 3.85 8.74 山东省 14.29 6.25 0 0 8.33 河北省 0 5.88 0 6.25 6.67 广西壮族自治区 9.09 25.00 16.22 10.26 5.56 重庆市 0 0 0 0 5.00 浙江省 11.76 10.00 4.00 16.67 4.35 新疆维吾尔自治区 0 2.94 0 3.23 3.57 贵州省 14.81 16.98 0 12.00 2.44 内蒙古自治区 0 25.00 0 0 0 云南省 0 17.65 0 0 0 广东省 5.26 11.11 3.03 2.56 0 宁夏回族自治区 14.29 0 0 9.52 0 江苏省 0 0 0 14.29 0 表 4 常用的土壤重金属有效性减控措施
Table 4. Summary of control measures on bioavailability of heavy metals in soil
表 5 炮制类药品的超标状况
Table 5. Summary of the exceeding standard status on processing herbal medicines
重金属种类 炮制中药总数/种 超标数/种 超标比例/% Cu 163 4 2.45 Pb 242 8 3.31 As 239 2 0.84 Cd 237 7 2.95 Hg 178 8 4.49 -
[1] EBRAHIM A M, ELTAYEB M H, KHALID H, et al. Study on selected trace elements and heavy metals in some popular medicinal plants from Sudan[J]. Journal of Natural Medicines, 2012, 66(4): 671-679. doi: 10.1007/s11418-012-0630-6 [2] TRIPATHY V, BASAK B B, VARGHESE T S, et al. Residues and contaminants in medicinal herbs: A review[J]. Phytochemistry Letters, 2015, 14: 67-78. doi: 10.1016/j.phytol.2015.09.003 [3] 魏立新, 张伯礼. 含重金属传统药物安全性研究进展[J]. 药学进展, 2020, 44(10): 759-765. [4] JARUP L. Hazards of heavy metal contamination[J]. British Medical Bulletin, 2003, 68: 167-182. doi: 10.1093/bmb/ldg032 [5] ZUO T T, LI Y L, HE H Z, et al. Refined assessment of heavy metal-associated health risk due to the consumption of traditional animal medicines in humans[J]. Environmental Monitoring and Assessment, 2019, 191(3): 补充页码信息. ZUO T T, LI Y L, HE H Z, et al. Refined assessment of heavy metal-associated health risk due to the consumption of traditional animal medicines in humans[J]. Environmental Monitoring and Assessment, 2019, 191(3): 171.
[6] AMSTER E, TIWARY A, SCHENKER M B. Case report: Potential arsenic toxicosis secondary to herbal kelp supplement[J]. Environmental Health Perspectives, 2007, 115(4): 606-608. doi: 10.1289/ehp.9495 [7] KIM H, HUGHES P J, HAWES, E M. Adverse events associated with metal contamination of traditional Chinese medicines in Korea: A clinical review[J]. Yonsei Medical Journal, 2014, 55(5): 1177-1186. doi: 10.3349/ymj.2014.55.5.1177 [8] WANG Z, WANG H, WANG H, et al. Heavy metal pollution and potential health risks of commercially available Chinese herbal medicines[J]. Science of the Total Environment, 2019, 653: 748-757. doi: 10.1016/j.scitotenv.2018.10.388 [9] 孔繁越. 中药材重金属限量标准和农残限量标准研究及标准制定相关建议[D]. 北京: 北京中医药大学, 2017. [10] 国家药典委员会. 中华人民共和国药典2020年版[M]. 北京: 中国医药科技出版社, 2020. [11] British Standards Institution. Traditional Chinese Medicine-Determination of heavy metals in herbal medicines used in Traditional Chinese Medicine[S]. British: BSI Standards Publication, 2015. [12] The United States Pharmacopieial Convention. The United States Pharmacopoeia[M]. 43th edition. Rockville, 2020. [13] European Directorate for Quality Medicines. Europe Pharmacopoeia[M]. 10th edition. Strasbourg: European Directorate for the Quality of Medicines & Health Care, 2020. [14] 李璇. 重金属对《中国药典》收载6种中药材品质的影响及其限量标准的制定[D]. 成都: 西南交通大学, 2012. [15] 郭兰萍, 周利, 王升, 等. 《中医药-中药材重金属限量中药材重金属限量》ISO国际标准下中药材重金属污染现状与分析[J]. 科技导报, 2017, 35(11): 91-98. [16] 黑泽文, 向慧敏, 章家恩, 等. 豆科植物修复土壤重金属污染研究进展[J]. 生态科学, 2019, 38(3): 218-224. [17] SRIPRANG R, HAYASHI M, YAMASHITA M, et al. A novel bioremediation system for heavy metals using the symbiosis between leguminous plant and genetically engineered rhizobia[J]. Journal of Biotechnology, 2002, 99(3): 279-293. doi: 10.1016/S0168-1656(02)00219-5 [18] 张浩, 张凌云, 王济, 等. 3种禾本科植物耐Pb性及富集特征比较[J]. 贵州师范大学学报(自然科学版), 2019, 37(6): 29-33. [19] 何春杨. KH2PO4-NaOH土壤改良剂对川芎栽培中Cd吸收影响的研究[D]. 成都: 成都中医药大学, 2016. [20] 周斯建, 赵印泉, 彭培好, 等. 不同土地利用方式下川芎Cd的累积特征及健康风险评估[J]. 地球与环境, 2014, 42(6): 779-783. [21] 周斯建, 赵印泉, 彭培好, 等. 不同耕作方式下土壤: 川芎系统中Cd、Pb的累积特征及污染评价[J]. 中国农学通报, 2014, 30(31): 199-204. doi: 10.11924/j.issn.1000-6850.2014-1495 [22] 张家春, 曾宪平, 张珍明, 等. 不同功能区土壤-钩藤系统重金属累计特征及评价[J]. 中国中药杂志, 2016, 41(20): 3746-3752. [23] 林晓燕, 唐彪, 熊云武, 等. Pb锌矿区土壤重金属含量及木本植物吸收特征[J]. 湖北农业科学, 2016, 55(18): 4656-4659. [24] 周亚文, 刘璐, 何越, 等. 姜黄各药用部位对土壤中重金属的富集能力分析[J]. 科技通报, 2015, 31(3): 254-257. doi: 10.3969/j.issn.1001-7119.2015.03.061 [25] 张寒梅, 吕瑞, 黄彩霞. 不同区域中姜黄对土壤中As、Hg吸收富集能力研究[J]. 食品工业, 2016, 37(6): 295-297. [26] 燕江伟. 干旱条件下三种旱生灌木对土壤重金属Cd、Pb胁迫响应及其修复潜能研究[D]. 重庆: 西南大学, 2017. [27] 孙年喜, 李隆云, 瞿显友, 等. 黄连植株及其土壤中Cd含量分析[J]. 中国中药杂志, 2010, 35(23): 3120-3122. [28] 刘周莉, 何兴元, 陈玮. 忍冬: 一种新发现的Cd超富集植物[J]. 生态环境学报, 2013, 22(4): 666-670. doi: 10.3969/j.issn.1674-5906.2013.04.020 [29] 钱华, 王衍彬. 中药材不同吸收特性对土壤重金属含量标准要求的变化[J]. 中国现代中药, 2006, 8(11): 34-36. doi: 10.3969/j.issn.1673-4890.2006.11.012 [30] 杨敏, 张杰, 沈昱翔, 等. 滇重楼与丛枝菌根的共生对重金属元素吸收的影响[J]. 环境化学, 2018, 37(4): 860-870. doi: 10.7524/j.issn.0254-6108.2017081405 [31] 贾薇. 中药材中重金属的分析方法及其吸收富集特征研究[D]. 广州: 广州中医药大学, 2009. [32] 田伟, 谢晓亮, 温春秀, 等. 黄芩对土壤中重金属吸收规律的研究[J]. 河北林果研究, 2007(1): 15-18. doi: 10.3969/j.issn.1007-4961.2007.01.005 [33] 陈雅丽, 翁莉萍, 马杰, 等. 近十年中国土壤重金属污染源解析研究进展[J]. 农业环境科学学报, 2019, 38(10): 2219-2238. doi: 10.11654/jaes.2018-1449 [34] 王婷, 张倩, 杨海雪, 等. 农田土壤中Cu的来源分析及控制阈值研究[J]. 生态毒理学报, 2014, 9(4): 774-784. [35] 王娜, 魏样. 土壤重金属Cd污染来源及其修复技术探究[J]. 环境与发展, 2019, 31(8): 55-56. [36] 张云芸. 基于海量文献的中国农田土壤重金属Cd的时空分布及风险评价[D]. 太原: 山西大学, 2019. [37] 贾丽, 乔玉辉, 陈清, 等. 我国设施菜田土壤重金属含量特征与影响因素[J]. 农业环境科学学报, 2020, 39(2): 263-274. doi: 10.11654/jaes.2019-1027 [38] 焦荔, 沈建东, 姚琳, 等. 杭州市大气降尘重金属污染特征及来源研究[J]. 环境污染与防治, 2013, 35(1): 73-76. doi: 10.3969/j.issn.1001-3865.2013.01.016 [39] 秦丽娟, 赵有益, 黎虹. 兰州市设施菜地土壤重金属污染程度及污染源等[J]. 甘肃农业大学学报, 2019, 54(3): 125-133. [40] 我国农药使用量已连续3年负增长[J]. 营销界(农资与市场), 2018(9): 21. [41] 张静, 李鹏. 南宁市稻米重金属污染状况及环境因素分析[J]. 粮食与油脂, 2021, 34(11): 158-162. [42] 刘钦普, 濮励杰. 中国粮食主产区化肥施用时空特征及生态经济合理性分析[J]. 农业工程学报, 2019, 35(23): 142-150. doi: 10.11975/j.issn.1002-6819.2019.23.018 [43] 陈文轩, 李茜, 王珍, 等. 中国农田土壤重金属空间分布特征及污染评价[J]. 环境科学, 2020, 41(6): 2822-2833. [44] LIU X, SONG Q, TANG Y, et al. Human health risk assessment of heavy metals in soil-vegetable system: A multi-medium analysis[J]. Science of the Total Environment, 2013, 463: 530-540. [45] ZHANG J, WIDER B, SHANG H, et al. Quality of herbal medicines: challenges and solutions[J]. Conplementary Therapies in Medicine, 2012, 20(1/2): 100-106. [46] STREET R A. Heavy metals in medicinal plant products: An African perspective[J]. South African Journal of Botany, 2012, 82: 67-74. doi: 10.1016/j.sajb.2012.07.013 [47] 孙慧. 基于规则模型的广东省土壤重金属源识别及影响因子解析[D]. 太原: 山西农业大学, 2017. [48] ZHU Y, YOSHINAGA M, ZHAO F, et al. Earth abides arsenic biotransformations[J]. Annual Review of Earth and Planetary Sciences, 2014, 42: 443-467. [49] MAHARIA R S, DUTTA R K, ACHARYA R, et al. Heavy metal bioaccumulation in selected medicinal plants collected from Khetri copper mines and comparison with those collected from fertile soil in Haridwar, India[J]. Journal of Environmental Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes, 2010, 45(2): 174-181. [50] STREET R A, STIRK W A, VAN STADEN J. South African traditional medicinal plant trade-Challenges in regulating quality, safety and efficacy[J]. Journal of Ethnopharmacology, 2008, 119(3): 705-710. doi: 10.1016/j.jep.2008.06.019 [51] 金雪莲. 中药重金属污染源头及控制措施研究[J]. 西部中医药, 2011, 24(7): 24-26. doi: 10.3969/j.issn.1004-6852.2011.07.009 [52] 郑京胜. 中药炮制辅料麦麸的质量标准研究[D]. 杭州: 浙江中医药大学, 2018. [53] 容艳芬. 炮制辅料麦麸质量标准研究[D]. 武汉: 湖北中医药大学, 2018. [54] 王蕾, 燕彩云, 乐智勇, 等. 盐制法及炮制辅料盐的炮制历史沿革研究[J]. 中国中药杂志, 2017, 42(20): 3880-3885. [55] GOVINDARAGHAVAN S, SUCHER N J. Quality assessment of medicinal herbs and their extracts: Criteria and prerequisites for consistent safety and efficacy of herbal medicines[J]. Epilepsy & Behavior, 2015, 52: 363-371. [56] 朱侠. Pb锌矿区及农田土壤中重金属的化学形态与生物有效性研究[D]. 北京: 中国科学院大学, 2019. [57] 张明, 罗亨明, 马开森, 等. 土壤与栽培半夏重金属含量的测定与认识[J]. 现代中药研究与实践, 2003, 17(3): 20-21. [58] TADESSE A W, GERESLASSIE T, YAN X, et al. Determination of heavy metal concentrations and their potential sources in selected plants: Xanthium strumarium L. (Asteraceae), Ficus exasperata Vahl (Moraceae), Persicaria attenuata (R. Br) Sojak (Polygonaceae), and Kanahia laniflora (Forssk. ) R. Br. (Asclepiadaceae) from awash river basin, Ethiopia[J]. Biological Trace Element Research, 2019, 191(1): 231-242. doi: 10.1007/s12011-018-1588-3 [59] 杨蕾. 中药材种植环境中重金属形态及其影响因素研究[J]. 安徽农业科学, 2013, 41(24): 9940-9942. doi: 10.3969/j.issn.0517-6611.2013.24.026 [60] HUANG G, DING C, LI Y, et al. Selenium enhances iron plaque formation by elevating the radial oxygen loss of roots to reduce cadmium accumulation in rice (Oryza sativa L. )[J]. Journal of Hazardous Materials, 2020, 398(5): 122860. [61] WU J, ZOU Y, ZHAN X, et al. Survey of heavy metal pollution in four Chinese crude drugs and their cultivated soils[J]. Bulletin of Environmental Contamination and Toxicology, 2008, 81(6): 571-573. doi: 10.1007/s00128-007-9170-2 [62] AWODELE O, POPOOLA T D, AMADI K C, et al. Traditional medicinal plants in Nigeria-Remedies or risks[J]. Journal of Ethnopharmacology, 2013, 150(2): 614-618. doi: 10.1016/j.jep.2013.09.015 [63] YANG X, MA S, LI J. Effects of different soil remediation methods on inhibition of lead absorption and growth and quality of Dianthus superbus L[J]. Environmental Science and Pollution Research, 2017, 24(36): 28190-28196. doi: 10.1007/s11356-017-0089-9 [64] 杨晓宇. 不同重金属修复技术对Pb污染下瞿麦品质的影响[D]. 保定: 河北大学, 2017. [65] HU Y, CHENG H, TAO S. The challenges and solutions for cadmium-contaminated rice in China: A critical review[J]. Environment International, 2016, 92-93: 515-532. doi: 10.1016/j.envint.2016.04.042 [66] MA J, CHEN Y, WANG H, et al. Traditional Chinese medicine residue act as a better fertilizer for improving soil aggregation and crop yields than manure[J]. Soil & Tillage Research, 2019, 195: 104386. [67] SHIV B, ANITHA K, BALAJI S, et al. Sources, distribution, bioavailability, toxicity, and risk assessment of heavy metal(loid)s in complementary medicines[J]. Environmental International, 2017, 108: 103-118. doi: 10.1016/j.envint.2017.08.005 [68] 张寒, 张婷盼, 张彦, 等. 不同炮制方法对杜仲中重金属含量及其赋存形态的影响[J]. 国际药学研究杂志, 2017, 44(5): 437-441. [69] 袁珂, 王麟, 孙素琴, 等. 三种浙产特色药材炮制前后微量元素与重金属的含量研究[J]. 光谱学与光谱分析, 2010, 30(5): 1400-1403. doi: 10.3964/j.issn.1000-0593(2010)05-1400-04 [70] SUN J, YU G, ZHANG Y, et al. Heavy metal level in human semen with different fertility: A meta-analysis[J]. Biological Trace Element Research, 2017, 176(1): 27-36. doi: 10.1007/s12011-016-0804-2 [71] 李琼, 梁成满, 吴婷, 等. 中药中重金属的去除[J]. 化学通报, 2005(11): 845-849. doi: 10.3969/j.issn.0441-3776.2005.11.013 [72] 夏良艳. 牛奶及中草药中金属元素含量的健康风险评价[D]. 保定: 河北大学, 2012. [73] 洪薇, 赵静, 李绍平. 中药重金属限量控制现状与对策[J]. 药物分析杂志, 2007, 27(11): 1849-1853. [74] 鄢星, 魏惠珍, 朱益雷, 等. 中药重金属研究概述[J]. 江西中医药大学学报, 2017, 29(5): 116-120. -





 下载:
下载: