-
药品与个人护理品(pharmaceuticals and personal care products,PPCPs)包括各种药物化合物及日常护理用品[1]。水体环境中的PPCPS主要来源于过期药物的直接排放、制药废水的排放、未经处理的农业和养殖废水的直接排放[2]、人的排泄及个人护理品的广泛使用[3]。
萘普生(naproxen,NPX)化学名称为α-甲基-6-甲氧基-2-萘乙酸,可溶解于甲醇、乙醇和氯仿,几乎不溶解于水,具有较好的消炎、镇痛、解热作用,是常见的消炎药物之一[4]。NPX凭借毒性较低、毒副作用较小、药效明显、耐受性良好等优点成为全球最畅销的非处方药之一[5]。20世纪80年代,我国NPX年产量仅有10 t左右,2002年已突破200 t[6]。近年来,NPX的产量仍在增长[7]。有研究[8-9]发现,城市污水处理厂进水的NPX浓度水平在ng·L−1~µg·L−1,传统生物处理技术不能完全将NPX及其代谢产物从水中去除,导致NPX随出水进入环境水体,甚至在饮用水中也检测出了NPX。有研究[10]表明,长期摄入痕量的NPX会诱发心脏病、中风,对肺部产生毒害作用。目前,水中NPX主要处理方法包括吸附法、膜处理法、高级氧化法。吸附法对NPX的去除率较低,膜处理法则由于膜污染问题发展受到阻碍,以光催化剂技术为主的高级氧化法发挥了重要的作用。
光催化技术是高级氧化法的一种,以太阳能为光源,利用光催化剂的氧化还原的能力去除污染物[11]。光催化技术能够完全去除水中的有机污染物而且不产生二次污染,反应条件简单、效率高、矿化能力强[12]。近几年来,钨酸铋(Bi2WO6)作为新型光催化剂备受关注。Bi2WO6晶型为正交晶型,结构为层状结构,具备压电、铁电、催化等性能,化学稳定性较强,不会发生光化学腐蚀的现象[13],因而在离子半导体、铁磁性材料、催化和光解水制氢等领域有着广泛的应用[14]。Bi2WO6由于其良好的光催化性能,而被广泛应用于有机染料、有毒物质废水处理等领域。
Bi2WO6是具有高效催化性能的一种新型催化剂。NPX是常见的消炎药之一,其逐年增加的产量和用量对水体环境构成严重的影响。目前,关于Bi2WO6光催化降解NPX性能及机理方面的研究鲜有报道,因此,探明Bi2WO6光催化降解NPX过程的主要活性自由基及降解机理,将有助于为环境水体中NPX的高效去除开拓新思路。本研究以NPX为目标污染物,对Bi2WO6光催化降解NPX性能与机理进行研究;采用水热法制备Bi2WO6,通过扫描电镜(SEM)、透射电镜(TEM)、X射线衍射仪(XRD)、固体紫外-可见分光光度计(UV-vis)、比表面积及孔径测定仪(BET)对其微观形貌、晶体结构、禁带宽度及比表面积进行表征;详细考察NPX浓度、Bi2WO6投加量、阴离子种类、溶液pH对Bi2WO6光催化降解NPX效果的影响并确定最佳反应条件;通过COD去除效果评价反应体系矿化度,采用原位捕获实验定性分析反应过程中产生的活性自由基,利用高效液相色谱-离子阱-飞行时间质谱识别中间产物并提出NPX降解路径,揭示Bi2WO6光催化降解NPX机理;建立光催化降解NPX最佳反应体系,阐明NPX降解机理,为光催化技术去除环境水体中典型消炎药物提供参考。
全文HTML
-
五水合硝酸铋(Bi(NO)3·5H2O,纯度≥99.0%),二水合钨酸钠(Na2WO6·2H2O,纯度≥99.5%),NPX(C14H14O3,纯度≥99.9%),草酸铵((NH4)2C2O4·H2O,色谱纯),异丙醇((CH3)2CHOH),色谱纯),TEMPOL(C9H18NO3,纯度≥99.9%),乙腈(C2H3N,色谱纯),冰醋酸(CH3COOH,分析纯),甲醇(CH3OH,色谱纯),高锰酸钾(KMnO4,分析纯),草酸钠(Na2C2O4,分析纯),浓硫酸(H2SO4,分析纯)。
电子天平、恒温磁力搅拌器(型号SH23-2)、聚四氯乙烯内衬、不锈钢高压反应釜、真空恒温干燥箱(型号DZ-2BC)、真空泵、光化学反应器、高效液相色谱-离子阱-飞行时间质谱仪(LCMS-IT-TOF)。
-
本研究采用水热法制备可见光催化剂Bi2WO6。在常温常压下,分别称取0.02 mol Bi(NO3)3·5H2O和0.02 mol Na2WO4·2H2O,将其依次溶解于150 mL去离子水中,置于搅拌器上,持续搅拌0.5 h,使之混合均匀。随后将混合物移入体积为200 mL的聚四氟乙烯内衬,并置于不锈钢高压反应釜中,密封后放入160 ℃干燥箱中反应12 h;待其冷却至室温后,用去离子水抽滤3次,得到淡黄色固体,将该固体于60 ℃干燥箱中恒温干燥,得到Bi2WO6样品。
采用SEM、TEM、XRD、UV-vis、BET对所制催化剂的微观形貌、晶体结构、禁带宽度及比表面积进行表征。
-
使用甲醇配置1 g·L−1的NPX储备液,用去离子水稀释NPX储备液,配置400 mL不同浓度NPX污染液,用超声清洗器超声处理NPX污染液10 min,使NPX更好地溶解于去离子水中。将污染液放置在光化学反应器内的搅拌台上持续搅拌,加入不同量Bi2WO6。暗反应30 min,达到吸附平衡后,用500 W长弧氙灯光(波长为200~900 nm)照射180 min。该过程每30 min取1次样,所取样液经过0.22 μm滤头过滤,储存在1 mL液相瓶子内待测。每组实验设置平行对照实验,以确保其实验条件的重复性与实验结果的重现性。本研究所配制的NPX污染液浓度明显高于实际水体中检测到的NPX浓度,目的是更全面地检测光催化反应过程中产生的活性自由基和中间产物,以便于揭示NPX的降解机理。
-
在光催化反应实验中加入捕获剂,通过考察添加不同捕获剂后NPX的降解效果,确定光催化反应中产生的活性自由基及其作用。本实验采用草酸铵做空穴(h+)捕获剂,投加量为1 mmol·L−1;异丙醇做羟基自由基(·OH)捕获剂,投加量为1 mL·L−1;TEMPOL做超氧自由基(
⋅O−2 )捕获剂,投加量为1 mmol·L−1。 -
通过高效液相色谱仪测定样品中NPX浓度。使用热电HPLC Betasil C18 分析柱(2.1 mm×150 mm,5 µm)色谱柱,水相(0.1%冰醋酸水溶液)∶有机相(乙腈)=50%∶50%,流速为0.2 mL·min−1,柱温40 ℃,进样体积10 µL,检测波长为232 nm;通过高效液相色谱-离子阱-飞行时间质谱测定中间产物,液相分析条件同上,负离子模式下测定,质荷比m/z为100~400。
1.1. 实验原料及装置
1.2. Bi2WO6的制备和表征
1.3. 活性测试
1.4. 活性自由基的测定
1.5. NPX浓度及中间产物的测定
-
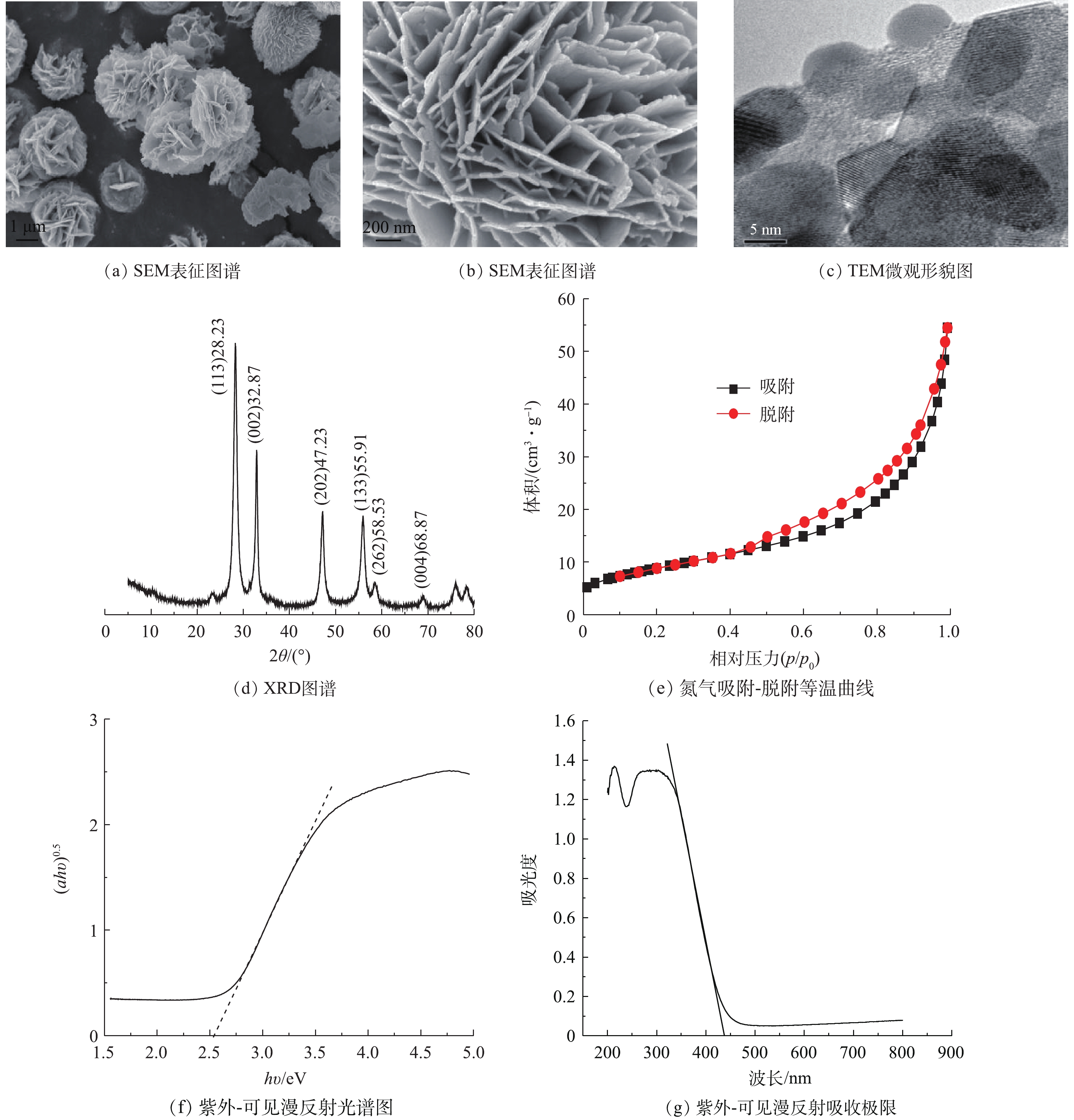
Bi2WO6样品的SEM表征图谱见图1(a)和图1(b)。可以看出,所得样品是由2D纳米小方片组成的3D花朵状,直径在2 μm左右,纳米小方片的长度在200 nm左右。纳米小方片之间存在着空隙,这些空隙的存在增大了样品的比表面积,使样品具备很好的催化性能。TEM表征图谱见图1(c),可以看出,Bi2WO6的颗粒分布比较均匀,有明显的晶格条纹,该形貌的边缘存在明显的格纹,样品属于单晶结构。Bi2WO6的Bi、W、O的原子含量分别为25.14%、11.02%、63.84%,由此可得样品的原子比为2.28∶1∶5.79。Bi2WO6的XRD图谱见图1(d),可以看出,Bi2WO6的衍射峰2θ=28.23°、32.87°、47.23°、55.91°、58.53°、68.87°所对应的晶体的晶面分别是(113)、(002)、(202)、(133)、(262)、(004),与正交晶系标准卡片(JCPDS No. 39-0256)所对应,Bi2WO6样品为纯正交晶系。XRD图谱中未见其他杂峰,说明样品的纯度较高。Bi2WO6的氮气吸附-脱附等温曲线图谱如图1(e)所示。该样品等温曲线属于Ⅳ型,滞后环的形状属于H3型,说明该样品存在较小的介孔,具有片状颗粒松散堆积形成的楔形孔。Bi2WO6样品的平均孔径为10.79 nm,比表面积为32.54 m2·g−1。UV-vis吸收光谱及吸收极限如图1(f)和图1(g)所示。符合光吸收带边遵循公式[15](式(1))。
式中:v为光频率;A为常数;α为吸收系数;Eg为禁带宽度;n与半导体类型相关(直接跃迁n=1,间接跃迁n=4)。Bi2WO6样品n=1,通过(αhv)1/2对hv作图,将该图的延长线延长后,与横坐标交于一点,如图1(g)所示。该交点为禁带宽度,可以得出Bi2WO6的带隙宽度为2.54 eV。
-
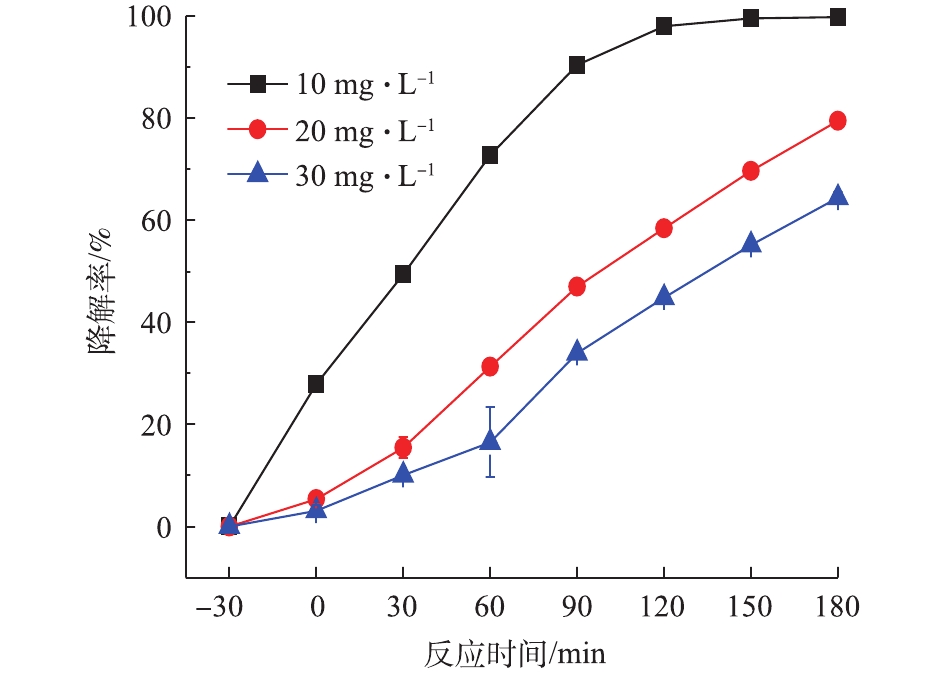
在Bi2WO6投加量0.4 g·L−1条件下,分别考察初始浓度为10、20、30 mg·L−1 NPX的降解效果,结果如图2所示。随着NPX浓度的提高,光催化降解效率下降。在暗反应阶段,当NPX浓度由10 mg·L−1升至30 mg·L−1时,吸附降解率从27.90%降至3.07%。因为一定浓度的Bi2WO6饱和吸附量是一定的,当达到饱和吸附量时,NPX浓度升高,其吸附降解率下降。180 min光照后,30 mg·L−1 NPX光催化降解率仅有62.23%,10 mg·L−1光催化降解率高达99.83%。NPX分子和Bi2WO6通过发生分子接触碰撞,实现降解NPX[16]。随着NPX浓度的提高,单位体积内能够与Bi2WO6分子发生碰撞的NPX分子的百分比下降。由于光照强度是恒定的,光子量也恒定,因此,NPX浓度的提高降低了单位分子所能得到的光子量,光催化的效率降低。在Bi2WO6浓度恒定的条件下,所产生的活性自由基浓度恒定,可氧化降解的NPX分子数量恒定。因此,随着NPX浓度的增加,降解效果会下降。
-
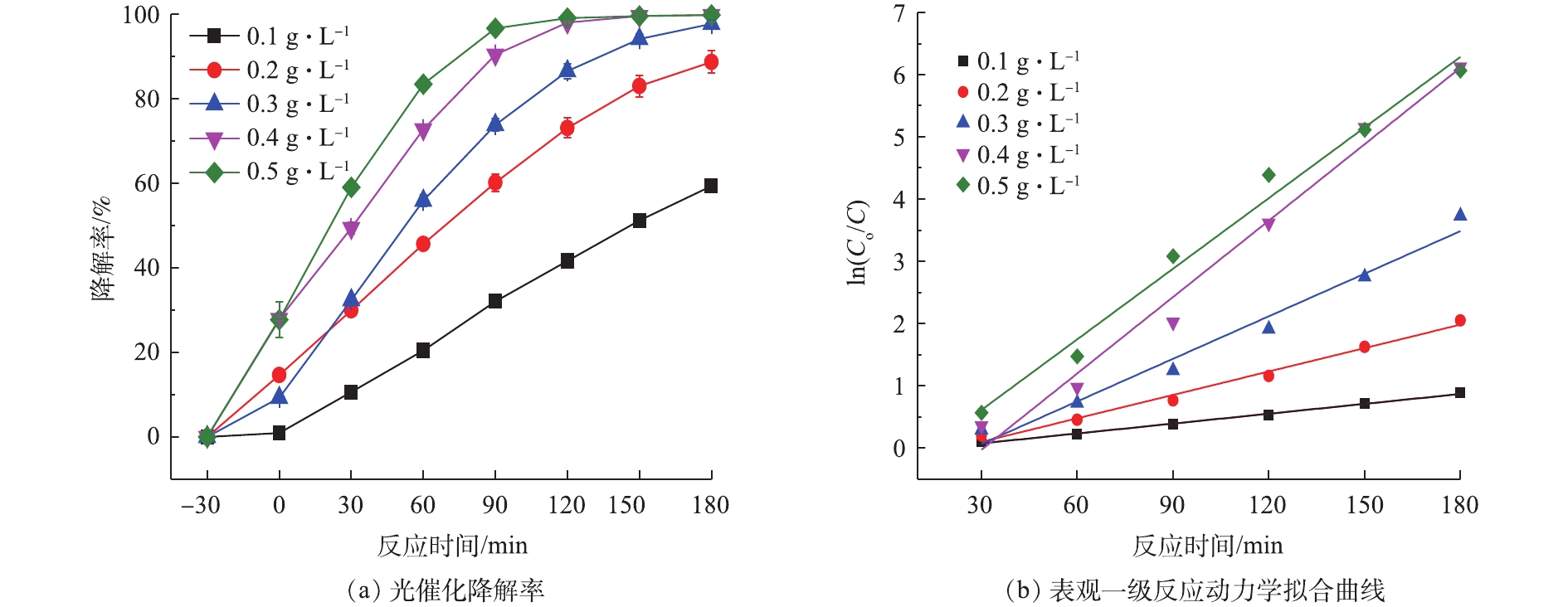
在NPX初始浓度为10 mg·L−1条件下,Bi2WO6投加量为0.1、0.2、0.3、0.4、0.5 g·L−1时,NPX的降解结果如图3(a)所示。随着Bi2WO6浓度的升高,NPX被光催化降解得更加彻底。当Bi2WO6浓度从0.1 g·L−1增加至0.4 g·L−1时,暗反应30 min,NPX的吸附降解率由0.94%升至27.90%,光照180 min后,NPX光催化降解率由59.30%增加至99.80%;当Bi2WO6浓度增加至0.5 g·L−1时,吸附降解率略有下降,光催化降解率几乎不变。这是因为,Bi2WO6浓度在0.4 g·L−1时,NPX和Bi2WO6分子接触碰撞百分比达到了最高值,在此基础上增加Bi2WO6分子的浓度,并不会增加碰撞百分比,反而多余的Bi2WO6分子会发生团聚导致活性中心减少,故Bi2WO6浓度由0.4 g·L−1升至0.5 g·L−1时,吸附降解率没有明显提高反而有所下降,光催化降解过程中降解率有所增加,但在光照180 min时,降解率几乎相等。不同浓度的Bi2WO6降解10 mg·L−1的NPX的动力学拟合曲线如图3(b)所示。可以看出,Bi2WO6光催化降解NPX过程符合表观一级反应动力学。由表1可知,0.1、0.2、0.3、0.4、0.5 g·L−1 Bi2WO6降解NPX的表观反应速率常数K分别为0.16、0.38、0.68、1.23、1.13 min−1。这说明:当Bi2WO6浓度由0.1 g·L−1增加至0.4 g·L−1时,降解速率是上升的;当浓度继续增加至0.5 g·L−1时,降解速率略有下降。因此,确定最佳催化剂的投加量为0.4 g·L−1。
-
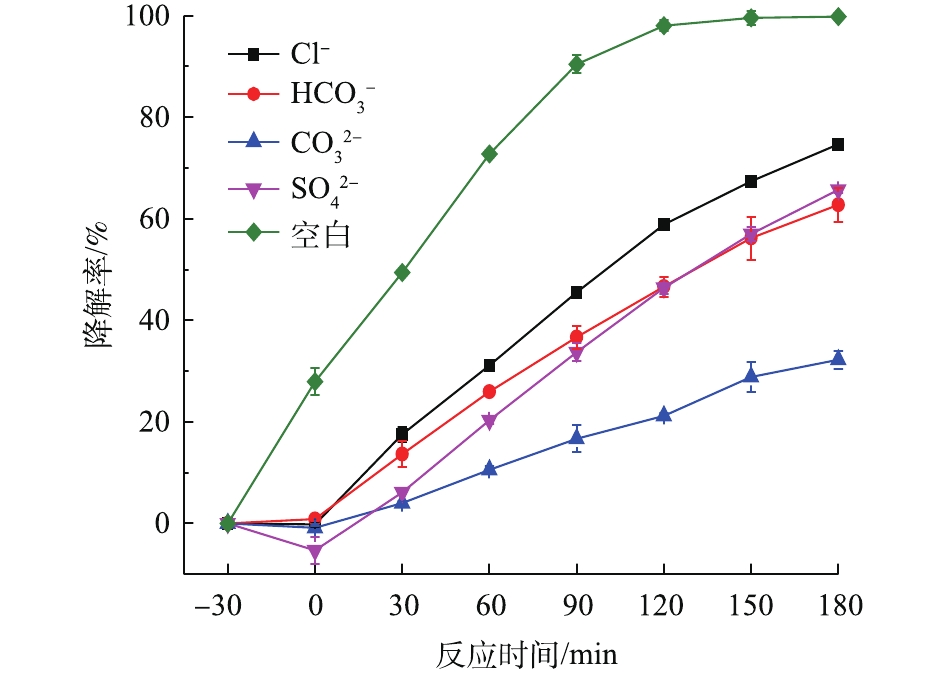
天然水体由多种化学成分组成,水体中含有Cl−、
HCO−3 、CO2−3 、SO2−4 4种常见的阴离子,本实验考察了不同阴离子对Bi2WO6降解NPX效果的影响。配置1 mmol·L−1的Cl−、
HCO−3 、CO2−3 、SO2−4 钠盐溶液与NPX溶液混合,进行光催化实验,采用未添加离子实验作为空白对照实验组,结果如图4所示。阴离子对Bi2WO6光催化降解NPX有抑制作用,抑制作用顺序为CO2−3 >HCO−3 ≈SO2−4 >Cl−。在暗反应阶段,阴离子对NPX的吸附均有抑制作用;在光反应阶段,光催化反应速率顺序为空白>Cl−>SO2−4 ≈HCO−3 >CO2−3 。这些阴离子是自由基活性抑制剂,会与·OH发生反应,消耗·OH,从而抑制Bi2WO6光催化降解NPX。加入CO2−3 和HCO−3 ,在离子消耗·OH的同时,还会改变溶液的pH,使溶液呈现碱性,碱性条件抑制Bi2WO6光催化降解NPX。Cl−、SO2−4 吸附在催化剂的表面,占据活性位点[17],且SO2−4 带有2个负电荷,较Cl−消耗羟基自由基的能力更强,所以抑制作用为CO2−3 >HCO−3 ≈SO2−4 >Cl−。 -
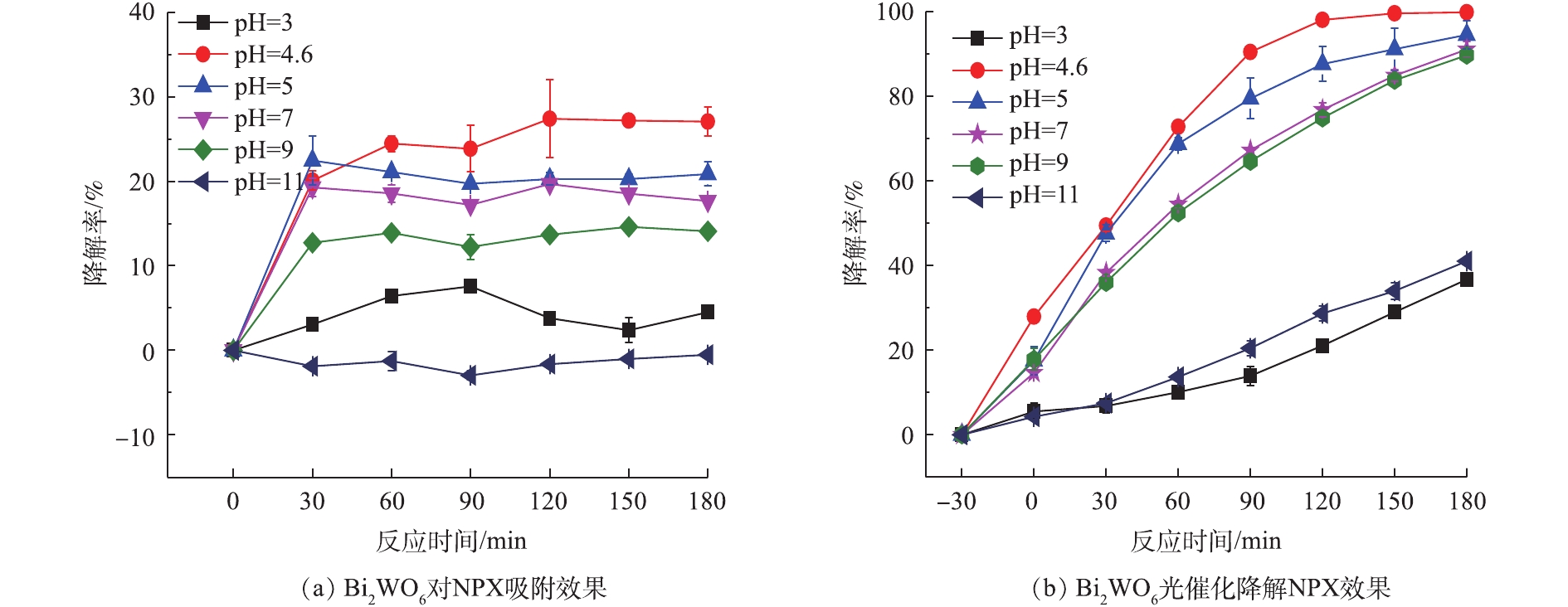
pH是影响光催化的重要因素之一,Bi2WO6和NPX表面所带电荷及吸附方式会随pH的改变而改变。本实验分别用1 mol·L−1的HCl和1 mol·L−1的NaOH调节污染液的pH。考察pH=3、4.6、5、7、9、11条件下,Bi2WO6吸附和光催化去除NPX效果,结果如图5(a)和图5(b)所示。随着pH的增加,NPX的吸附降解率和光催化降解率均先升高后降低,在pH为4.6时,吸附和光催化降解率最高,分别为36.70%和99.84%。在强酸强碱条件下,NPX的光催化降解率迅速下降。在强酸环境下,Bi2WO6非常不稳定,易发生反应生成H2WO4和Bi2O3,催化活性大大下降。Bi2WO6的等电点为6.29[18],当pH<6.29时,Bi2WO6表面带正电荷,并随着pH接近6.29,表面所带正电荷减少;当pH>6.29时,Bi2WO6带负电荷,随着pH的增加,表面所带负电荷呈现增加的趋势。NPX的pKa=4.15,pH<4.15时,NPX以分子形式存在[19];pH>4.15时,NPX分子中的羧基开始解离,与氢键结合能力下降,NPX从分子态变为表面带负电荷,并随着pH的增加,表面所带电荷增加;pH<4.15时,NPX以分子的形式存在,Bi2WO6表面带正电荷,所以在pH=3时,吸附效果较差,光催化降解效率也较差;pH=4.15~6.29时,NPX所带负电荷呈增加的趋势,Bi2WO6所带正电荷呈下降的趋势,所以在该范围内,随着pH的增加,两者之间的作用力减弱,吸附效果有所下降,光催化效果也下降;pH>6.29时,NPX和Bi2WO6表面均带负电荷,且随着pH的增加,表面所带负电荷增加,两者之间的相互排斥力增加,从而导致吸附效果减弱,光催化效率也随之下降。在不同pH条件下,Bi2WO6分子和NPX分子表面所带电荷不同导致了Bi2WO6对NPX的吸附性能差异,进一步影响Bi2WO6光催化降解NPX的能力[20]。未调整pH的污染液pH为4.6,此条件下Bi2WO6对NPX的降解效果最佳。
-
本实验采用高锰酸盐指数法测定Bi2WO6光催化降解NPX体系中化学需氧量(COD)的去除效果,以此评价反应体系矿化度。在最优反应条件下,光照180 min后,反应体系矿化度为67.91%。为了深入研究中间产物在体系内的矿化程度,将光照时间延长至360 min,矿化度上升至82.14%,这表明,延长反应时间能将反应体系中的中间产物进一步降解,有效提高矿化度。研究结果证实,光催化技术是去除NPX甚至实现其矿化的有效途径,为减缓典型药物对环境的危害提供了一定的理论依据。
-
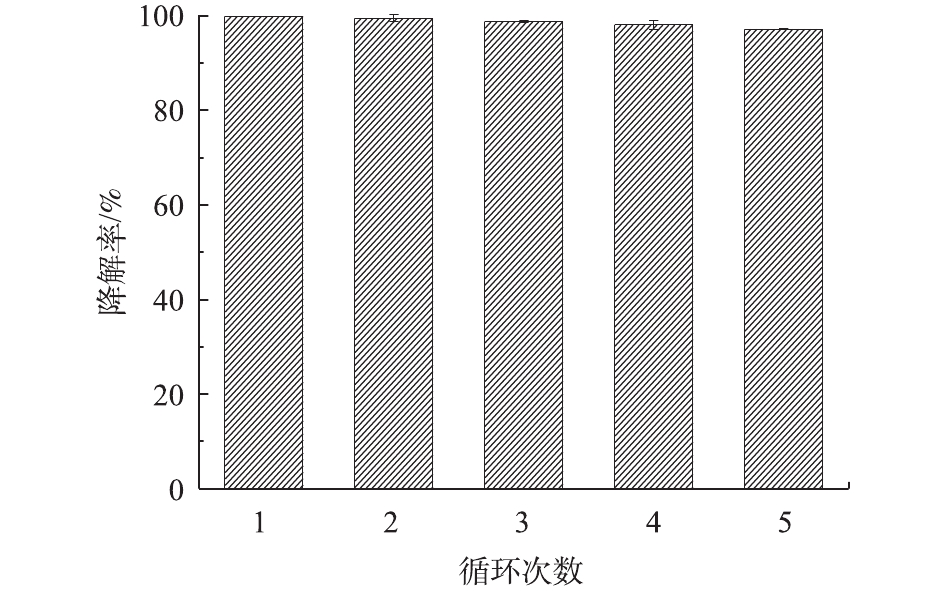
在实际工程应用中,催化剂在循环使用过程中的稳定性是评价其性能的关键指标,同时决定了其回收应用价值。通过考察Bi2WO6在5个批次循环实验中对NPX的降解效果评价其光催化性能稳定性,结果如图6所示。可以看出,在循环反应过程中,Bi2WO6始终对NPX具有较高的降解率,表现出了良好的光催化性能稳定性。经过5个批次循环实验,NPX的降解率由最初的99.85%下降至97.13%。由于每批次实验结束后需要对Bi2WO6进行分离、清洗、烘干等一系列操作,操作过程导致一定程度的催化剂损失,这可能是造成其降解率略有下降的重要原因。但是,5个批次循环实验后,NPX的降解率仍高于97%,保持在很高的水平,因此,Bi2WO6具有非常好的稳定性及可循环性。
-
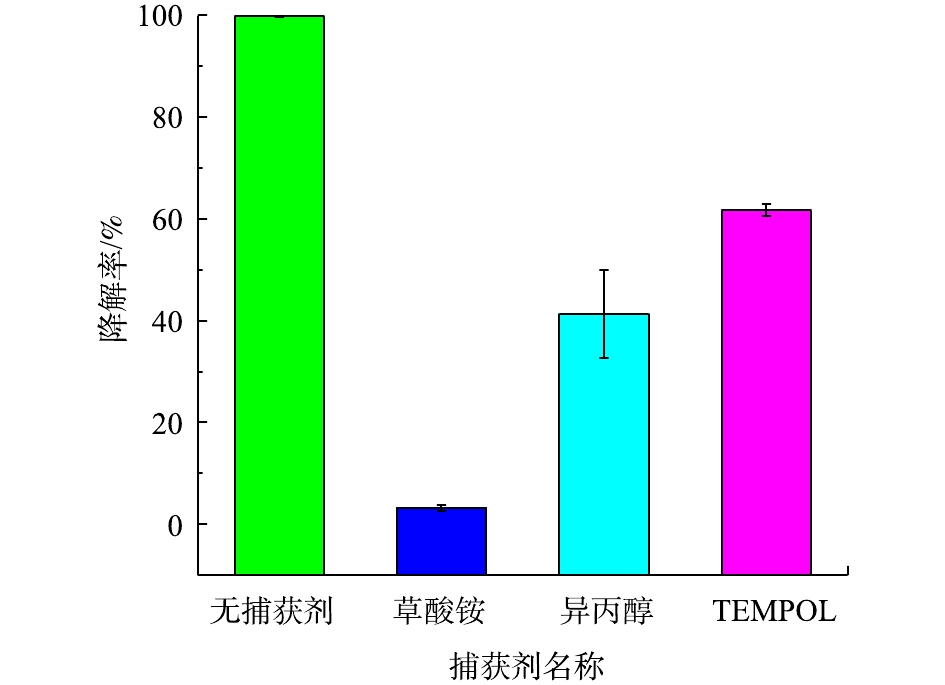
通过捕获实验确定Bi2WO6降解NPX过程中产生的活性自由基种类及其作用是常见的活性自由基鉴定手段。在反应体系中分别加入1 mmol·L−1草酸铵、1 mL·L−1异丙醇、1 mmol·L−1 TEMPOL,作为h+、·OH、
⋅O−2 的捕获剂,NPX降解率如图7所示。与无捕获剂的空白实验组作对比,以此确定不同活性自由基在降解NPX过程中的作用。空白实验的去除率为99.83%,当加入草酸铵、异丙醇、TEMPOL后,光催化反应均受到了抑制,去除率分别降至3.18%、41.39%、61.70%。三者的抑制作用顺序为TEMPOL<异丙醇<草酸铵。草酸铵和异丙醇加入后,NPX降解反应受到明显抑制,加入TEMPOL后,NPX的降解率较空白实验有所降低,但是被抑制效果明显弱于加入草酸铵和异丙醇后的降解效果。可以看出,Bi2WO6降解NPX过程中起主要作用的活性自由基是h+和·OH,⋅O−2 起辅助作用。JO等[21]通过原位捕获实验,发现h+和·OH是Bi2WO6降解甲硝唑过程中起主要氧化作用的活性自由基。钟爽[22]的研究结果表明,在Bi2WO6光催化降解四环素体系中,同样是·OH发挥主要氧化作用,⋅O−2 起辅助作用。刘丁菡[23]以DMPO为自旋捕获剂,采用电子自旋共振技术(ESR)分析Bi2WO6光催化体系中活性自由基时发现,ESR图谱中同时出现了DMPO-·OH加合物与DMPO-⋅O−2 加合物的特征图谱,表明Bi2WO6光催化反应过程中同时产生了·OH和⋅O−2 ,根据特征图谱峰强度可知,体系产生·OH数量明显高于产生⋅O−2 的数量。上述研究结果与本研究经捕获实验得到的相关结果基本一致。导带和价带的位置决定了光催化反应产生活性自由基的种类。由UV-vis数据可知,Bi2WO6样品的带隙宽度为2.54 eV,通过公式[24]计算可得其导带电势(ECB)和价带电势(EVB),计算方法见式(2)和式(3)。
式中:χ为半导体催化剂的绝对电负性;Ee为自由电子能(4.5 eV);Eg为半导体的禁带宽度。Bi2WO6电势和物质摩尔比如表2所示。
由式(2)和式(3)可得导带电势为0.47 eV,价带电势为3.01 eV。价带的电势3.01 eV高于OH−/·OH和H2O/·OH电势,h+可以氧化OH−和H2O,生成的·OH具有强氧化性,能够直接氧化分解NPX。因此,当加入草酸铵和异丙醇后,NPX的去除效果下降非常明显。Bi2WO6导带电势0.47 eV高于O2/
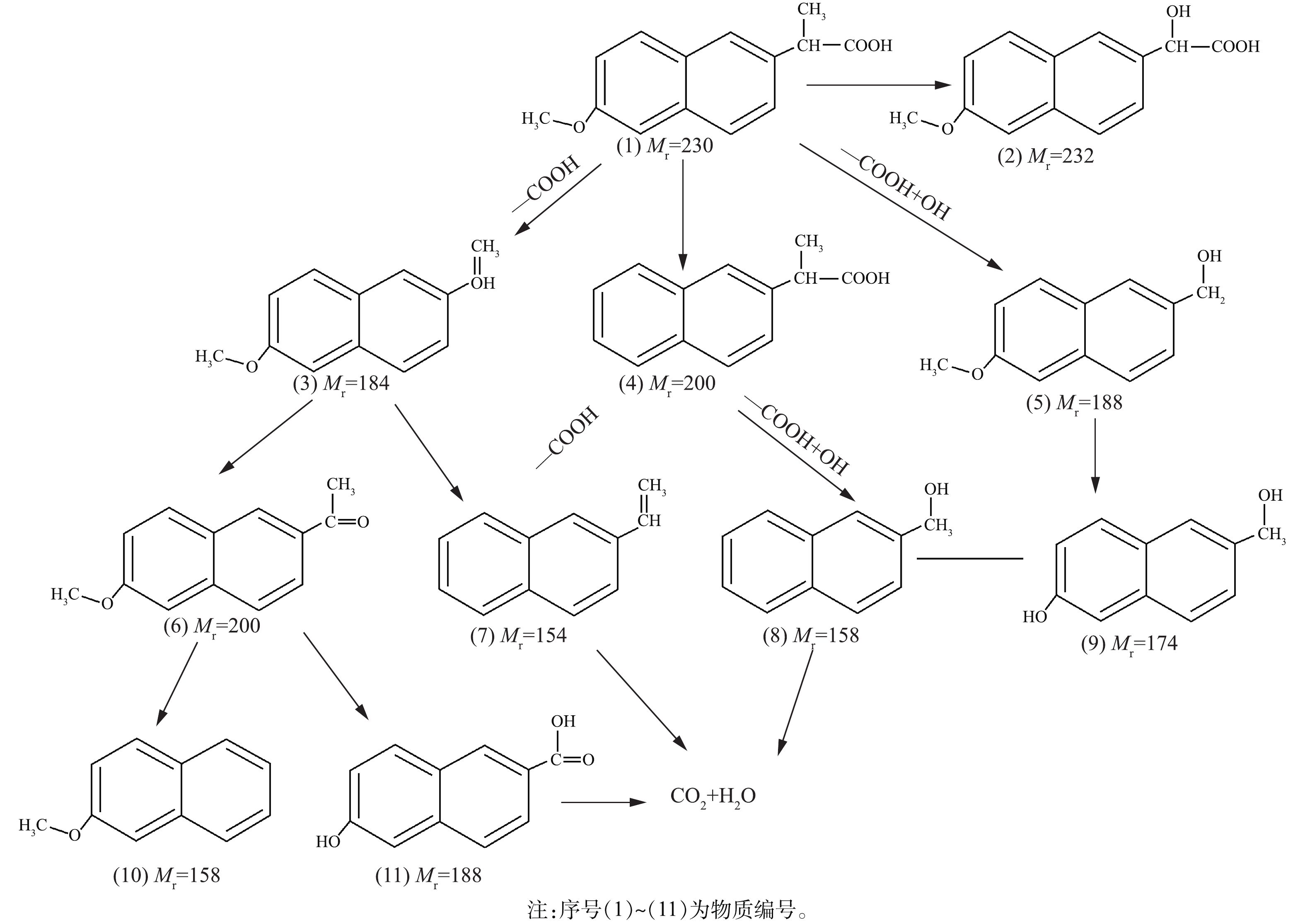
⋅O−2 的电势,因此单原子还原O2的过程很难发生,但是多个强氧化性的e−可以联合捕获吸附在催化剂表面的O2,生成⋅O−2 ,辅助降解污染物。因此,当⋅O−2 被捕获后,虽然NPX的降解被抑制,但效果不明显。使用高效液相色谱-离子阱-飞行时间质谱仪(LCMS-IT-TOF)鉴定Bi2WO6光催化降解NPX中间产物。在目前的研究[25-26]中,去甲基化和脱氢化是NPX主要降解途径,其次是夺氢和羧基化。NPX的降解途径如图8所示。
根据光催化反应过程中活性自由基分析及中间产物分析结果,可知Bi2WO6分子光催化降解NPX机理为,·OH主氧化,
⋅O−2 辅助氧化,实现NPX分子降解。在氧化作用下,NPX分子一部分发生脱羧反应[26],另一部分发生脱羧反应的同时加羟基,生成次级产物。次级产物进一步被氧化,部分C—C单键断裂,发生脱甲基反应,部分C—O直接发生断裂,生成更次一级的产物。苯环进一步被氧化,C=C、C—C被攻击断裂,生成简单的小分子,部分小分子化合物进一步矿化成CO2和H2O。
2.1. Bi2WO6表征结果
2.2. NPX初始浓度对降解效果的影响
2.3. 催化剂投加量对NPX降解效果的影响
2.4. 阴离子对降解效果的影响
2.5. pH对NPX降解效果的影响
2.6. 最优条件下体系矿化度分析
2.7. 稳定性分析
2.8. Bi2WO6降解NPX机理
-
1)所制备的Bi2WO6具有由2D纳米方片构成的3D花朵状结构,为纯正交晶系单晶结构,元素比例为Bi∶W∶O=2.28∶1∶5.79。其平均孔径与比表面积分别为10.79 nm和32.54 m2·g−1,带隙宽度为2.54 eV。
2)当NPX浓度为10 mg·L−1、Bi2WO6投加量为0.4 g·L−1,溶液pH为4.6时Bi2WO6光催化降解NPX效率最佳。光照180 min,后降解率高达99.84%,体系矿化度为67.91%,延长反应时间至360 min后,体系矿化度上升到82.14%。这表明中间产物能被有效降解,光催化技术是去除NPX甚至实现其矿化的有效途径。当反应体系中加入不同类型阴离子后,NPX的降解效果明显被抑制,抑制作用为
CO2−3 >HCO−3 ≈SO2−4 >Cl−,该结果是由不同阴离子抑制活性自由基、改变溶液pH及占据Bi2WO6活性点位引起的差异造成的。3)原位捕获实验结果表明,在Bi2WO6光催化降解NPX过程中,h+和·OH起主要氧化作用,
⋅O−2 起辅助作用。综合活性自由基解析、中间产物识别及反应体系矿化度评价结果可看出,NPX的降解机理是在活性自由基协同氧化下,NPX分子中的C—C、C—O、C=C键被攻击断裂,发生脱羧反应和羟基化反应,生成结构简单的中间产物,中间产物继续氧化分解为小分子化合物并部分矿化成CO2和H2O。











 下载:
下载: