-
厌氧氨氧化(Anammox)为在缺氧条件下,厌氧氨氧化菌利用
NO−2 -N(电子受体)将NH+4 -N(电子供体)氧化为N2,同时利用CO2进行细胞合成的过程[1-3]。相较于传统硝化-反硝化脱氮工艺,Anammox工艺具有曝气量少、不消耗有机物及污泥产率低等特点[4-5],并且已成功应用于城市污水处理厂的污泥水及与此类似的含有高浓度氨氮的工业废水[6-9]。然而厌氧氨氧化菌生长缓慢(μmax=0.065 d−1),世代周期长(11 d)[10-12],这已成为制约Anammox工艺广泛应用的主要因素,因此,如何快速启动Anammox成为突破其应用的一种有效手段。与污泥水和其他高浓度氨氮废水相比,城市污水温度低,且氨氮浓度也低,这是Anammox工艺应用于城市污水处理厂主流工艺的瓶颈。LOTTI等[13]研究发现,温度越低,Anammox菌活性越小(15 ℃下Anammox活性仅为30 ℃下的15%~42%),因此,在低温条件下,对Anammox菌进行培养时,增殖相同数量的Anammox菌则需要更长的时间。Anammox菌在常温下生长缓慢,但SCAGLIONE等[14]研究表明,Anammox菌衰减系数为0.004 8 d−1,这表明Anammox菌一旦增殖到一定数量,将长期存在并发挥作用。因此,如何在常温低基质浓度下快速富集Anammox菌是Anammox工艺处理低浓度氨氮废水的关键。
本研究采用某城市污水处理厂A2/O系统中缺氧池填料作为MBBR的载体,在常温(13~37 ℃)和低浓度含氮废水条件下,直接进行启动,对Anammox菌进行富集培养,探讨启动策略及Anammox菌的富集情况,为MBBR在常温下处理低浓度含氮废水提供了参考。
-
MBBR有效容积为5 L,水力停留时间(hydraulic retention time, HRT)为6~24 h,温度为13~37 ℃。反应器以序批式模式运行,进出水及搅拌均由PLC系统控制,周期为3~8 h,进出水时间均为10 min。反应器运行期间,采用人工配水,其成分为
NH+4 -N 0.050~0.26 g·L−1,NO−2 -N 0.066~0.264 g·L−1,KHCO3 0.5 g·L−1,KH2PO4 0.5 g·L−1,CaCl2·2H2O 0.18 g·L−1,MgSO4·7H2O 0.10 g·L−1,微量元素[15]为1 mL·L−1。接种填料取自某城市污水处理厂A2/O系统中缺氧池填料,填料型号为K3(500 m2·m−3),填充率为29%。 -
NH+4 -N、NO−2 -N和NO−3 -N的测定参照文献推荐的标准分析方法[16]。NH+4 -N的测定采用纳氏试剂分光光度法,NO−2 -N的测定采用N-(1-萘基)-乙二胺分光光度法,NO−3 -N的测定采用紫外分光光度法。pH由在线式pH计(Inpro 4010,梅特勒)测定。溶解氧(DO)由在线式溶氧仪(Inpro 6050,梅特勒)测定。 -
Anammox菌活性测定方法如下:从反应器中取出若干填料,用无氧水淘洗2~3次后,置于600 mL的反应瓶中,同时加入30 mg·L−1
NH+4 -N、40 mg·L−1NO−2 -N及微量元素,然后通入氮气5 min,使DO降低至0.05 mg·L−1以下,最后加入KHCO3(0.5 g·L−1)。在测定过程中,反应瓶置于恒温摇床上以保证基质混合均匀,温度设定为35 ℃,定期从反应瓶中取出水样,通过分析水样中的NH+4 -N和NO−2 -N浓度变化,计算Anammox菌活性。 -
厌氧氨氧化菌的荧光原位杂交参照AMANN等[17]描述的标准方法进行。杂交后的污泥样品通过激光共聚焦显微镜(TSC SP8,莱卡)进行观察,并在100倍物镜下采集图像。实验所用探针如表1所示。
-
增殖系数a为在基质充足且生长环境理想的条件下,单位质量的微生物在单位时间内增加的细胞量,计算方法见式(1)。对式(1)进行积分得到式(2),对式(2)进行变形,得到式(3)。
式中:a为增殖系数,d−1;X为Anammox菌污泥浓度,g·m−2;i为富集培养时间,d;Xi为富集培养i天污泥浓度,g·m−2;X0为起始污泥浓度,g·m−2。
由于本实验中MBBR为混合体系,在对Anammox菌的富集培养过程中,硝化菌等微生物也可能存在于填料上,这使得采用污泥浓度确定增殖系数时存在较大误差。为准确表征Anammox菌的污泥浓度,可根据活性估算Anammox污泥浓度(式(4)),最终通过污泥浓度变化确定Anammox菌的增殖系数。
式中:LSAA为Anammox活性,mg·(m2·d)−1;qmax为Anammox最大活性,取值667 mg·(g·d)−1。
-
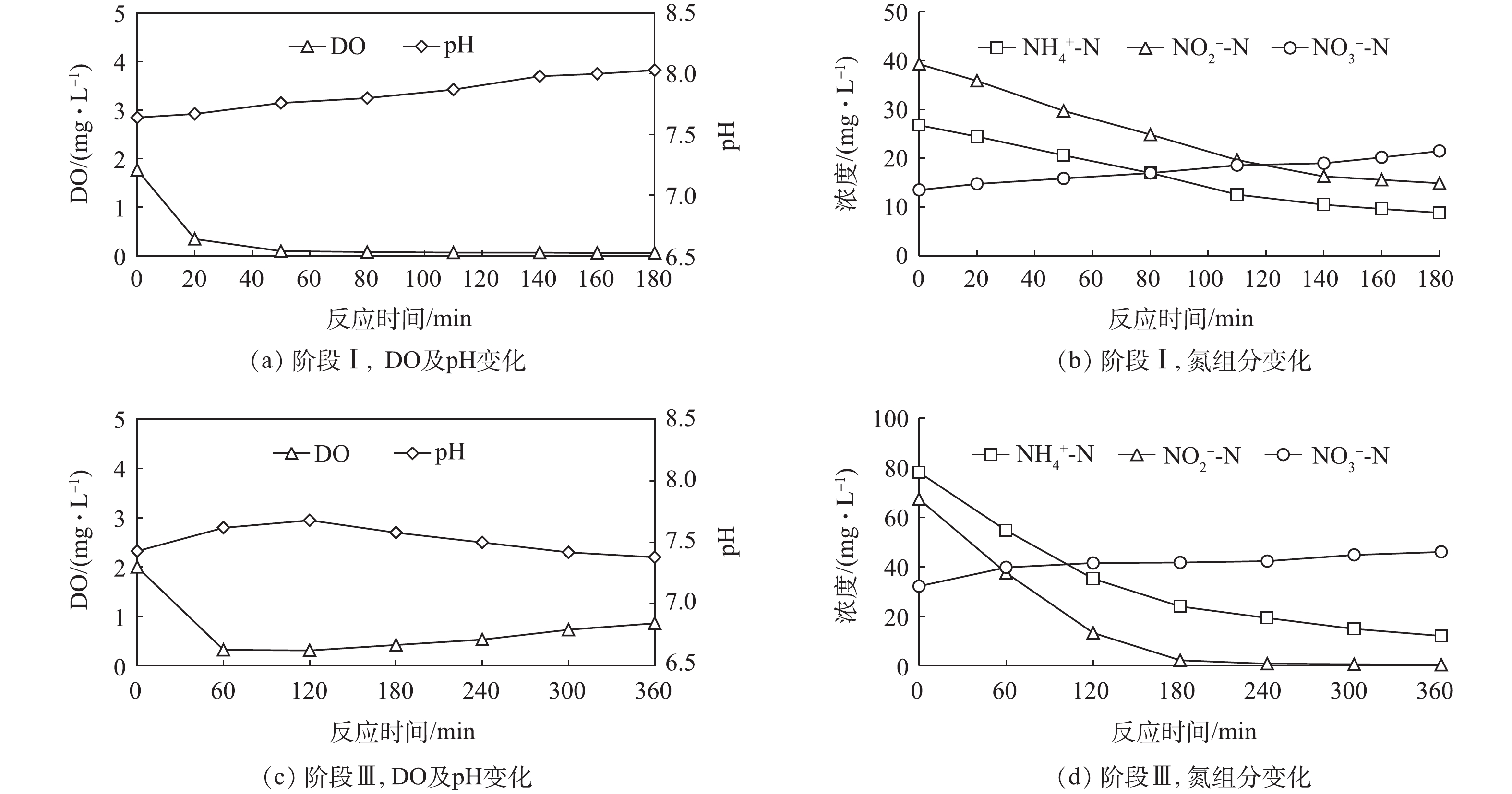
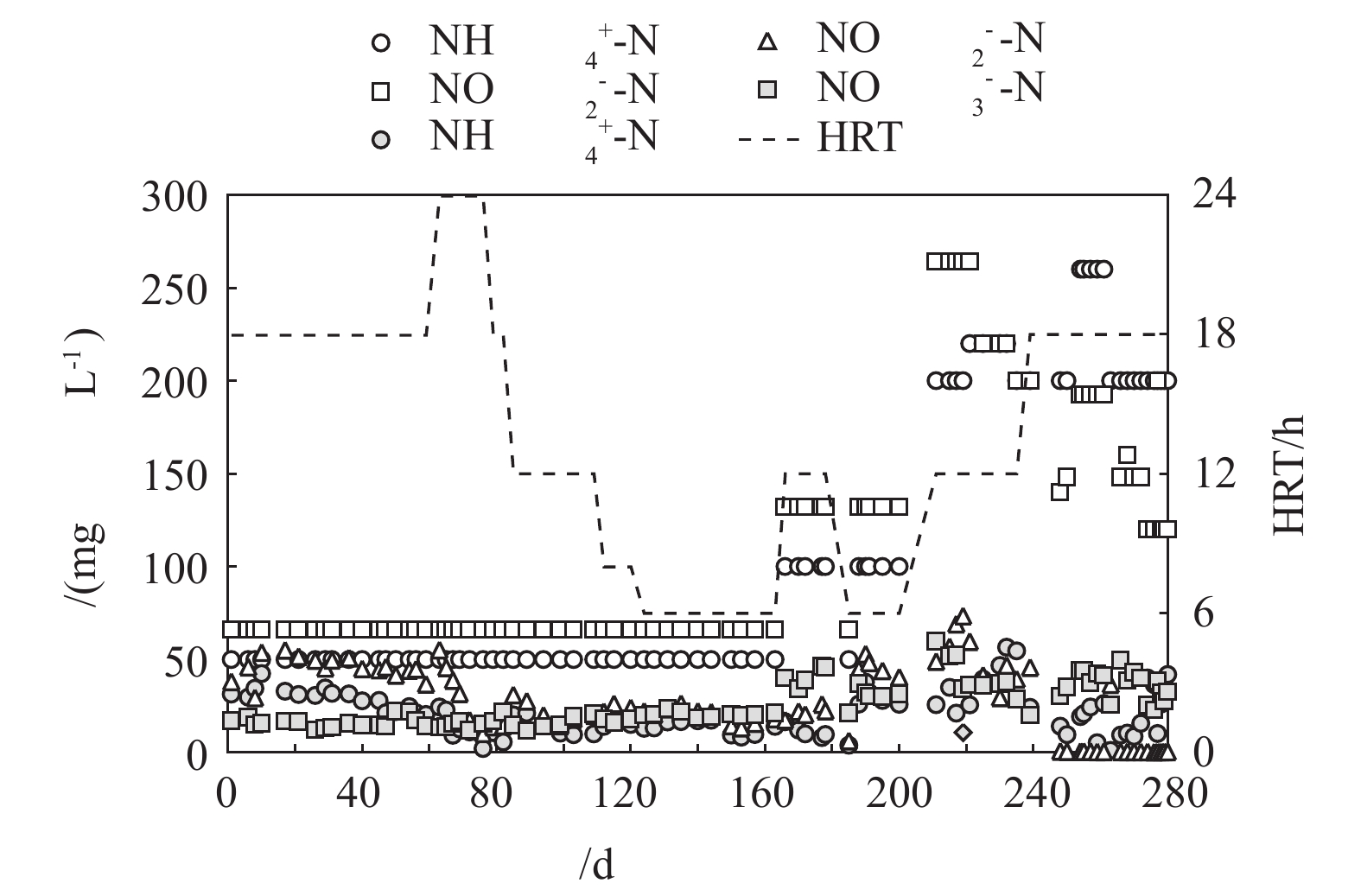
MBBR启动后,通过逐步缩短HRT和提高进水基质浓度的方法提升反应器负荷。图1反映了启动阶段至稳定运行阶段的运行效果。根据反应器进水
NO−2 -N与NH+4 -N比值关系,可将整个过程分为3个阶段,分别为NO−2 -N/NH+4 -N=1.32(0~200 d)、NO−2 -N/NH+4 -N=1~1.32(200~248 d)和NO−2 -N/NH+4 -N=0.74(248~280 d)。在阶段Ⅰ中(0~200 d),MBBR温度为13~28 ℃。为保证启动阶段Anammox菌以最大速率增殖,出水
NH+4 -N与NO−2 -N浓度控制在10 mg·L−1以上,避免因基质不足而出现Anammox菌生长受限。此阶段中,反应器最大处理负荷达到4 590.75 mg·(m2·d)−1,ΔNO−2 -N/ΔNH+4 -N为1.20,ΔNO−3 -N/ΔNH+4 -N为0.43。在阶段Ⅱ中(200~248 d),MBBR温度为28~37 ℃。由于出水
NO−2 -N浓度持续升高,进水NO−2 -N与NH+4 -N比值从1.32逐步降低至1,反应器处理负荷维持在4 748.29~6 206.85 mg·(m2·d)−1,ΔNO−2 -N/ΔNH+4 -N为1.11,ΔNO−3 -N/ΔNH+4 -N为0.26。在阶段Ⅲ中(248~280 d),MBBR温度为31~35 ℃。HRT设定为18 h,进水
NO−2 -N与NH+4 -N比值为0.74,通过反应器内AOB氧化NH+4 -N为Anammox菌来提供NO−2 -N。在此阶段中,反应器处理负荷稳定在4 351.05 ~6 923.87 mg·(m2·d)−1,出水NH+4 -N和NO−2 -N分别维持在25 mg·L−1和1 mg·L−1以下,TN去除率为84.93%,ΔNO−2 -N/ΔNH+4 -N为0.81,ΔNO−3 -N/ΔNH+4 -N为0.18。 -
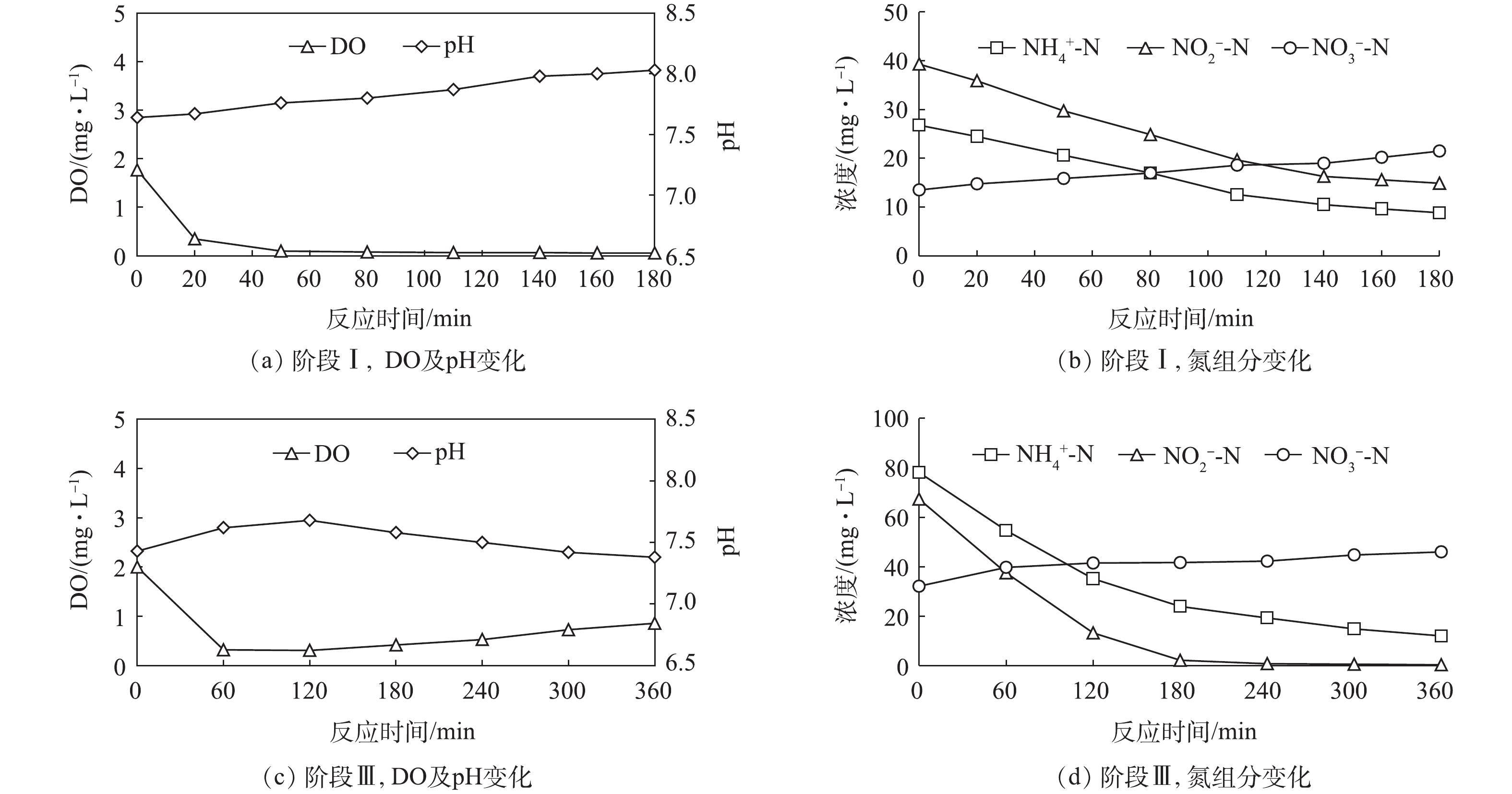
图2反映了典型周期内DO、pH和氮组分变化情况(阶段Ⅰ和阶段Ⅲ)。MBBR采用一次性进水,进水以自来水配置且反应器不做密封处理,在进水结束后,DO浓度会达到2 mg·L−1左右,随着反应的进行,DO在1 h后降至0.1 mg·L−1以下并维持不变。周期内基质浓度线性关系良好,Anammox活性并未因DO的存在而受到影响,这主要是由于填料上形成了好氧菌在外,Anammox菌在内的空间结构。
在阶段Ⅰ中,为避免Anammox菌受基质限制,出水
NH+4 -N与NO−2 -N浓度控制在10 mg·L−1以上,保证Anammox菌以最大速率进行增殖。图2(a)为DO及pH的变化情况,由于厌氧氨氧化反应产生的N2释出会带走溶液中的CO2,这使得HCO−3 加速反应生成CO2,pH不断上升。图2(b)为氮组分的变化情况。可以看出:当基质浓度为10 mg·L−1以上时,单位时间内基质浓度变化量较大;当基质浓度低于10 mg·L−1时,单位时间内基质浓度变化量较小。这说明Anammox菌的基质利用速率降低,造成这一现象的主要原因是基质浓度降低而使得扩散速率减小。在阶段Ⅲ中,进水
NO−2 -N和NH+4 -N比值为0.74,以期通过系统内AOB氧化NH+4 -N来为厌氧氨氧化过程提供NO−2 -N,从而在低浓度NO−2 -N进水条件下实现稳定脱氮。由图2(d)可以看出,在180 min后,NO−2 -N浓度已降至5 mg·L−1以下,此时Anammox菌基质利用速率减小,硝化过程开始占据主导,NH+4 -N浓度持续降低。虽然NH+4 -N浓度持续降低,但NO−3 -N增加量小于NH+4 -N减少量,这是因为发生了同步亚硝化厌氧氨氧化过程。NH+4 -N被AOB氧化为NO−2 -N后,Anammox菌很快利用其进行厌氧氨氧化反应,由于Anammox活性远大于NOB,NOB不具备竞争优势,NO−2 -N也就未被进一步氧化。由图2(c)中可以看出:阶段Ⅲ中的DO和pH变化和阶段Ⅰ存在差异,这是由于进水NH+4 -N和NO−2 -N比值不同引起的;阶段Ⅰ中,厌氧氨氧化反应始终进行且占据主导,反应过程中始终产生N2,表面复氧速率较低,DO浓度可维持在较低状态,pH也因CO2的持续释出而不断升高;阶段Ⅲ中,当NO−2 -N浓度较低时,硝化反应开始占据主导,尤其是NH+4 -N氧化为NO−2 -N这一过程。厌氧氨氧化反应的减弱使得表面复氧速率增大,且表面复氧速率大于硝化菌耗氧速率,因而DO浓度上升,pH也因为CO2释出量的减少和硝化反应的进行逐渐降低。 -
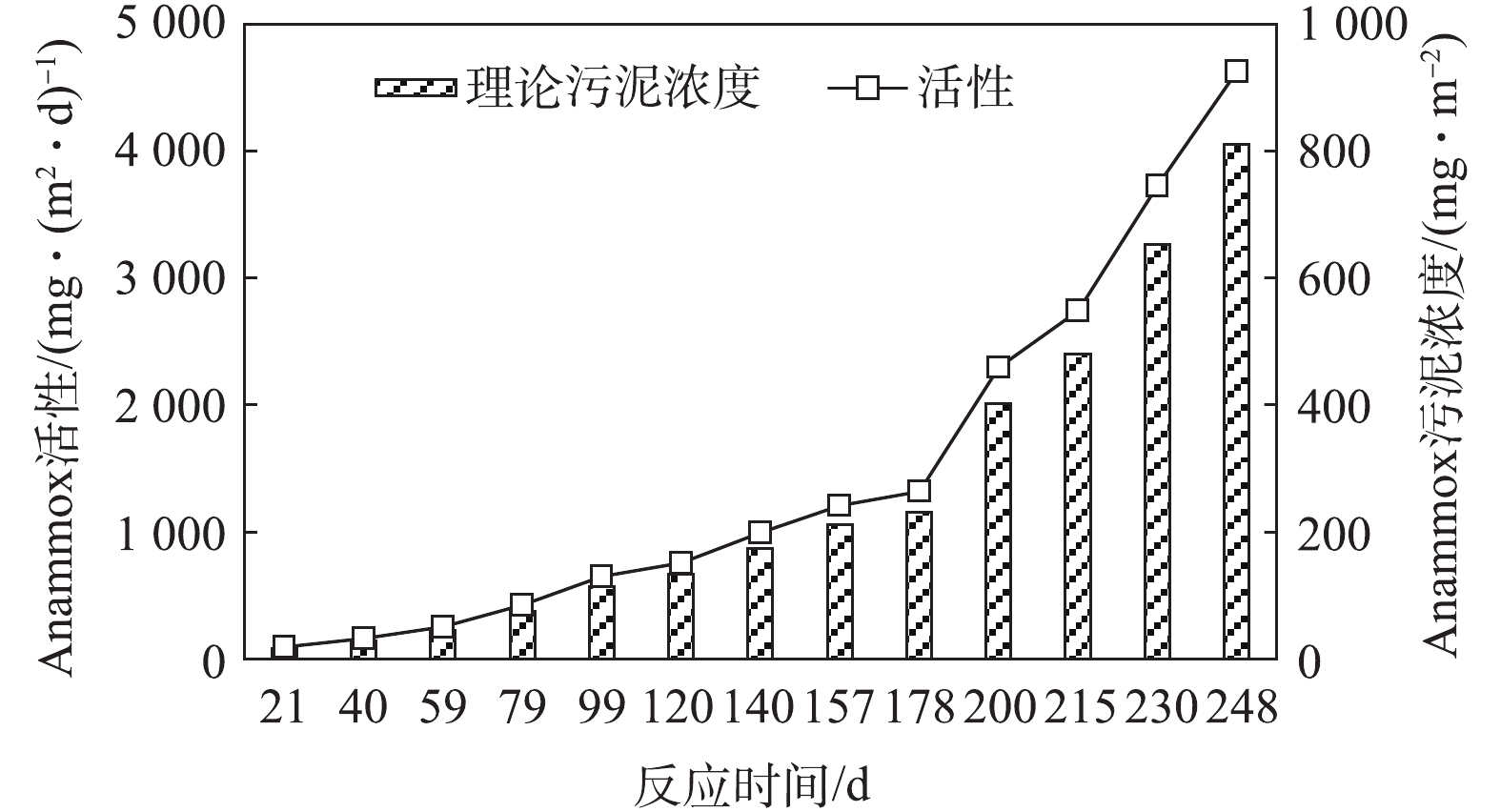
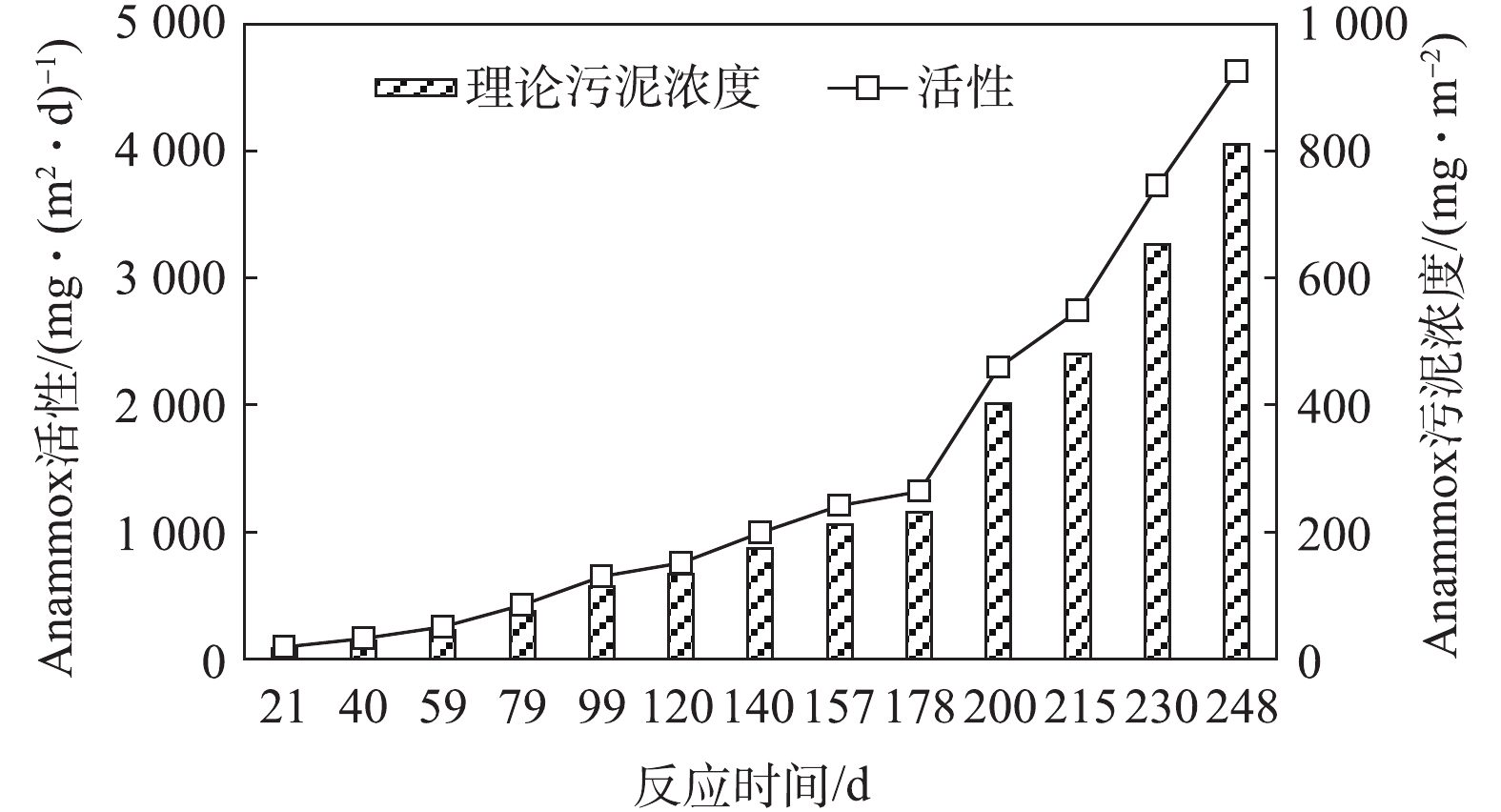
通过测定基质利用速率可得到Anammox菌活性,根据活性数据可计算得出Anammox污泥浓度,利用污泥浓度变化可确定培养过程中Anammox菌的增殖系数。从活性及污泥浓度结果(图3)可知,培养进行21 d时,Anammox活性为95.31 mg·(m2·d)−1(Anammox污泥浓度为16.69 mg·m−2),随着富集的进行,Anammox活性逐渐升高,在培养进行248 d时,Anammox活性达到4 627.25 mg·(m2·d)−1,Anammox污泥浓度为809.60 mg·m−2。
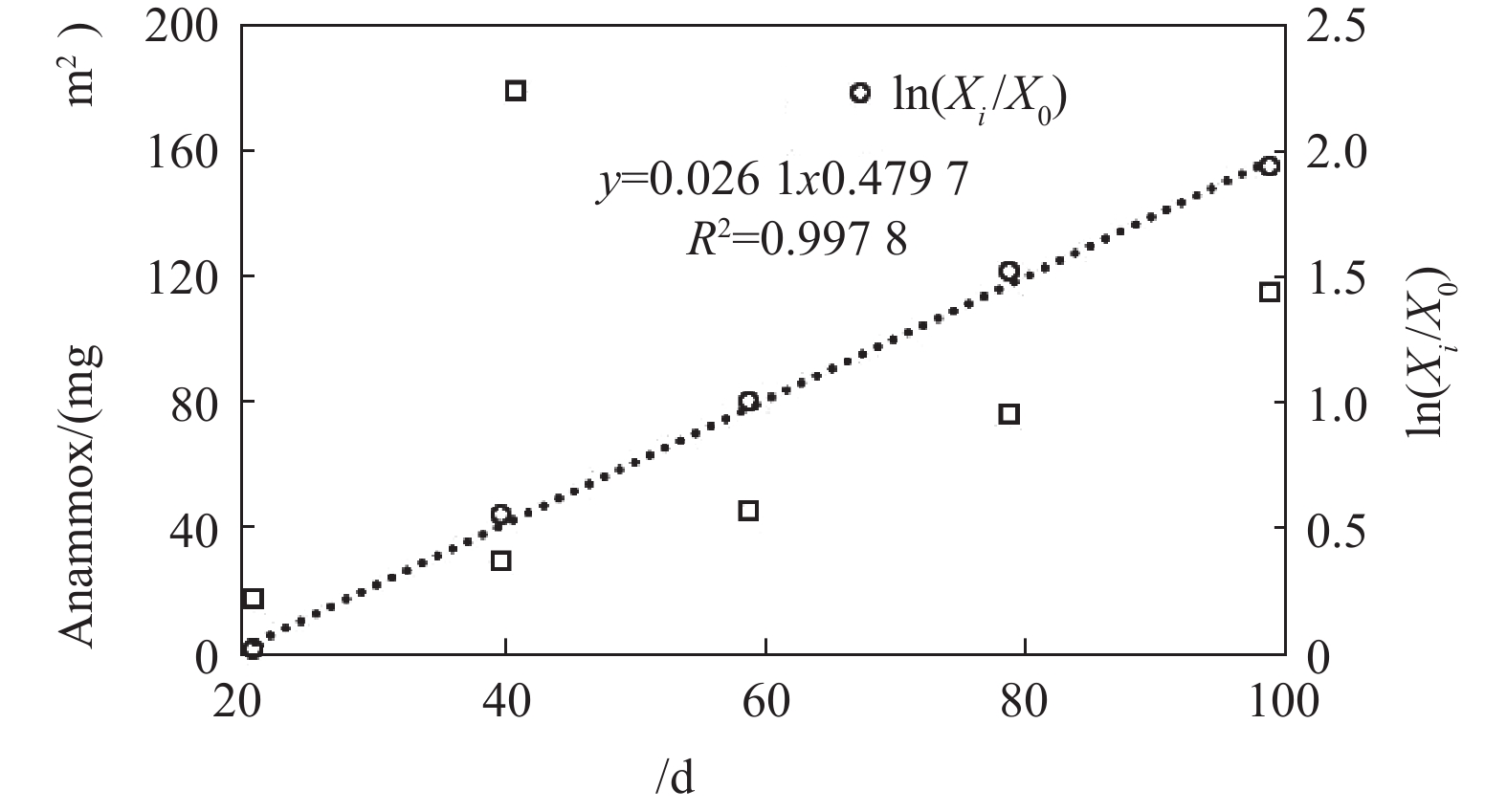
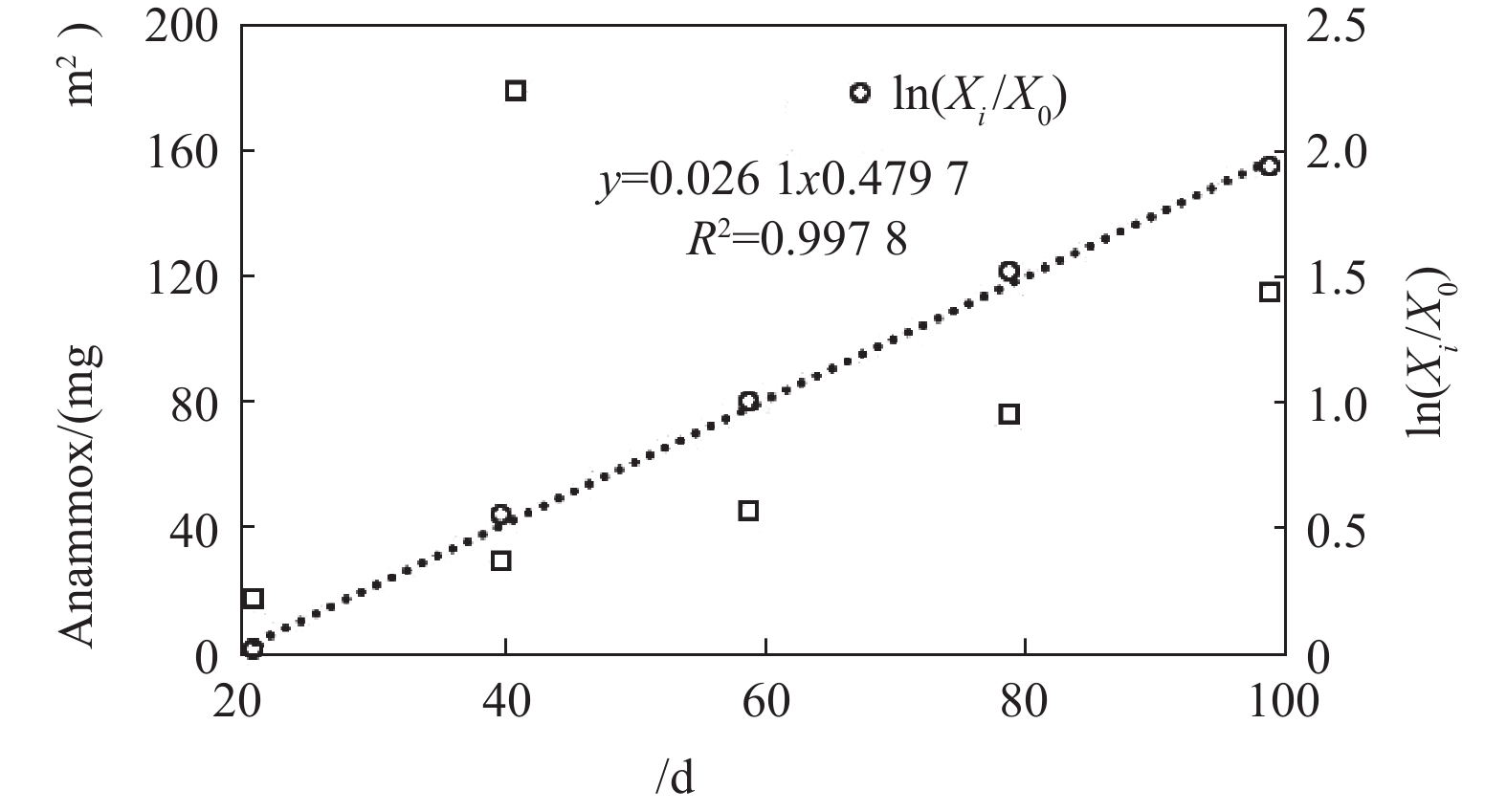
为确定培养过程Anammox菌的增殖系数,须保证实验过程中Anammox菌以最大速率进行增殖,而随着培养过程中生物膜厚度的不断增加,部分Anammox菌由于基质扩散受限,难以最大速率进行增殖,这使得培养后期Anammox菌的增殖速率减小。因此,为确保所得Anammox菌增殖系数准确,仅采用21~99 d培养阶段的污泥浓度进行计算,结果见图4。本实验中Anammox菌增殖系数为0.026 1 d−1,此数值小于理论值0.065 d−1(35 ℃条件下),这表明Anammox菌实际增长速率小于理论值。LOTTI等[13]研究显示,15 ℃下Anammox活性仅为30 ℃下的15%~42%,由于本实验在常温下进行,Anammox活性较小,这是造成本实验所得Anammox菌增殖系数小于理论值的主要原因。除温度影响[21-22]外,DO的存在也会对Anammox菌的增殖产生影响[23-24]。
-
除Anammox活性增加外,填料上生物膜在启动前后也发生明显变化,结果见图5。反应器启动初期,生物膜呈现黑灰色,这是因为Anammox菌数量较少而其他微生物及杂质较多;当反应器启动248 d时,随着Anammox菌数量的增加,生物膜表现出明显的红棕色,这表明Anammox菌成功富集。
MBBR启动成功后,填料上的微生物通过荧光原位杂交技术进行测定。由杂交结果(图5)可知,经过248 d启动,生物膜上的微生物以Anammox菌为主,其大部分以聚集体的形式存在,Anammox菌表现出较强的荧光信号,这表明Anammox菌状态良好。利用Image-pro plus软件对Anammox菌占比进行计算,结果显示,Anammox菌所占份额较大,为总微生物量的78.34%,Anammox菌此时已成为优势菌种。
-
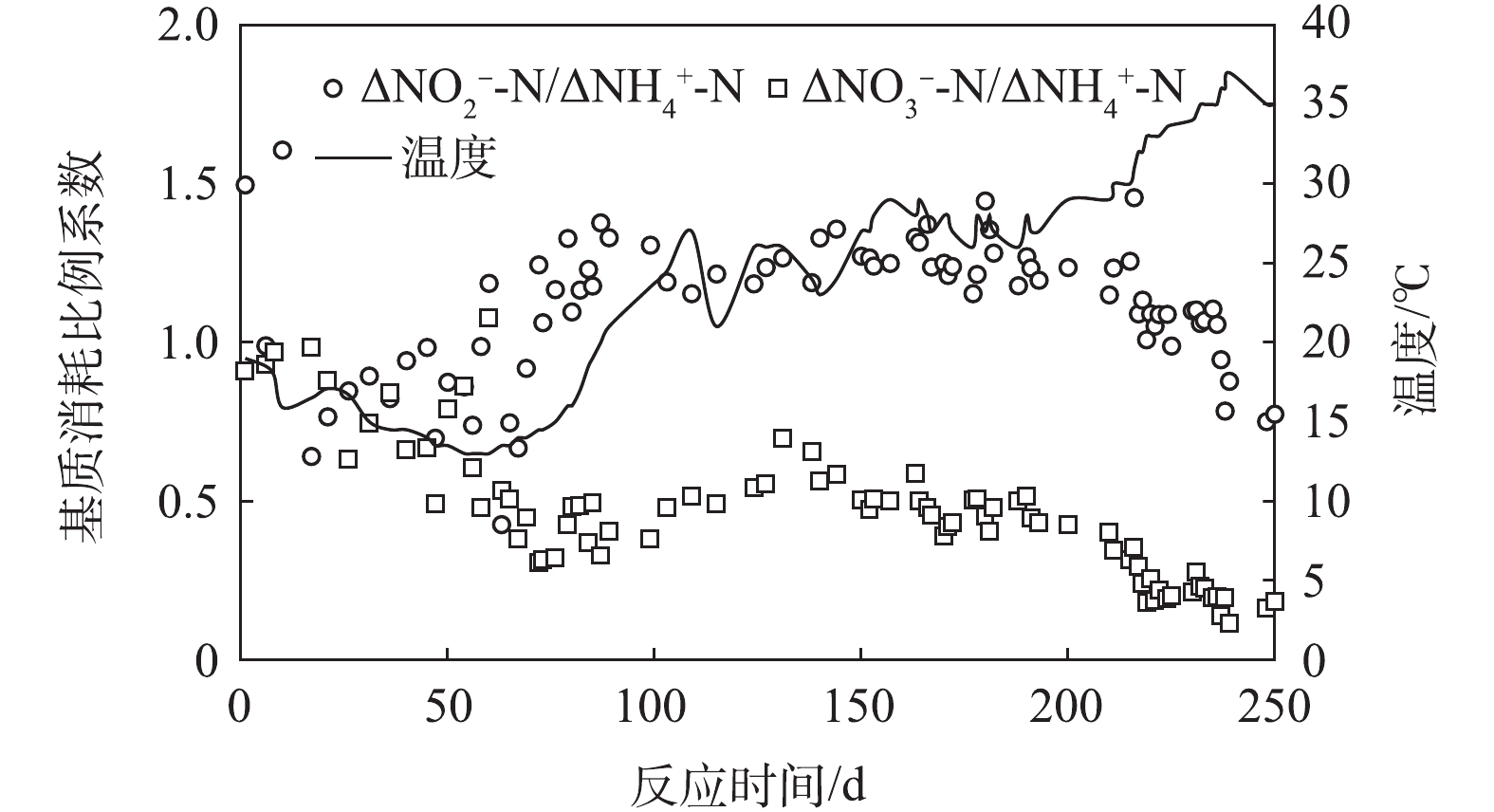
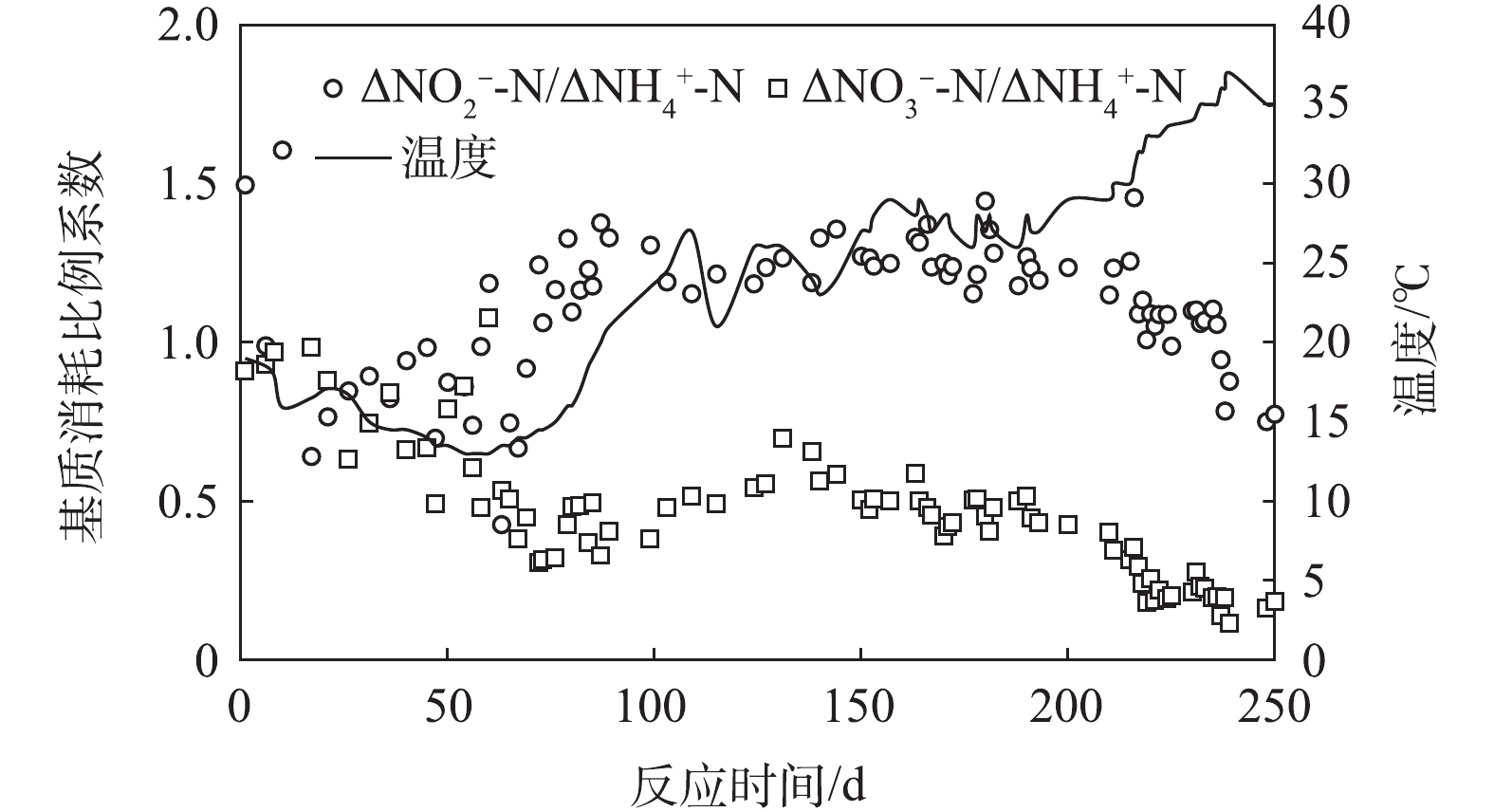
目前,研究者普遍接受的Anammox反应化学计量关系[25]如式(5)所示,
ΔNO−2 -N/ΔNH+4 -N为1.32,ΔNO−3 -N/ΔNH+4 -N为0.26。当系统中存在除Anammox菌之外的微生物时,由于其他微生物代谢的进行,基质消耗与生成比值关系会发生变化,这是部分研究结果和理论值存在偏差的主要原因。本研究中温度与基质消耗和生成比值变化如图6所示,0~80 d时,NH+4 -N与NO−2 -N的消耗量比值小于1而NO−3 -N的生成量与NH+4 -N消耗量比值大于0.5,这是因为此阶段中Anammox活性较小,大部分NH+4 -N和NO−2 -N被硝化菌氧化。启动80~220 d时,NH+4 -N与NO−2 -N的消耗量和NO−3 -N的生成量的比值趋于稳定,此时Anammox菌在系统内占据主导,NH+4 -N和NO−2 -N主要被Anammox菌消耗。启动220~248 d时,NH+4 -N与NO−2 -N的消耗量和NO−3 -N的生成量的比值均不同程度降低,这是由于温度升高所致。温度升高使得硝化菌活性增大(尤其是AOB菌),NH+4 -N氧化为NO−2 -N的速率加快,这使得NO−2 -N在系统中积累。FNA浓度由于NO−2 -N浓度的升高而增加,Anammox活性因此降低,这使得基质消耗和生成量的比值关系发生变化。综上,NH+4 -N与NO−2 -N的消耗量和NO−3 -N的生成量的比值关系和反应器内各微生物活性及反应器运行条件及方式有关。 -
1)经过248 d的富集培养,MBBR处理负荷达到5 046.57 mg·(m2·d)−1,Anammox活性达到4 627.25 mg·(m2·d)−1。
2)当进水
NO−2 -N与NH+4 -N比值分别为1.32、1~1.32和0.74时,NH+4 -N与NO−2 -N的消耗量和NO−3 -N的生成量之间的比值关系依次为1∶1.20∶0.43、1∶1.11∶0.26和1∶0.81∶0.18,反应器基质消耗与生成的比值关系和系统内各微生物活性及反应器运行条件及方式有关。3)常温下对Anammox菌进行富集培养时,Anammox菌增殖系数为0.026 1 d−1。
4)常温下MBBR反应器中成功启动厌氧氨氧化,对Anammox工艺处理低浓度含氮废水提供了参考。
常温MBBR处理低浓度含氮废水的快速启动及运行状况
Rapid start-up and running of MBBR treating low nitrogen concentration wastewater at room temperature
-
摘要: 为探讨厌氧氨氧化MBBR的快速启动及处理低浓度含氮废水特性,采用某城市污水处理厂A2/O系统中缺氧池填料作为MBBR的载体直接启动并运行。结果表明,经过248 d启动,MBBR处理负荷(以N计)达到5 046.57 mg·(m2·d)−1,Anammox活性(以NH
+4 -N计)达到4 627.25 mg·(m2·d)−1;NH+4 -N与NO−2 -N的消耗量和NO−3 -N的生成量之间的比值关系和反应器内各微生物活性及反应器运行条件及方式有关。采用基质利用速率测定方法对Anammox活性进行测定,探讨Anammox菌在常温条件下的增殖情况,确定Anammox菌增殖系数为0.026 1 d−1。Anammox菌MBBR的成功启动为Anammox技术处理低浓度含氮废水提供了参考。Abstract: In order to investigate the rapid start-up of anammox process in MBBR and the treatment of low nitrogen concentration wastewater, the fillers from an anoxic tank of A2/O system in a municipal wastewater treatment plant was taken as MBBR carrier for direct start-up and running. The result showed that after 248 days start-up, the treating loading of MBBR as nitrogen could reach 5 046.57 mg·(m2·d)−1, and anammox activity asNH+4 -N could reach 4 627.25 mg·(m2·d)−1. The ratios ofNH+4 -N andNO−2 -N consumption toNO−3 -N production were related to the activity of microorganisms in MBBR and its running conditions and modes. A test for the substrate utilization rate was used to determine the anammox activity and study the proliferation of at room temperature. The corresponding proliferation coefficient of anammox bacteria was 0.026 1 d−1. The successful start-up of the anammox MBBR provides a reference for low nitrogen concentration wastewater treatment by anammox tecnology. -
厌氧氧氨氧化(Anammox)为在缺氧条件下,厌氧氨氧化菌利用
NO−2 -N(电子受体)将NH+4 -N(电子供体)氧化为N2,同时利用CO2进行细胞合成[1-3]。相较于传统硝化-反硝化脱氮工艺,Anammox工艺具有曝气量少、不消耗有机物及污泥产率低等特点[4-5],并且已成功应用于城市污水处理厂的污泥水及与此类似的含有高浓度氨氮的工业废水[6-9]。然而厌氧氨氧化菌生长缓慢(μmax=0.065 d−1),世代周期长(11 d)[10-12],这已成为制约Anammox工艺广泛应用的主要因素,因此,如何快速启动Anammox成为突破其应用的一种有效手段。与污泥水和其他高浓度氨氮废水相比,城市污水温度低,且氨氮浓度也低,这是Anammox工艺应用于城市污水处理厂主流工艺的瓶颈。LOTTI等[13]研究发现,温度越低,Anammox菌活性越小(15 ℃下Anammox活性仅为30 ℃下的15%~42%),因此,在低温条件下,对Anammox菌进行培养时,增殖相同数量的Anammox菌则需要更长的时间。Anammox菌在常温下生长缓慢,但SCAGLIONE等[14]研究表明,Anammox菌衰减系数为0.004 8 d−1,这表明Anammox菌一旦增殖到一定数量,将长期存在并发挥作用。因此,如何在常温低基质浓度下快速富集Anammox菌是Anammox工艺处理低浓度氨氮废水的关键。
本研究采用某城市污水处理厂A2/O系统中缺氧池填料作为MBBR的载体,在常温(13~37 ℃)和低浓度含氮废水条件下,直接进行启动,对Anammox菌进行富集培养,探讨启动策略及Anammox菌的富集情况,为MBBR在常温下处理低浓度含氮废水提供了参考。
1. 材料与方法
1.1 MBBR运行及接种填料
MBBR有效容积为5 L,水力停留时间(hydraulic retention time, HRT)为6 ~24 h,温度为13~37 ℃。反应器以序批式模式运行,进出水及搅拌均由PLC系统控制,周期为3~8 h,进出水时间均为10 min。反应器运行期间,采用人工配水,其成分为
NH+4 -N 0.050~0.26 g·L−1,NO−2 -N 0.066~0.264 g·L−1,KHCO3 0.5 g·L−1,KH2PO4 0.5 g·L−1,CaCl2·2H2O 0.18 g·L−1,MgSO4·7H2O 0.10 g·L−1,微量元素[15]为1 mL·L−1。接种填料取自某城市污水处理厂A2/O系统中缺氧池填料,填料型号为K3(500 m2·(m3)−1),填充率为29%。1.2 水质指标测定
NH+4 -N、NO−2 -N和NO−3 -N的测定参照文献推荐的标准分析方法[16]。NH+4 -N的测定采用纳氏试剂分光光度法,NO−2 -N的测定采用N-(1-萘基)-乙二胺分光光度法,NO−3 -N的测定采用紫外分光光度法。pH由在线式pH计(Inpro 4010,梅特勒)测定。溶解氧(DO)由在线式溶氧仪(Inpro 6050,梅特勒)测定。1.3 活性的测定
Anammox菌活性测定方法如下:从反应器中取出若干填料,用无氧水淘洗2~3次后,置于600 mL的反应瓶中,同时加入30 mg·L−1
NH+4 -N、40 mg·L−1NO−2 -N及微量元素,然后通入氮气5 min,使DO降低至0.05 g·L−1以下,最后加入KHCO3(0.5 g·L−1)。在测定过程中,反应瓶置于恒温摇床上以保证基质混合均匀,温度设定为35 ℃,定期从反应瓶中取出水样,通过分析水样中的NH+4 -N和NO−2 -N浓度变化,计算Anammox菌活性。1.4 荧光原位杂交
厌氧氨氧化菌的荧光原位杂交参照AMANN等[17]描述的标准方法进行。杂交后的污泥样品通过激光共聚焦显微镜(TSC SP8,莱卡)进行观察,并在100倍物镜下采集图像。实验所用探针如表1所示。
表 1 荧光原位杂交所用探针Table 1. Probes used in FISH1.5 增殖系数计算
增殖系数a为在基质充足且生长环境理想的条件下,单位质量的微生物在单位时间内增加的细胞量,计算方法见式(1)。对式(1)进行积分得到式(2),对式(2)进行变形,得到式(3)。
a=1X⋅dXdi (1) Xi=X0eai (2) lnXiX0=ai (3) 式中:a为增殖系数,d−1;X为Anammox菌污泥浓度,g·m−2;i为富集培养时间,d;Xi为富集培养i天污泥浓度,g·m−2;X0为起始污泥浓度,g·m−2。
由于本实验中MBBR为混合体系,在对Anammox菌的富集培养过程中,硝化菌等微生物也可能存在于填料上,这使得采用污泥浓度确定增殖系数时存在较大误差。为准确表征Anammox菌的污泥浓度,可根据活性估算Anammox污泥浓度(见式(4)),最终通过污泥浓度变化确定Anammox菌的增殖系数。
X=LSAAqmax (4) 式中:LSAA为Anammox活性,mg·(m2·d)−1;qmax为Anammox最大活性,取值667 mg·(g·d)−1。
2. 结果与讨论
2.1 MBBR运行情况
MBBR启动后,通过逐步缩短HRT和提高进水基质浓度的方法提升反应器负荷。图1反映了启动阶段至稳定运行阶段的运行效果。根据反应器进水
NO−2 -N与NH+4 -N比值关系,可将整个过程分为3个阶段,分别为NO−2 -N/NH+4 -N=1.32(0~200 d)、NO−2 -N/NH+4 -N=1~1.32(200~248 d)和NO−2 -N/NH+4 -N=0.74(248~280 d)。在阶段I中(0~200 d),MBBR温度为13~28 ℃。为保证启动阶段Anammox菌以最大速率增殖,出水
NH+4 -N与NO−2 -N浓度控制在10 mg·L−1以上,避免因基质不足而出现Anammox菌生长受限。此阶段中,反应器最大处理负荷达到4 590.75 mg·(m2·d)−1,△NO−2 -N/△NH+4 -N为1.20,△NO−3 -N/△NH+4 -N为0.43。在阶段II中(200~248 d),MBBR温度为28~37 ℃。由于出水
NO−2 -N浓度持续升高,进水NO−2 -N与NH+4 -N比值从1.32逐步降低至1,反应器处理负荷维持在4 748.29~6 206.85 mg·(m2·d)−1,△NO−2 -N/△NH+4 -N为1.11,△NO−3 -N/△NH+4 -N为0.26。在阶段III中(248~280 d),MBBR温度为31~35 ℃。HRT设定为18 h,进水
NO−2 -N与NH+4 -N比值为0.74,通过反应器内AOB氧化NH+4 -N为Anammox菌来提供NO−2 -N。在此阶段中,反应器处理负荷稳定在4 351.05 ~6 923.87 mg·(m2·d)−1,出水NH+4 -N和NO−2 -N分别维持在25 mg·L−1和1 mg·L−1以下,TN去除率为84.93%,△NO−2 -N/△NH+4 -N为0.81,△NO−3 -N/△NH+4 -N为0.18。2.2 典型周期基质浓度及pH变化
图2反映了典型周期内DO、pH和氮组分变化情况(阶段I和阶段3)。MBBR采用一次性进水,进水以自来水配置且反应器不做密封处理,在进水结束后,DO浓度会达到2 mg·L−1左右,随着反应的进行,DO在1 h后降至0.1 mg·L−1以下并维持不变。周期内基质浓度线性关系良好,Anammox活性并未因DO的存在而受到影响,这主要是由于填料上形成了好氧菌在外,Anammox菌在内的空间结构。
在阶段I中,为避免Anammox菌受基质限制,出水
NH+4 -N与NO−2 -N浓度控制在10 mg·L−1以上,保证Anammox菌以最大速率进行增殖。图2(a)为DO及pH的变化情况,由于厌氧氨氧化反应产生的N2释出会带走溶液中的CO2,这使得HCO−3 加速反应生成CO2,pH不断上升。图2(b)为氮组分的变化情况。可以看出:当基质浓度为10 mg·L−1以上时,dc/dt值较大;当基质浓度低于10 mg·L−1时,dc/dt值较小。这说明Anammox菌的基质利用速率降低,造成这一现象的主要原因是基质浓度降低而使得扩散速率减小。在阶段III中,进水
NO−2 -N和NH+4 -N比值为0.74,以期通过系统内AOB氧化NH+4 -N来为厌氧氨氧化过程提供NO−2 -N,从而在低浓度NO−2 -N进水条件下实现稳定脱氮。由图2(d)可以看出,在180 min后,NO−2 -N浓度已降至5 mg·L−1以下,此时Anammox菌基质利用速率减小,硝化过程开始占据主导,NH+4 -N浓度持续降低。虽然NH+4 -N浓度持续降低,但NO−3 -N增加量小于NH+4 -N减少量,这是因为发生了同步亚硝化厌氧氨氧化过程。NH+4 -N被AOB氧化为NO−2 -N后,Anammox菌很快利用其进行厌氧氨氧化反应,由于Anammox活性远大于NOB,NOB不具备竞争优势,NO−2 -N也就未被进一步氧化。由图2(c)中可以看出:阶段III中的DO和pH变化和阶段I存在差异,这是由于进水NH+4 -N和NO−2 -N比值不同引起的;阶段I中,厌氧氨氧化反应始终进行且占据主导,反应过程中始终产生N2,表面复氧速率较低,DO浓度可维持在较低状态,pH也因CO2的持续释出而不断升高;阶段III中,当NO−2 -N浓度较低时,硝化反应开始占据主导,尤其是NH+4 -N氧化为NO−2 -N这一过程。厌氧氨氧化反应的减弱使得表面复氧速率增大,且表面复氧速率大于硝化菌耗氧速率,因而DO浓度上升,pH也因为CO2释出量的减少和硝化反应的进行逐渐降低。2.3 活性及增殖系数的计算
通过测定基质利用速率可得到Anammox菌活性,根据活性数据可计算得出Anammox污泥浓度,利用污泥浓度变化可确定培养过程中Anammox菌的增殖系数。从活性及污泥浓度结果(见图3)可知,培养进行21 d时,Anammox活性为95.31 mg·(m2·d)−1(Anammox污泥浓度为16.69 mg·m−2),随着富集的进行,Anammox活性逐渐升高,在培养进行248 d时,Anammox活性达到4 627.25 mg·(m2·d)−1(Anammox污泥浓度为809.60 mg·m−2。
为确定培养过程Anammox菌的增殖系数,须保证实验过程中Anammox菌以最大速率进行增殖,而随着培养过程中生物膜厚度的不断增加,部分Anammox菌由于基质扩散受限,难以最大速率进行增殖,这使得培养后期Anammox菌的增殖速率减小。因此,为确保所得Anammox菌增殖系数准确,仅采用21~99 d培养阶段的污泥浓度进行计算,结果见图4。本实验中Anammox菌增殖系数为0.026 1 d−1,此数值小于理论值0.065 d−1(35 ℃条件下),这表明Anammox菌实际增长速率小于理论值。LOTTI等[13]研究显示,15 ℃下Anammox活性仅为30 ℃下的15%~42%,由于本实验在常温下进行,Anammox活性较小,这是造成本实验所得Anammox菌增殖系数小于理论值的主要原因。除温度影响[21-22]外,DO的存在也会对Anammox菌的增殖产生影响[23-24]。
2.4 生物膜变化及FISH检测
除Anammox活性增加外,填料上生物膜在启动前后也发生明显变化,结果见图5。反应器启动初期,生物膜呈现黑灰色,这是因为Anammox菌数量较少而其他微生物及杂质较多;当反应器启动248 d时,随着Anammox菌数量的增加,生物膜表现出明显的红棕色,这表明Anammox菌成功富集。
MBBR启动成功后,填料上的微生物通过荧光原位杂交技术进行测定。由杂交结果(图5)可知,经过248 d启动,生物膜上的微生物以Anammox菌为主,其大部分以聚集体的形式存在,Anammox菌表现出较强的荧光信号,这表明Anammox菌状态良好。利用Image-pro plus软件对Anammox菌占比进行计算,结果显示,Anammox菌所占份额较大,为总微生物量的78.34%,Anammox菌此时已成为优势菌种。
2.5 基质消耗和生成比值关系分析
目前,研究者普遍接受的Anammox反应化学计量关系[25]如式(5)所示,△
NO−2 -N/△NH+4 -N为1.32,△NO−3 -N/△NH+4 -N为0.26。当系统中存在除Anammox菌之外的微生物时,由于其他微生物代谢的进行,基质消耗与生成比值关系会发生变化,这是部分研究结果和理论值存在偏差的主要原因。本研究中温度与基质消耗和生成比值变化如图6所示,0~80 d时,NH+4 -N与NO−2 -N的消耗量比值小于1而NO−3 -N的生成量与NH+4 -N消耗量比值大于0.5,这是因为此阶段中Anammox活性较小,大部分NH+4 -N和NO−2 -N被硝化菌氧化。启动80~220 d时,NH+4 -N与NO−2 -N的消耗量和NO−3 -N的生成量的比值趋于稳定,此时Anammox菌在系统内占据主导,NH+4 -N和NO−2 -N主要被Anammox菌消耗。启动220~248 d时,NH+4 -N与NO−2 -N的消耗量和NO−3 -N的生成量的比值均不同程度降低,这是由于温度升高所致。温度升高使得硝化菌活性增大(尤其是AOB菌),NH+4 -N氧化为NO−2 -N的速率加快,这使得NO−2 -N在系统中积累。FNA浓度由于NO−2 -N浓度的升高而增加,Anammox活性因此降低,这使得基质消耗和生成量的比值关系发生变化。综上,NH+4 -N与NO−2 -N的消耗量和NO−3 -N的生成量的比值关系和反应器内各微生物活性及反应器运行条件及方式有关。NH+4+1.32NO−2+0.066HCO−3+0.13H+→1.02N2+0.26NO−3+0.066CH2O0.5N0.15+2H2O (5) 3. 结论
1)经过248 d的富集培养,MBBR处理负荷达到5 046.57 mg·(m2·d)−1,Anammox活性达到4 627.25 mg·(m2·d)−1。
2)当进水
NO−2 -N与NH+4 -N比值分别为1.32、1~1.32和0.74时,NH+4 -N与NO−2 -N的消耗量和NO−3 -N的生成量之间的比值关系依次为1:1.20:0.43、1:1.11:0.26和1:0.81:0.18,反应器基质消耗与生成的比值关系和系统内各微生物活性及反应器运行条件及方式有关。3)常温下对Anammox菌进行富集培养时,Anammox菌增殖系数为0.026 1 d−1。
4)常温下MBBR反应器中成功启动厌氧氨氧化,对Anammox工艺处理低浓度含氮废水提供了参考。
-
-
[1] BAGCHI S, BISWAS R, NANDY T. Autotrophic ammonia removal processes: Ecology to technology[J]. Critical Reviews in Environmental Science and Technology, 2012, 42(13): 1353-1418. doi: 10.1080/10643389.2011.556885 [2] KUENEN J G. Anammox bacteria: From discovery to application[J]. Nature Reviews Microbiology, 2008, 6(4): 320-326. doi: 10.1038/nrmicro1857 [3] SCHMIDT I, SLIEKERS O, SCHMID M, et al. New concepts of microbial treatment processes for the nitrogen removal in wastewater[J]. FEMS Microbiology Reviews, 2003, 27(4): 481-492. doi: 10.1016/S0168-6445(03)00039-1 [4] TERADA A, ZHOU S, HOSOMI M. Presence and detection of anaerobic ammonium-oxidizing (anammox) bacteria and appraisal of anammox process for high-strength nitrogenous wastewater treatment: A review[J]. Clean Technologies & Environmental Policy, 2011, 13(6): 759-781. [5] KARTAL B, KUENEN J G, VAN LOOSDRECHT M C M. Sewage treatment with anammox[J]. Science, 2010, 328(5979): 702-703. doi: 10.1126/science.1185941 [6] 盖书慧, 张雁秋, 杨燕舞. 新型脱氮工艺-厌氧氨氧化(ANAMMOX)[J]. 环境科学与管理, 2008, 34(4): 98-101. doi: 10.3969/j.issn.1673-1212.2008.04.026 [7] 张少辉. 厌氧氨氧化工艺研究[D]. 杭州: 浙江大学, 2004. [8] AZARI M, WALTER U, REKERS V, et al. More than a decade of experience of landfill leachate treatment with a full-scale anammox plant combining activated sludge and activated carbon biofilm[J]. Chemosphere, 2017, 174: 117-126. doi: 10.1016/j.chemosphere.2017.01.123 [9] WANG G, XU X, ZHOU L, et al. A pilot-scale study on the start-up of partial nitrification-anammox process for anaerobic sludge digester liquor treatment[J]. Bioresource Technology, 2017, 241: 181-189. doi: 10.1016/j.biortech.2017.02.125 [10] ZHANG L, NARITA Y, GAO L, et al. Maximum specific growth rate of anammox bacteria revisited[J]. Water Research, 2017, 116: 296-303. doi: 10.1016/j.watres.2017.03.027 [11] LÓPEZ H, PUIG S, GANIGUÉ R, et al. Start-up and enrichment of a granular anammox SBR to treat high nitrogen load wastewaters[J]. Chemical Technology and Biotechnology, 2008, 83(3): 233-241. doi: 10.1002/jctb.1796 [12] JETTEN M, STROUS M, VAN DE PAS-SCHOONEN K T, et al. The anaerobic oxidation of ammonium[J]. FEMS Microbiology, 1999, 22(5): 421-437. [13] LOTTI T, KLEEREBEZEM R, VAN LOOSDRECHT M C M. Effect of temperature change on anammox activity[J]. Biotechnology and Bioengineering, 2015, 112(1): 98-103. doi: 10.1002/bit.25333 [14] SCAGLIONE D, CAFFAZ S, BETTAZZI E, et al. Experimental determination of Anammox decay coefficient[J]. Journal of Chemical Technology & Biotechnology, 2009, 84(8): 1250-1254. [15] VAN D G A A, DE BRUIJN P, ROBERTSON L A, et al. Autotrophic growth of anaerobic ammonium-oxidizing micro-organisms in a fluidized bed reactor[J]. Microbiology, 1996, 142(8): 2187-2196. doi: 10.1099/13500872-142-8-2187 [16] 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. [17] AMANN R I, KRUMHOLZ L, STAHL D A. Fluorescent- oligonucleotide probing of whole cells for determinative, phylogenetic, and environmental studies in microbiology[J]. Journal of Bacteriology, 1990, 172(2): 762-770. doi: 10.1128/JB.172.2.762-770.1990 [18] AMANN R I, BINDER B J, OLSON R J, et al. Combination of 16S rRNA-targeted oligonucleotide probes with flow cytometry for analyzing mixed microbial populations[J]. Applied and Environmental Microbiology, 1990, 56(6): 1919-1925. doi: 10.1128/AEM.56.6.1919-1925.1990 [19] DAIMS H, BRÜHL A, AMANN R, et al. The domain-specific probe EUB338 is insufficient for the detection of all bacteria: Development and evaluation of a more comprehensive probe set[J]. Systematic and Applied Microbiology, 1999, 22(3): 434-444. doi: 10.1016/S0723-2020(99)80053-8 [20] KARTAL B, RATTRAY J, NIFTRIK L A V, et al. Candidatus “Anammoxoglobus propionicus” a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria[J]. Systematic & Applied Microbiology, 2007, 30(1): 39-49. [21] STROUS M, KUENEN J G, JETTEN M S M. Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology, 1999, 65(7): 3248-3250. doi: 10.1128/AEM.65.7.3248-3250.1999 [22] LOTTI T, KLEEREBEZEM R, KIP C V E T, et al. Anammox growth on pretreated municipal wastewater[J]. Environmental Science and Technology, 2014, 48(14): 7874-7880. doi: 10.1021/es500632k [23] YUYA K, KAZUICHI I, FUTABA K, et al. Tolerance level of dissolved oxygen to feed into anaerobic ammonium oxidation (Anammox) reactor[J]. Journal of Water and Environment Technology, 2011, 9(2): 169-178. doi: 10.2965/jwet.2011.169 [24] CARVAJAL-ARROYO J M, SUN W J, SIERRA-ALVAREZ R, et al. Inhibition of anaerobic ammonium oxidizing (anammox) enrichment cultures by substrates, metabolites and common wastewater constituents[J]. Chemosphere, 2013, 91(1): 22-27. doi: 10.1016/j.chemosphere.2012.11.025 [25] STROUS M, HEIJNEN J J, KUENEN J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 1998, 50(5): 589-596. doi: 10.1007/s002530051340 -














 DownLoad:
DownLoad: