-
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类持久性有机污染物,具有致癌、致畸、致突变的特性[1]。近代工业的快速发展导致大量PAHs排放至环境,经大气湿沉降、污水灌溉等途径最终汇聚于土壤,这导致了严重的PAHs污染土壤问题,对人类健康及生态环境构成了巨大威胁[2]。目前,土壤PAHs污染修复已成为国内外面临的亟待解决的问题之一。
微生物修复技术具有经济高效、绿色环保等优点,是目前PAHs污染修复的主要方法之一[3],而获得具有PAHs降解能力的微生物是微生物修复技术成功与否的前提[4]。许多研究筛选探究了对PAHs有分解代谢能力并可显著修复PAHs污染的降解菌及其降解特性,用于发展微生物修复技术[5]。黄兴如等[6]筛选分离出一株能以菲、芘为唯一碳源的菌株Rhizobium petrolearium。许晓毅等[7]筛选出的黄杆菌属(Flavobacterium sp.)和克雷伯氏杆菌属(Klebsiella sp.)能高效降解菲和荧蒽。目前,已有研究中涉及的降解菌只能降解一种或几种PAHs,可降解底物种类有限[8-9]。而污染土壤中的PAHs多以混合形式存在,各种PAHs单体之间会相互影响,从而增加微生物降解的难度[10]。虽已有一些针对PAHs降解菌展开的研究,但是针对具有降解广谱性,能以多种高环PAHs为唯一碳源生长代谢,可修复混合PAHs污染的降解菌研究仍然较少。因此,筛选具有降解广谱性、尤其对高环PAHs具有高效降解能力,可有效修复土壤混合PAHs污染的降解菌具有重要意义。
本研究采用富集分离法从北京某焦化厂PAHs污染土壤中分离筛选出一株具有降解广谱性且能以多种高环PAHs为唯一碳源的菌株,通过观察其形态以及借助分子生物学等手段对该菌株进行了鉴定;并系统研究了该菌株的生长特性及其对单一和混合PAHs的降解能力;同时,在实验室条件下考察了降解菌投加对野外PAHs污染土壤的强化修复潜力。研究工作可为PAHs污染土壤微生物修复技术发展提供一定的科技支撑。
-
在北京某退役焦化厂厂房附近选取有代表性的、多年未经扰动地段的土壤样地(N 39°51′0.42″,E 116°31′38.83″)进行采样。供试土壤采自该样地0~20 cm的表层土,其pH为8.64,总碳含量为16.60%,总氮含量为0.24%,总硫含量为0.56%,有机质含量为8.20%。供试土壤中PAHs含量如表1所示。
本研究所使用的主要药品:芘、菲、苯并[b]荧蒽等多环芳烃(纯度大于97%,美国AccuStandard公司);正己烷、甲醇、丙酮等有机试剂(色谱纯,美国Tedia公司);琼脂粉等非有机试剂(分析纯,国药集团化学试剂)。
LB培养基:蛋白胨10 g,酵母粉5 g,NaCl 10 g,加蒸馏水定容至1 000 mL。固体培养基则再加入2%琼脂粉。无机盐培养基:KH2PO4 5.5 g、K2HPO4 6.0 g、KCl 2.0 g、MgSO4·7H2O 0.2 g、Na2SO4 2.0 g、微量金属盐1.0 mL (MnSO4 39.9 mg,ZnSO4·H2O 42.8 mg,(NH4)MoO2·4H2O 34.7 mg,蒸馏水1 000 mL)、蒸馏水1 000 mL、pH 7.0。固体培养基则再加入2%琼脂粉。选择性无机盐液体培养基:在已灭菌的无机盐培养基中加入一定量PAHs的丙酮溶液,则可得到含PAHs的无机盐液体培养基。PAHs溶液及无机盐液体培养基加入量根据所需PAHs浓度添加。含芘的无机盐固体培养基:采用平板升华法[11],在无机盐固体培养基上镀一层芘膜。
-
1) PAHs降解菌的富集分离与筛选。采用富集培养法从污染土壤中将PAHs降解菌富集,然后用含芘的选择性培养基和平板划线的方法将降解菌分离[12],最后用含苯并[a]芘(50 mg·L−1)的选择性培养基对降解菌进行进一步的筛选。将各菌株对数期(OD600为0.8)菌悬液按10%的体积比(5 mL),接种于含50 mg·L−1苯并[a]芘的选择性无机盐液体培养基(45 mL)中,使液体培养体系为50 mL,同时设置无菌对照组,每组实验均设置5个重复处理。然后置于180 r·min−1,37 ℃摇床中避光振荡,培养8 d后,测定各菌株对苯并[a]芘的降解率,根据降解率对菌株进行二次筛选。
2) PAHs降解菌的鉴定。在进行分子生物学鉴定时,提取菌株Q3的DNA,用16S rDNA通用引物PCR扩增其16S rDNA基因序列。其中16S rDNA通用引物为厦门博瑞生物技术有限公司合成的引物27F:AGAGTTTGATCCTGGCTCAG,1492R:TACGGCTACCTTGTTACGACTT。扩增体系为25 μL Premix Ex Taq 酶(2×)、2 μL DNA(DNA浓度约10 μmol·L−1)、上游引物和下游引物各1 μL(引物初始浓度10 μmol·L−1)、灭菌水补足50 μL。扩增条件为94 ℃ 15 s、58 ℃ 35 s、72 ℃ 35 s、40个循环。将扩增产物送去厦门博瑞生物技术有限公司测序,测序结果在Ezbiocloud网站进行相似性比对,用MEGA 6.0进行序列相似性分析,构建系统发育树。表型特征鉴定与保藏工作委托中国普通微生物菌种保藏管理中心(CGMCC)完成,保藏编号为CGMCC No.16446。
3) PAHs降解菌生长特性分析。将Q3菌液分装后,于3 500 r·min−1下离心10 min,弃上清液后,加入等量已灭菌的无机盐液体培养基,即制得Q3菌悬液。本研究以菌液在OD600处的吸光度为考察指标,考察了Q3最适生长温度、pH及盐度。将对数期(OD600为0.8)菌悬液按10%的体积比(5 mL)接种于含有1% NaCl的LB培养基(45 mL)中,使液体培养体系为50 mL,同时设置无菌对照组,每组实验均设置5个重复处理。设置LB培养基初始pH分别为5、6、7、8、9,于180 r·min−137 ℃摇床中避光振荡培养,再连续取样测定菌液OD600变化,以探究菌株Q3最适生长pH。按照上述步骤,将对数期菌液按10%的比例接种于pH为7的LB培养基中,将LB培养基中的NaCl含量分别设置为0.1%、0.5%、1%、2%、3%、5%,以探究Q3最适生长盐度。将对数期菌液按10%的比例接种于pH为7、NaCl含量为1%的LB培养基中,分别设置摇床温度为25、30、37、40 ℃,以探究Q3最适生长温度。
4) PAHs降解菌降解性能分析。按照上述方法,制备芘(50 mg·L−1)选择性无机盐液体培养基(45 mL),并接种10% OD600=0.8的Q3菌悬液(5 mL),使液体培养体系为50 mL,同时设置无菌对照组,每组实验设置5个重复处理。然后置于37 ℃ 180 r·min−1摇床中避光振荡培养,分别于第2、4、8、12、16天破坏性取样测定锥形瓶中芘残余量。
在考察不同初始浓度对芘降解的影响时,按照上述步骤,培养8 d后,测定该菌株对初始含量分别为25、50、100、200 mg·L−1芘的降解率。
在对菌株Q3降解广谱性进行研究时,按照上述步骤,分别测定该菌株对菲(50 mg·L−1)、芘(50 mg·L−1)、苯并蒽(50 mg·L−1)、䓛(50 mg·L−1)、苯并[a]芘(50 mg·L−1)、苯并[b]荧蒽(10 mg·L−1)、苯并[k]荧蒽(10 mg·L−1)、二苯并[a,h]蒽(10 mg·L−1)、苯并[g,h,i]苝(10 mg·L−1)培养8 d或16 d后的降解率。
在考察菌株Q3对混合PAHs模拟液的降解效果时,按照上述步骤,测定该菌株对包含菲(50 mg·L−1)、芘(50 mg·L−1)、苯并[b]荧蒽(10 mg·L−1)和苯并[a]芘(50 mg·L−1)的混合PAHs培养8 d后的降解率。
在考察菌株Q3对土壤PAHs的去除效果时,称取10 g供试土壤置于250 mL锥形瓶中,加入90 mL无机盐液体培养基,用灭菌锅灭菌30 min后备用。将Q3菌悬液按照与土壤体系重量比为10%的比例(10 mL),分别接种于灭菌/未灭菌土壤培养体系(10 g供试土壤,90 mL无机盐液体培养基)中,同时设置对照组,每组实验设置5个重复处理,所有处理均置于37 ℃ 180 r·min−1摇床中,避光振荡培养24 d后,测定土壤中PAHs去除率。
5) PAHs含量测定。液相PAHs含量的测定参照国标HJ 478-2009[13]。以萃取剂样品比为3∶10的比例向样品溶液中加入正己烷,于摇床中振荡提取30 min,静置后分离收集有机相。上述萃取步骤重复3次,收集合并所有萃取液旋蒸至2 mL左右,并用甲醇定容至10 mL,取1 mL过0.45 μm有机滤膜后,置于棕色色谱瓶中待HPLC分析。分析仪器为日立L-2000液相色谱仪,采用C18反向色谱分析柱(250 mm×4.6 mm,5 μm),流动相为甲醇/水(体积比9∶1),流速为1 mL·min−1,检测波长为254 nm,柱温为35 ℃,进样体积为10 μL。
土壤PAHs含量检测步骤如下:将土样置于ASE350中萃取,萃取溶剂采用二氯甲烷∶丙酮=1∶1的混合溶剂。萃取条件:湿度为100 ℃,时间为5 min;大气压为10 342.5 kPa;静态提取5 min,循环3次,氮气吹扫100 s。萃取液在39 ℃水浴锅中完成浓缩与溶剂替换,溶剂替换为正己烷,过硅胶-氧化铝净化柱净化后,氮吹至1 mL,装入色谱瓶,用GC-MS测定。本研究中全部样品替代物的回收率为42%~120%。
以空白对照处理组PAHs含量为基础,菌株对液相PAHs的降解率(Da)、对土壤PAHs的去除率(Ds)分别按照式(1)和式(2)进行计算。
式中:Rc为对照组液相PAHs残余量,mg·L−1;Rs为实验组液相PAHs残余量,mg·L−1;Rm为供试土壤PAHs初始含量,mg·kg−1;Rs1为实验组土壤PAHs残余量,mg·kg−1。
-
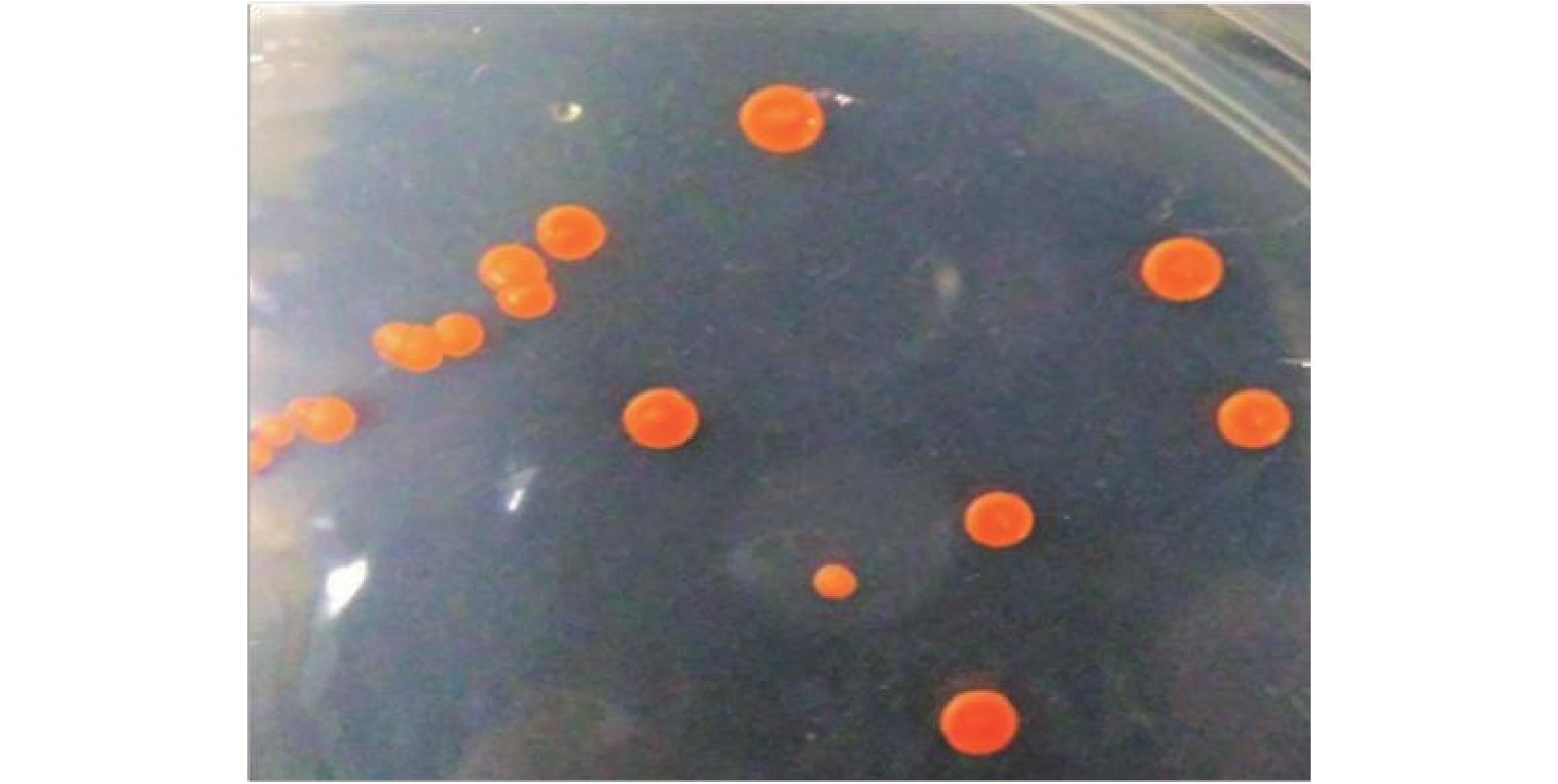
本研究以芘为底物进行PAHs降解菌的初筛,以含苯并[a]芘的选择性培养基进行复筛,最终得到一株PAHs的高效降解菌Q3。该菌株在LB固体培养基上菌落形态如图1所示。
菌株Q3经16S rDNA测序和Ezbiocloud比对结果表明,Q3与玫瑰色红球菌(Rhodococcus rhodochrous)相似性为99.79%,其系统发育树如图2所示。结合该菌株生理生化特征(表2),初步鉴定菌株Q3为玫瑰色红球菌(Rhodococcus rhodochrous)。
-
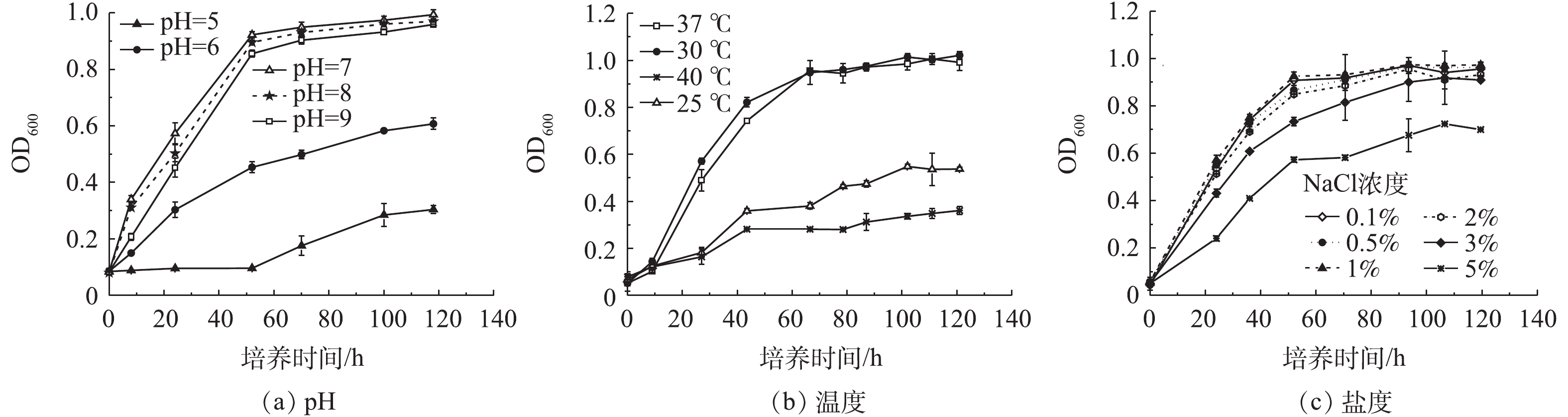
通过测定不同pH、温度及盐度培养条件下菌液OD600的吸光度变化,绘制了不同条件下菌株的生长曲线(图3)。实验结果表明,Q3最适生长的pH为7,温度为30~37 ℃,盐度为1%。盐度和pH是影响PAHs降解菌生长代谢的重要因素[14-15]。高盐度可能会引起微生物体内蛋白质等大分子物质变形,破坏微生物细胞结构或抑制一些重要的生物反应;高盐度也可能使环境中氧浓度减少,从而降低微生物代谢活性[14]。环境pH会影响微生物细胞膜所带的电荷,改变某些化合物分子进入细胞的状态,从而促进或抑制微生物的生长;强碱环境可能会破坏细胞质膜、抑制酶活性并影响膜运输蛋白的功能,从而抑制微生物生长[15]。赵百锁等[16]的研究表明,当盐浓度高于3%、pH大于9时,微生物的代谢活性显著受到抑制。顾平等[17]的研究也发现,强酸、强碱条件对PAHs降解菌株BB-1的生长具有抑制作用。而本研究中菌株Q3在pH为9,盐度为5%时均可正常生长,这表明该菌株具有一定的耐盐性和耐碱性。
-
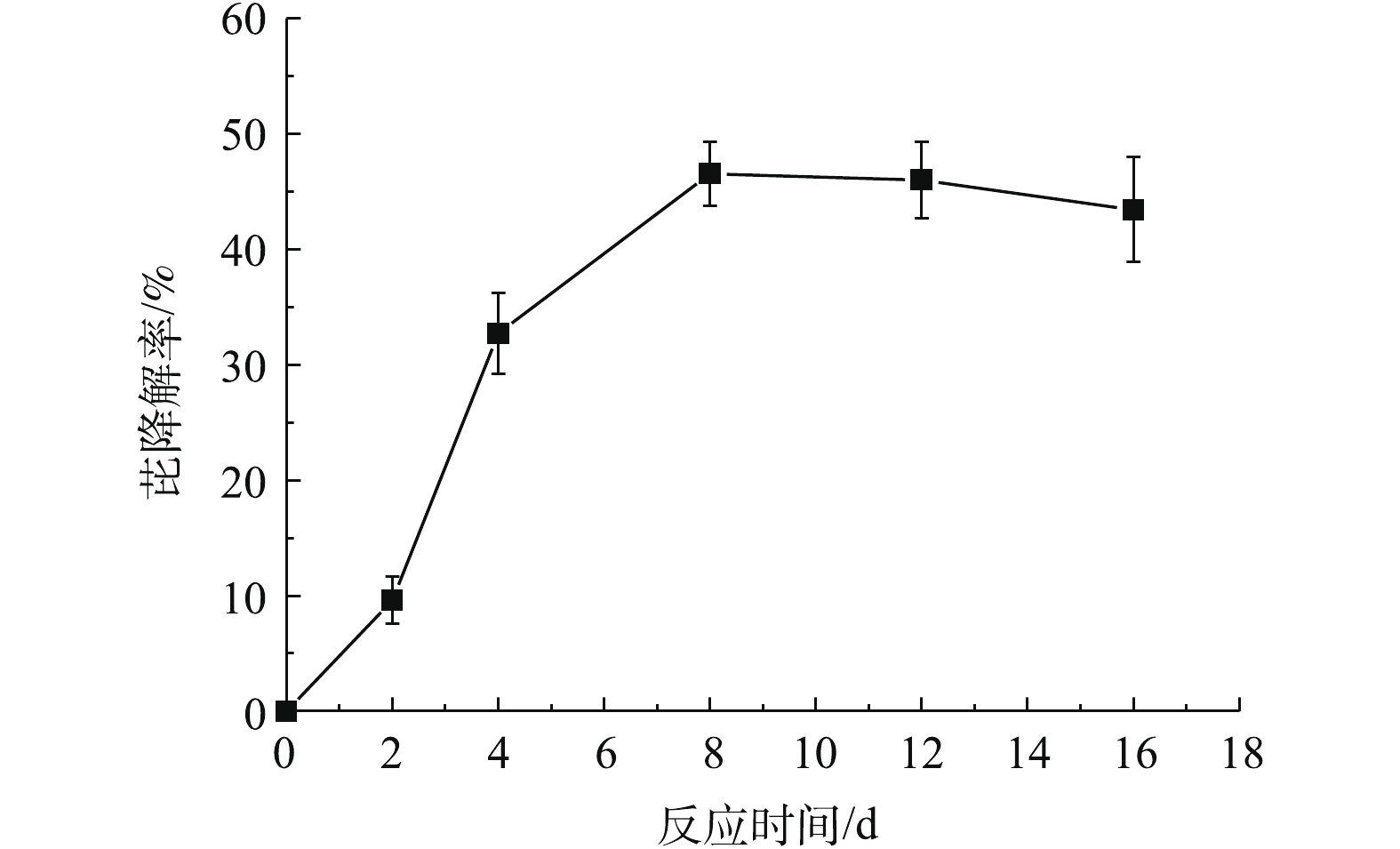
1)菌株Q3对单一芘的降解效率。在实验过程中,在无菌处理的对照组中,各采样时间点对应的芘浓度没有发生显著变化。菌株Q3对典型PAHs芘的降解率见图4。结果表明,菌株Q3能够降解体系中的芘,在以50 mg·L−1芘为唯一碳源的无机盐培养基中,菌株Q3第4天对芘的降解率为33%,第8天可达47%。在8~16 d内,Q3对芘的降解率没有显著变化,这可能是由于菌株Q3对芘的代谢中间产物具有生物毒性,从而抑制了该菌株的生长代谢,进而导致芘去除率相对稳定[18]。RAVELET等[19]的研究也表明,芘的代谢产物醌毒性比芘更大,对微生物生长具有显著抑制作用。菌株生长处于稳定期或衰亡期,代谢过程无增加也可能是芘去除率几乎无变化的原因之一[20]。王春明等[21]的研究也发现了类似的现象,微杆菌培养到第6天时,即在对数期时,培养液中蒽浓度开始明显下降;培养到第16天时,菌体处于稳定期,在第16~22天蒽几乎不被降解。
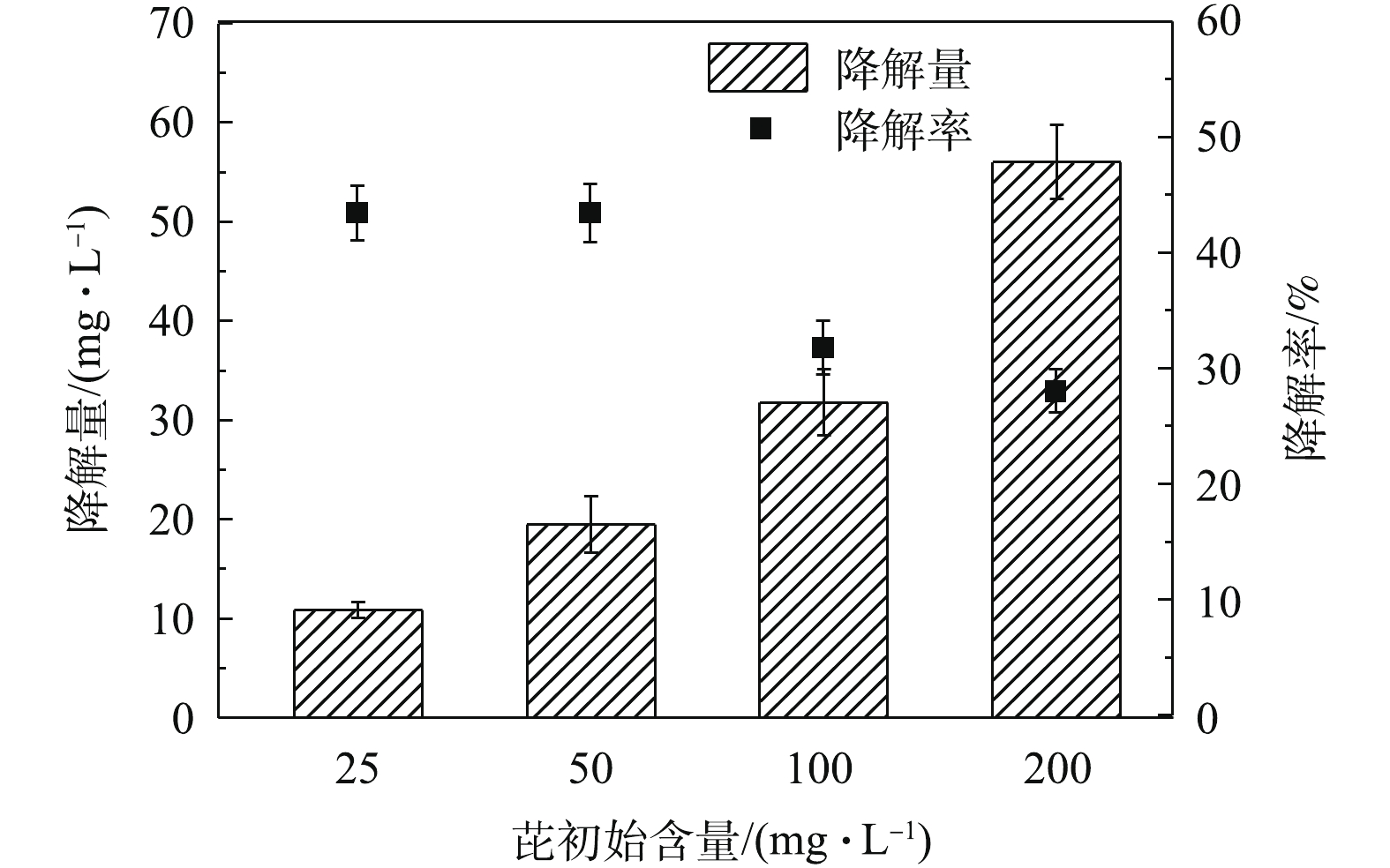
2)不同初始浓度对芘降解的影响。为探究Q3对PAHs的耐受能力,本研究测定了不同芘初始浓度下Q3芘降解量及其芘降解效率(图5)。在实验处理过程中,在各无菌对照处理中芘的浓度未出现显著变化。分析结果表明,菌株Q3能够降解体系中高浓度(200 mg·L−1)芘,且对芘具有耐受性,随着初始芘浓度的增加,体系中芘的降解量也随之增加。
3)菌株Q3降解广谱性。在实验过程中,各无菌对照处理中PAHs单体的浓度均没有显著变化。菌株Q3降解广谱性如表3所示。菌株Q3培养8 d后,对初始浓度为50 mg·L−1的菲、芘、苯并蒽、䓛和苯并[a]芘均有显著的降解效果,但对苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽和苯并[g,h,i]苝无降解作用。将上述菌株Q3对其无降解效果的苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽和苯并[g,h,i]苝的初始浓度由50 mg·L−1降低至10 mg·L−1,并延长培养时间至16 d后,菌株Q3对苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽和苯并[g,h,i]苝产生了显著的降解效果。综上所述,菌株Q3对菲、芘、苯并蒽、䓛、苯并[a]芘、苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽、苯并[g,h,i]苝等9种PAHs均具有一定的降解效果,对PAHs的具有降解广谱性。Q3对各类环境标准中的指示污染物—苯并[a]芘既具有较好的耐受能力,可降解初始浓度为50 mg·L−1的苯并[a]芘,也具有较高的降解能力,培养8 d后,对其降解率可达65%。
近年来,已有的大量研究从不同环境中筛选分离得到200余种不同类别的PAHs降解菌,但筛选出的菌株普遍降解底物范围较窄[22]。有研究表明,玫瑰色红球菌具有较好的有机污染物降解能力,如石油烃[23]、二苯并噻吩[24]、卤代烷烃[25]等,而利用其降解PAHs的研究较少。关于其他种类可降解PAHs的红球菌虽已有所报道,但是其降解率相对较小,且可降解的底物范围较窄。SONG等[26]从石油污染的沉积物中筛选分离出一株红球菌Rhodococcus sp. P14,其只对菲、芘、苯并[a]芘3种PAHs具有降解效果,且培养30 d后,其对50 mg·L−1菲、芘和苯并[a]芘的降解率分别为43%、34%和30%,低于本研究中Q3对菲、芘和苯并[a]芘的降解率。刁硕等[27]筛选分离的红球菌DYC-1对苯并[b]荧蒽、苯并[k]荧蒽无显著代谢作用,只可降解菲、芴、荧蒽。WALTER等[28]报道的赤红球菌可代谢芘,但要在以芘为基质的情况下才可共代谢苯并[a]芘。而本研究从PAHs污染土壤中分离出的降解菌Rhodococcus rhodochrous Q3,对苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘等9种PAHs均具有显著的降解能力,较多数已报道菌株具有更广泛的可降解底物范围。
4)菌株Q3对混合PAHs的降解。环境介质中的PAHs多以混合物形式存在,考察菌株对混合PAHs中高低环PAHs的降解效果具有重要的现实意义。在实验过程中,无菌对照处理中PAHs的浓度没有显著变化。菌株Q3对混合PAHs的降解效果如图6所示。菌株Q3培养8 d后,对4种PAHs(菲、芘、苯并[a]芘、苯并[b]荧蒽)的降解率比对照组提高了27%,对单一底物菲、芘和苯并[a]芘降解率可达到98%、47%和65%;而对混合PAHs中的菲、芘和苯并[a]芘降解率降低至57%、29%和33%。
本研究中菌株Q3可以有效地降解混合PAHs,但菌株Q3对混合PAHs中菲、芘、苯并[a]芘的降解效果显著低于其对单一菲、芘、苯并[a]芘的降解,表明混合PAHs的降解难度远大于PAHs单体。这可能是因为PAHs种类和浓度的增加显著抑制了降解菌的活性[29]。卢晓霞等[30]的研究发现了类似的结果,当液体培养基中16种PAHs总浓度为17 μg·mL−1时,降解菌即可生长良好,且具有降解活性;但当16种PAHs总浓度为166 μg·mL−1时,降解菌的生长及其活性均受到抑制。ANNE等[31]的研究也表明,污染物浓度过高或其他毒性物质的存在显著抑制了降解菌生长。另一方面,PAHs代谢中间产物也可能会转化成有毒物质,进而抑制降解菌的活性,如芘的中间代谢产物—二氢二醇芘会转化成一种有毒中间体二醇芘[32]。水杨酸、邻苯二酚等无毒性的代谢中间产物也可能因与PAHs共用同1个降解酶系,而对PAHs降解产生竞争性抑制作用[33]。
菌株Q3培养8 d后,对单一底物苯并[b]荧蒽不具有显著降解作用,而对混合PAHs中的苯并[b]荧蒽降解率显著提高至24%。这可能是因为微生物利用不同碳源作为生长基质时,会诱导出不同的降解酶系,多种降解底物即碳源的存在可增加混合体系中的降解酶系,从而使苯并[b]荧蒽的降解显著提高[34-35]。JAMES等[36]的研究表明,对多环芳烃降解能力有限的加氧酶,能被某些多环芳烃诱导,从而提高活性增强降解作用。巩宗强等[37]也报道了类似研究结果,芘和低分子质量多环芳烃菲存在共代谢关系,即对芘具有潜在降解性能的酶因为菲的氧化降解而增强了活性,从而促进了芘的降解。另外,低环PAHs作为碳源和能源能支持降解菌的快速生长繁殖,从而分泌更多的降解酶来促进高环PAHs和其代谢产物的降解,通过增大生物量来促进难降解物的转化[38]。本研究中菲、芘较苯并[b]荧蒽更容易被降解,菲、芘的存在可能进一步促进了降解菌的生长繁殖,从而促进了其对苯并[b]荧蒽的降解。FENG等[39]的研究显示,毕赤酵母(Pichia anomala)在萘存在下通过共代谢作用可增加体系中微生物数量,进而促进降解了较难降解的丁烯。李政等[40]的研究也表明,芴和菲的存在不仅促进了降解菌的生长繁殖,而且能够促进芘的完全快速降解和芘代谢产物的降解。由此可见:混合体系中存在的多种PAHs可能诱导多种降解酶系,从而使难降解的PAHs发生变化;也可能增大微生物对碳源和能源的选择范围,促进降解菌的生长繁殖和代谢活动。
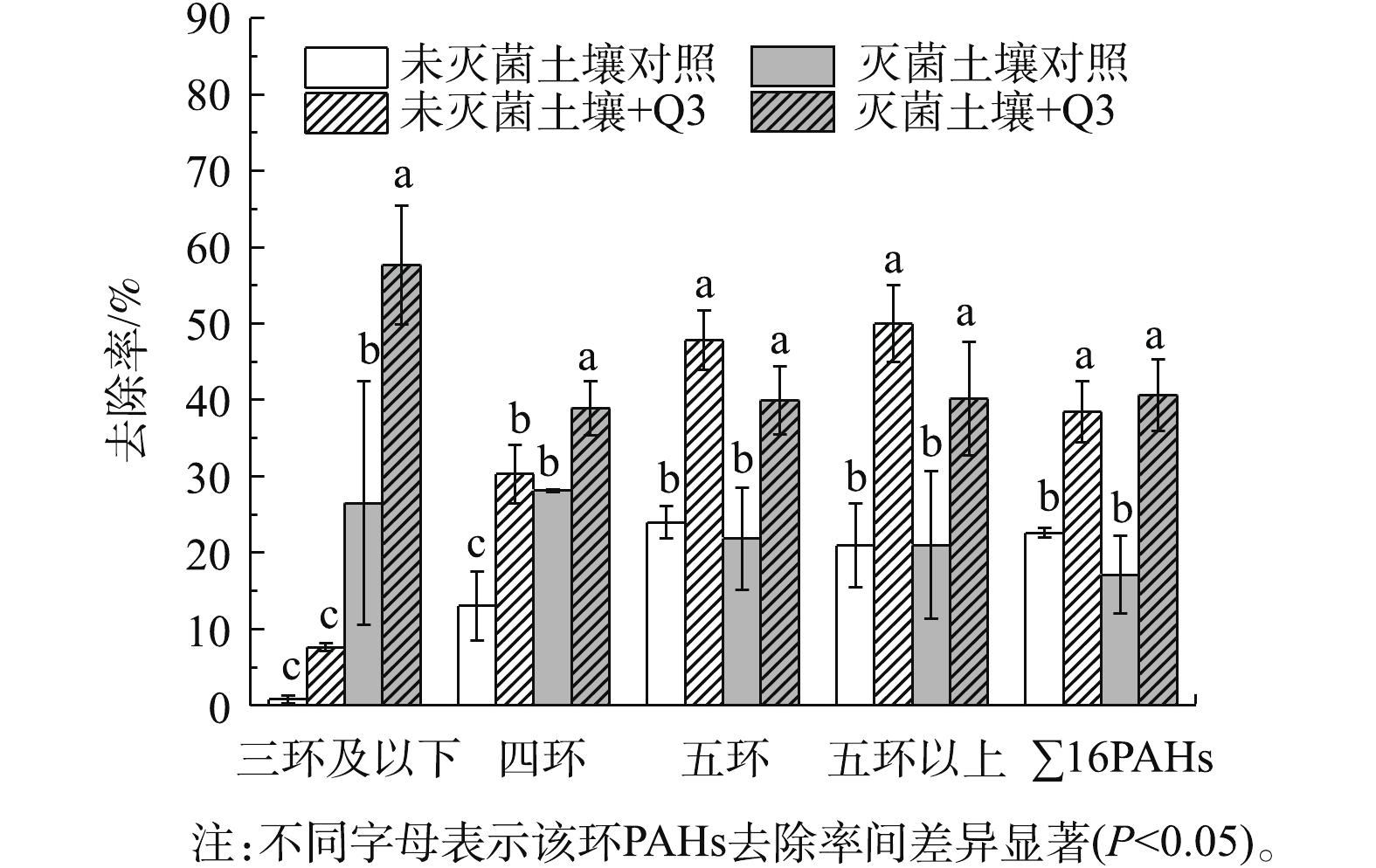
5)菌株Q3对土壤PAHs的强化修复潜力分析。为了考察菌株Q3对污染土壤中PAHs的强化修复潜力,本研究采集了野外PAHs长期污染土壤用于模拟实验。实验土壤中高环PAHs含量显著高于低环,通常这类土壤PAHs去除难度较大。菌株Q3投加后污染土壤中PAHs的去除效果如图7所示。菌株Q3培养24 d后,对灭菌和未灭菌土样中的PAHs均具有显著的强化去除效果,对灭菌土壤中16种EPA优控总PAHs(255.47 mg·kg−1)去除率比对照组提高了24%,且该菌株投加后,灭菌土壤中各环PAHs的去除率均在38%以上。
菌株Q3投加处理对灭菌土壤中四环及以下PAHs的强化去除显著高于未灭菌土壤。这可能是由于未灭菌土壤培养前期菌株Q3正处于适应环境的阶段,与土壤中某些土著菌存在生长竞争,而在微生物降解研究中,低环PAHs更容易在培养前期被降解菌优先利用[41]。因此,与土著菌的生长竞争影响了Q3对四环及以下PAHs的代谢降解。陈瑞蕊等[42]报道了类似的研究结果,将菌根真菌应用到土壤中时,土著菌群的竞争会影响菌根真菌发挥降解作用。王聪颖等[43]的研究也表明,土著微生物和接种的微生物会在一定程度上发生竞争作用,影响总微生物活性,进而影响微生物对PAHs的修复效果。随时间的延长,菌株Q3逐渐适应土壤环境后,代谢能力会趋于稳定,因此,灭菌与未灭菌土壤中五环及以上和总PAHs的去除率没有显著差异。王菲等[44]也报道了类似的研究结果,外接降解菌荧光假单胞菌(Psedomonas fluorescens)和分枝杆菌(Mycobacterium sp.)逐渐适应新环境后,会由刚接入土壤时的弱势种群逐渐变强,进而发挥了显著的去除作用。由此可见,本研究中菌株Q3的适应性较强,对环境中被PAHs污染的土壤有较好的强化修复应用潜力。
-
1)红球菌Q3最适生长pH为7,温度为30~37 ℃,盐度为1%;同时,其具有较好的耐盐和耐碱能力。
2)红球菌Q3的性能表征结果表明,该菌株芘耐受能力强,可降解初始浓度为200 mg·L−1的芘;降解广谱性高,可利用菲、芘、苯并蒽、䓛、苯并[a]芘、苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽、苯并[g,h,i]苝等9种PAHs为底物进行代谢,特别是对苯并[a]芘等高环PAHs具有较好的降解效果。
3)红球菌Q3对环境中复合PAHs污染具有一定的强化修复效果,可有效降解模拟液中的混合PAHs(菲、芘、苯并[a]芘、苯并[b]荧蒽);菌株Q3的投加对野外PAHs长期污染土壤中16种PAHs具有较好的强化去除效果,与对照组相比,16种PAHs总去除率提高了24%。
一株多环芳烃降解菌的筛选及其降解特性
Screening and degradation characteristics of a PAHs-degrading bacteria
-
摘要: 微生物修复是治理土壤多环芳烃(polycyclic aromatic hydrocarbons, PAHs)污染的主要方法,而高效降解菌筛选是微生物修复技术的重要基础。从北京焦化厂土壤中筛选分离得到一株PAHs降解菌Q3,通过生理生化和16S rDNA等分析手段鉴定其为Rhodococcus rhodochrous。结果表明:该菌株对芘的耐受能力较强,可降解初始浓度为200 mg·L−1的芘;该菌株具有降解广谱性,可利用苯并[a]芘、苯并[b]荧蒽、二苯并[a,h]蒽、苯并[g,h,i]苝等9种PAHs为唯一碳源进行代谢,特别是对苯并[a]芘等高环PAHs具有较好的降解效果;此外,该菌株可有效降解模拟液中的混合PAHs,并且对野外被PAHs长期污染的土壤具有较好的强化修复效果。投加菌株处理后的处理组与对照组相比,土壤PAHs总去除率提高了24%。以上结果表明该菌株对环境中被PAHs污染的土壤具有较好的强化修复潜力,可为PAHs污染土壤的微生物修复技术提供技术参考。Abstract: Microbial remediation is the main way to remove polycyclic aromatic hydrocarbons (PAHs) from the contaminated soil. It is essential to screen highly efficient degrading bacteria for bioremediation of PAHs-contaminated environment. A PAHs-degrading strain Q3 was isolated from PAHs contaminated soil in Beijing Coking Plant and identified as Rhodococcus rhodochrous by biochemical analysis and 16S rDNA sequence. The results showed the strain Q3 could tolerate pyrene, and could degrade it with initial concentration up to 200 mg·L−1 in liquid medium. Meanwhile, Q3 showed broad-spectra property for PAHs degradation, and could use nine individual PAHs, including phenanthrene, pyrene, benzoanthracene, benzo[a]pyrene, benzo[b]fluoranthene, benzo[k]fluoranthene, dibenzo[a, h]anthracene or benzo[g, h, i]perylene, as sole carbon source to perform metabolism. Especially for PAHs with high-ring structures, such as benzo[a]pyrene, a relatively high degradation capacity also occurred. In addition, the strain Q3 could effectively degrade the mixed PAHs in the simulated solution, and had a good effect on enhancing remediation for long-term PAHs contaminated soil. The PAHs removal rate in treatment group increased by 24% compared with the control group. The results can provide a technical reference for the bioremediation technology of PAHs contaminated soil.
-
Key words:
- PAHs /
- degradation bacteria /
- screening /
- degradation characteristics /
- soil remediation
-
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类持久性有机污染物,具有致癌、致畸、致突变的特性[1]。近代工业的快速发展导致大量PAHs排放至环境,经大气湿沉降、污水灌溉等途径最终汇聚于土壤,这导致了严重的PAHs污染土壤问题,对人类健康及生态环境构成了巨大威胁[2]。目前,土壤PAHs污染修复已成为国内外面临的亟待解决的问题之一。
微生物修复技术具有经济高效、绿色环保等优点,是目前PAHs污染修复的主要方法之一[3],而获得具有PAHs降解能力的微生物是微生物修复技术成功与否的前提[4]。许多研究筛选探究了对PAHs有分解代谢能力并可显著修复PAHs污染的降解菌及其降解特性,用于发展微生物修复技术[5]。黄兴如等[6]筛选分离出一株能以菲、芘为唯一碳源的菌株Rhizobium petrolearium。许晓毅等[7]筛选出的黄杆菌属(Flavobacterium sp.)和克雷伯氏杆菌属(Klebsiella sp.)能高效降解菲和荧蒽。目前,已有研究中涉及的降解菌只能降解一种或几种PAHs,可降解底物种类有限[8-9]。而污染土壤中的PAHs多以混合形式存在,各种PAHs单体之间会相互影响,从而增加微生物降解的难度[10]。虽已有一些针对PAHs降解菌展开的研究,但是针对具有降解广谱性,能以多种高环PAHs为唯一碳源生长代谢,可修复混合PAHs污染的降解菌研究仍然较少。因此,筛选具有降解广谱性、尤其对高环PAHs具有高效降解能力,可有效修复土壤混合PAHs污染的降解菌具有重要意义。
本研究采用富集分离法从北京某焦化厂PAHs污染土壤中分离筛选出一株具有降解广谱性且能以多种高环PAHs为唯一碳源的菌株,通过观察其形态以及借助分子生物学等手段对该菌株进行了鉴定;并系统研究了该菌株的生长特性及其对单一和混合PAHs的降解能力;同时,在实验室条件下考察了降解菌投加对野外PAHs污染土壤的强化修复潜力。研究工作可为PAHs污染土壤微生物修复技术发展提供一定的科技支撑。
1. 材料与方法
1.1 实验原料
在北京某退役焦化厂厂房附近选取有代表性的、多年未经扰动地段的土壤样地(N 39°51′0.42″,E 116°31′38.83″)进行采样。供试土壤采自该样地0~20 cm的表层土,其pH为8.64,总碳含量为16.60%,总氮含量为0.24%,总硫含量为0.56%,有机质含量为8.20%。供试土壤中PAHs含量如表1所示。
表 1 供试土壤中PAHs含量Table 1. PAHs concentrations in test soils多环芳烃 缩写 环 浓度/(mg·kg−1) 萘 NAP 2 1.89±0.27 苊烯 ANY 2 0.44±0.15 苊 ANA 3 2.74±0.37 芴 FLU 3 1.58±0.29 菲 PHE 3 8.99±1.73 蒽 ANT 3 1.88±0.26 荧蒽 FLT 4 21.91±3.87 芘 PYR 4 22.46±2.61 苯并蒽 BaA 4 20.78±2.67 䓛 CHR 4 23.52±3.35 苯并[b]荧蒽 BbF 5 31.87±4.43 苯并[k]荧蒽 BkF 5 14.91±2.05 苯并[a]芘 BaP 5 32.05±3.67 茚并[1,2,3-cd]芘 ICP 6 7.36±0.76 二苯并[a,h]蒽 DBA 6 36.03±3.11 苯并[g,h,i]苝 BPE 6 27.07±2.03 ∑16 PAHs 255.47±22.46 本研究所使用的主要药品:芘、菲、苯并[b]荧蒽等多环芳烃(纯度大于97%,美国AccuStandard公司);正己烷、甲醇、丙酮等有机试剂(色谱纯,美国Tedia公司);琼脂粉等非有机试剂(分析纯,国药集团化学试剂)。
LB培养基:蛋白胨10 g,酵母粉5 g,NaCl 10 g,加蒸馏水定容至1 000 mL。固体培养基则再加入2%琼脂粉。无机盐培养基:KH2PO4 5.5 g、K2HPO4 6.0 g、KCl 2.0 g、MgSO4·7H2O 0.2 g、Na2SO4 2.0 g、微量金属盐1.0 mL (MnSO4 39.9 mg,ZnSO4·H2O 42.8 mg,(NH4)MoO2·4H2O 34.7 mg,蒸馏水1 000 mL)、蒸馏水1 000 mL、pH 7.0。固体培养基则再加入2%琼脂粉。选择性无机盐液体培养基:在已灭菌的无机盐培养基中加入一定量PAHs的丙酮溶液,则可得到含PAHs的无机盐液体培养基。PAHs溶液及无机盐液体培养基加入量根据所需PAHs浓度添加。含芘的无机盐固体培养基:采用平板升华法[11],在无机盐固体培养基上镀一层芘膜。
1.2 实验方法
1) PAHs降解菌的富集分离与筛选。采用富集培养法从污染土壤中将PAHs降解菌富集,然后用含芘的选择性培养基和平板划线的方法将降解菌分离[12],最后用含苯并[a]芘(50 mg·L−1)的选择性培养基对降解菌进行进一步的筛选。即将各菌株对数期(OD600为0.8)菌悬液按10%的体积比(5 mL),接种于含50 mg·L−1苯并[a]芘的选择性无机盐液体培养基(45 mL)中,使液体培养体系为50 mL,同时设置无菌对照组,每组实验均设置5个重复处理。然后置于180 r·min−1,37 ℃摇床中避光振荡,培养8 d后,测定各菌株对苯并[a]芘的降解率,根据降解率对菌株进行二次筛选。
2) PAHs降解菌的鉴定。在进行分子生物学鉴定时,提取菌株Q3的DNA,用16S rDNA通用引物PCR扩增其16S rDNA基因序列。其中16S rDNA通用引物为厦门博瑞生物技术有限公司合成的引物27F:AGAGTTTGATCCTGGCTCAG,1492R:TACGGCTACCTTGTTACGACTT。扩增体系为25 μL Premix Ex Taq 酶(2×)、2 μL DNA(DNA浓度约10 μmol·L−1)、上游引物和下游引物各1 μL(引物初始浓度10 μmol·L−1)、灭菌水补足50 μL。扩增条件为94 ℃ 15 s、58 ℃ 35 s、72 ℃ 35 s、40个循环。将扩增产物送去厦门博瑞生物技术有限公司测序,测序结果在Ezbiocloud网站进行相似性比对,用MEGA 6.0进行序列相似性分析,构建系统发育树。表型特征鉴定与保藏工作委托中国普通微生物菌种保藏管理中心(CGMCC)完成,保藏编号为CGMCC No.16446。
3) PAHs降解菌生长特性分析。将Q3菌液分装后,于3 500 r·min−1下离心10 min,弃上清液后,加入等量已灭菌的无机盐液体培养基,即制得Q3菌悬液。本研究以菌液在OD600处的吸光度为考察指标,考察了Q3最适生长温度、pH及盐度。将对数期(OD600为0.8)菌悬液按10%的体积比(5 mL)接种于含有1% NaCl的LB培养基(45 mL)中,使液体培养体系为50 mL,同时设置无菌对照组,每组实验均设置5个重复处理。设置LB培养基初始pH分别为5、6、7、8、9,于180 r·min−137 ℃摇床中避光振荡培养,再连续取样测定菌液OD600变化,以探究菌株Q3最适生长pH。按照上述步骤,将对数期菌液按10%的比例接种于pH为7的LB培养基中,将LB培养基中的NaCl含量分别设置为0.1%、0.5%、1%、2%、3%、5%,以探究Q3最适生长盐度。将对数期菌液按10%的比例接种于pH为7、NaCl含量为1%的LB培养基中,分别设置摇床温度为25、30、37、40 ℃,以探究Q3最适生长温度。
4) PAHs降解菌降解性能分析。按照上述方法,制备芘(50 mg·L−1)选择性无机盐液体培养基(45 mL),并接种10% OD600=0.8的Q3菌悬液(5 mL),使液体培养体系为50 mL,同时设置无菌对照组,每组实验设置5个重复处理。然后置于37 ℃ 180 r·min−1摇床中避光振荡培养,分别于第2、4、8、12、16天破坏性取样测定锥形瓶中芘残余量。
在考察不同初始浓度对芘降解的影响时,按照上述步骤,培养8 d后,测定该菌株对初始含量分别为25、50、100、200 mg·L−1芘的降解率。
在对菌株Q3降解广谱性进行研究时,按照上述步骤,分别测定该菌株对菲(50 mg·L−1)、芘(50 mg·L−1)、苯并蒽(50 mg·L−1)、䓛(50 mg·L−1)、苯并[a]芘(50 mg·L−1)、苯并[b]荧蒽(10 mg·L−1)、苯并[k]荧蒽(10 mg·L−1)、二苯并[a,h]蒽(10 mg·L−1)、苯并[g,h,i]苝(10 mg·L−1)培养8 d或16 d后的降解率。
在考察菌株Q3对混合PAHs模拟液的降解效果时,按照上述步骤,测定该菌株对包含菲(50 mg·L−1)、芘(50 mg·L−1)、苯并[b]荧蒽(10 mg·L−1)和苯并[a]芘(50 mg·L−1)的混合PAHs培养8 d后的降解率。
在考察菌株Q3对土壤PAHs的去除效果时,称取10 g供试土壤置于250 mL锥形瓶中,加入90 mL无机盐液体培养基,用灭菌锅灭菌30 min后备用。将Q3菌悬液按照与土壤体系重量比为10%的比例(10 mL),分别接种于灭菌/未灭菌土壤培养体系(10 g供试土壤,90 mL无机盐液体培养基)中,同时设置对照组,每组实验设置5个重复处理,所有处理均置于37 ℃ 180 r·min−1摇床中,避光振荡培养24 d后,测定土壤中PAHs去除率。
5) PAHs含量测定。液相PAHs含量的测定参照国标HJ 478-2009[13]。以萃取剂样品比为3∶10的比例向样品溶液中加入正己烷,于摇床中振荡提取30 min,静置后分离收集有机相。上述萃取步骤重复3次,收集合并所有萃取液旋蒸至2 mL左右,并用甲醇定容至10 mL,取1 mL过0.45 μm有机滤膜后,置于棕色色谱瓶中待HPLC分析。分析仪器为日立L-2000液相色谱仪,采用C18反向色谱分析柱(250 mm×4.6 mm,5 μm),流动相为甲醇/水(体积比9∶1),流速为1 mL·min−1,检测波长为254 nm,柱温为35 ℃,进样体积为10 μL。
土壤PAHs含量检测步骤如下:将土样置于ASE350中萃取,萃取溶剂采用二氯甲烷∶丙酮=1∶1的混合溶剂。萃取条件:湿度为100 ℃,时间为5 min;大气压为10 342.5 kPa;静态提取5 min,循环3次,氮气吹扫100 s。萃取液在39 ℃水浴锅中完成浓缩与溶剂替换,溶剂替换为正己烷,过硅胶-氧化铝净化柱净化后,氮吹至1 mL,装入色谱瓶,用GC-MS测定。本研究中全部样品替代物的回收率为42%~120%。
以空白对照处理组PAHs含量为基础,菌株对液相PAHs的降解率(Da)、对土壤PAHs的去除率(Ds)分别按照式(1)和式(2)进行计算。
Da=Rc−RsRC×100% (1) Ds=Rm−Rs1Rm×100% (2) 式中:Rc为对照组液相PAHs残余量,mg·L−1;Rs为实验组液相PAHs残余量,mg·L−1;Rm为供试土壤PAHs初始含量,mg·kg−1;Rs1为实验组土壤PAHs残余量,mg·kg−1。
2. 结果与讨论
2.1 PAHs降解菌的筛选与鉴定
本研究以芘为底物进行PAHs降解菌的初筛,以含苯并[a]芘的选择性培养基进行复筛,最终得到一株PAHs的高效降解菌Q3。该菌株在LB固体培养基上菌落形态如图1所示。
菌株Q3经16S rDNA测序和Ezbiocloud比对结果表明,Q3与玫瑰色红球菌(Rhodococcus rhodochrous)相似性为99.79%,其系统发育树如图2所示。结合该菌株生理生化特征(表2),初步鉴定菌株Q3为玫瑰色红球菌(Rhodococcus rhodochrous)。
表 2 生理生化测试结果Table 2. Results of physiological and biochemical test项目 Q3 空白对照 革兰氏染色 + − 芽孢染色 − − 接触酶实验 + − 明胶水解实验 − − 硫化氢实验 − − 吲哚产生 − − 8% NaCl + − 脲酶实验 − − 注:“+”表示反应为阳性;“−”表示反应为阴性。 2.2 PAHs降解菌的生长特性
通过测定不同pH、温度及盐度培养条件下菌液OD600的吸光度变化,绘制了不同条件下菌株的生长曲线(图3)。实验结果表明,Q3最适生长的pH为7,温度为30~37 ℃,盐度为1%。盐度和pH是影响PAHs降解菌生长代谢的重要因素[14-15]。高盐度可能会引起微生物体内蛋白质等大分子物质变形,破坏微生物细胞结构或抑制一些重要的生物反应;高盐度也可能使环境中氧浓度减少,从而降低微生物代谢活性[14]。环境pH会影响微生物细胞膜所带的电荷,改变某些化合物分子进入细胞的状态,从而促进或抑制微生物的生长;强碱环境可能会破坏细胞质膜、抑制酶活性并影响膜运输蛋白的功能,从而抑制微生物生长[15]。赵百锁等[16]的研究表明,当盐浓度高于3%、pH大于9时,微生物的代谢活性显著受到抑制。顾平等[17]的研究也发现,强酸、强碱条件对PAHs降解菌株BB-1的生长具有抑制作用。而本研究中菌株Q3在pH为9,盐度为5%时均可正常生长,这表明该菌株具有一定的耐盐性和耐碱性。
2.3 PAHs降解菌的降解特性
1)菌株Q3对单一芘的降解效率。在实验过程中,在无菌处理的对照组中,各采样时间点对应的芘浓度没有发生显著变化。菌株Q3对典型PAHs芘的降解率见图4。结果表明,菌株Q3能够降解体系中的芘,在以50 mg·L−1芘为唯一碳源的无机盐培养基中,菌株Q3第4天对芘的降解率为33%,第8天可达47%。在8~16 d内,Q3对芘的降解率没有显著变化,这可能是由于菌株Q3对芘的代谢中间产物具有生物毒性,从而抑制了该菌株的生长代谢,进而导致芘去除率相对稳定[18]。RAVELET等[19]的研究也表明,芘的代谢产物醌毒性比芘更大,对微生物生长具有显著抑制作用。菌株生长处于稳定期或衰亡期,代谢过程无增加也可能是芘去除率几乎无变化的原因之一[20]。王春明等[21]的研究也发现了类似的现象,微杆菌培养到第6天时,即在对数期时,培养液中蒽浓度开始明显下降;培养到第16天时,菌体处于稳定期,在第16~22天蒽几乎不被降解。
2)不同初始浓度对芘降解的影响。为探究Q3对PAHs的耐受能力,本研究测定了不同芘初始浓度下Q3芘降解量及其芘降解效率(图5)。在实验处理过程中,在各无菌对照处理中芘的浓度未出现显著变化。分析结果表明,菌株Q3能够降解体系中高浓度(200 mg·L−1)芘,且对芘具有耐受性,随着初始芘浓度的增加,体系中芘的降解量也随之增加。
3)菌株Q3降解广谱性。在实验过程中,各无菌对照处理中PAHs单体的浓度均没有显著变化。菌株Q3降解广谱性如表3所示。菌株Q3培养8 d后,对初始浓度为50 mg·L−1的菲、芘、苯并蒽、䓛和苯并[a]芘均有显著的降解效果,但对苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽和苯并[g,h,i]苝无降解作用。将上述菌株Q3对其无降解效果的苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽和苯并[g,h,i]苝的初始浓度由50 mg·L−1降低至10 mg·L−1,并延长培养时间至16 d后,菌株Q3对苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽和苯并[g,h,i]苝产生了显著的降解效果。综上所述,菌株Q3对菲、芘、苯并蒽、䓛、苯并[a]芘、苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽、苯并[g,h,i]苝等9种PAHs均具有一定的降解效果,对PAHs的具有降解广谱性。Q3对各类环境标准中的指示污染物—苯并[a]芘既具有较好的耐受能力,可降解初始浓度为50 mg·L−1的苯并[a]芘,也具有较高的降解能力,培养8 d后,对其降解率可达65%。
表 3 菌株Q3降解广谱性Table 3. Broad-spectra property of degradation by strain Q3PAHs 初始浓度50 mg·L−1第8天的降解率/% 初始浓度10 mg·L−1第16天的降解率/% 菲 98.12±2.7 — 芘 46.54±12.78 — 苯并蒽 35.13±2.92 — 䓛 15.07±4.80 — 苯并[a]芘 64.73±9.40 — 苯并[b]荧蒽 0 21.32±1.03 苯并[k]荧蒽 0 36.75±7.79 二苯并[a,h]蒽 0 82.43±3.85 苯并[g,h,i]苝 0 48.95±4.45 近年来,已有的大量研究从不同环境中筛选分离得到200余种不同类别的PAHs降解菌,但筛选出的菌株普遍降解底物范围较窄[22]。有研究表明,玫瑰色红球菌具有较好的有机污染物降解能力,如石油烃[23]、二苯并噻吩[24]、卤代烷烃[25]等,而利用其降解PAHs的研究较少。关于其他种类可降解PAHs的红球菌虽已有所报道,但是其降解率相对较小,且可降解的底物范围较窄。SONG等[26]从石油污染的沉积物中筛选分离出一株红球菌Rhodococcus sp. P14,其只对菲、芘、苯并[a]芘3种PAHs具有降解效果,且培养30 d后,其对50 mg·L−1菲、芘和苯并[a]芘的降解率分别为43%、34%和30%,低于本研究中Q3对菲、芘和苯并[a]芘的降解率。刁硕等[27]筛选分离的红球菌DYC-1对苯并[b]荧蒽、苯并[k]荧蒽无显著代谢作用,只可降解菲、芴、荧蒽。WALTER等[28]报道的赤红球菌可代谢芘,但要在以芘为基质的情况下才可共代谢苯并[a]芘。而本研究从PAHs污染土壤中分离出的降解菌Rhodococcus rhodochrous Q3,对苯并[b]荧蒽、苯并[k]荧蒽、苯并[a]芘等9种PAHs均具有显著的降解能力,较多数已报道菌株具有更广泛的可降解底物范围。
4)菌株Q3对混合PAHs的降解。环境介质中的PAHs多以混合物形式存在,考察菌株对混合PAHs中高低环PAHs的降解效果具有重要的现实意义。在实验过程中,无菌对照处理中PAHs的浓度没有显著变化。菌株Q3对混合PAHs的降解效果如图6所示。菌株Q3培养8 d后,对4种PAHs(菲、芘、苯并[a]芘、苯并[b]荧蒽)的降解率比对照组提高了27%,对单一底物菲、芘和苯并[a]芘降解率可达到98%、47%和65%;而对混合PAHs中的菲、芘和苯并[a]芘降解率降低至57%、29%和33%。
本研究中菌株Q3可以有效地降解混合PAHs,但菌株Q3对混合PAHs中菲、芘、苯并[a]芘的降解效果显著低于其对单一菲、芘、苯并[a]芘的降解,表明混合PAHs的降解难度远大于PAHs单体。这可能是因为PAHs种类和浓度的增加显著抑制了降解菌的活性[29]。卢晓霞等[30]的研究发现了类似的结果,当液体培养基中16种PAHs总浓度为17 μg·mL−1时,降解菌即可生长良好,且具有降解活性;但当16种PAHs总浓度为166 μg·mL−1时,降解菌的生长及其活性均受到抑制。ANNE等[31]的研究也表明,污染物浓度过高或其他毒性物质的存在显著抑制了降解菌生长。另一方面,PAHs代谢中间产物也可能会转化成有毒物质,进而抑制降解菌的活性,如芘的中间代谢产物—二氢二醇芘会转化成一种有毒中间体二醇芘[32]。水杨酸、邻苯二酚等无毒性的代谢中间产物也可能因与PAHs共用同1个降解酶系,而对PAHs降解产生竞争性抑制作用[33]。
菌株Q3培养8 d后,对单一底物苯并[b]荧蒽不具有显著降解作用,而对混合PAHs中的苯并[b]荧蒽降解率显著提高至24%。这可能是因为微生物利用不同碳源作为生长基质时,会诱导出不同的降解酶系,多种降解底物即碳源的存在可增加混合体系中的降解酶系,从而使苯并[b]荧蒽的降解显著提高[34-35]。JAMES等[36]的研究表明,对多环芳烃降解能力有限的加氧酶,能被某些多环芳烃诱导,从而提高活性增强降解作用。巩宗强等[37]也报道了类似研究结果,芘和低分子质量多环芳烃菲存在共代谢关系,即对芘具有潜在降解性能的酶因为菲的氧化降解而增强了活性,从而促进了芘的降解。另外,低环PAHs作为碳源和能源能支持降解菌的快速生长繁殖,从而分泌更多的降解酶来促进高环PAHs和其代谢产物的降解,通过增大生物量来促进难降解物的转化[38]。本研究中菲、芘较苯并[b]荧蒽更容易被降解,菲、芘的存在可能进一步促进了降解菌的生长繁殖,从而促进了其对苯并[b]荧蒽的降解。FENG等[39]的研究显示,毕赤酵母(Pichia anomala)在萘存在下通过共代谢作用可增加体系中微生物数量,进而促进降解了较难降解的丁烯。李政等[40]的研究也表明,芴和菲的存在不仅促进了降解菌的生长繁殖,而且能够促进芘的完全快速降解和芘代谢产物的降解。由此可见:混合体系中存在的多种PAHs可能诱导多种降解酶系,从而使难降解的PAHs发生变化;也可能增大微生物对碳源和能源的选择范围,促进降解菌的生长繁殖和代谢活动。
5)菌株Q3对土壤PAHs的强化修复潜力分析。为了考察菌株Q3对污染土壤中PAHs的强化修复潜力,本研究采集了野外PAHs长期污染土壤用于模拟实验。实验土壤中高环PAHs含量显著高于低环,通常这类土壤PAHs去除难度较大。菌株Q3投加后污染土壤中PAHs的去除效果如图7所示。菌株Q3培养24 d后,对灭菌和未灭菌土样中的PAHs均具有显著的强化去除效果,对灭菌土壤中16种EPA优控总PAHs(255.47 mg·kg−1)去除率比对照组提高了24%,且该菌株投加后,灭菌土壤中各环PAHs的去除率均在38%以上。
菌株Q3投加处理对灭菌土壤中四环及以下PAHs的强化去除显著高于未灭菌土壤。这可能是由于未灭菌土壤培养前期菌株Q3正处于适应环境的阶段,与土壤中某些土著菌存在生长竞争,而在微生物降解研究中,低环PAHs更容易在培养前期被降解菌优先利用[41]。因此,与土著菌的生长竞争影响了Q3对四环及以下PAHs的代谢降解。陈瑞蕊等[42]报道了类似的研究结果,将菌根真菌应用到土壤中时,土著菌群的竞争会影响菌根真菌发挥降解作用。王聪颖等[43]的研究也表明,土著微生物和接种的微生物会在一定程度上发生竞争作用,影响总微生物活性,进而影响微生物对PAHs的修复效果。随时间的延长,菌株Q3逐渐适应土壤环境后,代谢能力会趋于稳定,因此,灭菌与未灭菌土壤中五环及以上和总PAHs的去除率没有显著差异。王菲等[44]也报道了类似的研究结果,外接降解菌荧光假单胞菌(Psedomonas fluorescens)和分枝杆菌(Mycobacterium sp.)逐渐适应新环境后,会由刚接入土壤时的弱势种群逐渐变强,进而发挥了显著的去除作用。由此可见,本研究中菌株Q3的适应性较强,对环境中被PAHs污染的土壤有较好的强化修复应用潜力。
3. 结论
1)红球菌Q3最适生长pH为7,温度为30~37 ℃,盐度为1%;同时,其具有较好的耐盐和耐碱能力。
2)红球菌Q3的性能表征结果表明,该菌株芘耐受能力强,可降解初始浓度为200 mg·L−1的芘;降解广谱性高,可利用菲、芘、苯并蒽、䓛、苯并[a]芘、苯并[b]荧蒽、苯并[k]荧蒽、二苯并[a,h]蒽、苯并[g,h,i]苝等9种PAHs为底物进行代谢,特别是对苯并[a]芘等高环PAHs具有较好的降解效果。
3)红球菌Q3对环境中复合PAHs污染具有一定的强化修复效果,可有效降解模拟液中的混合PAHs(菲、芘、苯并[a]芘、苯并[b]荧蒽);菌株Q3的投加对野外PAHs长期污染土壤中16种PAHs具有较好的强化去除效果,与对照组相比,16种PAHs总去除率提高了24%。
-
表 1 供试土壤中PAHs含量
Table 1. PAHs concentrations in test soils
多环芳烃 缩写 环数 浓度/(mg·kg−1) 萘 NAP 2 1.89±0.27 苊烯 ANY 2 0.44±0.15 苊 ANA 3 2.74±0.37 芴 FLU 3 1.58±0.29 菲 PHE 3 8.99±1.73 蒽 ANT 3 1.88±0.26 荧蒽 FLT 4 21.91±3.87 芘 PYR 4 22.46±2.61 苯并蒽 BaA 4 20.78±2.67 䓛 CHR 4 23.52±3.35 苯并[b]荧蒽 BbF 5 31.87±4.43 苯并[k]荧蒽 BkF 5 14.91±2.05 苯并[a]芘 BaP 5 32.05±3.67 茚并[1,2,3-cd]芘 ICP 6 7.36±0.76 二苯并[a,h]蒽 DBA 6 36.03±3.11 苯并[g,h,i]苝 BPE 6 27.07±2.03 ∑16 PAHs 255.47±22.46 表 2 生理生化测试结果
Table 2. Results of physiological and biochemical test
项目 Q3 空白对照 革兰氏染色 + − 芽孢染色 − − 接触酶实验 + − 明胶水解实验 − − 硫化氢实验 − − 吲哚产生 − − 8% NaCl + − 脲酶实验 − − 注:“+”表示反应为阳性;“−”表示反应为阴性。 表 3 菌株Q3降解广谱性
Table 3. Broad-spectra property of degradation by strain Q3
PAHs 初始浓度50 mg·L−1第8天的降解率/% 初始浓度10 mg·L−1第16天的降解率/% 菲 98.12±2.7 — 芘 46.54±12.78 — 苯并蒽 35.13±2.92 — 䓛 15.07±4.80 — 苯并[a]芘 64.73±9.40 — 苯并[b]荧蒽 0 21.32±1.03 苯并[k]荧蒽 0 36.75±7.79 二苯并[a,h]蒽 0 82.43±3.85 苯并[g,h,i]苝 0 48.95±4.45 -
[1] LOMZA P, POSZYTEK K, SKLODOWSKA A, et al. Evaluation of bioremediation of soil highly contaminated by petroleum hydrocarbons[J]. New Biotechnology, 2016, 141(33): 14-28. [2] 熊丽君, 吴杰, 王敏. 交通道路沿线土壤多环芳烃污染及风险防控综述[J]. 生态环境学报, 2018, 27(5): 974-982. [3] 周际海, 袁颖红, 朱志保, 等. 土壤有机污染物生物修复技术研究进展[J]. 生态环境学报, 2015, 24(2): 343-351. [4] 吴作军, 卢滇楠, 张敏莲, 等. 微生物分子生态学技术及其在石油污染土壤修复中的应用现状与展望[J]. 化工进展, 2010, 30(5): 789-795. [5] 吴枭雄, 王红旗, 刘自力. 多环芳烃污染土壤的微生物修复技术研究进展[J]. 环境与发展, 2018, 30(7): 108-109. [6] 黄兴如, 张彩文, 张瑞杰, 等. 多环芳烃降解菌的筛选、鉴定及降解特性[J]. 微生物学通报, 2016, 43(5): 965-973. [7] 许晓毅, 苏攀, 姬宇, 等. 沉积物中2株多环芳烃降解菌的分离鉴定及其对菲、荧蒽的降解特性[J]. 环境工程学报, 2015, 9(3): 1513-1520. doi: 10.12030/j.cjee.20150386 [8] 田晶, 徐小琳, 康彦顺, 等. 广谱性多环芳烃降解真菌Aspergillus flavus AD-X-1的筛选及其性能研究[J]. 生物技术通报, 2018, 34(8): 115-122. [9] 杨轩, 张威, 李师翁, 等. 多环芳烃降解菌的分离鉴定及其生理特性研究[J]. 环境科学学报, 2012, 32(5): 1033-1040. [10] CRAMPON M, BUREAU F, AKPA-VINCESLAS M, et al. Correlations between PAH bioavailability degrading bacteria and soil characteristics during PAH biodegradation in five diffusely contaminated dissimilar soils[J]. Environmental Science and Pollution Research, 2014, 21(13): 8133-8145. [11] ALLEY J F, BROWN L R. Use of sublimation to prepare solid microbial media with water-insoluble substrates[J]. Applied Environmental Microbiology, 2000, 66(1): 439-442. doi: 10.1128/AEM.66.1.439-442.2000 [12] PING L F, ZHANG C R, ZHU Y H, et al. Biodegrading of pyrene by a newly isolated Pseudomonas putida PL2[J]. Biotechnology and Bioprocess Engineering, 2011, 16: 1000-1008. doi: 10.1007/s12257-010-0435-y [13] 环境保护部. 水质多环芳烃的测定液液萃取和固相萃取高效液相色谱法: HJ 478-2009[S]. 北京: 中国环境科学出版社, 2009. [14] 范瑞娟, 刘雅琴, 张琇. 嗜盐碱高环PAHs降解菌的分离及其降解特性研究[J]. 农业环境科学学报, 2019, 38(6): 1280-1287. doi: 10.11654/jaes.2018-1023 [15] 陈燕飞. pH对微生物的影响[J]. 太原师范学院学报(自然科学版), 2009, 8(3): 121-124. doi: 10.3969/j.issn.1672-2027.2009.03.032 [16] 赵百锁, 王慧, 毛心慰. 嗜盐微生物在环境修复中的研究进展[J]. 微生物学通报, 2007, 34(6): 1209-1212. doi: 10.3969/j.issn.0253-2654.2007.06.038 [17] 顾平, 周启星, 王鑫, 等. 一株土著B[a]P降解菌的筛选及降解特性研究[J]. 农业环境科学学报, 2018, 37(5): 926-932. doi: 10.11654/jaes.2017-0954 [18] 卫昆, 陈烁娜, 尹华, 等. 蜡状芽胞杆菌对芘的降解特性及降解酶研究[J]. 环境科学学报, 2016, 36(2): 506-512. [19] RAVELET C, KRIVOBOK S, SAGE L, et al. Biodegradation of pyrene by sediment fungi[J]. Chemosphere, 2000, 40(5): 557-563. doi: 10.1016/S0045-6535(99)00320-3 [20] 毛健, 骆永明, 滕应, 等. 一株高分子量多环芳烃降解菌的筛选、鉴定及降解特性研究[J]. 微生物学通报, 2008, 35(7): 1011-1015. doi: 10.3969/j.issn.0253-2654.2008.07.003 [21] 王春明, 李大平, 王春莲. 微杆菌3-28对萘、菲、蒽、芘的降解[J]. 应用与环境生物学报, 2009, 15(3): 361-366. [22] 杜彦玲, 台培东, 施秋峰, 等. 多环芳烃降解菌X20的鉴定及降解特性[J]. 生态学杂志, 2010, 29(6): 1208-1212. [23] SORKHOH N A, GHANNOUM M A, IBRAHIM A S, et al. Crude oil and hydrocarbon-degrading strains of Rhodococcus rhodochrous isolated from soil and marine environments in Kuwait[J]. Environmental Pollution, 1990, 65(1): 1-17. doi: 10.1016/0269-7491(90)90162-6 [24] HIROYUKI H, HIROYASU S, IKUO S, et al. High cell density culture of Rhodococcus rhodochrous by pH-stat feeding and dibenzothiophene degradation[J]. Journal of Fermentation and Bioengineering, 1998, 85(3): 334-338. doi: 10.1016/S0922-338X(97)85685-1 [25] HELEN C, ORLA F, MICHAEL J L, et al. Haloalkane degradation and assimilation by Rhodococcus rhodochrous NCIMB 13064[J]. Microbiology, 1994, 140(6): 1433-1442. doi: 10.1099/00221287-140-6-1433 [26] SONG X H, XU Y, LI G M, et al. Isolation, characterization of Phodococcus sp. P14 capable of degrading high-molecular-weight polycyclic aromatic hydrocarbons and aliphatic hydrocarbons[J]. Marine Pollution Bulletin, 2011, 62(10): 2122-2128. doi: 10.1016/j.marpolbul.2011.07.013 [27] 刁硕, 王红旗, 许洁, 等. 低温耐盐芘降解菌的筛选鉴定及降解特性研究[J]. 中国环境科学, 2017, 37(2): 677-685. [28] WALTER U, BEYER M, KLEIN J, et al. Degradation of pyrene by Rhodococcus sp. UW1[J]. Applied Microbiology and Biotechnology, 1991, 34(5): 671-676. doi: 10.1007/BF00167921 [29] 丁克强, 骆永明, 刘世亮, 等. 多环芳烃菲对淹水土壤微生物动态变化的影响[J]. 土壤, 2002, 45(4): 229-236. doi: 10.3321/j.issn:0253-9829.2002.04.012 [30] 卢晓霞, 李秀利, 马杰, 等. 焦化厂多环芳烃污染土壤的强化微生物修复研究[J]. 环境科学, 2011, 32(3): 864-869. [31] ANNE H B, BARBARA B H. Enumeration of phenanthrene-degrading bacteria by an overlayer technique and its use in evaluation of petrolirm-contaminated sites[J]. Applied Environment Microbiology, 1992, 58(8): 2579-2582. doi: 10.1128/AEM.58.8.2579-2582.1992 [32] 唐婷婷, 金卫根. 多环芳烃微生物降解机理研究进展[J]. 土壤, 2010, 42(6): 876-881. [33] 张杰, 刘永生, 孟玲, 等. 多环芳烃降解菌筛选及其降解特性[J]. 应用生态学报, 2003, 14(10): 1783-1786. doi: 10.3321/j.issn:1001-9332.2003.10.043 [34] CHEN S H, AITKEN M D. Salicylate stimulates the degradation of high molecular weitht polycyclic aromatic hydrocarbons by Pseudomonas saccharophila P15[J]. Environmental Science and Technology, 1999, 33(3): 435-439. doi: 10.1021/es9805730 [35] GHAZALI F M, RAHMAN R N Z A, SALLEH A B, et al. Biodegradation of hydrocarbons in soil by microbial consortium[J]. International Biodeterioration & Biodegradation, 2004, 54(1): 61-67. [36] JAMES E B, DOUGLAS G C. Effects of co-occurring aromatic hydrocarbons on degradation of individual polycyclic aromatic hydrocarbons in marine sediment slurries[J]. Applied Environment Microbiology, 1988, 54(7): 1649-1655. doi: 10.1128/AEM.54.7.1649-1655.1988 [37] 巩宗强, 李培军, 王新, 等. 芘在土壤中的共代谢降解研究[J]. 应用生态学报, 2001, 12(3): 447-450. doi: 10.3321/j.issn:1001-9332.2001.03.031 [38] ZHONG Y, ZOU S C, LIN L, et al. Effects of pyrene and fluoranthene on the degradation characteristics of phenanthrene in the cometabolism process by Sphingomonas sp. strain PheB4 isolated from mangrove sediments[J]. Marine Pollution Bulletin, 2010, 60(11): 2043-2049. doi: 10.1016/j.marpolbul.2010.07.017 [39] FENG P, YANG Q X, ZHANG Y, et al. Biodegradation of polycyclic aromatic hydrocarbons by Pichia anomala[J]. Biotechnology Letters, 2004, 26(10): 803-806. doi: 10.1023/B:BILE.0000025882.33234.91 [40] 李政, 顾贵洲, 赵朝成, 等. 高相对分子质量多环芳烃的生物共代谢降解[J]. 石油学报, 2015, 31(3): 720-725. [41] 杜丽娜, 高大文. 青顶拟多孔菌对单一和复合多环芳烃的降解特性[J]. 中国环境科学, 2011, 31(2): 277-282. [42] 陈瑞蕊, 林先贵, 尹睿, 等. 有机污染土壤中菌根的作用[J]. 生态学杂志, 2005, 24(2): 176-180. doi: 10.3321/j.issn:1000-4890.2005.02.012 [43] 王聪颖, 王芳, 王涛, 等. 生物强化和生物刺激对土壤中PAHs降解的影响[J]. 中国环境科学, 2010, 30(1): 121-127. [44] 王菲, 苏振成, 杨辉, 等. 土壤中多环芳烃的微生物降解及土壤细菌种群多样性[J]. 应用生态学报, 2009, 20(12): 3020-3026. -




 DownLoad:
DownLoad: