-
中国发现及使用铜的历史悠久,至今铜在电力、电子和机械等领域中发挥着巨大作用[1]。随着社会经济的快速发展,各产业对铜的需求越来越大;同时对企业的环保要求也日益严格,使得铜冶炼制酸尾气中二氧化硫(SO2)的有效治理和资源化利用显得十分必要[2]。SO2是大气主要污染物之一,削减SO2的排放量及保护大气环境质量,是我国环境保护须重点关注的问题之一[3]。铜冶炼行业排放的SO2现行标准为《铜、钴、镍工业污染源排放标准》(GB 25467-2010)[4],标准要求排放到大气中的SO2浓度低于400 mg·m−3。在2013年,标准修订单中增加了特殊排放限值,二氧化硫的特殊排放值为100 mg·m−3。
许斌等[5]分析对比了液态氢氧化钠和工业过氧化氢2种吸收剂对治理硫酸尾气SO2的工艺设备、处理效果及成本等。从脱硫成本分析结果显示:工业过氧化氢的成本较液态氢氧化钠成本低31 395元·月−1,故工业过氧化氢具有明显的可行性和经济性。王庆轮[6]介绍了双氧水脱硫法去除铜阳极炉中的SO2工艺的选择以及生产实践情况,结果表明,双氧水法在该公司成功应用,且脱硫成本适宜,脱硫过程产生的污染物全部在系统内部得到回收利用,且外排SO2浓度明显低于国家标准。
冶炼烟气制酸系统是冶炼系统的辅助设施,其作用是以冶炼工序产生的烟气为原料,将烟气中的SO2转化为SO3,然后利用浓硫酸对SO3的亲和性吸收SO3,其可与浓硫酸中的水分子反应产生H2SO4。在此过程中,由于SO2转化为SO3的反应是可逆反应,不能实现100%的转化率,因此,尾气脱硫是冶炼烟气制酸系统的必备设施。其作用是将烟气中制酸系统中未转化为SO3的SO2进行脱除,以确保排放到大气中的SO2达标排放,是保障尾气排放的最后一道防线。
全文HTML
-
某铜业公司(以下简称公司),最初选用的氨法脱硫工艺,其在后期存在脱硫效果不稳定、无法满足生产需求等问题。因此,公司根据自身实际情况,对4种脱硫技术进行比较,将氨法脱硫工艺改造成双氧水脱硫工艺。
目前,铜冶炼制酸尾气脱硫常用的方法主要有氨法、双碱法、有机胺法和双氧水法[7],其各自的脱硫工艺特点如表1所示。
氨法脱硫是目前最常用、也是最成熟的硫酸尾气脱硫工艺[8],随着工艺的发展,其从一级脱硫演变出二级氨法脱硫工艺,脱硫效率可达到95%左右。双碱法脱硫是采用钠基脱硫剂(氢氧化钠、亚硫酸钠)等进行塔内脱硫,从而生成钙碱的方法[9],脱硫效率约为90%。钠基脱硫剂碱性强,吸收SO2后反应产物溶解度大,不会生成过饱和结晶,造成结垢堵塞问题。双碱法脱硫产物排入再生池后,可用Ca(OH)2进行还原再生,再生出的钠基脱硫剂可再回到脱硫塔循环使用,同时产生亚硫酸钙及硫酸钙等副产物[10]。有机胺法脱硫以有机阳离子为脱硫剂与SO2水合反应产生的氢离子反应,促进SO2与水的反应向右进行,增加SO2的溶解量,进而可有效脱除气相中的SO2,脱硫效率可达93%左右。脱硫剂对SO2具有良好的吸附及解吸能力[11],其在低温状态下吸收SO2,而在高温状态下解吸,再生出高浓度SO2[12],从而达到脱除烟气中SO2的目的。有机胺法使用最简单的脱硫剂乙二胺,其存在脱硫率高、烟气中脱硫范围广、副产物可用于生产硫产品、无磨损和结垢堵塞问题[13]。双氧水脱硫是利用双氧水的强氧化性,将SO2中的四价硫氧化到六价硫,生成硫酸后进入液相,从而实现脱除气相中SO2的目的[14]。双氧水与SO2的反应为氧化还原反应,且反应速度较快,脱硫效率可达95%左右。
双碱法在脱硫过程中会产生副产物——硫酸钙和亚硫酸钙,从而造成二次污染,还存在脱硫系统结垢、脱硫渣含水率高、反应池溢流、脱硫效率低等一系列问题,故该技术还有待继续完善。有机胺法所采用的脱硫剂挥发性大、易被氧化,在解吸过程中能耗高,且有机胺法在脱硫过程中会产生一些热稳定性的盐,以降低脱硫剂的再生率,因此,目前该技术大多数还处在实验阶段,发展尚不成熟。相比之下,氨法脱硫技术较为成熟,工艺相对简单,但在实际应用中仍会存在拖尾、硫酸雾超标等问题,需要根据具体的工艺条件对其进行优化。双氧水脱硫相较于其他技术,具有投资少、操作简便、无二次污染、脱硫率高等特点,不仅在技术上可行,在设备和实际应用中逐渐成熟,而且在运行费用和经济效益上也具有一定优势。综上所述,双碱法及有机胺法涉及脱硫液再生和循环液再生循环利用的问题,因此,脱硫工序现场占地面积相对较大,运行成本相对较低。氨法脱硫和双氧水脱硫方法仅需在脱硫现场设置一个脱硫塔,占地面积相对较小,但氨法脱硫须设置附属固氨工序对脱硫循环液进行处置,因此,流程相对较长[15]。
-
氨法脱硫是在气-液两相之间相互传质传热并发生化学反应的过程[16],既有化学吸收也有物理吸收。反应后生成NH4HSO3,其被强制氧化生成(NH4)2SO3,经过浓缩、结晶、分离、干燥等工艺,生产出高品质的硫酸铵产品。主要的反应[17]如式(1)~式(8) 所示。
由式(4)可知,实际对SO2进行吸收的是(NH4)2SO3,NH4HSO3并不吸收SO2;NH3的主要作用是调节吸收液的pH,将NH4HSO3转化为(NH4)2SO3,为吸收SO2提供吸收剂[18]。
-
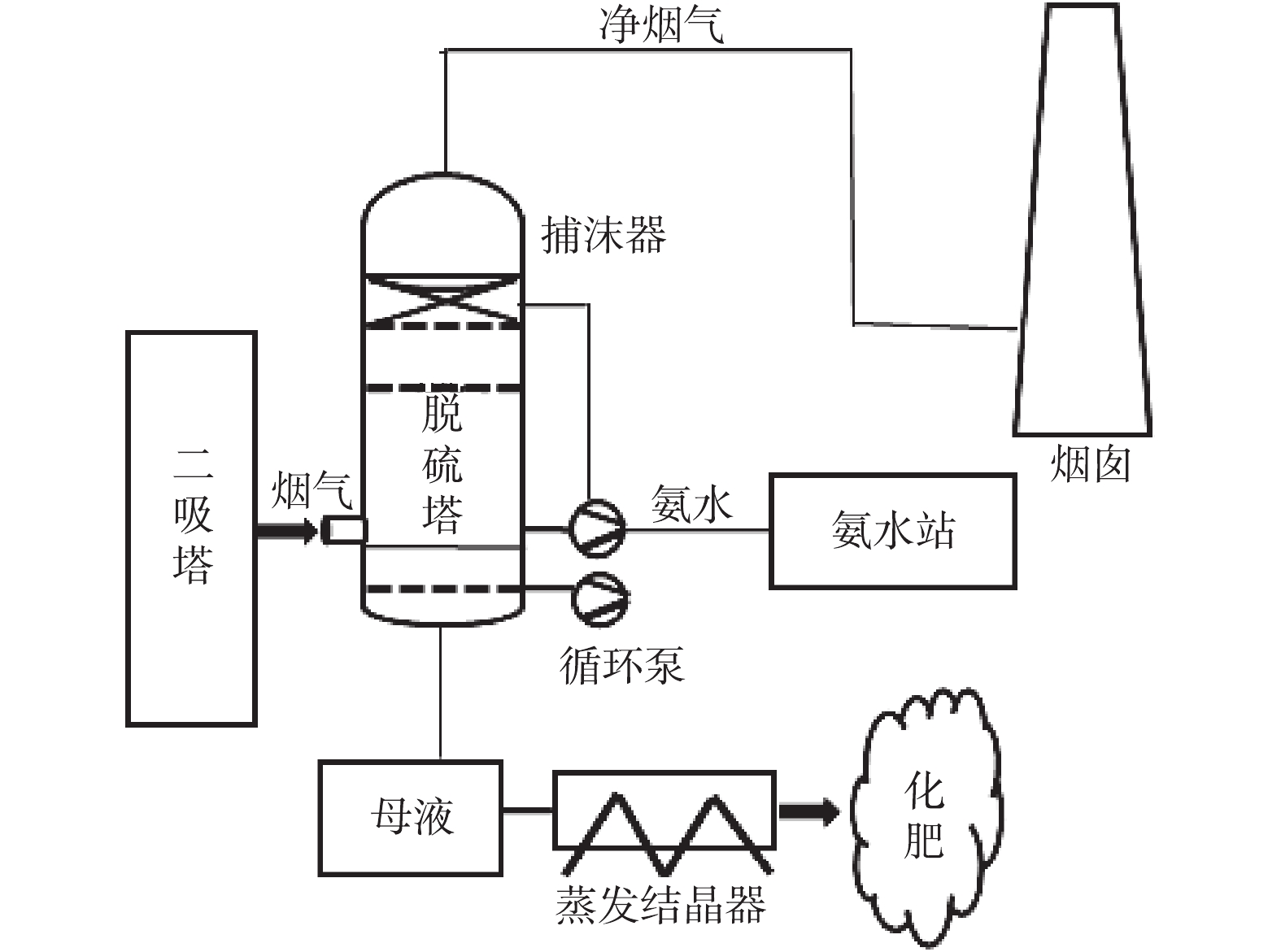
公司原尾气脱硫工艺为氨法脱硫。外购液氨用槽车运输到氨站,利用稀氨器将液氨与水混合后,稀释到15%左右进行储存,利用加压泵将氨水供入脱硫系统。因氨水腐蚀性强,所以氨站管理难度大、安全风险较高。氨法脱硫的动力波塔阻力较高,增大了风机设备能耗;脱硫过程会产生硫酸铵、亚硫酸铵结晶体,容易造成管道堵塞,且易导致尾气排放颗粒物指标偏高;脱硫循环液中含有烟尘和油污等杂质,需设置固氨工序将脱硫废液进行处置,因此,氨酸法脱硫工艺流程较长,运行成本较高。公司将硫酸吸收塔含SO2的烟气经尾气吸收塔喷淋吸收,使排空烟气中的SO2含量达到环保排放要求。工艺流程如图1所示。
其主要工艺技术操作条件:吸收率≥95%,排空尾气SO2含量<400 mg·m−3,循环液碱度1~3 t,产品液密度>1.2 g·cm−3(出料)。
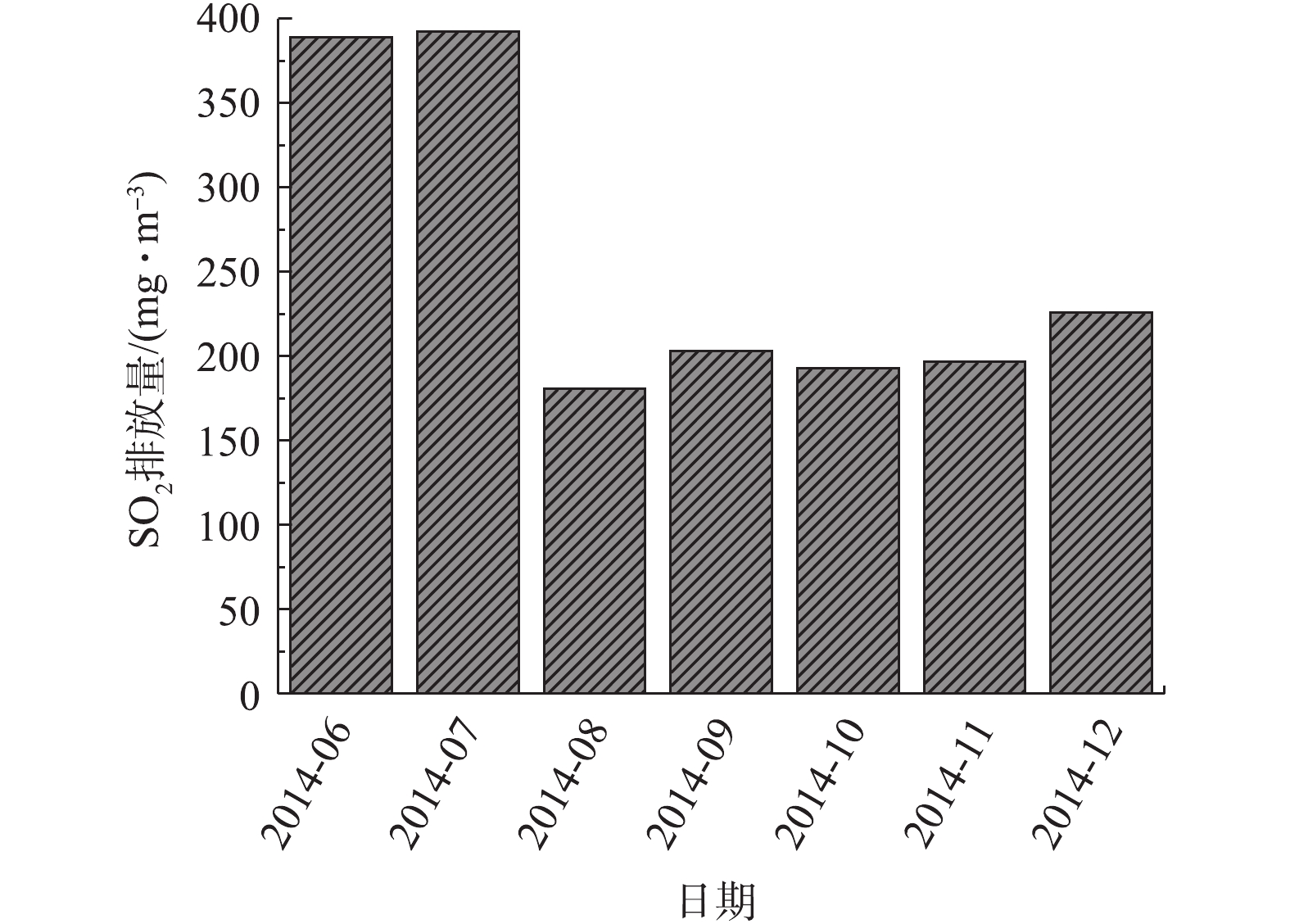
图2列出了公司在2014年6—12月氨法脱硫后的SO2排放量。由图2可知,氨法脱硫后SO2排放值达到了国家标准,但脱硫效果不稳定。公司原有的氨法脱硫设备为一段动力波洗涤塔,脱硫效率约为90%~93%。在系统开停车时,需延长升温时间和低负荷生产时间,以保证排放指标稳定达标,且随着工艺技术的发展及环保要求的日趋严格,公司原有一段氨酸法脱硫难以满足生产需求。
2.1. 氨法脱硫工艺的原理
2.2. 原氨法脱硫工艺运行中的问题
-
双氧水脱硫的基本原理是将双氧水加到脱硫塔内,经泵循环和塔内喷淋装置使双氧水溶液与含SO2的尾气充分接触,利用H2O2的强氧化性将SO2氧化成硫酸,然后进入液相,从而达到脱硫的目的。主要反应[19]如式(9)~式(11)所示。
式(9)为气液传质和水结合过程的反应,尾气中的SO2与水接触后,与水分子结合生成H2SO3;式(10)为H2SO3的氧化吸收过程。
-
公司两转两吸制酸系统原设计产能为160 kt·a−1,现场场地相对狭小。其尾气脱硫系统仅针对制酸尾气进行脱硫,无其他烟气进入脱硫系统。在制酸过程中,吸收工序和净化工序均为液体环境,所以进入脱硫工序烟气杂质十分微量,可有效避免双氧水因与金属离子或其他杂质发生反应而造成的分解。因此,基于对生产实际考虑,公司选定尾气脱硫工艺改造为双氧水脱硫工艺。
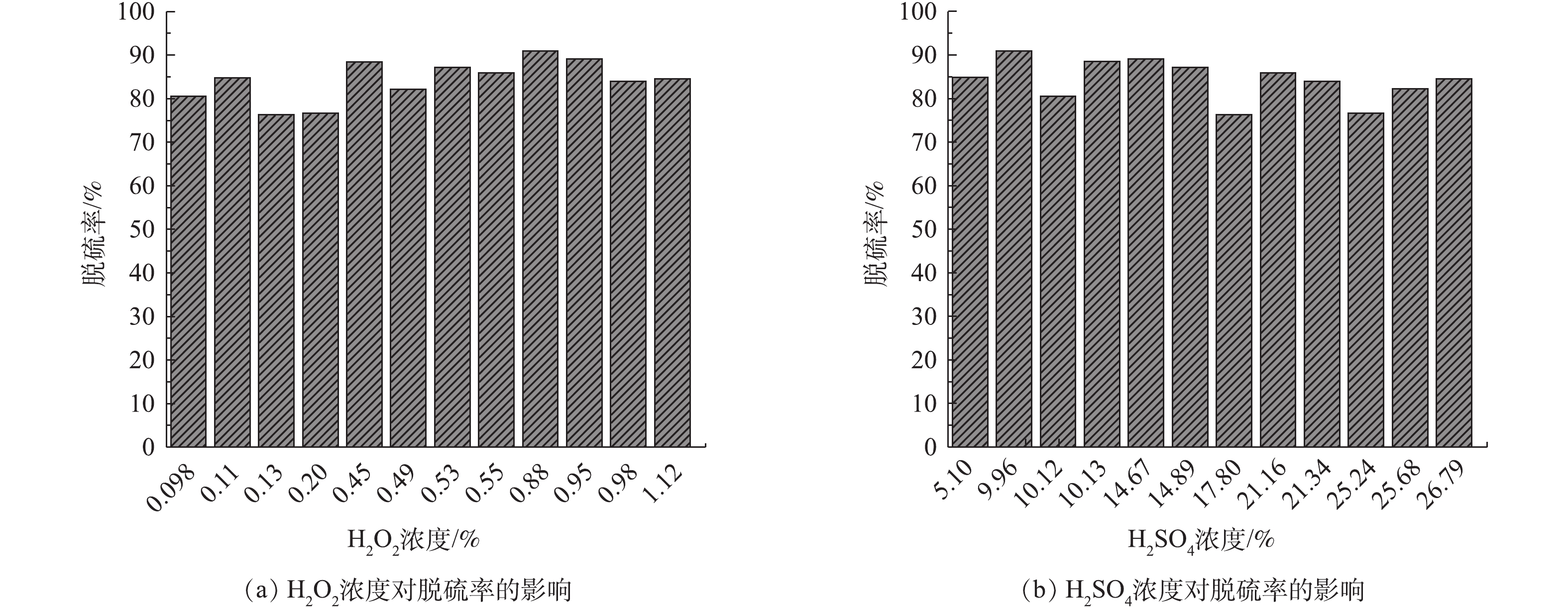
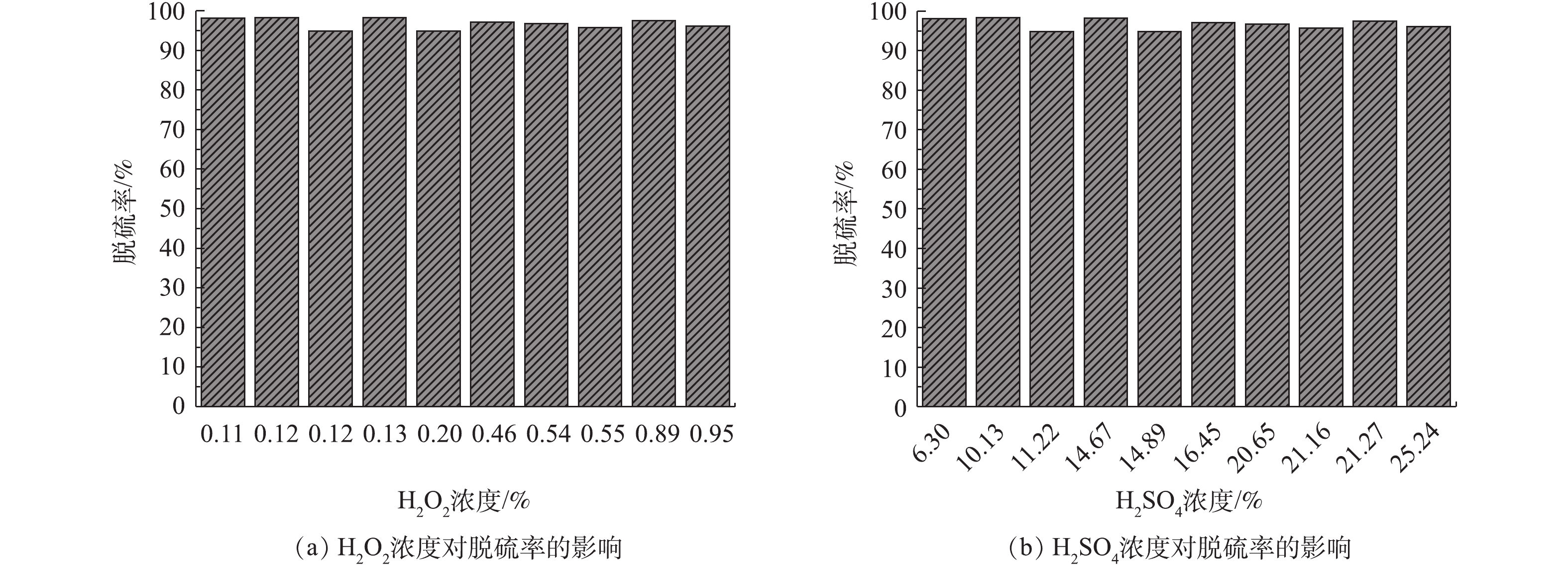
公司利用月度检修时间对原有动力波脱硫塔进行水洗后,利用动力波洗涤塔进行双氧水脱硫实验,控制不同循环液指标,实验记录(仅列出部分数据)如图3所示。图3为多次重复在动力波洗涤塔采用双氧水脱硫的实验数据记录。由图3可知,循环液中双氧水浓度、硫酸浓度与脱硫效率之间有一定的关系,在同一硫酸浓度条件下,双氧水浓度越高,脱硫效率越高;在同一双氧水浓度下,硫酸浓度越高,脱硫效率越低。在双氧水浓度为0.5%以上时,脱硫效率为85%~90%;当H2O2浓度为0.88%,H2SO4浓度为9.96%时,双氧水脱硫效率最高,为90.92%。
在实验过程中,通过检测循环液中的含固量、F含量、双氧水浓度、硫酸浓度,发现脱硫循环液中含固量、F含量较低,因此,将脱硫循环液排入干吸工序补水使用。双氧水稳定性相对较差,在金属离子或其他杂质存在时,其易发生分解。通过对排入干吸系统的循环液进行计量,计算补入干吸的脱硫循环液中硫酸总量,并与补充进入脱硫塔内双氧水理论产生的硫酸量进行比较,比较结果如表2所示。可以看出,尾气脱硫双氧水的使用效率为94%~97%,因此,脱硫循环液中含固量较低时,仅存在少量的双氧水分解。在动力波洗涤器中,含有双氧水的脱硫循环液从逆喷管下部往上喷淋,烟气从逆喷管上部进入动力波洗涤器,在逆喷管内烟气与脱硫液逆流接触进行脱硫反应。
-
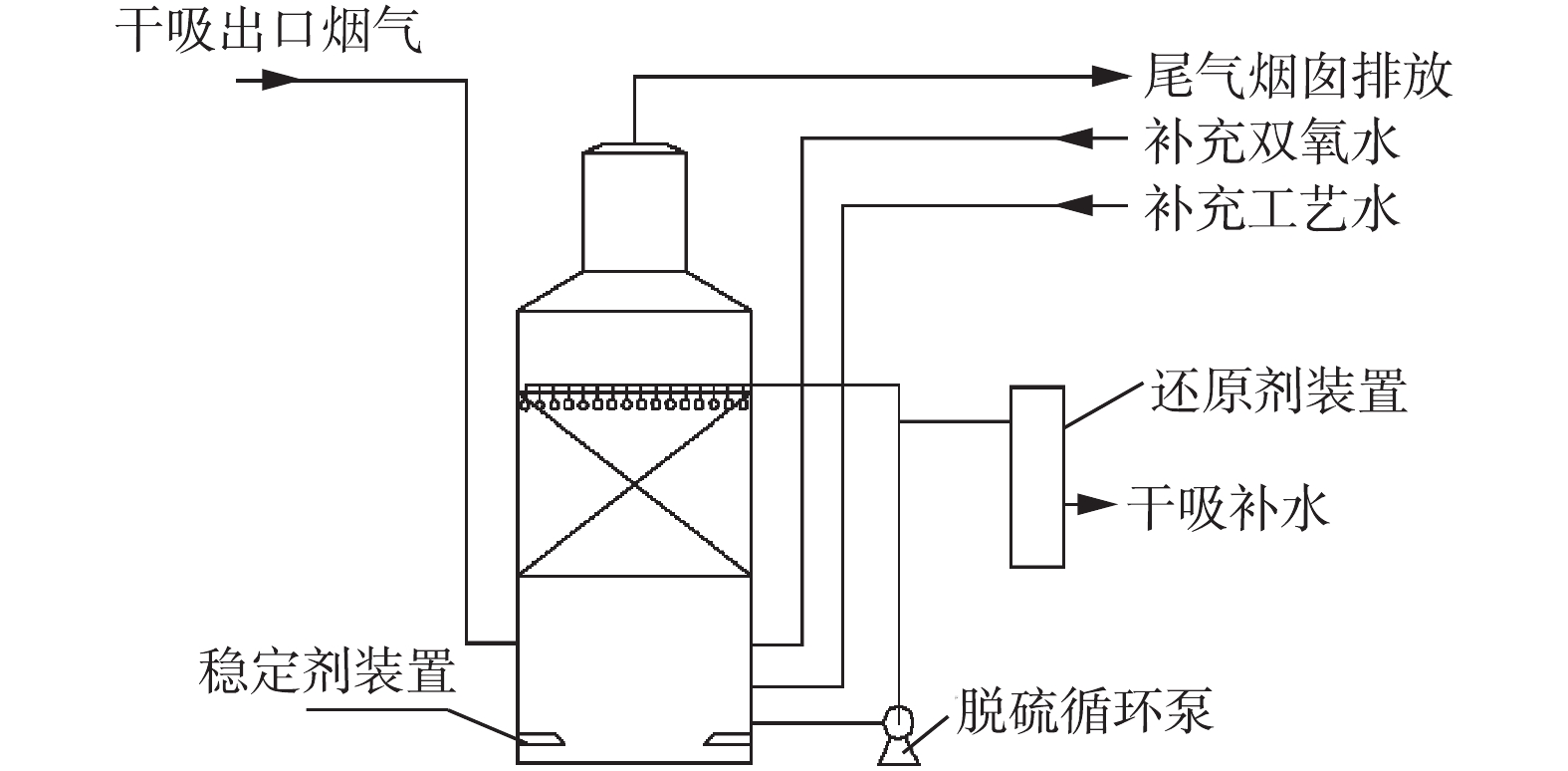
公司尾气排放工况的烟气量约为110 000 m3·h−1,原有动力波洗涤器逆喷管管径为1.5 m,逆喷管气速约为17.3 m·s−1,逆喷管长度为16 m,在逆喷管内气液接触反应时间约为0.92 s。在此条件下,脱硫效率可达90%左右,因此,公司确认将尾气脱硫改为双氧水脱硫。公司制酸尾气双氧水脱硫在2015年建成投运,工艺流程如图4所示。
双氧水脱硫塔为填料塔,脱硫泵将循环液供入填料层上部,通过分酸器进行喷洒,在填料表面形成液膜,烟气从脱硫塔下部进入脱硫塔内,烟气与脱硫液在填料层逆流接触,通过填料的传质作用,双氧水与SO2在填料层反应生成硫酸,烟气中的SO2被脱除后经烟囱排放。为减少双氧水的分解,在脱硫塔内装有稳定装置,减少双氧水的分解损耗。随着脱硫反应的进行,脱硫液中的双氧水浓度逐渐降低,硫酸浓度逐渐升高,脱硫效率逐渐降低,将含有硫酸的脱硫循环液排入中间储槽中暂存,用作干吸工序补水使用。同时,在脱硫塔内加入新水及双氧水,保持脱硫塔内液位平衡,控制循环液中双氧水及硫酸浓度,以获得较高的脱硫效率。在脱硫循环液排入中间储槽前端,设置还原装置,脱硫循环液经还原系统时,脱硫液中的双氧水被分解为水和氧气,降低脱硫循环液对硫酸成品品质的影响。
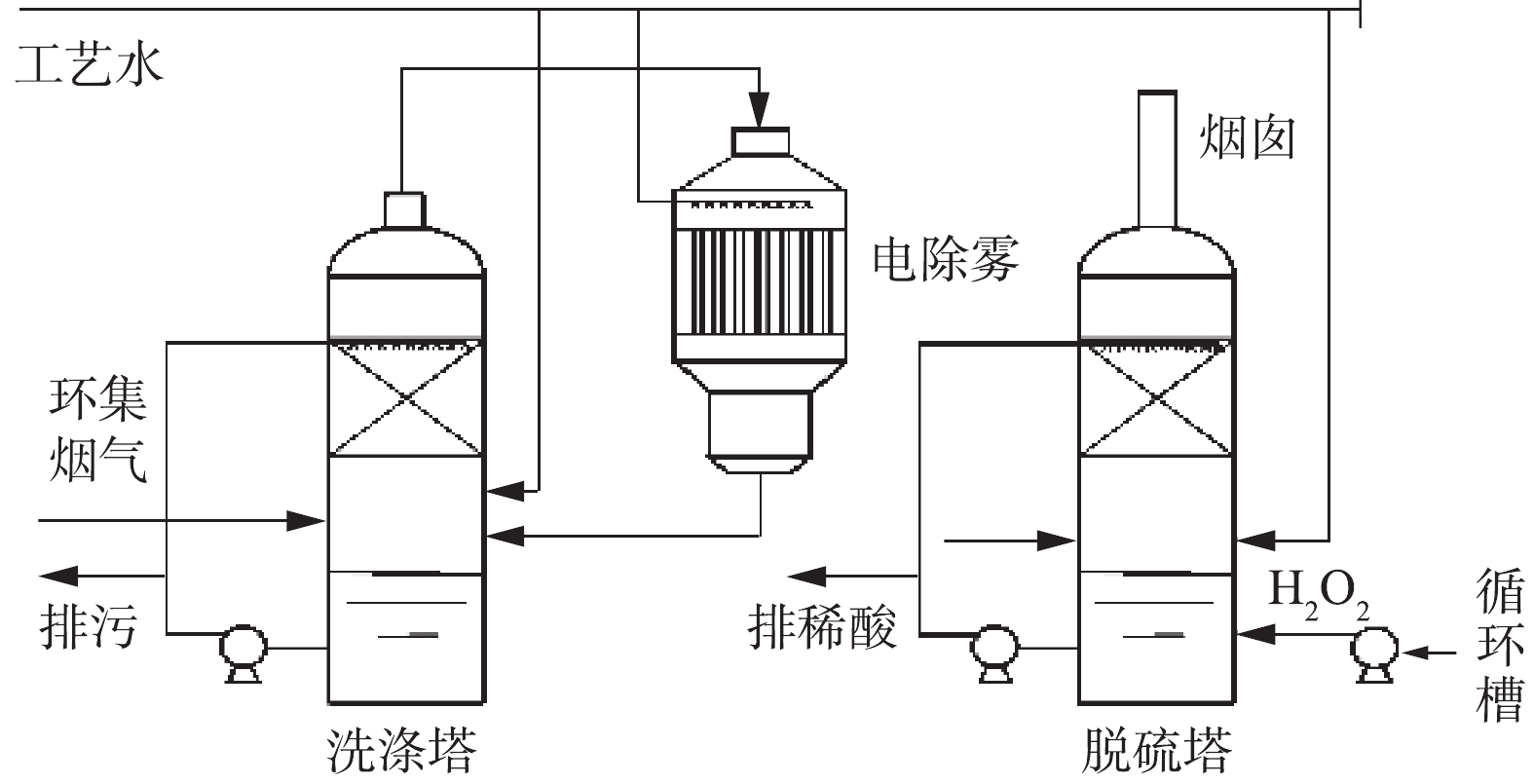
公司的环集烟气处理包含环集烟气净化与环集烟气脱硫2个工段,其流程图如图5所示。其主要工艺技术操作条件:洗涤塔出口气体温度<40 ℃;电除雾器出口气体温度<40 ℃;洗涤塔循环液温度<35 ℃;喷淋洗涤塔压降≤1 500 Pa;电除雾器压降≤1 000 Pa;含尘量<5 mg·m−3(电除雾器出口测);电除雾器二次电压为30~72 kV;电除雾器二次电流<1 200 mA;排污酸量<0.85 m3·h−1;脱硫塔出口SO2≤300 mg·m−3;脱硫塔循环液酸浓度为15%~22%(根据生产情况进行调整);循环液酸双氧水浓度为0.1%~0.5%(根据生产实际情况调整);脱硫塔液位为0.8~1.5 m;稀酸贮槽液位为0~2 m。
环集烟气首先进入布袋除尘器除去烟气中绝大部分烟尘,然后经环集风机将烟气送入环集洗涤塔,进一步除去烟气中残余的烟尘。同时将烟气温度降低至35 ℃左右,在洗涤过程中,烟气中的SO3与水分子发生反应,并以烟气中的残余的颗粒杂质为核心形成硫酸雾。因此,在环集洗涤塔出口设置1台高效电除雾器,将洗涤过程产生的硫酸雾进行去除。经环集布袋除尘、环集洗涤塔、环集电除雾后,烟气中约99%的固体杂质和可溶性气态杂质可被去除,含有SO2的干净烟气进入环集脱硫系统,SO2与脱硫循环液中双氧水在填料层接触反应被去除。环集脱硫液经还原装置分解双氧水后排入干吸系统作补水使用。双氧水脱硫投入运行后,环集烟气的脱硫效率统计如图6所示。由图6可知,稀酸浓度接近10%时,脱硫效率可达97%~98%;当H2O2的浓度为0.12%,H2SO4的浓度为11.22%时,双氧水脱硫效率可高达98.3%。在开停车时SO2浓度较高,通过提高双氧水浓度并降低稀硫酸浓度,可保证获得较高吸收效率,在进口浓度不高于7 000 mg·m−3时,可保证尾气排放SO2达标。双氧水脱硫采用填料塔脱硫效率远高于动力波脱硫塔,因此,在系统开车时,可缩短低负荷运行时间,降低开停车时段能耗。
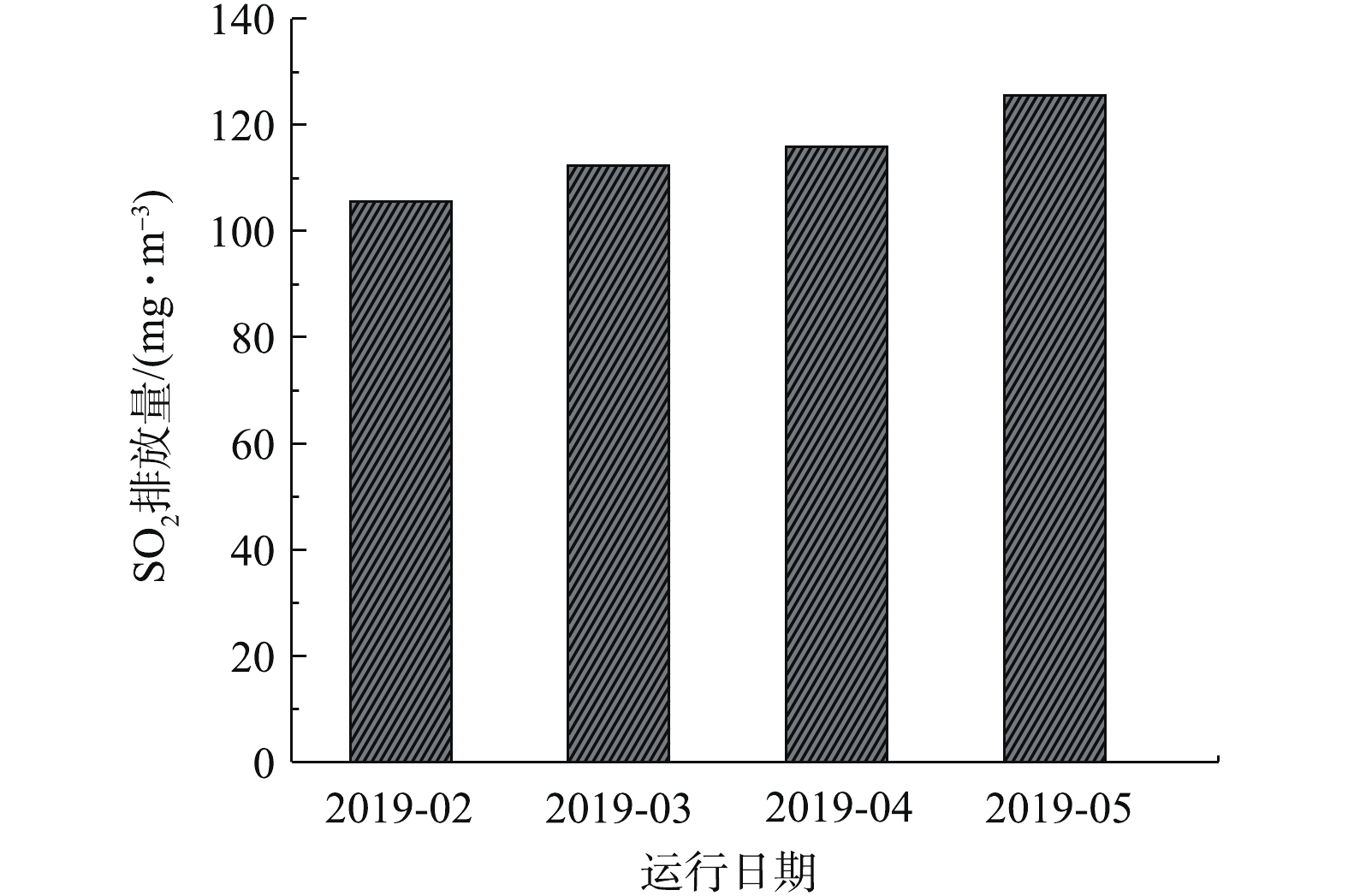
图7列出了公司2019年2—5月使用双氧水脱硫后的SO2排放量。可以看出,经双氧水脱硫后,SO2的排放值远低于国家标准,且脱硫效果稳定。双氧水脱硫后SO2的排放值远低于氨法脱硫后的SO2排放值,脱硫效果较氨法更好,脱硫效率高。公司双氧水填料脱硫塔塔径为5 m,填料高度为3.5 m,塔内气速约为1.56 m·s−1,通过填料层时间约为2.24 s,反应时间是动力波洗涤塔的2.43倍。填料塔填料为海尔环,大大增加了气液接触面积,因此,双氧水脱硫采用填料塔,脱硫效率远高于动力波洗涤器,且其脱硫效率高于氨法的脱硫效率。
3.1. 双氧水脱硫的原理
3.2. 采用双氧水脱硫工艺的初试情况
3.3. 改双氧水脱硫工艺后的运行情况
-
氨法脱硫技术成熟,工艺相对简单,但在实际应用过程中仍会存在一定的问题。氨法脱硫过程中氧化率越低,结晶母液中硫酸铵含量就越低[20]。此外,金属离子的大量存在,pH的升高,系统物料平衡的破坏,溶液中杂质和油的存在都会抑制硫酸铵晶体的生长,所得到的结晶产品颗粒小而多[21]。目前氨法脱硫过程中还存在脱硫装置的腐蚀、氯离子浓度的增加、氨逃逸和气溶胶控制等问题[22-23]。
双氧水脱硫是目前比较成熟的尾气脱硫工艺,多用于硫酸制酸系统的尾气脱硫,其产生的纯净稀硫酸可回收利用。双氧水脱硫吸收效率高,可以达到97%,脱硫活性强、反应迅速,可以通过精确控制双氧水的加入量保证脱硫效率[24]。脱硫过程生产的副产物稀硫酸可以作为干吸工序的补充水回收,不需二次加工,降低了回收成本,同时没有新的固体废物和废气废水产生排放,是典型的清洁生产工艺技术。相比氨法脱硫,双氧水脱硫流程简短,投资成本低,没有结晶堵塞脱硫塔等问题,系统阻力相对较小。双氧水也可用于脱除NOx,将NO、NO2等氧化成极易溶于水的N2O5,N2O5遇水生成硝酸后随硫酸被去除,使用双氧水联合脱硫、脱硝一体化技术可以有效降低运行费用和场地空间等[25]。但H2O2具有遇杂质和高温非常容易分解的特性,容易增加成本消耗,严重者有发生爆炸的危险,工艺中须设置稳定剂;H2O2氧化性强,对设备管道选材有特殊要求,增加了投资费用,且在运输、贮存、使用中应采取防爆、防泄漏、防中毒措施[26]。
-
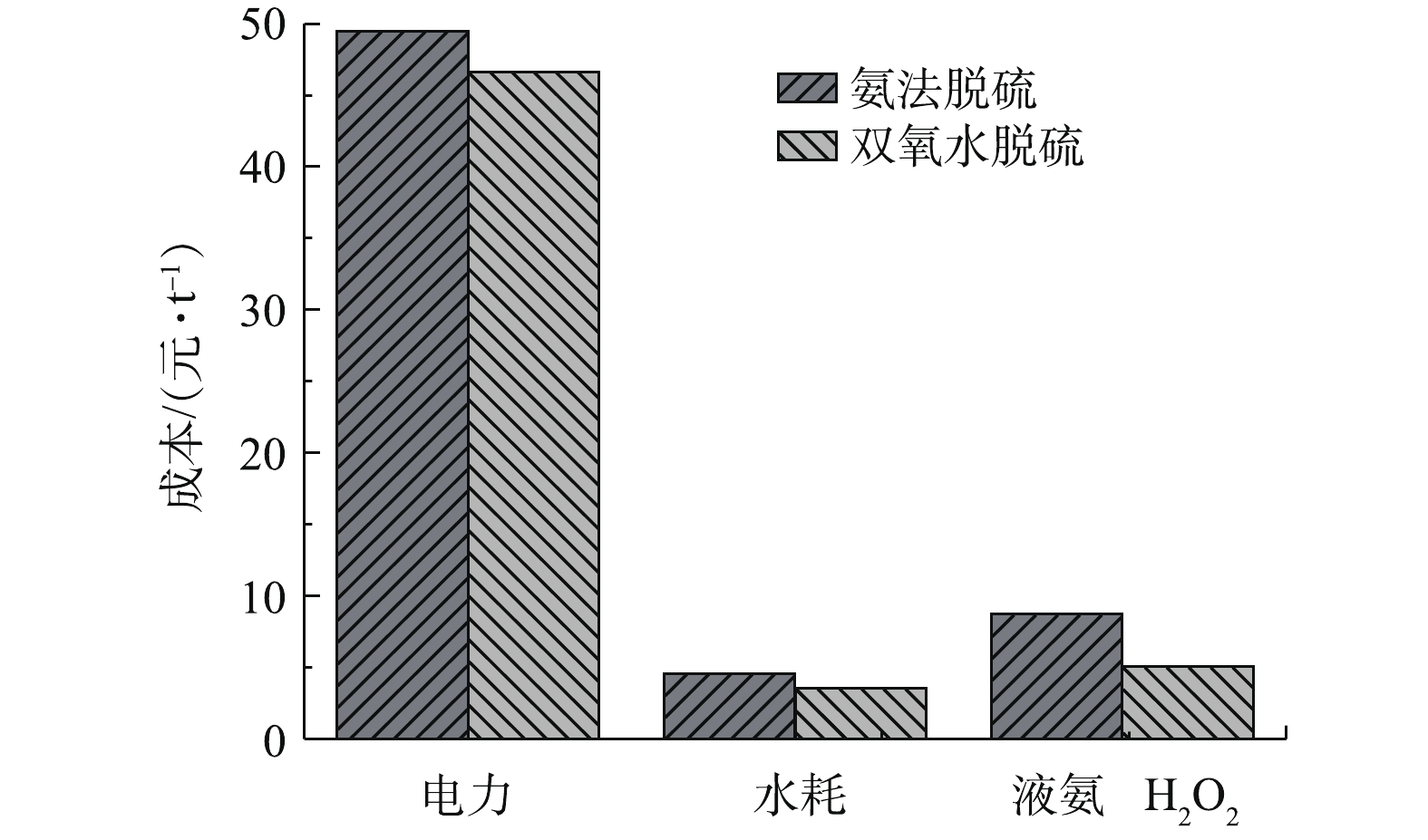
氨法脱硫和双氧水脱硫技术的具体比较如表3所示。由表3可知,双氧水脱硫在投资成本、占地面积、运行费用、水电耗、脱硫效率、设备维修等方面均比氨法脱硫更具有优势。且双氧水脱硫的副产物稀硫酸可全部回收利用,无二次污染。公司将氨法脱硫改为现运行的双氧水脱硫,脱硫效率有所提高,投资成本减少,水电消耗减少。氨法脱硫和双氧水脱硫运行所需水电耗、投资成本对比结果如图8所示。由图8可知,在将氨法脱硫工艺改为双氧水脱硫后,全硫酸厂的电耗由49.48元·t−1(以酸计)降为46.63元·t−1,全硫酸厂的水耗由4.57元·t−1降为3.53元·t−1;主系统吨酸双氧水成本为5.04元·t−1,脱硫率由93%提高到97%,尾气排放值由224.95 mg·m−3降为80.25 mg·m−3。实践证明,双氧水脱硫较氨法脱硫具有明显的优势:脱硫效率高、水电耗少、投资成本小。此外,双氧水脱硫在副产物的回收、设备维护上也具有一定的优势,尤其是在清洁生产上,在整个去除尾气的过程中,没有新的废物产生,从而减少了二次污染。
4.1. 运行情况的比较
4.2. 2种技术经济效益的比较
-
1)对铜冶炼制酸尾气的处理方法进行比较,双氧水脱硫较氨法脱硫更具优势。氨法脱硫工艺简单,技术成熟,但工艺流程相对复杂;双氧水脱硫流程简易,投资少。双氧水脱硫为单塔设计,可同时进行吸收反应和副产品的回收,相关配套设备少,流程简单易控制,可操作性强,不需要额外的操作人员,投资成本和运行成本低,占地面积小,故双氧水脱硫具有经济可行性。
2)实践证明:氨法脱硫效率大约为93%,双氧水脱硫效率≥97%,脱硫效率有所提高;双氧水脱硫中双氧水活性强、反应快,使SO2的排放控制指标远低于排放标准,脱硫后尾气中SO2的浓度由224.95 mg·m−3降为80.25 mg·m−3,且脱硫效果稳定,故双氧水脱硫具有可操作性。
3)改进后的双氧水脱硫工艺采用填料塔脱硫效率远高于动力波脱硫塔,使用填料塔脱硫开停车时SO2浓度较高,通过提高双氧水浓度并降低稀硫酸浓度,可保证获得较高吸收效率。
4)实践证明,双氧水脱硫工艺技术是具有可行性和经济性的,处理过程中无二次污染,属于典型的清洁生产工艺,将会在相关行业得到广泛应用。





 DownLoad:
DownLoad:
 百度学术
百度学术


