-
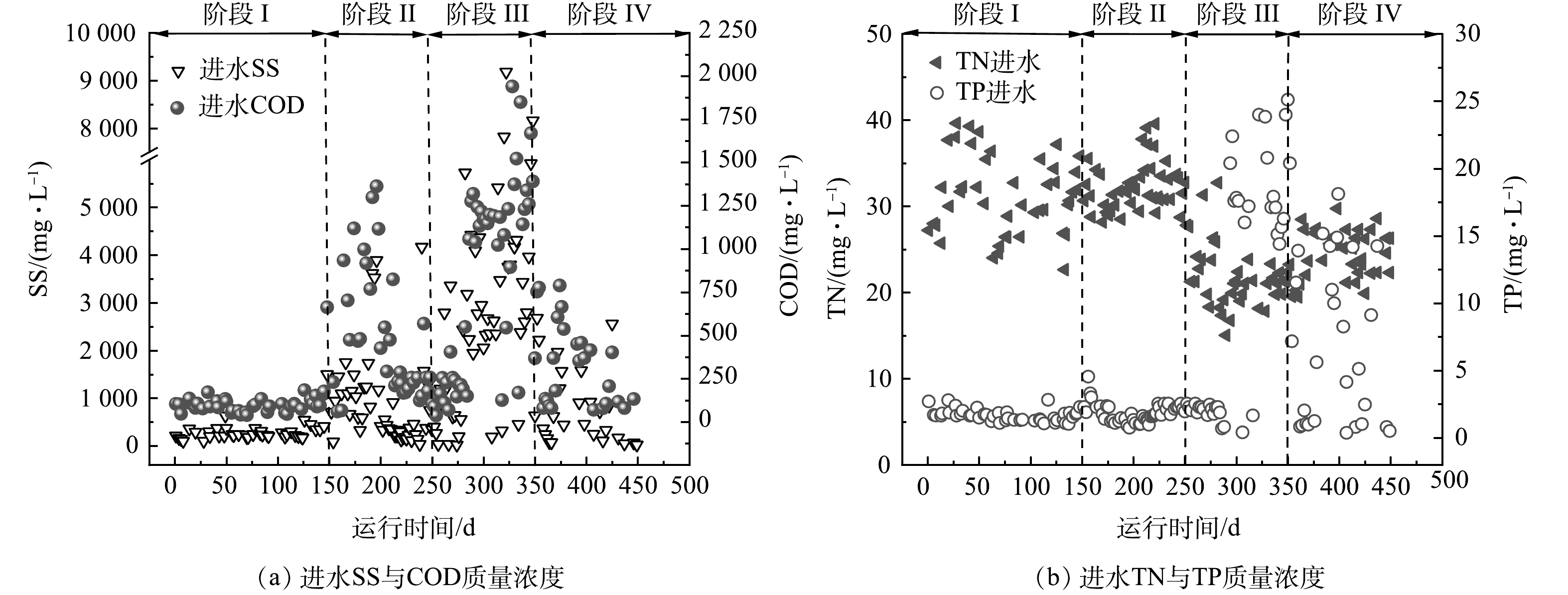
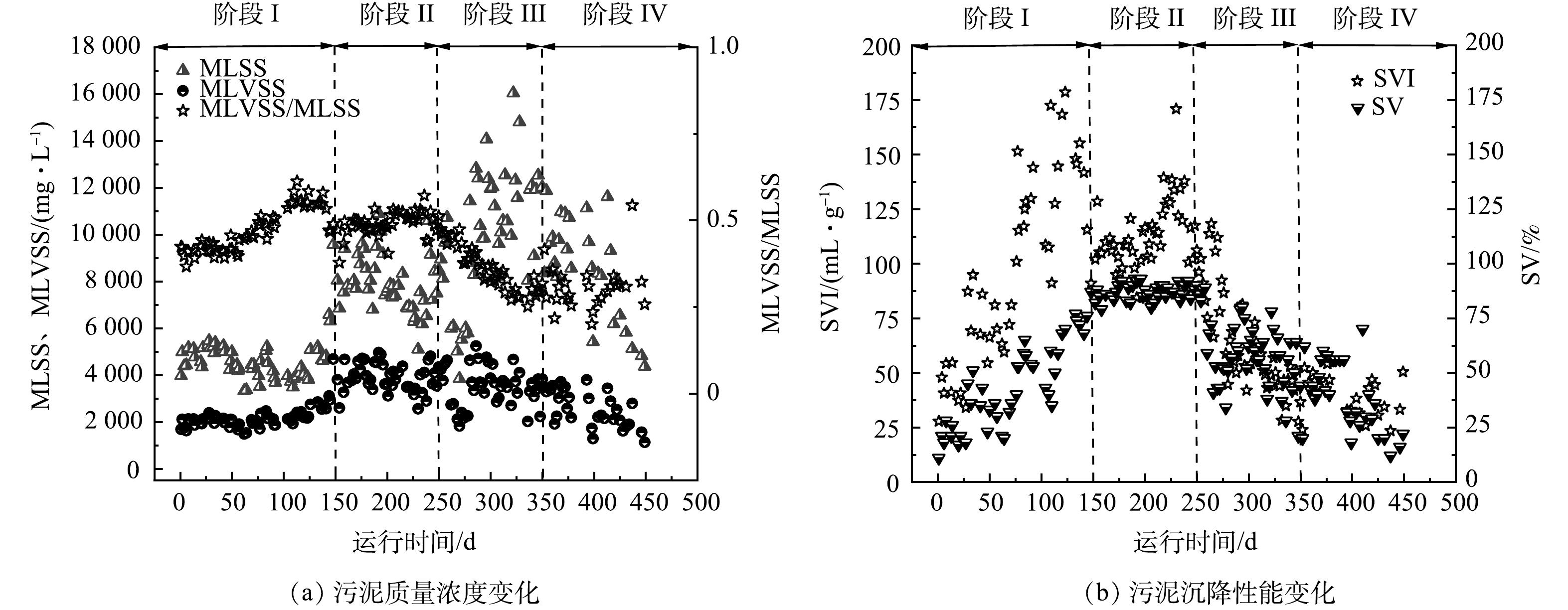
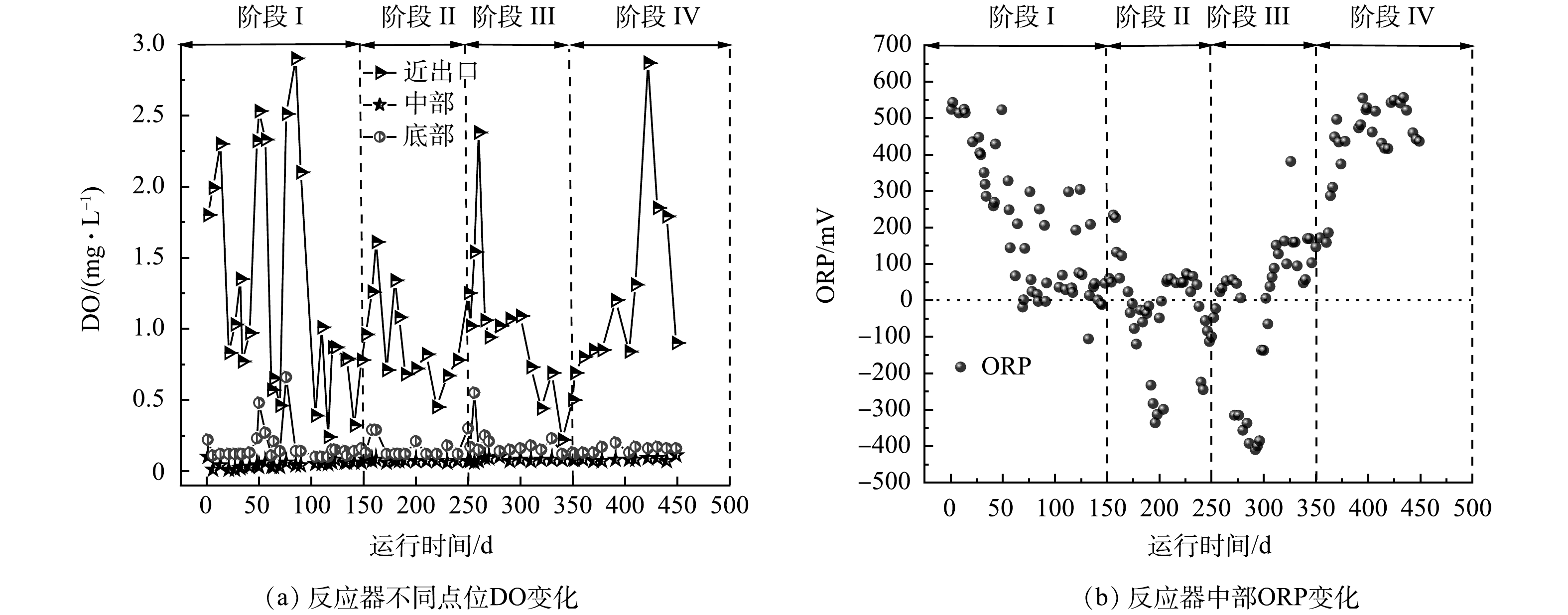
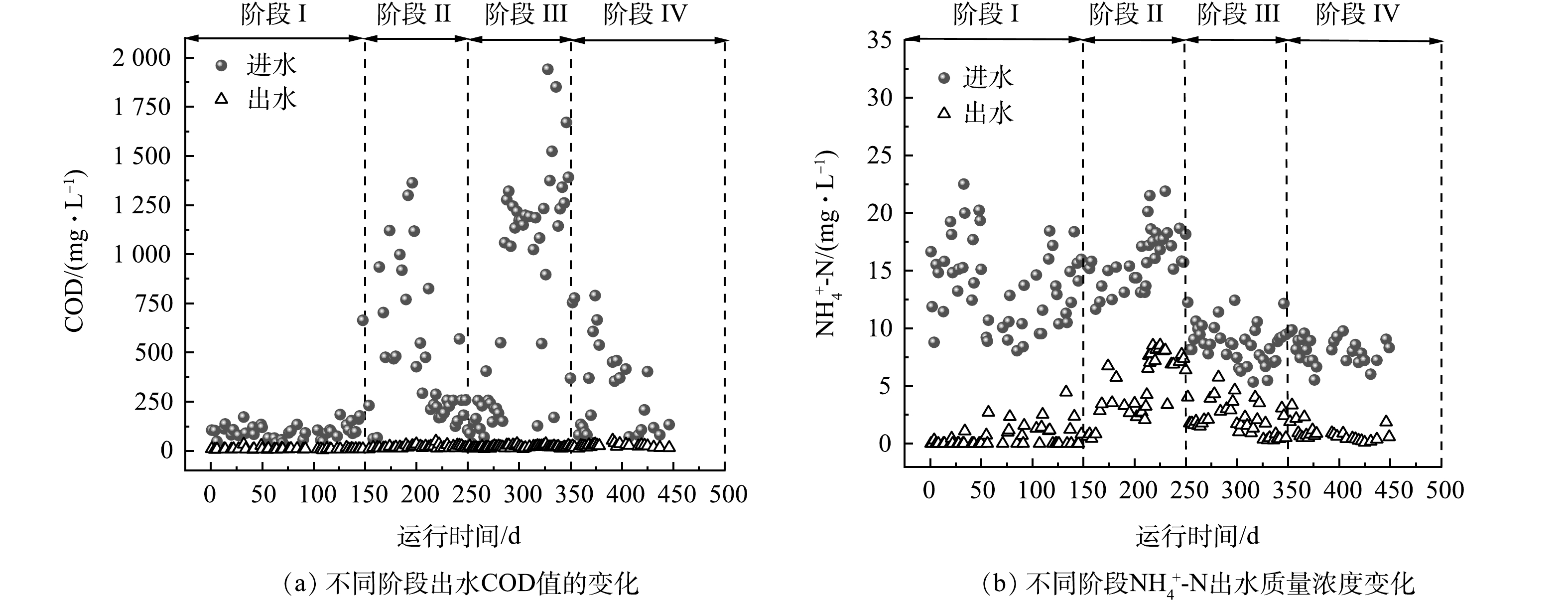
我国餐厨垃圾产量巨大,每年产量大约为8.28×107 t,且逐年增加[1],因此,合理处理餐厨垃圾是我国面临的一个重要挑战。餐厨垃圾富含有机质,是厌氧生物处理的理想原料[2]。使用厌氧消化技术处理餐厨垃圾,能够在处理餐厨垃圾的同时产生甲烷,实现资源化[3]。然而,在实际应用中,餐厨垃圾厌氧消化往往面临酸化时间较长和产甲烷速率低等问题[4]。许多研究表明,将生物炭作为添加剂投放到厌氧消化体系中,可以有效缓解酸抑制,促进产甲烷[5-8]。WANG等[9]发现,蚯蚓粪便制成的生物炭可促进体系中挥发性脂肪酸(volatile fatty acids, VFAs)的降解,从而提高餐厨垃圾厌氧消化;SUNYOTO等[10]发现,木屑生物炭可以使餐厨垃圾厌氧消化的最大产甲烷提高41.6%,并缩短酸化停滞期。
生物炭是生物质在缺氧条件下热解得到的碳化物[11],其来源广泛,包括粪便、木质垃圾以及市政污泥等。我国每年产生大量的城市污泥,截至2017年,我国城镇污泥年产量达到3.75×107 t[12]。将污泥制成生物炭可以有效实现污泥的减量化,减少污泥中的病原菌等有机污染,提高污泥废弃物的再利用[13]。然而,目前鲜有研究使用污泥基生物炭作为餐厨垃圾厌氧消化的添加剂。
接种比(inoculum to substrate ratio, ISR)是餐厨垃圾厌氧消化中的一个重要影响因素,对反应的代谢产物及运行稳定性有重要影响[14]。ISR的不同将会使厌氧消化体系的相对有机负荷不同,从而影响其酸化程度。有研究表明,生物炭具有酸性缓冲能力,可以提高厌氧消化的pH[10, 15]。然而,生物炭对不同酸化程度的厌氧消化影响尚不明朗。本研究主要通过设置不同接种比,模拟得到不同酸化程度的餐厨垃圾厌氧酸化体系,观察污泥基生物炭缓解酸化抑制的能力;通过分析产甲烷效果以及反应器微生物群落结构变化,探究污泥基生物炭对餐厨垃圾厌氧消化的影响,从而为污泥基生物炭在餐厨垃圾厌氧消化的实际应用提供参考。
全文HTML
-
生物炭原材料来自深圳市南山区滨河污水处理厂脱水污泥。接种污泥取自同一污水处理厂二沉池厌氧污泥。淀粉类垃圾是餐厨垃圾最重要的组成部分[16],占比可高达65%[17],且淀粉类物质在餐厨垃圾厌氧消化产甲烷过程中起到关键性作用[18],故本实验使用可溶性淀粉模拟餐厨垃圾。接种污泥和餐厨垃圾的基本性质如表1所示。
-
污泥基生物炭通过慢速热解而成,其制备方法如下:向热解管式炉(深圳市三利化学品有限公司;内径74 mm,有效热解区长400 mm)中通入N2(99.99%,流量为400 mL·s−1),将盛有干污泥的坩埚置于管式炉出气口,吹扫5 min,以驱赶原料中的氧气;后将坩埚放入管式炉有效热解区,管式炉以10 ℃·min−1的速率加热至500 ℃,并保温0.5 h;等热解产物冷却至室温后,将其研磨并筛选粒径为425~840 μm的颗粒,置于105 ℃的烘箱中,烘干保存备用。
-
采用批式实验方法,用体积为250 mL的血清瓶作为反应器,设计4种不同接种比,即2.0、1.5、1.0和0.5(以VS计),每种接种比分别有生物炭组(分别命名为2-SSB、1.5-SSB、1-SSB和0.5-SSB)、餐厨垃圾对照组以及空白组。生物炭浓度为5.0 g·L−1,生物炭组和对照组的餐厨垃圾干重浓度均为4.0 g·L−1。加入相应材料后,添加超纯水,使反应器有效工作体积为200 mL。对反应瓶的内部,用N2(纯度99.99%)吹洗2 min以上,保证厌氧环境,用橡胶塞和铝盖密封。将反应器置于恒温35 ℃培养箱培养,每天测量气体体积,检测气体组分(甲烷、二氧化碳);每隔一段时间检测液体的pH,直到实验结束。采取实验初期(第7天)和实验中后期(第21天)时的微生物样品,用于微生物群落测序。每组实验设置3个平行样,以保证实验数据的准确性。
-
污泥TG/DSC分析使用同步热分析仪(梅特勒托利多,瑞士)。利用美国麦克公司的快速表面积和孔隙分析仪(ASAP2460,US),测样品BET比表面积和微孔比表面积。在样品的孔径分布上,利用非定域密度函数理论(non-local density function theory,NLDFT)[19]进行分析。将生物炭与超纯水按质量∶体积=1 g∶10 mL的比例混合均匀,于恒温振荡器中(25 ℃,150 r·min−1)振荡5 h,用pH计(梅特勒,瑞士)测定上清液的pH,即为生物炭的pH。污泥基生物炭及其原材料的灰分组成使用能量色散X射线荧光分析法(EDX-LE,Shimadzu,Japan)分析,工业分析方法参考GB/T 17664-1999。污泥基生物炭及其原材料的物理化学性质见表2。
使用30 mL和100 mL规格的玻璃注射器测量气体体积;气体组分(CO2和CH4)通过气相色谱GC(安捷伦7890B,美国)进行检测,以He作为载气,检测器为热导检测器,进样口、柱箱和检测器温度分别为80、80和250 ℃。液体的pH由pH计(梅特勒,瑞士)直接检测。
修正的Gompertz模型在厌氧消化研究过程中的拟合应用非常广泛,相关参数可以作为抑制效果及厌氧消化效率的评价依据[20],使用Origin Pro 2019对其进行拟合,模型方程见式(1)。
式中:M(t)为t时刻单位VS甲烷的累积产率,mL·g−1;Mmax为最终单位VS甲烷产量,mL·g−1;Rmax为最大单位VS甲烷产率,mL·g−1;λ为停滞期,d;t为实验持续的时间,d;e=2.718 3。
微生物群落分析委托上海美吉生物医药科技有限公司进行分析。使用E.Z.N.A.® soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)提取样品中的DNA,DNA浓度和纯度利用NanoDrop2000分光光度计(Thermo Scientific, Wilmington, USA)进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;用338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对V3~V4可变区进行PCR扩增,扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s, 72 ℃延伸30 s),最后72 ℃延伸10 min;然后,使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit (AxygenBiosciences, Union City, CA, USA)进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST (Promega, USA)进行检测定量。根据Illumina MiSeq平台(Illumina, SanDiego, USA)标准操作规程,使用纯化后的扩增片段构建PE 2*300的文库。利用Illumina公司的Miseq PE300平台进行测序。
1.1. 实验材料
1.2. 污泥基生物炭的制备
1.3. 实验设计
1.4. 分析方法
-
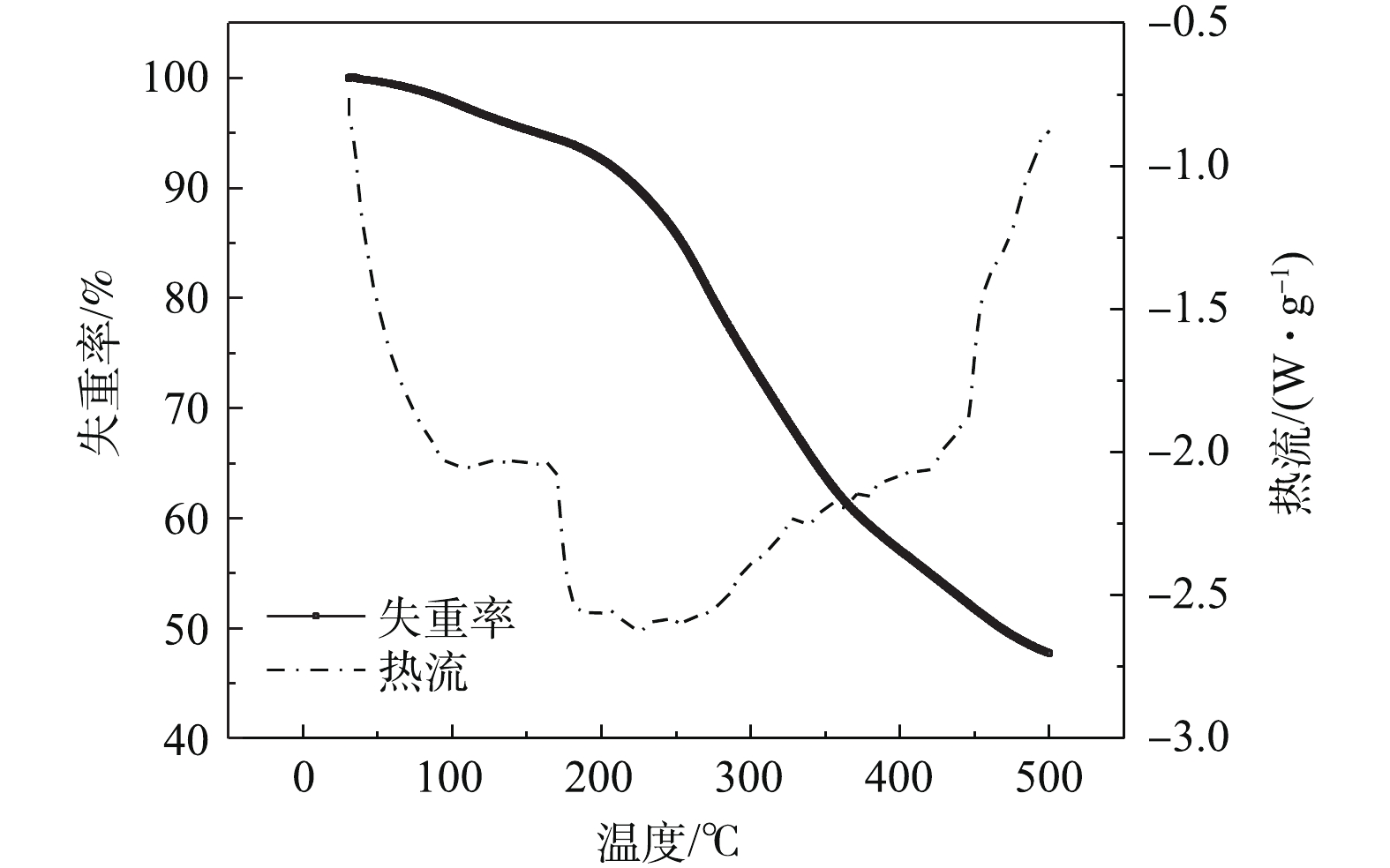
图1展示了污泥以10 ℃·min−1的慢速升温到500 ℃的TGA/DSC曲线。从TGA曲线可以看出,此热解过程大致为2个阶段:第1阶段发生在大约250 ℃以下,该过程主要是污泥样品的脱水和少量挥发性物质的挥发阶段;第2个阶段(250~500 ℃)主要是污泥中的纤维素等糖类化合物发生分解的阶段[21]。该结果与廖艳芬等[22]的研究相似。对比DSC曲线上可以看出,污泥热解前期为吸热过程,在200~300 ℃呈现1个吸热峰;后期直到500 ℃为放热过程。500 ℃后,失重率开始下降,说明此时污泥中的有机物大多分解殆尽,剩余物质以灰分和固定碳为主。通过对灰分的组成分析(表2),相比污泥原材料,污泥基生物炭中Fe、Al以及碱金属K、Ca和Mg等元素比例增加,该生物炭的pH约为7.22,与REGKOUZAS等[23]得到的结果类似。生物炭的BET比表面积较大,约为54.18 m2·g−1,其结果与REN等[24]报道的相似;微孔比表面积约为54.23 m2·g−1,与BET比表面积相差不大。该生物炭的热解终温为500 ℃,此时孔径分布曲线见图2,由此可知,介孔(2~50 nm)的上峰较多,说明该生物炭孔隙较为丰富。
-
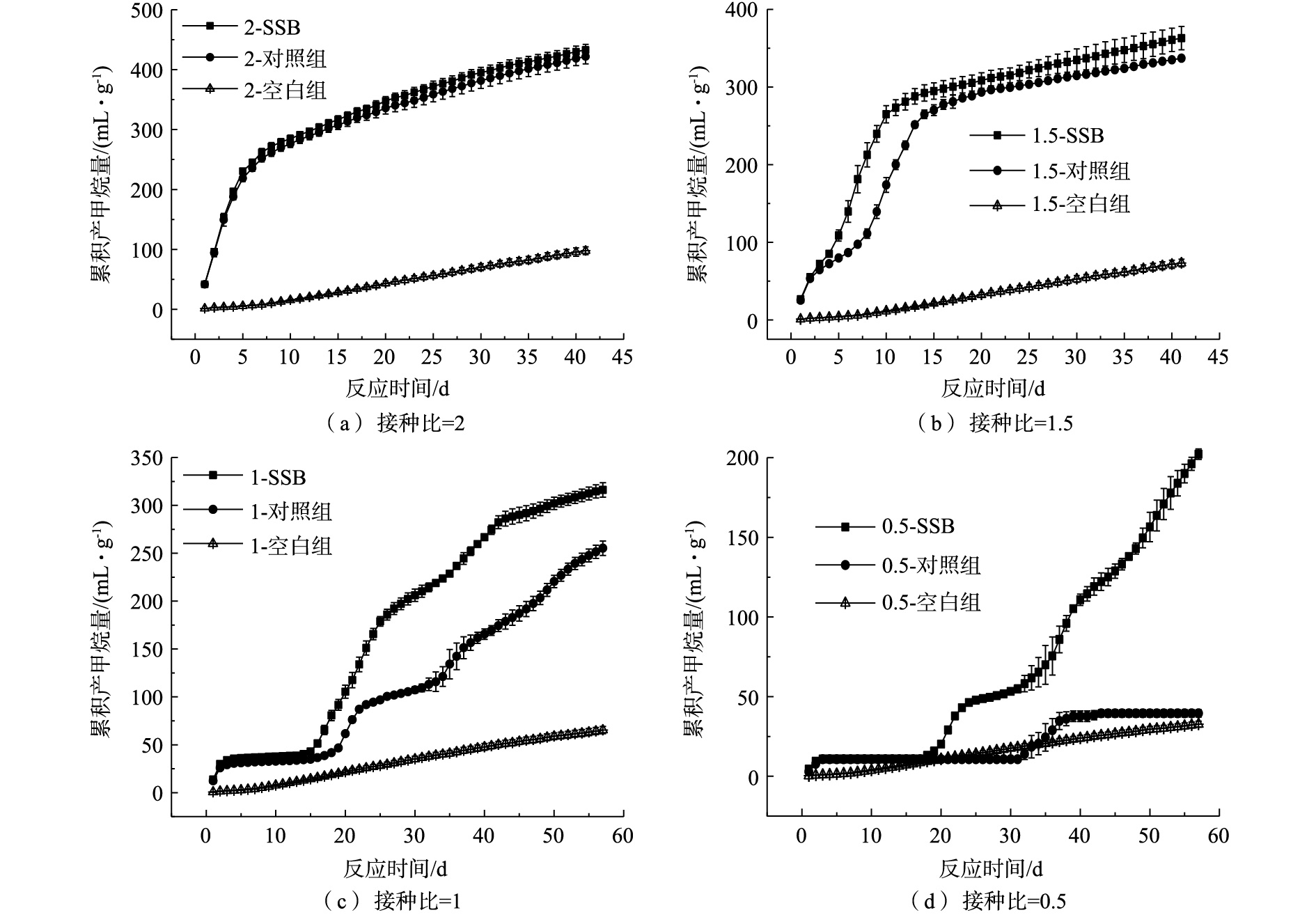
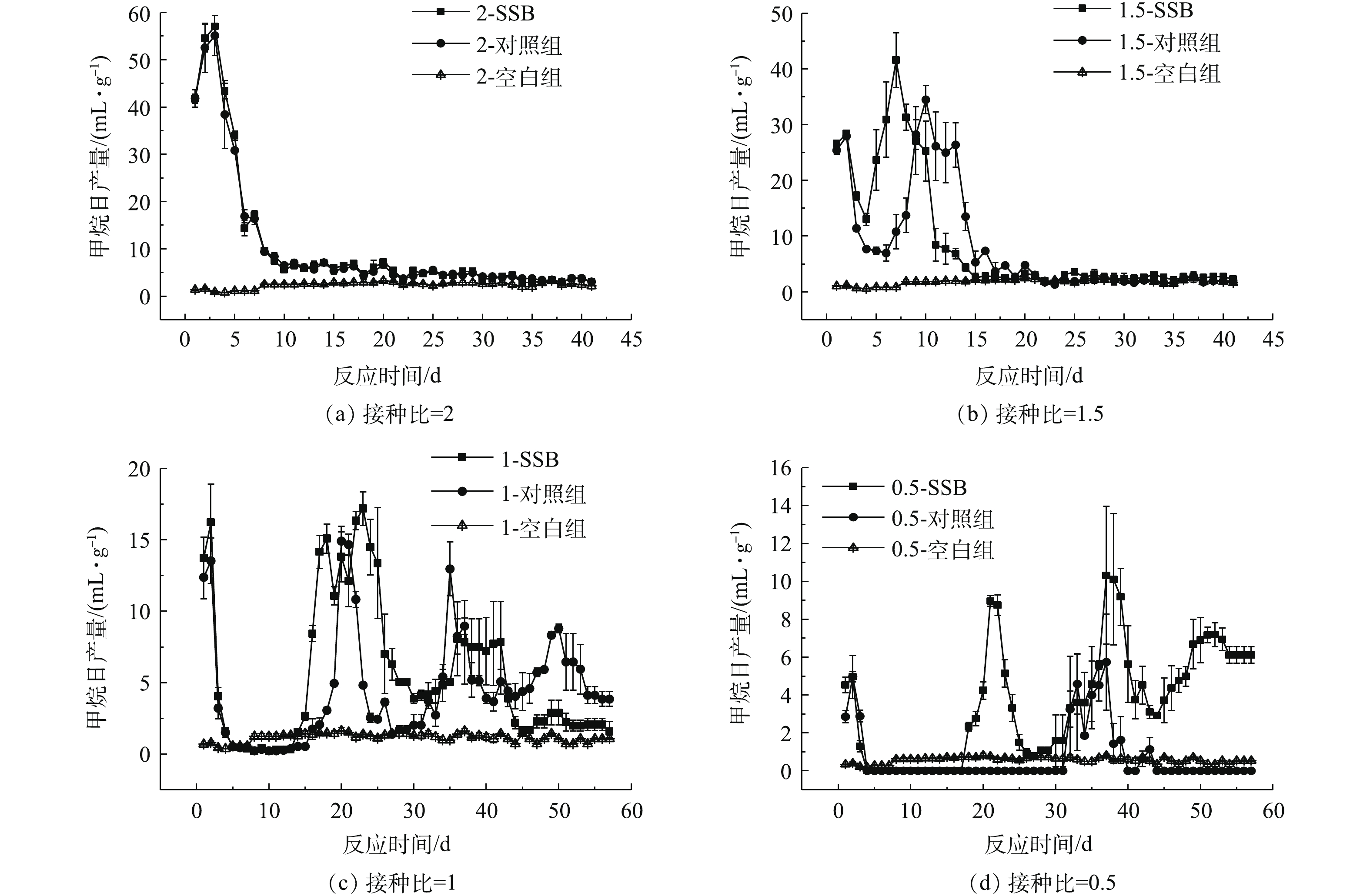
图3为各接种比下累积产甲烷量随反应时间的变化情况。如图3(a)和图3(b)所示,当ISR较高时,体系本身接种物浓度较高,厌氧消化反应启动稳定。因此,此时污泥基生物炭对促进产甲烷的方面并无明显作用。当ISR为1.5、1和0.5时,投加生物炭,提高了餐厨垃圾厌氧消化累积产甲烷量,且ISR越小,说明投加生物炭的效果越明显。截至反应第57天(实验结束),1.5-SSB、1-SSB和0.5-SSB的最终甲烷累积量分别为363.02、316.19、202.24 mL·g−1(以VS计),相比对照组,1.5-SSB和1-SSB对累积产甲烷分别提高了7.7%、23.8%。而当ISR为0.5时,酸化抑制进一步加重,对照组经历了较长的抑制期才开始产甲烷,投加生物炭后,产甲烷潜力得以恢复,0.5-SSB最终累积产甲烷量约为对照组的5.12倍。
图4反映了各组反应器甲烷日产量变化。当ISR=2时,添加污泥基生物炭与否未影响餐厨垃圾厌氧消化产甲烷的速率;随着ISR的减小,生物炭组与其对照组的反应情况开始逐渐产生差别。1.5-SSB在第7天达到了产甲烷高峰,比其对照组提前了3 d,且最大甲烷日产量相比对照组提高了20.59%。当ISR为1和0.5时,反应过程中的甲烷日产气量不够稳定,各组均出现多个产气高峰。房明等[25]也发现接种比会对产气高峰数量产生影响。同时,生物炭组的最大甲烷日产量仍高于其对照组,1-SSB和0.5-SSB的最大甲烷日产量分别高于其对照组15.2%和79.8%。
接种比的减小使产甲烷过程受到了不同程度的抑制,应用修正的Gompertz模型对添加污泥基生物炭的厌氧消化产甲烷进行拟合,结果如表3所示。可以发现,该模型可以较好地模拟不同ISR下污泥基生物炭对厌氧消化的产甲烷过程。拟合所得的最终累积甲烷产率Mmax随着ISR的减小逐渐下降,与实际的产甲烷率下降幅度和趋势均保持一致。此外,通过拟合得到的λ反映了厌氧消化过程中的停滞期,有效地量化了酸化抑制程度。当ISR为2或1.5时,并未出现明显的停滞期,说明此时接种物浓度适宜,反应体系较为稳定。当ISR减小为1或0.5时,投加污泥基生物炭使产甲烷停滞期分别缩短了22.1%和28.9%。
通过对比各组产甲烷情况发现,ISR足够大时,接种污泥浓度较高,接种污泥能够快速实现对底物的适应过程[26],且整个消化过程生物炭组和对照组的厌氧消化系统均表现出各微生物之间相互协调、相互共生的关系[27],故生物炭的作用效果较为微小。当ISR减少,反应器中的厌氧消化微生物数量随之减少,不足以利用VFA产甲烷,导致VFA过量累积,再次抑制了部分产甲烷菌的活性[28]。相比对照组,添加生物炭缩短了餐厨垃圾厌氧消化的酸化停滞时间。SUNYOTO等[10]也发现了类似的效果。该污泥基生物炭拥有较大的比表面积,介孔的数量较多,其丰富的孔隙为微生物的生长提供了生长位点,也增加了微生物的数量,增强了对微生物的富集,从而促进了VFA的利用效率,提高了甲烷产率[29]。
-
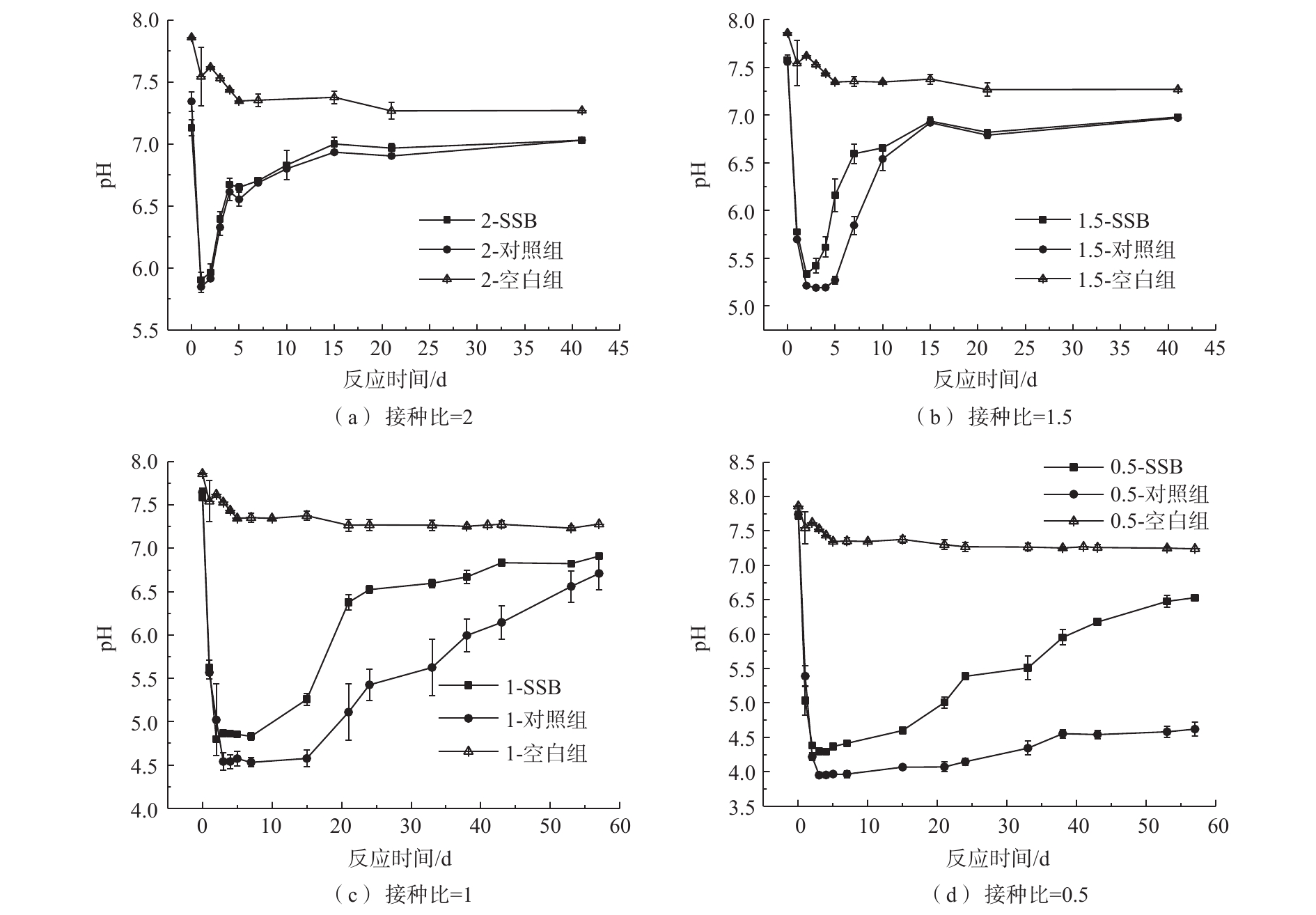
图5表示污泥基生物炭对厌氧消化pH的影响。反应前1~5 d,各反应器的pH均有不同程度的下降。随后,不同ISR下的pH增长速度不同。ISR为2时,投加生物炭与否对厌氧消化pH没有明显的作用。当ISR为1.5、1和0.5时,接种物浓度减小,体系更加酸化,此时投加生物炭提高了pH上升速度,使得生物炭组的酸化程度轻于其对照组。随着ISR的减小,实验结束时,生物炭组和其对照组的pH相差越大。当ISR降为0.5时,pH长期处于较低的值,说明反应体系的酸化严重,产生大量VFA并累积[30]。0.5-SSB和0.5-对照组的pH最低值分别为4.29和3.95。0.5-对照组最终pH维持在4.5左右,直到实验结束,也无法恢复到利于厌氧消化产甲烷的值(6.8~7.8)[31],此时也几乎没有甲烷生成,说明反应失败。而0.5-SSB的pH最后缓慢上升到6.5左右。说明当酸化严重时,投加生物炭可以缓解酸抑制,促进反应的稳定性。从灰分组成(表2)中可以看出,该污泥基生物炭中含有K、Ca和Mg等碱金属元素,元素在厌氧消化中可能释放出来并与CO2反应生成
HCO−3/CO2−2 ,从而提高系统的缓冲能力[32]。PAN等[15]也发现,生物炭中存在的K、Ca等元素不仅可以作为体系中微生物生长的营养元素,同时也增强了体系的酸缓冲能力。SUN等[6]和WANG等[9]也通过研究发现生物炭的缓冲能力可以帮助缓解厌氧消化体系中VFA的累积。 -
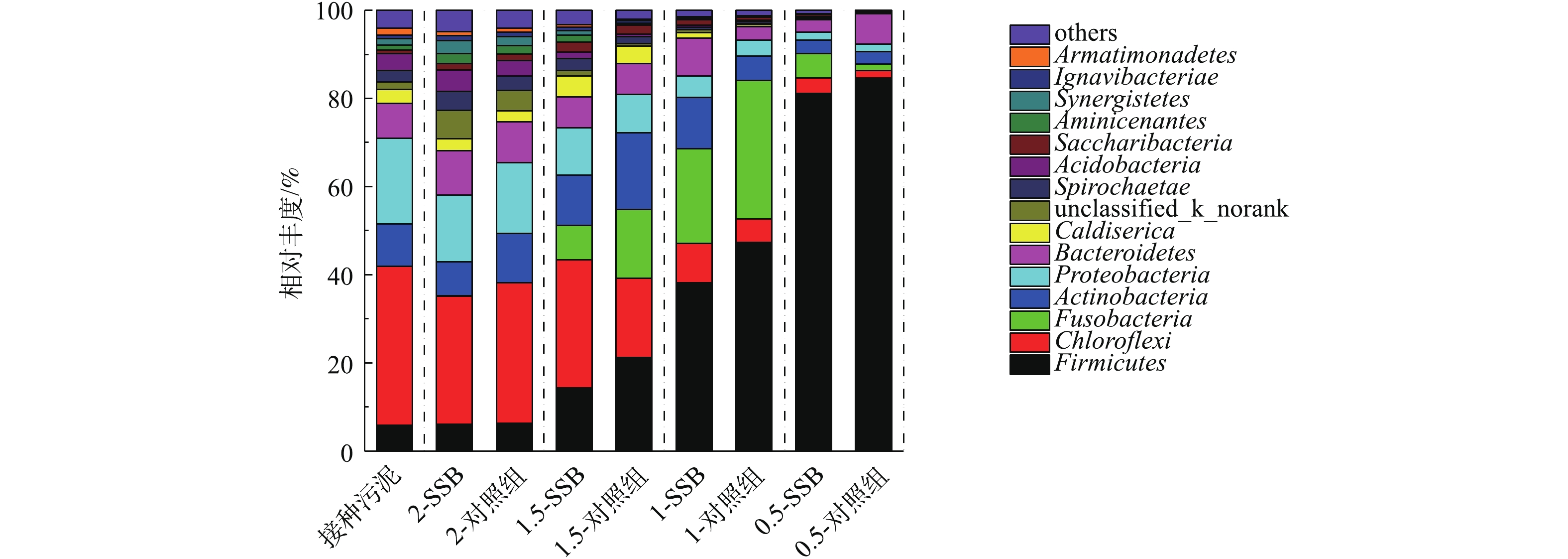
1)细菌群落结构分析。图6是反应早期(第7天)各组厌氧消化反应器中细菌微生物在门水平上的分析结果。细菌可以直接参与有机质厌氧消化的降解过程[33]。在本实验中,接种污泥的主要菌群分别为Chloroflexi (36.06%)、Proteobacteria (19.39%)、Actinobacteria (9.62%)、Bacteroidetes (7.96%)和Firmicutes (5.83%),均是中温厌氧消化的常见菌群[34]。当ISR为2时,2组反应器中细菌群落分布并无明显差别。随着ISR的减小,体系中的相对有机负荷增大,此时Chloroflexi的相对丰度更小。YI等[35]也发现,随着厌氧消化有机底物浓度的增大,Chloroflexi的微生物相对丰度减小。Chloroflexi通常被发现在碳水化合物的厌氧消化体系中[24],作为一种水解发酵细菌,可以加快厌氧消化反应的进行[36]。相比对照组,生物炭组的Chloroflexi相对丰度明显更高,且生物炭对该群菌的提高比例随着ISR的减小而增大。这说明生物炭有效促进了Chloroflexi的生长。SHEN等[37]也发现添加生物炭可以使Chloroflexi的相对丰度增加。与Chloroflexi相似,Proteobacteria的相对丰度也随着ISR的减小呈现出减小的趋势,说明该酸性环境会抑制该菌群的生长。此时,添加生物炭可以在一定程度上提高Proteobacteria的生长稳定性。Proteobacteria的主要作用是分解VFA[37],说明添加生物炭可以促进VFA的分解和利用。相反, Firmicutes的相对丰度随着ISR的减小逐渐增大。Firmicutes主要可以降解体系中大分子物质,它可以适应比较酸的厌氧消化环境[38]。Firmicutes的相对丰度跟反应中的基质浓度有关,对比产甲烷情况可以看出,ISR为2和1的厌氧消化过程反应基本完全,说明多余的、可利用的基质不多,故Firmicutes相对丰度较小。同时,在相同接种比下,添加生物炭使得Firmicutes相对丰度减小,对比产甲烷和pH情况,说明生物炭可以促进底物的降解和利用。
如图7所示,在反应中后期,各接种比下的微生物群落分布发生了一定程度的变化。与反应早期相似,在该阶段下,ISR为2的生物炭组与其对照组的微生物群落表现出很大的相似性。此时,1.5-SSB和1.5-对照组的产甲烷速率相似,对比该微生物群落分布图,发现二者反应器中的主要优势细菌相对丰度类似,说明此时二者的反应体系均已稳定。与反应早期相似,随着ISR的减小,Chloroflex和Proteobacteria的相对丰度减小,且在生物炭组更高。在ISR为1或0.5时,Bacteroidetes的相对丰度在生物炭组与对照组之间出现了较大差别。1-SSB和0.5-SSB的Bacteroidetes相对丰度分别是其对照组的的4.25倍和2.52倍。Bacteroidetes也是一种可以将大分子物质(如淀粉)水解成VFA的细菌。生物炭组的Bacteroidetes相对丰度更大,说明生物炭可以促进该群菌的生长,从而促进厌氧消化中间产物的生成。另一方面,当ISR为1或0.5时,与早期相比,在中后期,该生物炭与对照组的Firmicutes相对丰度差距增大,说明添加生物炭使反应底物的降解率更快。
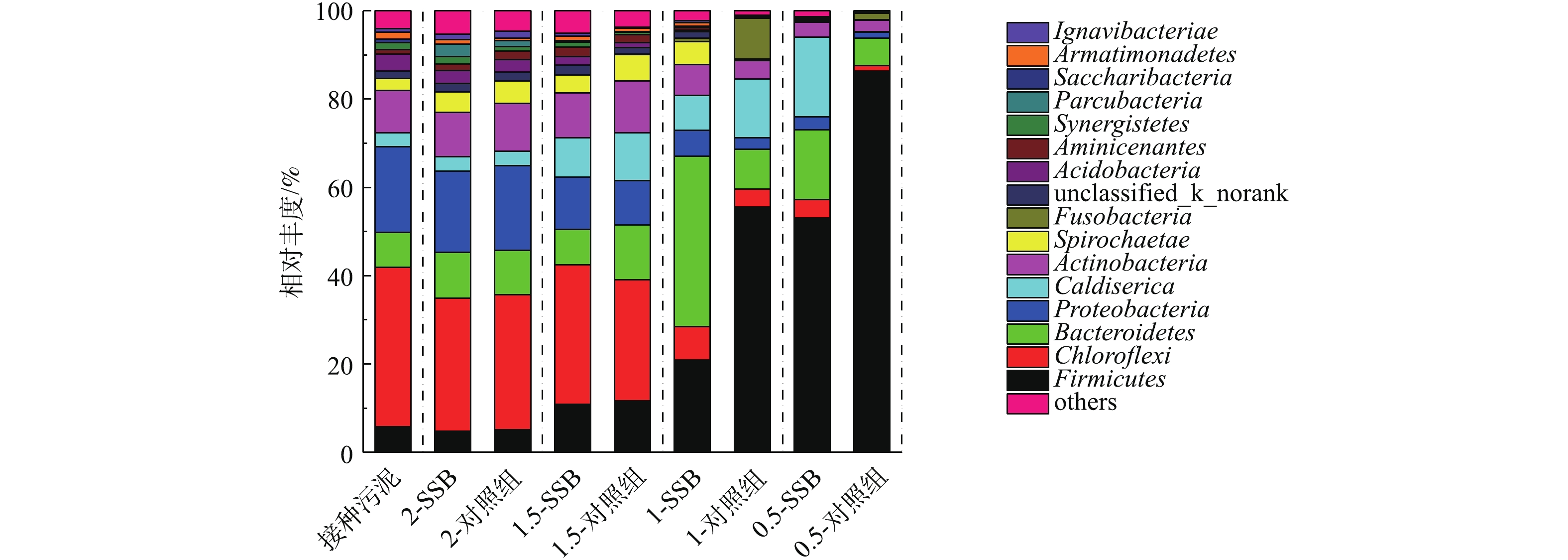
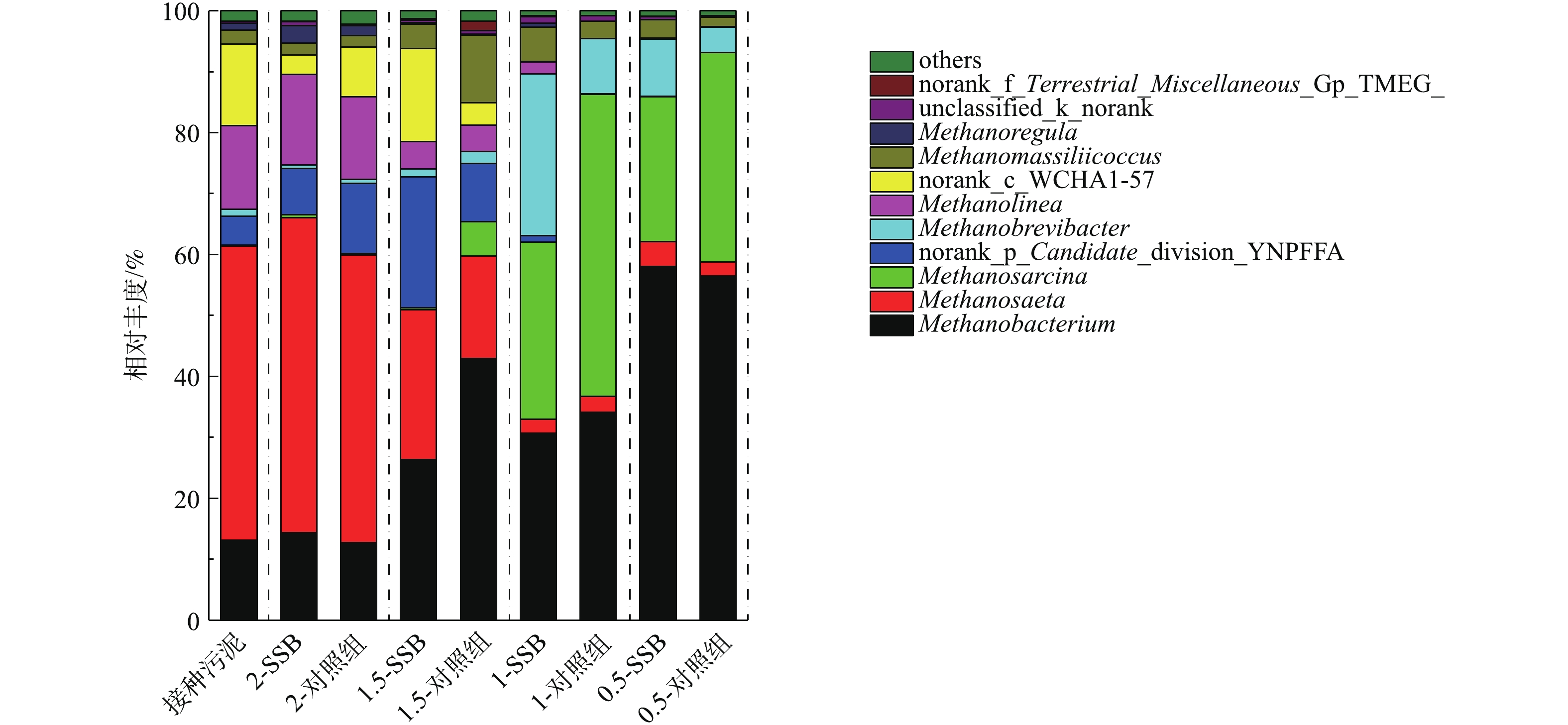
2)古菌群落结构分析。图8给出了反应早期(第7 d)各接种比下反应器中古菌在属水平上的微生物分布。本实验的接种污泥优势产甲烷菌属分别是Methanosaeta,Methanobacterium和Methanolinea。其中Methanosaeta在所有古菌中的相对丰度最大,为48.26%。Methanosaeta属于乙酸型产甲烷菌,其对环境要求严苛,只能在乙酸浓度较低的情况下对数生长[39]。Methanobacterium(13.11%)属于氢型产甲烷菌,主要是利用CO2和H2产甲烷[40]。Methanolinea(13.80%)同属于氢型产甲烷菌,主要靠分解丙酸产H2和产甲烷[41]。2-SSB的优势产甲烷菌群与接种污泥最为相似,说明该反应器中产甲烷菌稳定。随着ISR的减小, Methanosaeta的相对丰度逐渐减小,说明酸化程度加重,不适宜该菌落的生长。相反,Methanobacterium相对丰度随ISR的减小而增加,说明接种比小的反应器更倾向于氢型产甲烷途径。此时,对照组Methanobacterium在ISR为1时相对丰度均高于其生物炭组, Methanolinea在ISR为2和1时为优势菌群,且生物炭组的相对丰度高于其对照组,说明添加生物炭可以促进Methanolinea的生长,提高其丙酸的分解速率。随着ISR减小到1或0.5,Methanobrevibacter代替Methanolinea成为优势菌群。
图9是反应中后期(第21天)各组厌氧消化反应器古菌的分布情况。2-SSB和2-对照组的优势产甲烷菌群(Methanosaeta,Methanobacterium和Methanolinea)与接种污泥的分布情况相似,说明二者的产甲烷菌生长均达到稳定。除ISR=2以外,与反应早期相似,相同接种比下对照组Methanobacterium相对丰度大于生物炭组。同时,随着ISR减小,Methanosaeta相对丰度减少,生物炭组的Methanosaeta仍稍微大于其对照组。反应器中的产甲烷菌群差别说明2组的产甲烷途径有所不同,添加生物炭更利于乙酸型产甲烷。Methanolinea更适合在ISR较高的反应器中生长。随着ISR减小到1或0.5,Methanosaeta的数量可以忽略不计,此时Methanobrevibacter,Methanosacrina成为优势菌群。Methanobrevibacter的相对丰度随着ISR减小而减小,并且发现生物炭可以明显促进该菌落的生长。Methanosacrina同Methanosaeta一样也是酸型产甲烷菌,但其能够耐受高氨、高盐、高乙酸的环境[42]。结合pH情况可发现,此时pH更低,因此,更适合Methanosacrina的生长。同时,该菌群在生物炭组的相对丰度低于其对照组。对比产气和pH变化发现,生物炭可以在一定程度上缓解酸抑制。
2.1. 污泥基生物炭的表征
2.2. 污泥基生物炭对产甲烷的影响
2.3. 污泥基生物炭对厌氧消化pH的影响
2.4. 污泥基生物炭对厌氧消化微生物群落结构的影响
-
1)当ISR=2时,投加污泥基生物炭与否对餐厨垃圾厌氧消化的影响不明显;随着ISR的减小,厌氧消化酸化愈严重,投加污泥基生物炭能明显地提高体系酸性缓冲能力,缩短停滞时间,提高产甲烷速率。
2)与对照组相比,添加污泥基生物炭,使反应器中的Firmicutes相对丰度减小,说明其可以缓解酸抑制。同时,生物炭可以促进Chloroflex、Proteobacteria、Bacteroidetes的生长,从而提高厌氧消化中间产物的产生。
3)在反应早期,当ISR较大时,厌氧消化系统的产甲烷途径以乙酸利用型为主,投加生物炭可以促进乙酸型产甲烷;随着ISR的减小,产甲烷途径有逐渐向氢利用型转变的趋势。在反应中后期,随着ISR的减小,Methanobacterium的优势依然更明显,Methanosacrina逐渐替代Methanosaeta利用乙酸产甲烷。生物炭组Methanosacrina相对丰度更低,说明其可以减少酸累积。
4)在餐厨垃圾厌氧消化的实际应用中,可以通过添加污泥基生物炭,来缓解因接种物浓度过低,相对有机负荷过大导致的酸化现象,从而保证餐厨垃圾厌氧消化的正常运行和促进甲烷的产生。同时,本研究也为市政污泥的减量化和资源化利用提供了一种有效途径。



 下载:
下载: