-
我国土壤重金属污染形势严峻,矿区周边土壤污染事件频发[1-2]。李乔等[1]对新疆准东煤田周边农田土壤重金属研究发现,Cd和Hg污染风险较高,威胁农作物安全和人体健康。胡锋等[2]对新疆伊犁矿区土壤重金属Cd、Ni、Pb、Cr、Cu和Zn进行风险评价,结果显示Cu潜在生态危害程度最高。AOSTA等[3]对铅锌尾矿库周边土壤进行研究发现,Cd、Pb和Zn的迁移风险较高,对植物的危害较大。土壤重金属生态风险评估作为区域资源开发和污染控制策略指定的重要参考而受到国内外学者的广泛关注[4-5]。
传统土壤重金属生态风险评价的方法(单因子指数法、富集系数法、污染负荷指数法和内梅罗综合指数法等)可对区域土壤重金属污染情况进行初步评估[6]。但由于重金属活性、土壤理化性质和土壤背景值的显著差异,单一方法的评价结果存在很大的不确定性,难以充分反映区域土壤重金属污染的风险状况[7]。潜在生态风险指数法考虑到不同地区土壤的背景值,结合生态环境效应和毒理水平对生态危害进行评估,具有简单、精确且相对快捷的特点[8]。WANG等[9]应用潜在生态风险指数法对内蒙古某金矿区的某河段表层土壤重金属进行了风险评价;陈莹[10]应用潜在生态风险指数法对陕西西部矿区土壤重金属污染进行了风险评估。然而重金属的释放迁移轨迹与方向和其存在的化学形态有密切关系[11]。近年来,国外学者提出的风险评价编码法(RAC)可通过分析重金属形态分布特征来评价其对生态环境产生的风险[12],然而相关研究在国内还较薄弱。在欧共体改进的BCR法中,弱酸可溶态被确定为生物有效态,它和植物、生物中重金属含量间具有很强的相关性[13],可以反映重金属在土壤中的生物有效性。ZHANG等[14]研究发现铅锌矿区周围土壤Ni和Cu弱酸可溶态含量与玉米中的Ni和Cu含量呈显著相关(相关系数分别为0.75和0.62,P<0.01)。LIAO等[15]对广东省南部大宝山矿区进行研究发现,BCR法提取的土壤Zn和Cd弱酸可溶态含量与谷粒中Zn和Cd含量呈显著相关(相关系数分别为0.82和0.78,P<0.01),与芥菜中含量也呈显著相关(相关系数分别为0.87和0.69,P<0.01)。因此,在进行重金属生态风险评价时,对重金属化学形态的考虑就显得尤为重要。
鉴于针对生态环境脆弱地区矿冶区土壤重金属生物有效性和土壤理化性质以及生态风险关系的综合风险评价研究较少,因此,本研究以新疆某矿冶区为例,综合潜在风险指数法和RAC风险编码法,结合空间分析,对区域土壤重金属污染进行综合评估,并应用冗余(RDA)分析识别了影响风险水平的关键土壤因子,研究结果既可为当地主要污染物控制及资源可持续开发提供科学支撑,也可为其他地区土壤重金属污染风险评估提供参考。
-
研究区位于新疆西北部某矿冶区,地形为西北高、东南低,属于温带大陆性半干旱气候。研究区有河流流经,土地利用类型以草地为主。区域降水量少,风沙大,植被稀少(覆盖率低于30%),生态环境极为脆弱。矿冶区年可冶炼加工黄金2 t,生产硫酸3.5万t,产值达4.4亿元以上。矿冶区采用氯化挥发法提取黄金。频繁的矿业活动增加了区域环境重金属污染风险,已引起当地民众和政府部门的广泛关注。
-
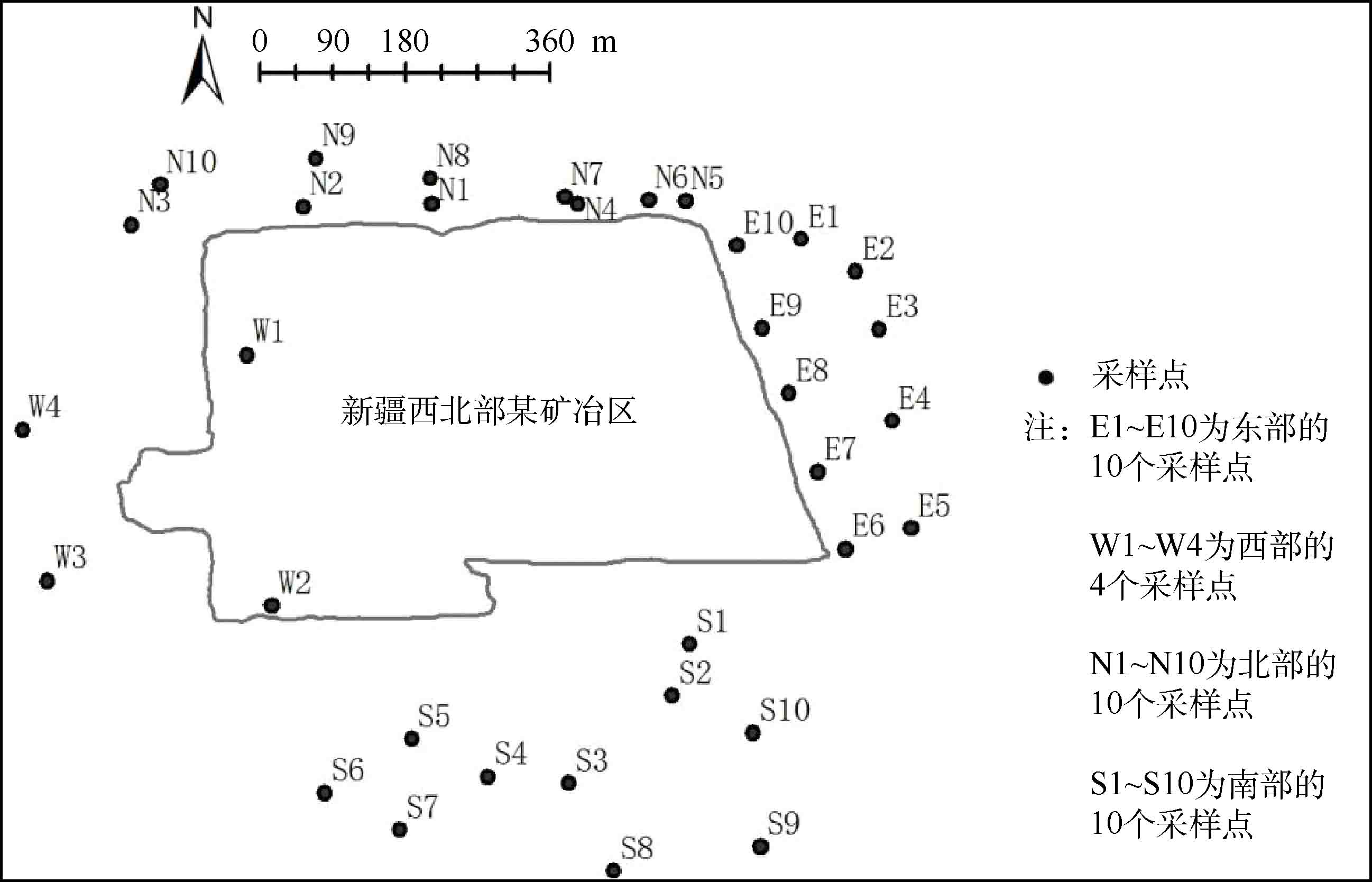
根据研究区地貌特征和常年盛行风向,围绕矿冶区在东(E)、西(W)、南(S)、北(N)4个方向,共设置34个样点,样点位置见图1。应用矩形(10 m×10 m) 5点混合采样法,采集表层土壤(0~10 cm)。在矿冶区E、S、N 3个方向,采集10个土壤样品,编号为N1~N10、E1~E10和S1~S10;在矿冶区W方向,采集4个土壤样品(接近矿山),编号为W1~W4。
-
土壤样品经风干、研磨后,过2 mm筛,用于测定土壤pH和EC、有机质等基本土壤理化性质。土壤As采用王水(HCl-HNO3,3∶1)进行水浴消解[16];其余重金属采用四酸法(HCl-HF-HNO3-HClO4,10∶3∶3∶1)[17]进行消解;采用BCR法[18]对重金属的弱酸可溶态(F1)、可还原态(F2)、可氧化态(F3)和残渣态(F4)进行形态分析。采用ICP-OES (Prodigy7,Leemanlabs,USA)测定Mn和Cu含量;采用ICP-MS (NexION 300x,PerkinElmer,USA)测定土壤Zn、Cr、Ni、Co、Cd和Pb含量;采用AFS(AF-610B,北京瑞利)测定土壤As含量。在实验过程中,采用GBW07447(国家土壤标准物质)进行质量控制,测得标准回收率为85.3%~107.3%。
-
单因子污染指数法[19]计算方法见式(1)。
式中:Pi为重金属元素污染指数;Ci为重金属元素实测值,mg·kg−1;Si为重金属元素的评价标准值,mg·kg−1,本研究采用新疆土壤重金属背景值[20]。
-
潜在生态风险评价[21]计算方法见式(2)和式(3)。
式中:Eir为单项重金属潜在风险指数;
Tir 为重金属的生物毒性响应因子[22],反映了重金属在水相、固相和生物相之间的响应关系,Mn、Cu、Zn、Pb、Ni、Co、As和Cd的生物毒性响应因子分别为1、5、1、5、1、5、10和30;CiD 为重金属含量,mg·kg−1;CiR 为参照值,mg·kg−1,本研究采用新疆土壤重金属背景值[20]。式中:IRI为重金属综合潜在风险指数。根据Eir和IRI,可将重金属划分为低生态风险(Eir<40,IRI<150)、中等生态风险(Eir为40~80,IRI为150~300)、高生态风险(Eir为80~160,IRI为300~600)、较高生态风险(Eir为160~320)、极高生态风险(Eir>320,IRI>600)[23]。
-
RAC风险评价编码法[24]计算方法见式(4)。
式中:CF1为弱酸可溶态含量,mg·kg−1;CF2为可还原态含量,mg·kg−1;CF3为可氧化态含量,mg·kg−1;CF4为残渣态含量,mg·kg−1;FRAC为单一重金属弱酸可溶态占4种形态总和的百分比。根据RAC风险指数,将风险划分为无风险(FRAC<1)、低风险(FRAC为1~10)、中等风险(FRAC为10~30)、高风险(FRAC为30~50)以及极高风险(FRAC>50)[25]。
-
应用普通Kriging(ArcGIS 10.4)进行空间插值分析。采用SPSS19.0和R3.4.3对数据进行统计分析。使用SigmaPlot12.5作图。重金属弱酸可溶态含量数据经对数转换后,进行正态分布检验(Shapin-wilk检验,P<0.05)。
-
研究区土壤pH为7.64~8.91,EC为77.3~1 402 μS·cm−1,有机质为14.7~32.5 g·kg−1,这符合西北干旱区典型土壤基本特征[26]。研究区土壤重金属全量与弱酸可溶态含量统计分析结果如表1所示。土壤重金属As(1.7~1 730 mg·kg−1)和Cu(3.4~1 809 mg·kg−1)全量变幅较大,变异系数分别为114%和172%。研究区土壤As和Cu超标率分别为88%和38%;Zn与Cd在少数点位有超标现象,超标率分别为24%和6%,而Mn超出背景值的比例为49%。土壤Mn、As、Cu弱酸可溶态含量平均值较高,分别为8.94、4.51和3.95 mg·kg−1;土壤Cu、Pb、Zn、Co和As弱酸可溶态含量变异系数较大,分别为274%、208%、169%、137%和131%;单因子污染指数评价显示,As和Cu污染风险较高,其风险指数值分别为41.9和8.28;As(431)的潜在生态风险指数最大,其次为Cd(107)和Cu(42.6);而Mn的RAC风险指数最大,为22.1%,其次为As和Cd,分别为16.5%和13.1%。综上所述,研究区土壤As、Cu、Cd和Mn存在一定污染风险,As和Cu受人为活动影响,并存在显著累积现象。
-
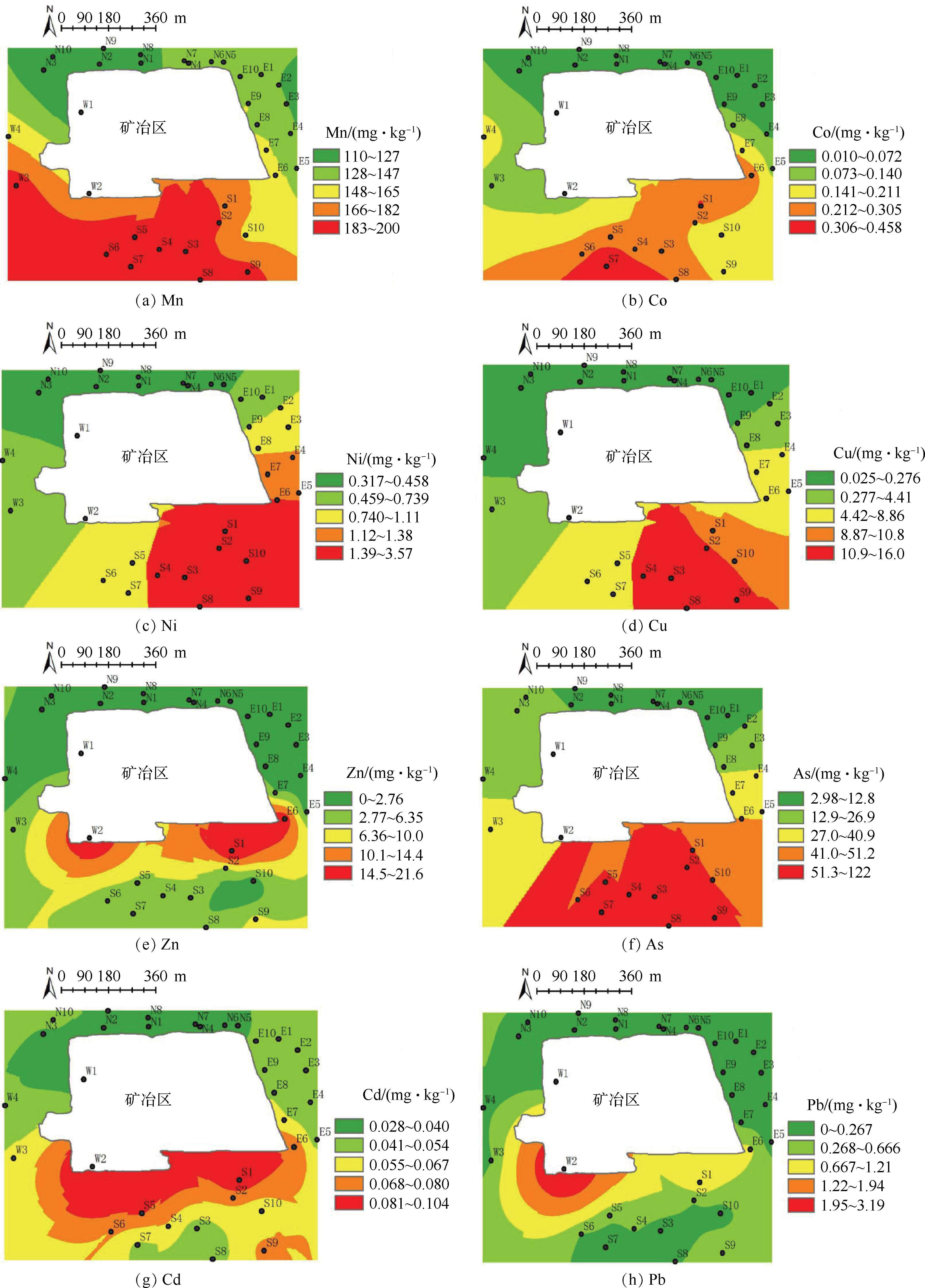
应用ArcGIS空间分析模块绘制了土壤重金属弱酸可溶态含量空间分布图,结果如图2所示。研究区土壤重金属弱酸可溶态含量空间分布格局整体上较为类似,都是北边较低,南边接近矿冶区的部分区域较高,离矿冶区一定距离后由高向低转变。其中土壤Co、Cu和Ni弱酸可溶态含量高值区主要集中在接近矿冶区东南边的尾砂库区域,如图2(a)~(d)所示。土壤Pb弱酸可溶态含量高值区主要集中在矿冶区南边偏西的收砷房附近,如图2(h)所示。土壤Mn、Zn、As和Cd弱酸可溶态含量高值区主要集中在矿冶区南边偏西的收砷房和东南边的尾砂库区域附近,如图2(f)~(g)所示。
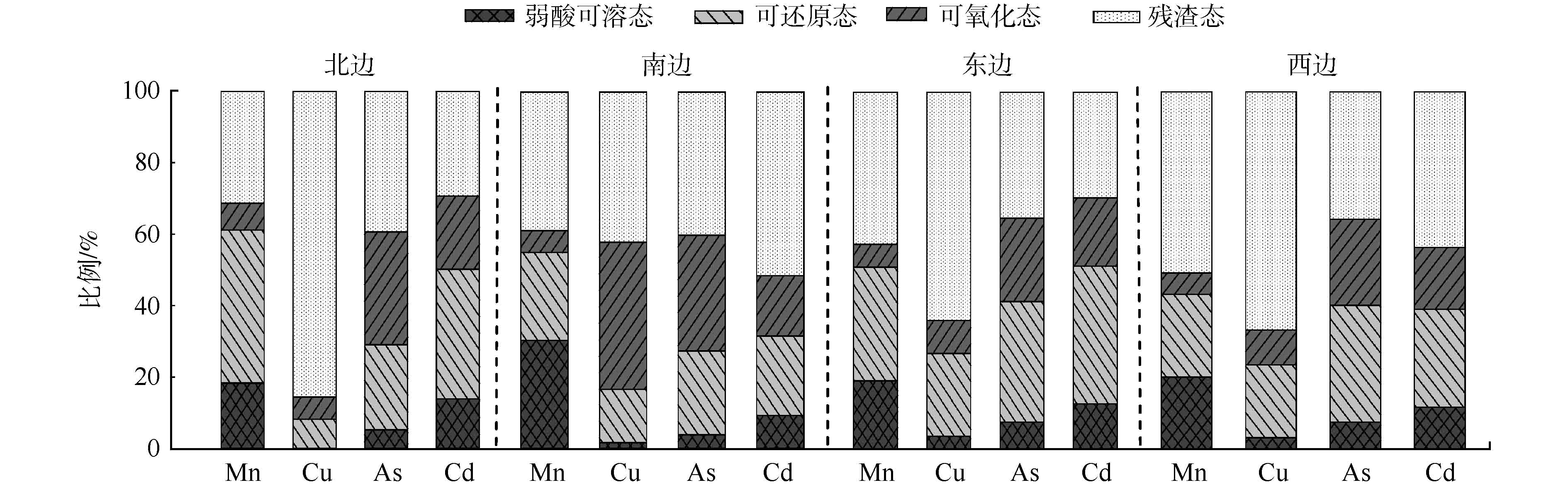
进一步分析土壤Mn、Cd、As和Cu重金属形态分布特征,结果如图3所示。弱酸可溶态所占比例从大到小依次为Mn>Cd>As>Cu(平均值)。在不同的方位,同一种金属的弱酸可溶态所占比例会有所不同,Mn在南边、Cu在东边、As在西边均出现较大比例分布,而Cd在不同区域相差较小。而重金属弱酸可溶态可以被生物直接吸收利用,对生物的危害较大[28]。因此,土壤Mn相对于Cd、As和Cu对生物的危害较大。可还原态在土壤环境中一般比较稳定,但随着pH和Eh等的改变,会被还原成弱酸可溶态,存在潜在对生物危害的风险[29]。土壤Mn、Cd、Cu和As可还原态所占比例与弱酸可溶态类似,而分布却不同;Mn可还原态比例在北边最高,As、Cd和Cu均在东边和西边最高,说明除Mn潜在毒性风险在北边较高外,其余3种重金属的潜在毒性风险均在东边和西边较高。可氧化态比例以As和Cu在南边最大,Mn和Cd相对较小。残渣态较为稳定,其中Cu在北边所占比例最大。李忠义等[30]的研究也发现土壤Cd、Zn和Cu等重金属弱酸可溶态在靠近尾砂库附近区域含量较高。由此可见,区域矿业活动对土壤重金属生物有效性存在显著影响。
-
单项重金属潜在生态风险指数评价结果如图4(a)所示。土壤As极高风险所占比例最大,为41%,中等风险比例为18%,而较高风险和高风险比例均未超过10%;Cu的中等生态风险与高生态风险所占比例分别为18%和6%,而较高生态风险和极高生态风险比例各占3%;Cd中等生态风险样点所占比例最大,为50%,高生态风险和较高生态风险所占比例分别为27%和18%,极高生态风险比例仅为3%;土壤Pb有1个样点处于中等风险水平,其余重金属元素均处于低生态风险水平。综合生态风险指数(RI)评价结果显示:研究区8种土壤重金属极高生态风险比例最大,约为41%;其次为低生态风险,所占比例为38%;中等生态风险和高生态风险比例分别为15%和6%。其中As、Cd和Cu对区域土壤重金属潜在生态风险水平贡献率显著高于其他元素。
RAC风险编码法评价结果如图4(b)所示。土壤Cu、Zn、Pb、Ni和Co所有样点RAC风险指数均小于10%,处于低风险或无风险水平。值得注意的是,土壤Mn有5个样点风险指数为30%~47%,处于高风险水平,27个样点风险指数为10%~30%,处于中等风险水平;土壤Cd有24个样点风险指数为10%~30%,处于中等风险水平;土壤As的RAC风险指数范围为2%~20%,平均值为7%,有7个样点处于中等风险水平。由此可知,As和Cu潜在毒性风险较高,而Cd和Mn存在一定的迁移风险,应重点关注该4种重金属污染状况。
-
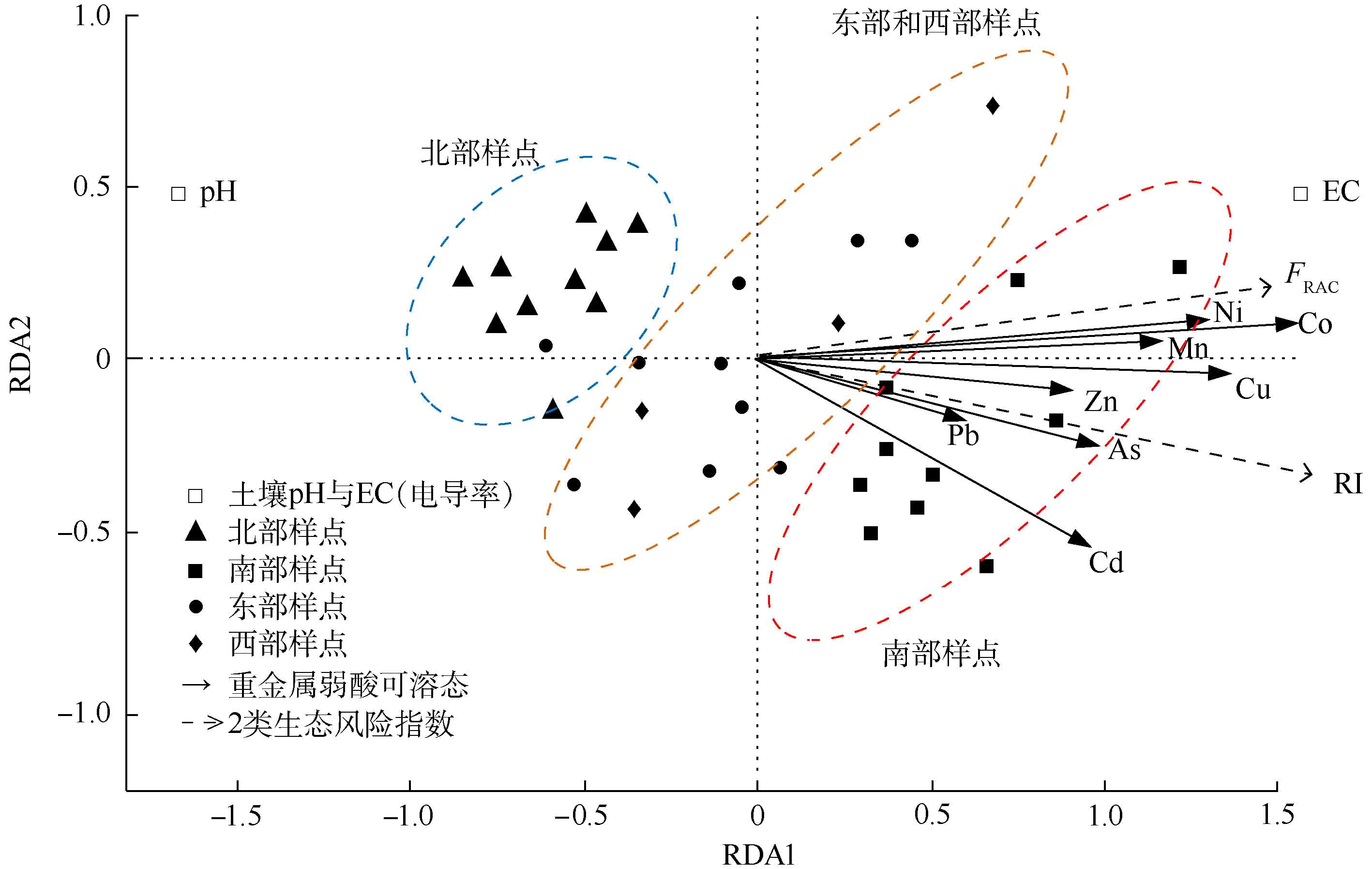
应用RDA冗余分析法进一步探究了土壤pH和电导率(EC)对土壤重金属弱酸可溶态含量以及风险指数的影响,结果如图5所示。第1排序轴RDA1的贡献率达到65.1%(R2=0.69,P<0.01),8种重金属弱酸可溶态含量之间均呈现正相关关系,尤其是弱酸可溶态Co、Cu、Mn、Ni和弱酸可溶态Zn,以及弱酸可溶态As和弱酸可溶态Pb;弱酸可溶态Cd与弱酸可溶态Co、Mn、Ni等几种重金属弱酸可溶态含量无显著相关性,但弱酸可溶态As和Pb含量的相关性显著,此结果与方月梅等[31]关于矿区重金属生物有效性关系的研究结论较为类似。
土壤pH与8种重金属弱酸可溶态含量均呈现显著的负相关关系。而土壤电导率(EC)与8种重金属弱酸可溶态含量均无显著相关关系(
r=0.496)。样本点大致分为3类:第1类是与pH接近的样本点,这类样本大多采自矿区的北部,土壤pH高,而土壤重金属弱酸可溶态含量低;第2类聚集的样本点大多采自矿区的南面,土壤pH低,重金属弱酸可溶态含量却高;第3类聚集样本点大多采自矿区东部和西部,其土壤pH和土壤重金属生物有效性变化幅度较小。可见不同地理位置下土壤pH的差异与土壤重金属弱酸可溶态含量的变化显著相关,而不同地理位置土壤电导率(EC)的差异可以反映土壤重金属弱酸可溶态含量的变化。 潜在生态风险指数(RI)与土壤pH呈显著的负相关关系,另外As、Cu等8种弱酸可溶态含量总和与潜在生态风险指数和RAC风险指数均呈现显著的正相关关系。可见土壤pH的降低会显著提高土壤重金属弱酸可溶态含量,而土壤弱酸可溶态含量的升高会直接影响到对生物的危害程度,从而增加重金属污染物的生态风险[32-33]。综上所述,研究区土壤重金属弱酸可溶态含量是影响土壤重金属污染风险的直接因素,而土壤pH是影响土壤重金属污染风险的间接因素。
-
1)基于全量的单因子污染指数和潜在生态风险指数法评价结果显示,As和Cu污染严重,潜在生态风险较高;而基于生物有效性的RAC风险编码法评价结果显示,土壤Mn与Cd具有迁移风险,因此,应对研究区土壤As、Cu、Mn与Cd重点关注。
2)矿业活动对周边土壤重金属生物有效性存在显著影响。土壤Co、Cu和Ni弱酸可溶态高值区主要集中在接近矿冶区东南部的尾砂库区域;Pb弱酸可溶态含量高值区主要集中在接近矿冶区南部偏西的收砷房区域,而Mn、Zn、As和Cd高值区集中在尾砂库和收砷房的附近区域。
3)单因子污染指数、潜在生态风险指数、RAC风险指数,空间分析方法以及冗余分析方法的联合使用,有助于区域土壤重金属污染风险管控和科学决策。
新疆某矿冶区周边土壤重金属生物有效性与生态风险评价
Bioavailability and ecological risk assessment of heavy metals in soils around a mining area in Xinjiang, China
-
摘要: 矿业活动对土壤系统良性运转带来较大的环境负荷,矿区周边土壤重金属污染风险评估是土壤污染防治和资源可持续开发的关键。在应用单因子污染指数法、潜在生态风险指数法、风险评价编码法(RAC),并结合空间分析和冗余分析手段的基础上,对新疆某矿冶区周边土壤重金属生物有效性和生态风险进行了系统研究。结果表明:研究区土壤As、Cu、Mn和Cd超标率分别为88%、38%、49%和24%;土壤Mn、Zn、As和Cd弱酸可溶态高值区主要集中在尾砂库和收砷房的附近区域。单因子污染指数评价揭示As和Cu污染累积较为严重。潜在生态风险评价显示,As、Cd和Cu生态风险较高,Mn为低生态风险。风险编码法(RAC)评价结果进一步揭示Mn和Cd具有显著的土壤迁移风险。冗余分析结果显示,空间异质性是影响土壤重金属弱酸可溶态含量变异的主要因素。土壤pH和重金属弱酸可溶态是影响潜在生态风险指数(RI)的2个重要因素。综合风险评价手段与多尺度分析方法的联合应用有助于提高区域风险评价的准确性。Abstract: The mining activities bring heavy environmental loads on functions and structures of soil system. Ecological risk assessment is the prerequisite for pollution prevention and sustainable exploitation of resources. It provides a scientific basis for local government departments to carry out comprehensive management planning. Based on potential ecological and risk assessment code (RAC), redundancy and spatial analysis, and other methods, the bioavailability and ecological risk of soil heavy metals in a mining area in Xinjiang were visualized. The results showed that the exceeding standard rates of As, Cu, Mn and Cd in tested soil were 88%, 38%, 49% and 24%, respectively. The high-concentration zone for weak acid soluble fraction of Mn, Zn, As and Cd was mainly concentrated in the tailing dump and arsenic collection chamber area. The evaluation by single factor pollution index showed that the accumulation of As and Cu in local soil was serious. Potential ecological risk assessment indicated that As, Cd, Cu had high ecological risks, while all samples of Mn had low ecological risk. The results determined by risk assessment code (RAC) further presented the high potential transfer risk for Mn and Cd in soils. The redundancy analysis indicated that the spatial heterogeneity was the key reason leading to different weak acid soluble fraction of heavy metals in soils. Soil pH and weak acid soluble fraction are two major factors affecting the potential ecological risk index (RI) of heavy metals in soils. The combination of comprehensive risk assessment and multi-scale analysis could improve the accuracy of regional ecological risk assessment.
-
Key words:
- mining area /
- soils /
- heavy metal pollution /
- risk assessment code /
- bioavailability /
- ecological risk
-
由于产生的废水量大且成分复杂,纺织行业被普遍认为是污染最严重的行业之一。据不完全统计,纺织行业每年生产超过
1×106 t染料,其中60%~70%是偶氮化合物,其特点是含有一种或多种偶氮键(—N=N—)及各种衍生物[1]。由于其毒性、致癌性和致突变性,偶氮染料及其降解中间产物对水生生物的生长具有较强的抑制作用,排放到自然环境中,会导致水体植物和动物大量死亡。此外,硫化物通常存在于染料废水中,一方面是添加硫化钠还原偶氮化合物而形成,另一方面可能是其他广泛存在于纺织染色工艺中的硫物质转化而来,如硫酸盐、亚硫酸盐和硫代硫酸盐[2]。有研究[3]表明,大量的硫化钠用于硫化染料的染色过程(>90%),产生含由15%~20%硫化物的废水。由于其毒性、风化性和腐蚀性强,硫化物(水性硫化物和气体硫化物)会对人体健康产生严重危害。因此,在含硫化物的偶氮染料废水最终排入天然水体之前,必须对其进行有效的处理。微生物燃料电池(microbial fuel cells, MFC)是一种在微生物的催化代谢作用下,使有机/无机污染物发生氧化反应,释放质子和电子,从而产生电流、并降解污染物的装置[4]。在MFC的运行中,阳极液pH能影响底物的代谢活性,进而影响质子和电子的生成和转移机制,对MFC的整体性能有着重要作用。外部pH的变化可导致几种主要生理参数的变化,包括内部pH、离子浓度、膜电位和质子动力[5]。一般来说,细菌的最佳生长需要接近中性的pH,而阴极电极上的氧还原反应会导致pH呈碱性[6]。传统的双室MFC可以保持2种不同的pH环境,以优化阳极反应和阴极反应。然而,空气阴极MFC中,在只有一种电解质存在的条件下不能做到这一点。在现有的研究中,电解质pH对空气阴极MFC产电性能和污染物降解的相关研究较少,因此,研究空气阴极MFC的最佳pH以及电解质pH对产电性能的影响是必要的。
本研究构建了单室空气阴极MFC,且将其用于处理含硫偶氮染料废水,以乙酸钠为底物,碳刷和碳布分别作为反应器的阳极和阴极材料。探究了阳极液在不同初始pH条件下单室微生物燃料电池的产电性能及其对硫化物和偶氮染料的降解效果,确定了该反应器运行的最佳pH,同时探究了硫和染料的协同降解机理。鉴于染料出水中含有大量的硫化物,MFC中硫化物作为本体还原剂和电子供体,可以加速偶氮染料的降解,本研究为印染厂染料废水的降解提供了一个新的思路。
1. 材料与方法
1.1 微生物燃料电池构建
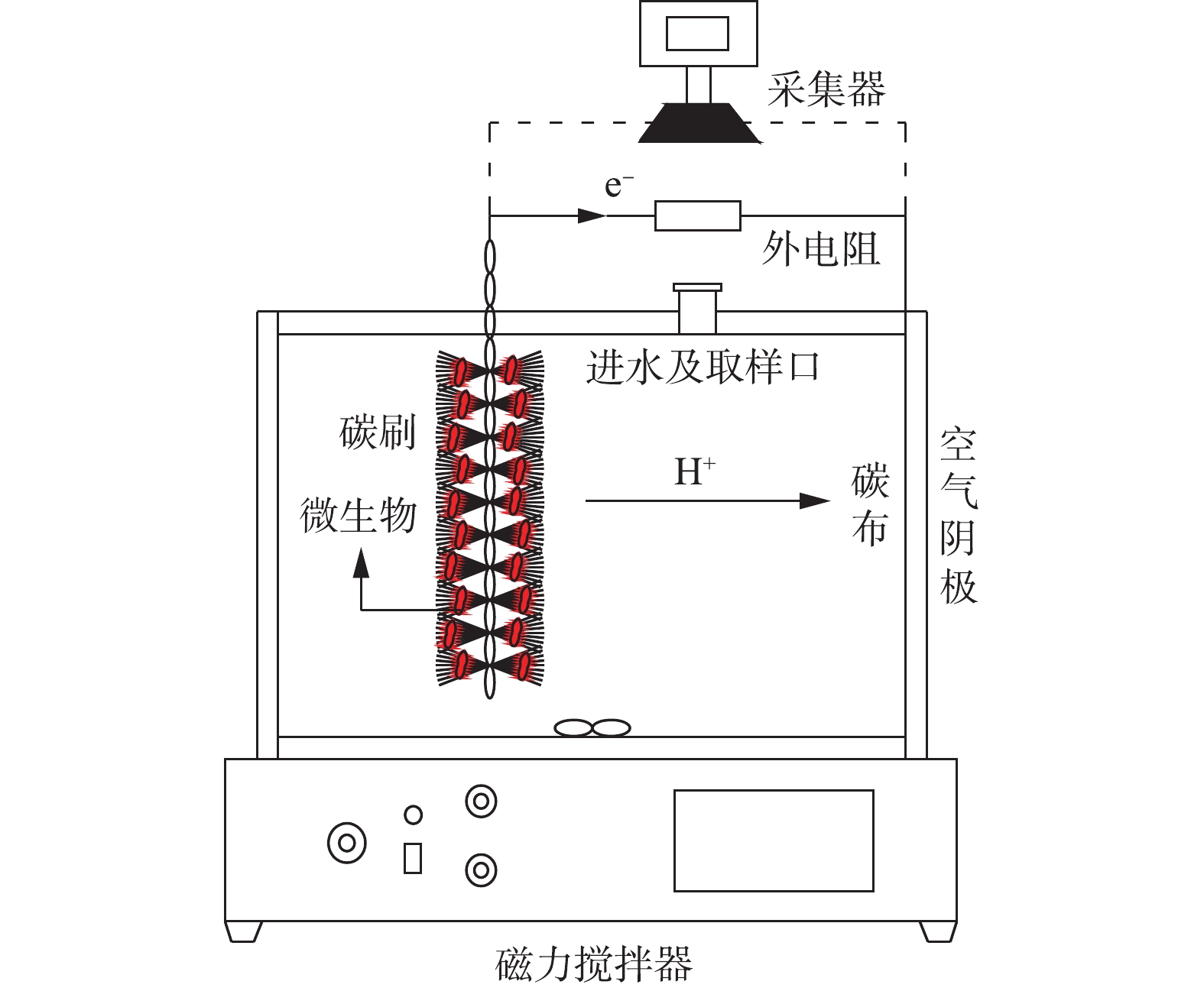
本研究采用单室空气阴极MFC,是在LOGAN典型的立方体型MFC结构基础上优化而成。将MFC的总圆柱形腔体积增加到400 mL,腔室的容积尺寸为φ16 cm×8 cm,示意图如图1所示。阳极电极为3 cm×6 cm石墨碳纤维刷(日本东丽),由钛丝和碳纤维丝组成。使用前,碳刷分别用1 mol·L−1 NaOH和1 mg·L−1 HCl浸泡24 h,再用去离子水浸泡12 h,目的是去除碳刷上多余的杂质,随后放置于450 ℃的马弗炉中烘烤30 min,以增大碳刷的电极面积。阴极材料为w1s1005疏水导电碳布(台湾碳能),先将碳布裁剪成直径为8 cm的圆形尺寸,在去离子水中超声清洗烘干。在碳布的空气侧均匀涂抹4层60%的PTFE,放置空气中干燥5~10 min,干燥后涂层呈微白色;将涂好的碳布置于370 ℃马弗炉中15 min,取出冷却后,涂层呈亮黑色,重复以上处理方式4次。在碳布亲水层均匀涂抹含20%铂碳催化剂(0.5 mg·cm−2)、Nafion®溶液(6.67 μL·mg−1)、异丙醇(3.33 μL·mg−1)和去离子水(0.83 μL·mg−1)的混合物,在室温下风干24 h。阳极和阴极通过钛丝(直径1 cm)与1 000 Ω的外部电阻连接,形成闭合电路。反应器所处的环境温度为(28±5) ℃。
1.2 微生物燃料电池的接种与驯化
本研究的驯化污泥取自重庆市唐家沱污水处理厂。阳极腔室接种厌氧和好氧混合污泥,以增加MFC体系微生物的多样性。为了加快驯化速度,使电极材料上富集产电微生物,将接种污泥加入含硫偶氮染料废水中,放置在磁力搅拌器上搅拌,阳极碳纤维刷在放入反应器之前浸泡在接种污泥中24 h。为保证体系内生物量充足,将接种污泥与反应基质按照1∶1的比例混合后,再将其加入MFC反应器中进行启动,每隔36 h取出上清液,并重新加入新的基质进行驯化。同时,用中泰科研EM 9636数据采集器连接电脑实时记录系统的产电电压。经过一段时间的培养,系统连续3个周期的最大稳定电压相同则代表系统启动成功。待系统稳定运行30 d之后,调整进水染料的pH,观察MFC的产电性能和污染物的降解情况。
选取典型的偶氮染料刚果红作为目标物。模拟废水主要成分如下:2.75 g·L−1 Na2HPO4、4.97 g·L−1 NaH2PO4·H2O、0.31 g·L−1 NH4Cl、0.13 g·L−1 KCl、12.5 mL·L−1微量金属元素溶液和1.25 mL·L−1维生素溶液。微量金属元素配比为:1.5 mg·L−1 NTA(氨三乙酸)、3 mg·L−1 MgSO4、0.5 mg·L−1 MnSO4·H2O、1 mg·L−1 NaCl、0.1 mg·L−1 FeSO4·7H2O、0.1 mg·L−1 CaCl2·2H2O、0.1 mg·L−1 CoCl2·6H2O、0.13 mg·L−1 ZnCl2、0.01 mg·L−1 CuSO4·5H2O、0.01 mg·L−1 AlK(SO4)2·12H2O、0.01 mg·L−1 H3BO3、0.025 mg·L−1 Na2MoO4、0.024 mg·L−1 NiCl2·6H2O、0.025 mg·L−1 Na2WO4·2H2O。
1.3 分析与计算
MFC电极两端的电压通过连接在电脑上的数据采集器(中泰科研EM 9636B)每5 min进行采集记录1次,并由电脑进行自动记录和保存。电流I由欧姆定律计算得到,计算方法见式(1)。
I=UR (1) 式中:I为电流;U为外电阻两端的电压;R为电极两端外电阻。
功率密度根据式(2)进行计算。
P=1000UIA (2) 式中:P为功率密度,mW·m−2;U为MFC电压,V;I为电流,A;A为反应器阴极的有效面积,cm2。
刚果红的浓度通过紫外分光光度计(日本岛津UV-3600)在496 nm处测量吸光度获得,降解率根据式(3)进行计算。
DCR=C0−CiC0×100% (3) 式中:DCR为刚果红降解率;C0为刚果红初始浓度,mg·L−1;Ci为第i次取样刚果红浓度,mg·L−1。
硫化物浓度采用国家标准分析方法GB/T16489亚甲基蓝分光光度法,COD采用国家标准分析方法HJ 828重铬酸钾法测定。
实验中不同pH条件下的功率密度曲线和极化曲线采用变电组法测定。MFC开路运行2 h,电压达到稳定状态之后,依次改变外电阻阻值为9 000、6 000、3 000、1 000、700、500、400、300、200、100、70、50、30、20、10 Ω。通过数据采集器实时记录电极两端的电压,当检测到的电压波动幅度在5 mV以内时,代表MFC在此电阻下达到稳定状态,检测时间大概为3~5 min。随后以电流密度为横坐标,分别以功率密度和电压为纵坐标绘制功率密度曲线和极化曲线。
循环伏安扫描(cyclic voltammetry,CV)采用电化学工作站在三电极体系下测得。以阳极碳刷为工作电极、阴极碳布为对电极、Ag/AgCl参比电极。扫描速度为5 mV·s−1,扫描电压为-0.6~0.6 V。本研究中的所有电势均在标准氢电极(SHE)下进行测试。测试前,反应后的样品以4 000 r·min−1的速度离心10 min,获得的上清液用于等量乙酸乙酯提取代谢物,然后在室温下用无水硫酸钠干燥提取物,最后将所得晶体溶解于少量的高效液相色谱级甲醇中用于高效液相色谱和LC-MS分析。高效液相色谱分析使用C18(250 mm×4.6 mm)反相柱进行,流动相为0.3꞉0.7(体积比例)的乙醇和水,流速为1 mL·min−1;紫外检测器波长设置为236 nm。LC-MS用乙腈铵将乙腈调整到pH=5.9,然后以3 mL·min−1的流速作为流动相,在400 ℃下使用氮气作为干燥气体(10 L·min−1),电喷雾电离源为负离子模式。
2. 结果与讨论
2.1 pH对MFC产电性能的影响
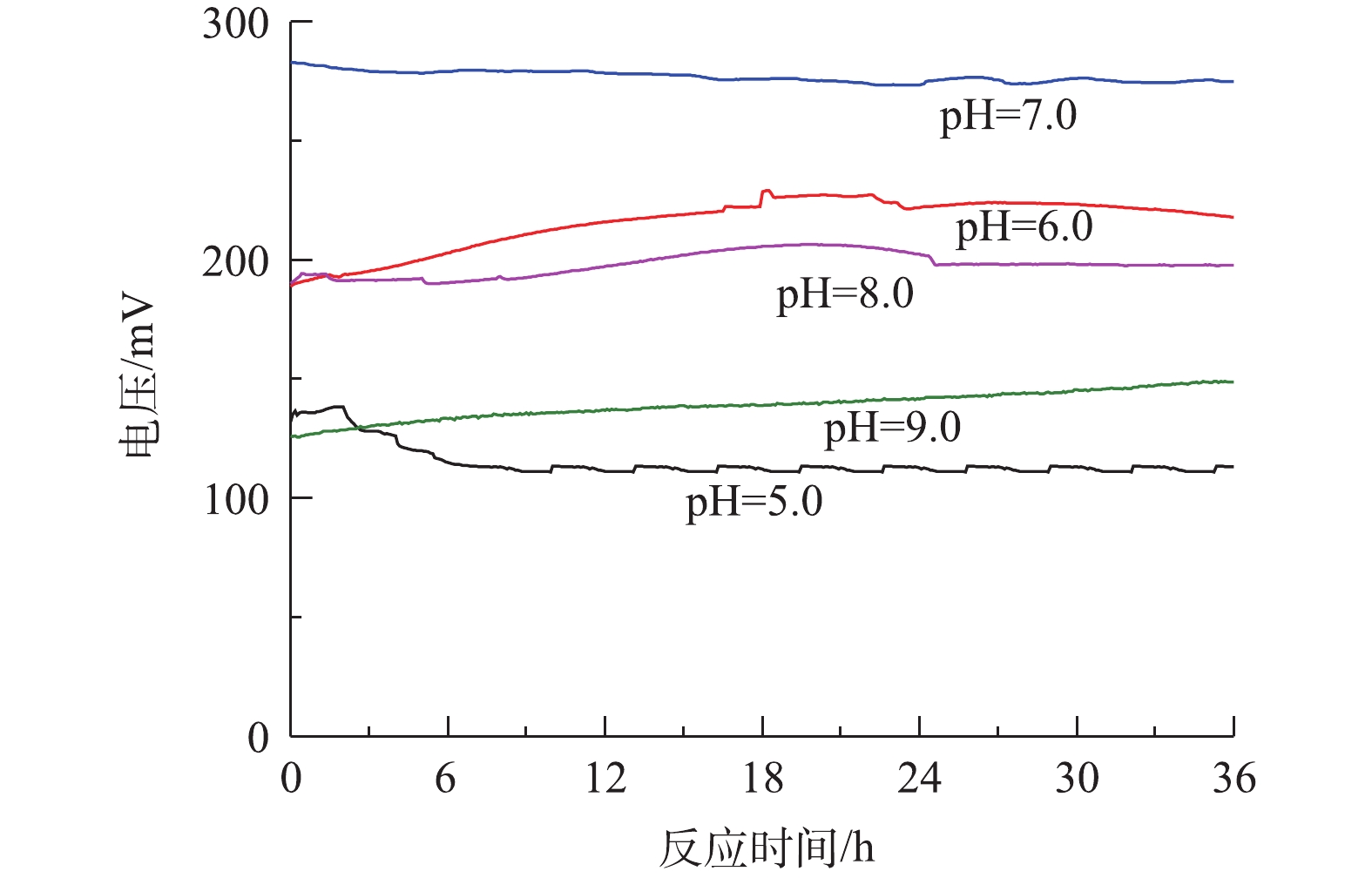
考察了MFC系统中pH对稳定电压的输出大小的影响,结果如图2所示。刚果红、硫化物和COD值分别固定为200、180和1 000 mg·L−1。在运行周期36 h内,不同pH条件下对应的输出电压数值波动幅度较小,表示MFC处于稳定的产电状态。由图2可知,pH对MFC的产电性能有较大的影响,当溶液初始pH=7.0、外电阻为1 000 Ω条件下,MFC最大的稳定输出电压为275.3 mV;当pH升高到8.0和9.0时,最大稳定输出电压分别降低至206.4 mV和140.3 mV;当pH降低为5.0和6.0时,最大稳定输出电压分别降低至113.5 mV和226.7 mV。pH=7.0时的稳定电压较pH=5.0时提高了58.77%,较pH=9.0时提高了49.04%,表明在中性条件下产电电压最高,其次是偏酸和偏碱条件,而在过酸和过碱条件下产电效果最差。其原因可能是,在中性条件下,阳极液中的产电菌活性最高,产甲烷菌的活性受到抑制,电子转移速率增加,有助于提高系统的输出电压;在偏酸或偏碱的环境下,阳极液中产电菌的活性受到抑制,电子输出减少,输出电压降低。因此,在含硫偶氮染料废水中的优势菌种适宜在中性环境下生长,pH=7.0有利于微生物的生长、繁殖和代谢,使得中性条件下阳极生物膜上富集的产电微生物增加,胞外电子转移速率加快,单室空气阴极MFC的输出电压最高。
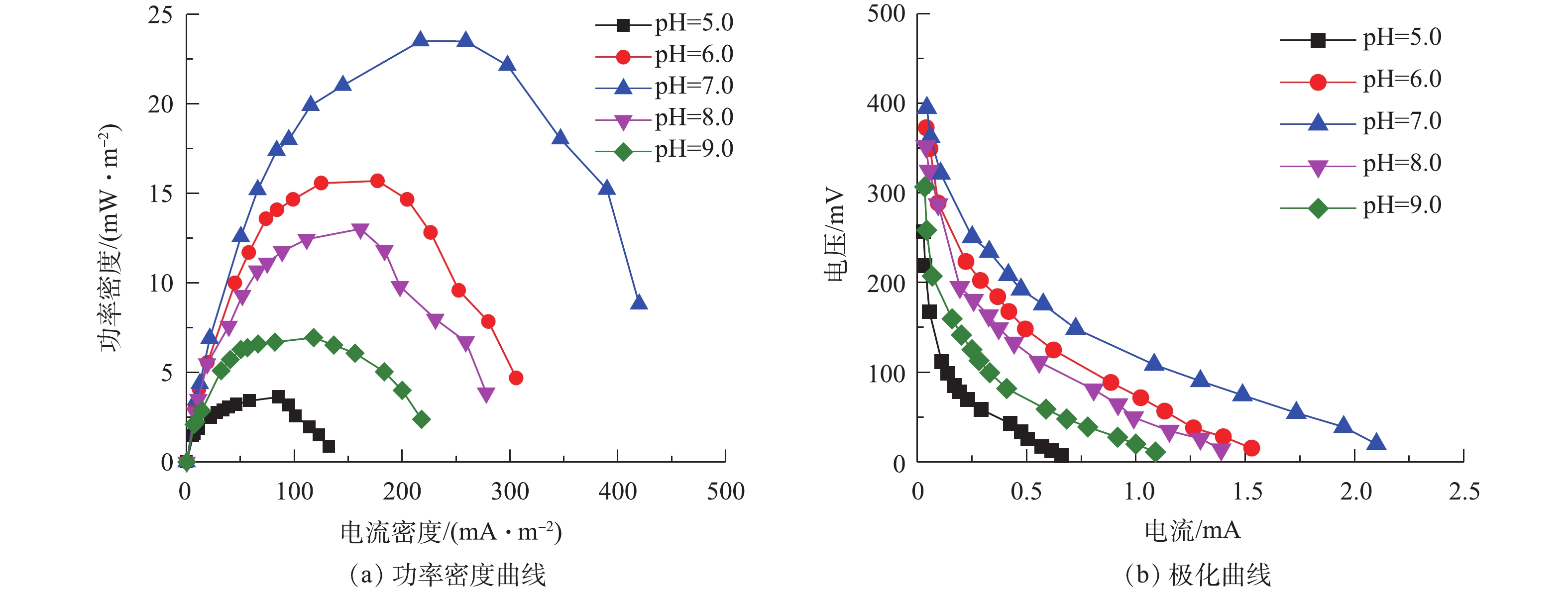
图3为不同pH条件下的功率密度曲线和极化曲线。当3个周期的驯化电压保持相对稳定(相差不超过20 mV)时,表示MFC驯化成功。从第4个周期开始,采用外电阻梯度变化方法,分别测定不同pH条件下MFC的功率密度曲线和极化曲线,结果如图3(a)所示。可以看出,最大功率密度分别为3.63(pH=5.0)、15.69(pH=6.0)、23.50(pH=7.0)、13.02 (pH=8.0)和6.93 mW·m−2 (pH=9.0)。在中性条件下功率密度最大,其次为偏酸和偏碱条件,过酸和过碱条件下功率密度最小。在pH=7.0时系统的功率密度最大,较pH=5.0时提高了84.55%,较pH=9.0时提高了70.51%,这说明阳极液pH过高或过低均会抑制产电菌的活性,影响MFC阳极反应速率,减低体系的最大功率密度,从而影响系统的整体产电性能。在pH=7.0时,含硫偶氮染料废水MFC的最大功率密度为23.50 mW·m−2,而SUN等[7]在单基质MFC中去除硫化物的最大功率密度为13 mW·m−2。这表明染料和硫化物均可以被微生物有效地利用,共同促进MFC的产电,也表明以偶氮染料作为电子受体的硫化物MFC有助于高功率输出。以上结果还表明,硫化物以及有机物和偶氮染料适合用作MFC中的电子供体和受体,含硫偶氮染料MFC是一种比较理想的燃料电池。
图3(b)为不同pH条件下,微生物燃料电池的极化曲线图。通过对极化曲线的线性拟合,可以得到在不同pH条件下的MFC内阻。5个电池(pH=5.0、6.0、7.0、8.0和9.0)的内阻分别为295.8、209.5、154.1、214.2和218.9 Ω。在反应器构型、材料和底物浓度等均相同的情况下,不同pH下MFC内阻表现出较大的差异,表明pH条件对微生物燃料电池的内阻有着较大的影响作用。在pH=7.0时,MFC的内阻最小,较pH=5.0时内阻降低了47.9%,表明中性条件有利于阳极产电微生物将生物化学能转化为电能,且系统内阻的降低似乎是产生更多电能的原因,在过酸或过碱性的条件下,阳极电位较高导致功率输出较低。在pH=7.0时,含硫偶氮染料废水中的阳极产电微生物活性较高,质子通过电解质的流动速度更快,故降低了内部阻力。5个电池的内阻均出现了活化极化区,欧姆极化区和浓差极化区,不同极化现象的存在使得电池的实际电压要远低于理论电压。因此,体系中的pH不仅影响阳极微生物的组成,也通过影响质子迁移而影响产电。GIL等[8]采用双室MFC装置研究发现,阳极基质的pH为7.0~8.0有利于MFC产电,与本研究的单室MFC所得的结论一致。
2.2 pH对硫化物和偶氮染料去除的影响
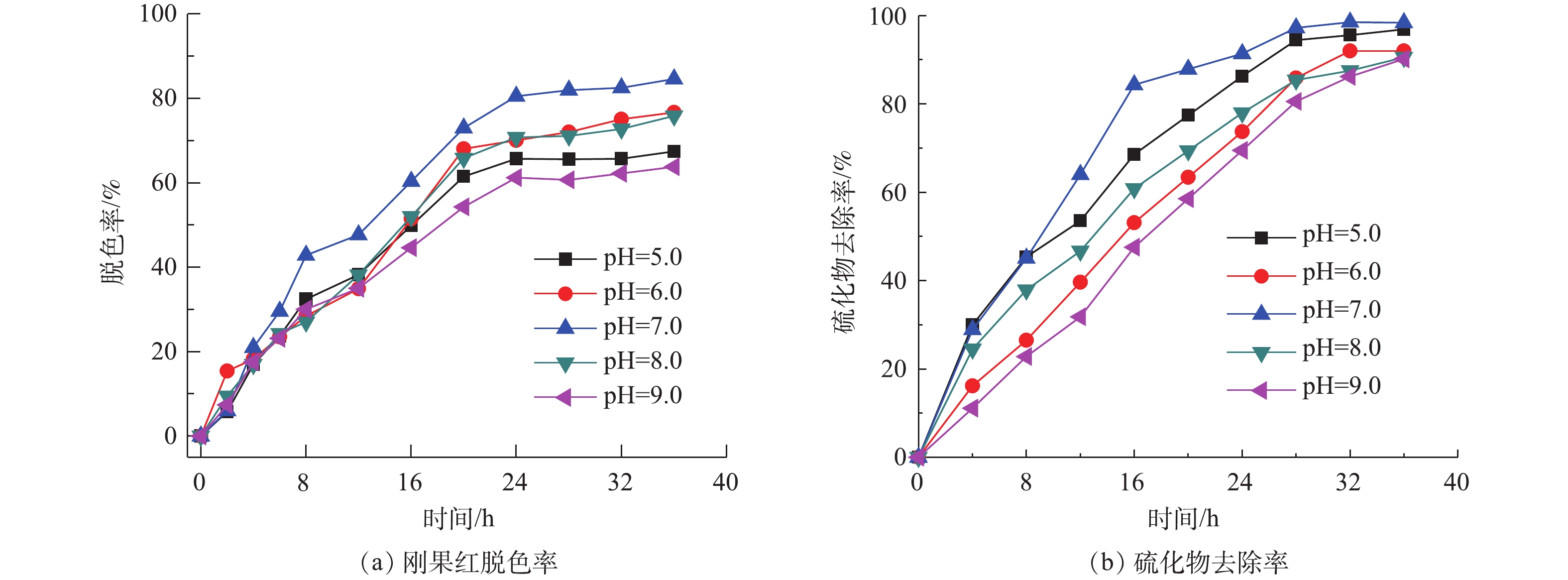
图4为不同pH条件下的刚果红脱色率和硫化物去除率变化情况。在大部分生物化学处理的设计和操作中,pH是至关重要的,pH影响着负责微生物活性的酶系统。因此,在废水处理中,pH对酶活性的影响进一步转化为对涉及到的相应微生物的影响。高于或者低于最佳pH均会导致酶活性的降低,进而影响反应速率。如图4(a)所示,在初始pH=7.0时,刚果红的脱色率最高为84.60%,在初始pH分别为5.0、6.0、8.0和9.0时,染料的脱色率分别为67.45%、76.66%、75.83%和63.78%。在中性条件下刚果红的脱色率最高,其次为偏酸或偏碱环境,而过酸或过碱环境下脱色率最低,说明过酸或过碱的环境抑制了微生物的代谢和生长,降低了酶的活性,从而降低了染料的降解效率。染料的脱色过程主要是通过氧化还原反应进行的,其中偶氮染料作为末端电子受体,在反应分解代谢过程中,MFC释放的电能主要取决于电子供体和电子受体之间的电位差。因此,为了能够最大限度地实现硫化物氧化和染料还原,还原电位较低的厌氧环境更加适合产电[9]。在中性条件下,硫的主要形式是的HS−,这就导致更负的阳极电势和来自MFC的更高电能[10]。因此,可以得出,中性条件有利于同时去除硫化物和偶氮染料,并有利于MFC发电。
如图4(b)所示,将初始pH分别设为5.0、6.0、7.0、8.0和9.0,外电阻为1 000 Ω,研究初始pH对硫化物氧化的影响。进水硫化物、染料浓度和COD分别维持在180、200和1 000 mg·L−1。在初始pH分别为5.0、6.0、7.0、8.0和9.0时,硫化物去除率分别为96.87%、91.98%、98.40%、88.53%和85.19%。在阳极液酸性和中性条件下可得到较高的硫化物去除率,表明中性和酸性条件更适合细菌生长,有利于硫酸盐的形成和硫化物的去除。当pH为5.0和9.0时,硫化物依然可以保持较高的降解率(96.87%和85.19%),表明MFC体系下的微生物具有较好的pH耐受性。MAHMOOD等[11]的研究表明,弱碱性条件有利于硫酸盐的形成。在碱性条件下,硫化物氧化可能导致过渡产物的积累,如硫代硫酸盐和多硫化物,其主要原因是,亚硫化氢离子的溶解性随着pH的升高而增加,其一旦溶解在水中,亚硫化氢就分解成硫化物离子,引起水的自电离,而高溶解的亚硫化氢离子可能抑制硫化物完全被氧化为硫酸盐,因此较高的pH会抑制硫化物的转化。对于大多数细菌来说,细菌生长的pH是4.0~9.0,而其最佳pH在6.5~7.5,一般来说,细菌更适宜于在弱碱性环境生存。然而,生物处理过程很少能完全在最佳生长条件下运行[12]。大多数先前报道的生物硫化物氧化系统均是在中性pH在7.0~8.0条件下运行的。
由图5可知,在中性pH的条件下,有机物的去除率最大,当pH降低至5.0时,COD去除率从49.56%下降到26.89%,当pH升高至9.0时,COD去除率下降到31.92%。单室MFC降解含硫偶氮染料废水中,COD的去除率不高,主要原因在于,硫化物和乙酸盐均为MFC体系中的电子供体,且硫化物的氧化电位较低,故先于乙酸盐发生氧化反应。在MFC中,乙酸盐作为复杂的大分子有机物并不会直接产生电能,而是被阳极产电菌分解为简单的小分子[13-14]。在微生物燃料电池的阳极膜上附着有大量的产电微生物,他们在细菌和电极的胞外电子转移过程中发挥着重大作用。而MFC中COD的去除是阳极微生物、产甲烷菌和发酵细菌的代谢活动综合作用的结果。当pH过酸或过碱影响了微生物的生长和代谢时,一方面大分子有机物转化为小分子有机物过程的速率降低;另一方面,阳极材料上产电细菌的功能也会受到抑制作用。因此,酸性和碱性条件下COD的去除率也会随之降低。
2.3 不同pH条件下CV分析
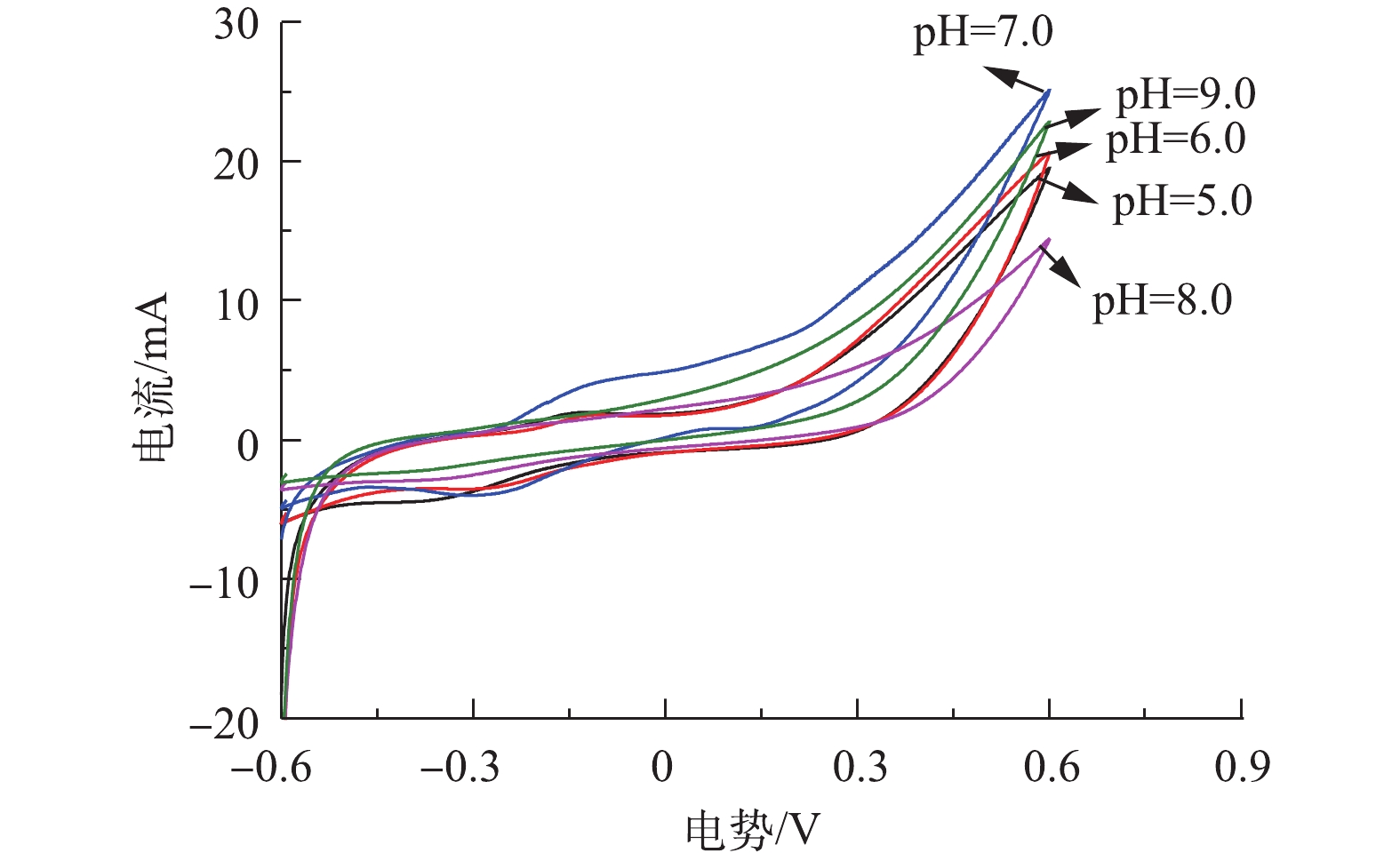
循环伏安法是一种常用的电化学研究方法,通过1次三角波扫描,完成1个还原和氧化反应的循环, 其电流-电压曲线就是循环伏安图,本研究通过循环伏安特性曲线来表征不同pH环境下阳极生物膜的氧化还原能力。由图6可知,当对其进行正向扫描时,在初始pH=7.0时,CV扫描曲线的氧化峰在-0.3 V时开始出现,表明此时电子从细菌转向电极,随后电流上升,表明生物膜上大量处于还原态的活性物质被氧化并形成氧化峰,而其他4个反应器没有明显的氧化峰。同时,5个反应器的还原峰相似,峰电流大小均在-0.005 A左右,表明pH条件的改变主要影响氧化反应速率。由图8可以看出,5个反应器的CV扫描形状比较接近,由CV曲线的闭合面积可知,当pH=5.0时闭合面积最小,当pH=7.0时闭合面积最大。CV曲线的闭合面积大小可以表示电极传输的电子数,并反映电极的电容。闭合面积越大,电极的电容就越好[15]。当pH=7.0时曲线面积最大,说明此时催化效率最高,电子转移速率最快。
2.4 硫的转化及刚果红降解中间产物分析
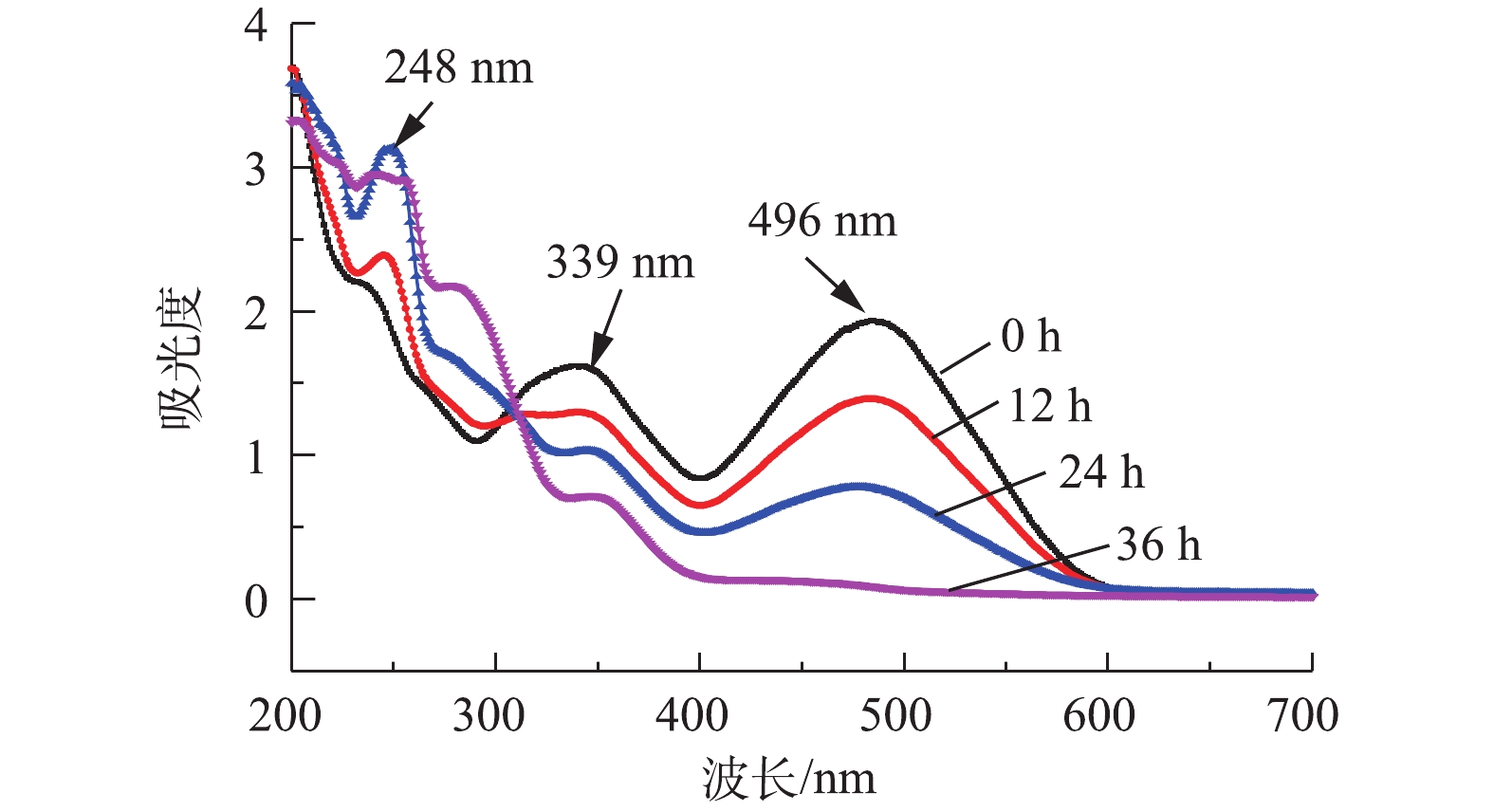
采用紫外-可见光扫描分光光度法测定了刚果红在最大吸收波长(λmax=496 nm)下的吸光度。偶氮键(—N=N—)与萘环和苯环形成的官能团在496 nm呈现吸收峰,使得刚果红染料的颜色呈红色[16],由图7可见,随着反应时间的增加,刚果红在496 nm处的吸收峰逐渐降低,在36 h后此处的吸收峰基本消失,表明含硫化物的偶氮染料在MFC中一个周期后基本反应完全。在36 h内,248 nm处出现明显吸收峰,表明有中间体生成,在24~36 h之间此处吸收峰未明显降低,表明中间体并未进一步降解。
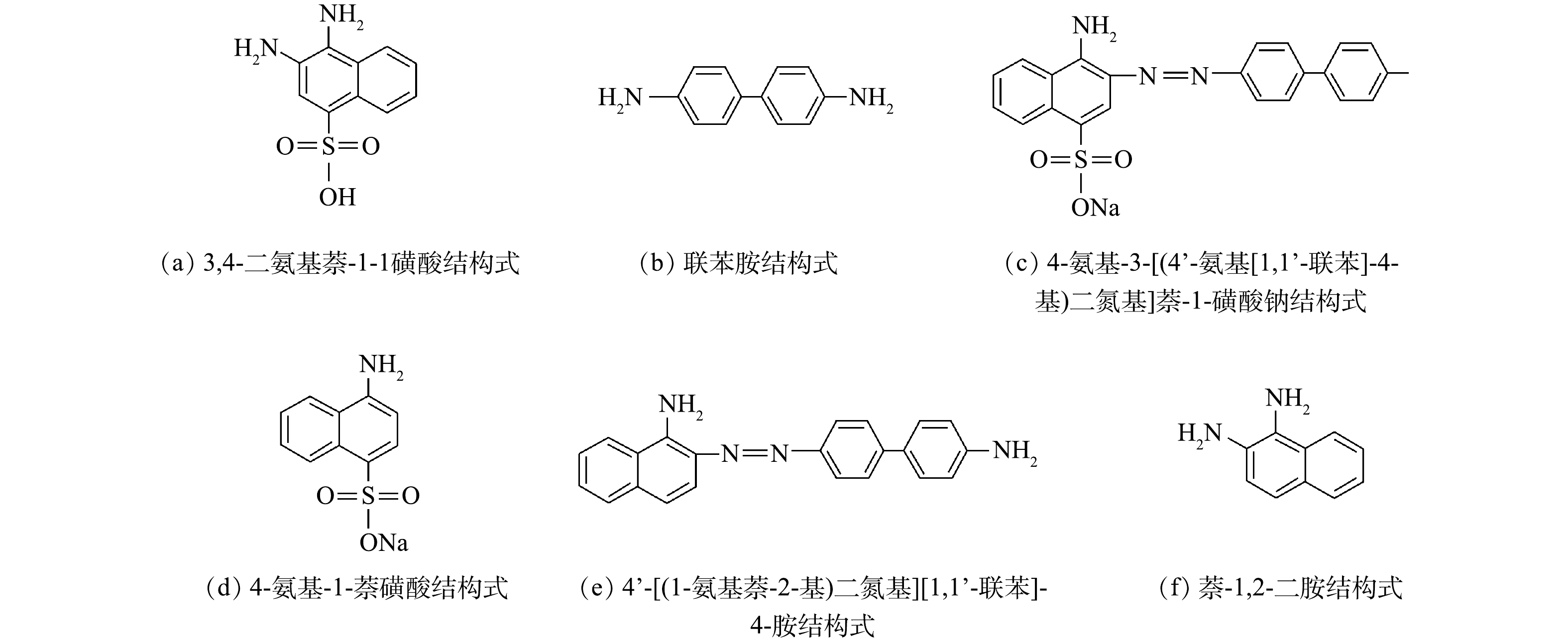
为深入分析刚果红中间产物,用液相色谱-质谱法对降解产物进行鉴定。如表1所示,刚果红的还原产物可能是3,4-二氨基萘-1-磺酸、4-氨基-3-[(4'-氨基[1,1'-联苯]-4-基)二氮基]萘-1-磺酸钠、4-氨基-1-萘磺酸钠,4'-[(1-氨基萘-2-基)二氮基][1,1'-联苯]-4-胺、萘-1,2-二胺和联苯胺等。在MFC还原偶氮染料中,萘环和苯环被认为是最常见的降解产物。在本研究中,乙酸盐氧化和硫化物氧化对产生电子起着重要作用,而偶氮染料则接受电子来破坏刚果红中的偶氮键。有研究[17]表明,3,4-二氨基萘-1-磺酸和联苯胺为刚果红降解的主要产物,与本研究结果一致。值得注意的是,MFC中染料降解的终产物主要是苯环和萘环,为了避免终产物对水体环境的污染,在污水排入自然环境之前,还需要进行进一步的好氧生物处理。
表 1 刚果红降解的可能中间产物Table 1. Possible degradation intermediates of Congo red分子式 名称 m/z 结构式 C10H10N2O3S 3,4-二氨基萘-1-磺酸 239 
C12H12N2 联苯胺 184 
C22H17N4SO3Na 4-氨基-3-[(4’-氨基[1,1’-联苯]-4-基)二氮基]萘-1-磺酸钠 441 
C10H8NNaO3S 4-氨基-1-萘磺酸钠 245 
C22H18N4 4’-[(1-氨基萘-2-基)二氮基][1,1’-联苯]-4-胺 338 
C10H10N2 萘-1,2-二胺 158 
在MFC中硫化物氧化期间每4 h测定不同种类的硫物质(硫化物、硫酸盐、硫代硫酸盐和亚硫酸盐)的浓度。当硫酸盐(
SO2−4 )和亚硫酸盐(SO2−3 )的浓度低于2 mg·L−1时可忽略不计。反应器中的总溶解硫化物浓度约为150 mg·L−1。在MFC中均检测到可溶性硫化物、单质硫、硫代硫酸盐和硫酸盐,表明硫化物可通过自发电化学反应实现单质硫、硫代硫酸盐和硫酸盐的转化。DAHL[18]的研究表明,通常在硫化物(HS−)的氧化过程中,首先会在黄素细胞色素c-硫化物脱氢酶(flavocytochrome c sulfide dehydrogenase,FCSD)和硫醌氧化还原酶(sulfide-quinone reductase,简称SQR)的作用下生成硫单质(S0),然后将电子分别转移到膜结合的细胞色素池或醌池中。随着氧化反应的进行,硫酸盐和硫代硫酸盐浓度逐渐增加,分别在36 h后达到45.41 mg·L−1和70.31 mg·L−1。在最后4 h可以观察到硫酸盐生成速率急剧增加,而硫化物浓度有所降低,这表明硫化物(S2-)首先被氧化成单质硫(S0),之后进一步氧化成其他更高价态(硫酸盐和硫代硫酸盐)。然而,未从系统中检测到亚硫酸盐(SO2−3 ),离子色谱未出现特征峰面积,与MIN等[19]的研究结果相一致。由图8可见,在生物膜中发现了一定数量的圆形菌毛样组分,表明与裸阳极相比,阳极生物膜密集附着有各种形状的微生物,这些微生物有利于硫化物氧化和电子转移。由8(a)可以清楚地观察到被白色沉淀物覆盖的阳极电极。EDX分析结果表明,沉淀物中含有大量的单质硫(S0),作为硫化物氧化反应中的中间产物,硫化物可以与单质硫同时结合形成多硫化物(S2−n ),这在正常情况下发生率很高[20]。硫在不同pH条件下的存在形式有很大区别,S2-、H+和H2S之间的动态反应平衡方程如式(4)~式(7)所示。
H2S=H++HS−Ka1=1.3×10−7pKa1=6.88 (4) HS−=H++S2−Ka2=7.1×10−15pKa1=14.15 (5) H2S=2H++S2−K=9.23×10−22pKa=21.04 (6) [H+]2[S2−][H2S]=9.23×10−22 (7) 当pH=7.0时,将[H+]=10−7代入,则[S2-]/[H2S]=9.23×10−7。这意味着,当pH=7.0时,硫以H2S的形式存在,H2S可以通过空气阴极膜(如碳布)扩散,或取样时H2S气体立即从反应器中逸出。pH<7.0时H2S含量较高,酸性和偏碱性的条件下,HS−的含量增加,有利于硫化物向硫单质及硫酸盐的生成;而pH>7.0时S2-含量较高,硫酸盐含量减少。在高碱性条件下,单质硫可能是硫化物不完全氧化的主要产物,KRISHNAKUMAR等[21]也发现了缺氧条件下硫化物氧化的相似行为。许多研究表明,高负荷和高碱性pH条件下硫化物氧化可能导致过渡产物的积累,如硫代硫酸盐和多硫化物,导致硫化物去除效率较低,说明H+在电化学反应和微生物催化反应中起主导作用。由此可得出,在中性和偏碱性的条件下硫化物的降解速率是最快的,与本文的结论相符。同时,对于大多数细菌来说,细菌生长的pH为4.0~9.0,而其生长的最佳pH为6.5~7.5。KRISHNAKUMAR等[22]的研究表明,当反应器的pH控制在8.0时,达到了最大硫化物负载和硫回收率。在本研究中,当pH=7.0时,可获得最高的硫化物氧化率和染料脱色率。
综上,单室空气阴极微生物燃料电池可以实现在硫化物和偶氮染料去除的同时产生电能。其反应机理如图9所示,硫化物以其强还原性和电子转移性加速偶氮染料的脱色。乙酸盐作为微生物的碳源,在SRB和产电微生物的作用下被氧化为
HCO2−3 和H+。硫化物一方面可以借助阳极生物膜上或阳极液中的SOB直接被氧化为硫酸盐和硫代硫酸盐等;另一方面硫化物可先被硫氧化菌氧化被硫单质,然后硫单质一部分黏附在阳极碳刷上,另一部分悬浮在阳极液中,其中的部分硫单质在SOB的作用下发生进一步的氧化作用,被氧化为SO2−4 和S2O2−3 等含硫物质。本研究中S0、SO2−4 、S2O2−3 的产生可能得益于SOB,SOB加速了MFC中物质的运输和代谢。硫化物在电化学活性和微生物作用下产生电子和质子,偶氮染料得到电子,生成芳香族类无色产物。实验证明刚果红的降解产物为4-氨基-1-萘磺酸钠,联苯胺和3,4-二氨基萘-1-磺酸。其中一些电子和质子分别通过外部电路和溶液到达阴极,与氧气结合生成水。因此,由于硫化物的强还原性、电子转移性和SOB富集,能够显著地加速偶氮染料的降解速率。3. 结论
1) pH对MFC系统的产电性能具有一定影响。在中性条件下,MFC输出电压和最大功率密度最大,内阻最小,偏酸或偏碱的条件下MFC的产电性能均不同程度降低。
2)单室空气阴极MFC能够实现含硫偶氮染料废水的有效去除,pH对MFC系统的污染物去除具有一定影响。当pH=7.0时,刚果红、硫化物和COD的去除率均达到最大值,分别为84.60%、98.40%和49.56%。而过酸或过碱的条件下,产电菌的活性会显著降低,阳极反应速率减慢。MFC的功率密度较低是制约MFC扩大化的主要因素。
3) pH可影响阳极产电菌的氧化还原能力,在中性条件下阳极产电菌的氧化能力最强。UV-Vis和LC-MS分析得出联苯胺和3,4-二氨基萘-1-磺酸为刚果红降解反应的主要中间产物。
-
表 1 土壤重金属全量与弱酸可溶态含量统计分析
Table 1. Statistical analysis of total and weak acid soluble fraction of heavy metals in soils
重金属元素 全量 弱酸可溶态 (平均值±标准差)/(mg·kg−1) 变异系数/% 超标率/% 单因子污染指数(Pi)平均值 潜在生态风险指数(Eir)平均值 (平均值±标准差)/(mg·kg−1) 变异系数/% FRAC平均值/% Mn 691±113 16 49 1.00 1.01 150±54.1 36.1 22.1 Co 19±13.1 69 0 1.19 6.11 0.123±0.169 137 0.477 Ni 35±19.1 54 0 1.00 6.82 0.811±1.02 126 1.99 Cu 221±381 172 38 8.28 42.6 4.3±11.9 274 0.77 Zn 136±95.4 70 6 1.98 2.03 3.46±5.85 169 1.65 As 469±535 114 88 41.9 431 28.6±37.6 131 16.5 Cd 0.4±0.285 71 24 3.33 107 0.051±0.032 62.7 13.1 Pb 31.1±30.7 98 0 1.60 8.24 0.273±0.576 208 0.703 注:超标率参考农用地土壤风险管控标准(GB 15618-2018)[27],其中Mn超标率参考新疆土壤元素背景值[20]。 -
[1] 李乔, 王淑芬, 曹有智, 等. 准东煤田周边农田土壤重金属污染生态风险评估与来源分析[J]. 农业环境科学学报, 2017, 36(8): 1537-1543. [2] 胡锋, 王兴磊, 刘世辉, 等. 伊犁矿区风险点土壤重金属污染特征及生态风险评价[J]. 矿业安全与环保, 2018, 45(1): 69-73. doi: 10.3969/j.issn.1008-4495.2018.01.016 [3] AOSTA J A, FA Z A, MAR T M, et al. Multivariate statistical and GIS-based approach to evaluate heavy metals baviour in mine sites for future reclamation[J]. Journal of Geochemical Exploration, 2011, 109: 8-17. doi: 10.1016/j.gexplo.2011.01.004 [4] PANDEY B, AGRAWAL M, SINGH S. Ecological risk assessment of soil contamination by trace elements around coal mining area[J]. Journal of Soils and Sediments, 2016, 16(1): 159-168. doi: 10.1007/s11368-015-1173-8 [5] 高宇潇, 塔西甫拉提·特依拜, 夏楠, 等. 新疆准东五彩湾煤田区不同深度土壤重金属污染评价、来源分析与空间分布特征[J]. 中国矿业, 2016, 25(9): 74-81. doi: 10.3969/j.issn.1004-4051.2016.09.017 [6] 王显炜, 徐友宁, 杨敏, 等. 国内外矿山土壤重金属污染风险评价方法综述[J]. 中国矿业, 2009, 18(10): 54-56. doi: 10.3969/j.issn.1004-4051.2009.10.018 [7] 张开军, 魏迎春, 徐友宁. 小秦岭金矿区土壤重金属生物有效性与影响因素[J]. 地质通报, 2014, 33(8): 1182-1187. doi: 10.3969/j.issn.1671-2552.2014.08.012 [8] 陈明, 杨涛, 徐慧, 等. 赣南某钨矿区土壤中Cd、Pb的形态特征及生态风险评价[J]. 环境化学, 2015, 34(12): 2257-2262. doi: 10.7524/j.issn.0254-6108.2015.12.2015070201 [9] WANG Q, LIU J F, CHEN Z, et al. A causation-based method developed for an integrated risk assessment of heavy metals in soil[J]. Science of the Total Environment, 2018, 642: 1396-1405. doi: 10.1016/j.scitotenv.2018.06.118 [10] 陈莹. 陕西西部矿区土壤重金属污染与生态风险评价[J]. 环境与发展, 2017, 29(7): 35-36. [11] SEBEI A, HELALI M A, OUESLATI W, et al. Bioavailability of Pb, Zn, Cu, Cd, Ni and Cr in the sediments of the Tessa River: A mining area in the North-West Tunisia[J]. Journal of African Earth Sciences, 2018, 137: 1-8. doi: 10.1016/j.jafrearsci.2017.09.005 [12] SUNDARY S K, NAYAK B B, LIN S, et al. Geochemical speciation and risk assessment of heavy metals in the river estuarine sediments: A case study: Mahanadi basin, India[J]. Journal of Hazardous Materials, 2011, 186(2/3): 1837-1846. [13] FERNÁNDEZ-ONDOÑO E, BACCHETTA G, LALLEN A M, et al. Use of BCR sequential extraction procedures for soils and plant metal transfer predictions in contaminated mine tailings in Sardinia[J]. Journal of Geochemical Exploration, 2017, 172: 133-141. doi: 10.1016/j.gexplo.2016.09.013 [14] ZHANG M K, LIU Z Y, HUO W. Use of single extraction methods to predict bioavailability of heavy metals in polluted soils to rice[J]. Communications in Soil Science & Plant Analysis, 2010, 41(7): 820-831. [15] LIAO J, WEN Z, RU X, et al. Distribution and migration of heavy metals in soil and crops affected by acid mine drainage: Public health implications in Guangdong Province, China[J]. Ecotoxicology and Environmental Safety, 2016, 124: 460-469. doi: 10.1016/j.ecoenv.2015.11.023 [16] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理员会. 土壤质量总汞、总砷、总铅的测定原子荧光法: GB/T 22105.2-2008[S]. 北京: 中国标准出版社, 2008. [17] 国家环境保护局. 土壤质量铜、锌的测定火焰原子吸收分光光度法: GB/T 17138-1997[S]. 北京: 中国环境科学出版社, 1997. [18] TOKALIOĞLU Ş, KARTAL Ş, GÜLTEKIN A. Investigation of heavy metal uptake by vegetables growing in contaminated soils using the modified BCR sequential extraction method[J]. International Journal of Environmental Analytical Chemistry, 2006, 86(6): 417-430. doi: 10.1080/03067310500352387 [19] 柳云龙, 章立佳, 韩晓非, 等. 上海城市样带土壤重金属空间变异特征及污染评价[J]. 环境科学, 2012, 33(2): 599-605. [20] 国家环境保护局, 中国环境监测总站. 中国土壤元素背景值[M]. 北京: 中国环境科学出版社, 1990. [21] HAKANSON L. An ecological risk index for aquatic pollution control. A sedimentological approach[J]. Water Research, 1980, 14(8): 975-1001. doi: 10.1016/0043-1354(80)90143-8 [22] 吕建树, 张祖陆, 刘洋, 等. 日照市土壤重金属来源解析及环境风险评价[J]. 地理学报, 2012, 67(7): 971-984. [23] 熊秋林, 赵佳茵, 赵文吉, 等. 北京市地表土重金属污染特征及潜在生态风险[J]. 中国环境科学, 2017, 37(6): 2211-2221. doi: 10.3969/j.issn.1000-6923.2017.06.028 [24] LIU J L, LI Y L, ZHANG B, et al. Ecological risk of heavy metals in sediments of the Luan River source water[J]. Ecotoxicology, 2009, 18(6): 748-758. doi: 10.1007/s10646-009-0345-y [25] 高彦鑫, 冯金国, 唐磊, 等. 密云水库上游金属矿区土壤中重金属形态分布及风险评价[J]. 环境科学, 2012, 33(5): 1707-1717. [26] 迪娜·吐尔生江, 李典鹏, 胡毅, 等. 新疆奴拉赛铜矿周边土壤理化特征和重金属污染生态风险评价[J]. 农业资源与环境学报, 2018, 35(1): 17-23. [27] 生态环境部, 国家市场监督管理总局. 土壤环境质量农用地土壤污染风险管控标准(试行): GB 15618-2018[S]. 北京: 中国环境科学出版社, 2018. [28] 李如忠, 徐晶晶, 姜艳敏, 等. 铜陵市惠溪河滨岸带土壤重金属形态分布及风险评估[J]. 环境科学研究, 2013, 26(1): 88-96. [29] LIU J J, NI Z X, DIAO Z H, et al. Contamination level, chemical fraction and ecological risk of heavy metals in sediments from Daya Bay, South China Sea[J]. Marine Pollution Bulletin, 2018, 128: 132-139. doi: 10.1016/j.marpolbul.2018.01.021 [30] 李忠义, 张超兰, 邓超冰, 等. 铅锌矿区农田土壤重金属有效态空间分布及其影响因子分析[J]. 生态环境学报, 2009, 18(5): 1772-1776. doi: 10.3969/j.issn.1674-5906.2009.05.033 [31] 方月梅, 张晓玲, 刘娟, 等. 湖北省铜绿山矿区农业土壤重金属形态及生物有效性[J]. 地球与环境, 2017, 45(6): 634-642. [32] ERIKSSON J E. The influence of pH, soil type and time on adsorption and by plants of Cd added to the soil[J]. Water, Air and Soil Pollution, 1989, 48(3/4): 317-335. [33] 江嵩鹤, 胡恭任, 于瑞莲, 等. 安溪铁观音茶园土壤重金属赋存形态及生态风险评价[J]. 地球与环境, 2016, 44(3): 359-369. -




 下载:
下载: