-
近十几年来,随着水产、养殖、医药等行业的迅速发展,我国的水体环境污染状况日趋严重。污染水体由最初的生活污水、工业废水衍变为地表水、地下水等在全国范围内的污染。在水污染治理技术中,膜技术由于其高效、环保的特点被广范应用。在膜技术处理废水的过程中,通过调节膜的孔径、表面结构等组装不同孔径的膜组件系列装置,可广泛用在炼油废水、印染废水及生活污水等的治理中[1-3]。但膜污染问题是限制膜技术广泛使用的瓶颈之一。膜污染导致膜的使用周期变短,清洗频率增高,大大提升了膜处理废水时的运行成本[4-6]。因此,在治理废水的过程中,如何有效减缓膜污染并节约能耗是当今膜技术研究的热点方向。
微生物燃料电池(microbial fuel cell,MFC)是一种新型的水处理技术[7-9]。该技术利用细菌的胞外电子传递机制,MFC的阳极厌氧细菌可将污水中氧化有机物时产生的电子释放出来,流经外接电路传递到阴极,在阴极与电子受体(多为O2)结合产生水,形成持续的电子回路,从而将污水中有机物的化学能转化为电能,进行能源回收。据研究报道,ZHANG等[10]将2个4 L的U型MFC用在城镇污水处理示范性工程中,结果表明,在水力停留时间为11 h时,MFC对COD的去除率达到0.2 kg·m−3,此时产生的电流密度为9 A·m−3。GE等[11]将200 L的MFC用在城镇污水处理过程中,最高产能达到0.009 kWh·m−3。但MFC单独处理污水时仅依靠细菌的降解作用,缺乏后续的深度处理技术,故其出水的水质通常较差,难以达到理想的处理效果。
将MFC与膜技术联用可以实现多重优势[12-14]。首先,膜过滤可以提升MFC处理污水后的出水水质,提升污水处理的整体效率;其次,MFC中电子和质子的定向移动会产生微电场,可以有效地减缓细菌代谢产物等向膜表面的附着,缓解膜污染。所以,将MFC与膜技术联用是一种集高效、节能为一体的污水处理技术。
电催化膜的研发是实现MFC与膜技术联用的关键技术之一[15]。在水处理过程中,电催化膜由于兼具导电和过滤作用,可同时充当MFC的阴极及过滤膜。污染物在经MFC分解后,再经过膜过滤,实现高效的污染物处理效率;并且,在此过程中可以将污水中的能源经MFC转化为电能,实现节能减排。在电催化膜上负载催化剂(如石墨烯、碳纳米管、过渡金属氧化物、聚苯胺等)可以有效提高MFC在污水处理中的产能效果[15-17]。
本研究将聚吡咯(polypyrrole,PPy)、碳纤维布和聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜复合,制备出PPy-PVDF/碳纤维催化膜(PPy-PVDF/碳纤维膜),研究了PPy对PVDF/碳纤维膜催化活性和抗污染性能的影响,并探究了PPy-PVDF/碳纤维膜在MFC-电催化膜反应器中的污染物去除效率和产能效果。
-
吡咯单体(C4H5N,化学纯),磷酸二氢钾(KH2PO4)、氯化钾(KCl)、聚乙烯吡咯烷酮((C6H9NO)n)、N,N-二甲基甲酰胺(C3H7NO)和乙醇(C2H6O)为分析纯。
-
在MFC-电催化膜反应器污水处理过程中,阳极室与阴极室呈H型构型(如图1所示),体积均为200 mL。阳极室中填充产电微生物负载的石墨颗粒,接种的产电微生物为杂菌,其有效的菌种成分是具胞外电子传递特点的厌氧希瓦氏菌M2-1。阴极室放置制备的电催化膜,底部配置气石曝气。阳极室与阴极室之间采用多孔隔板隔开。反应器进水中各污染物的浓度约为COD∶N∶P=100∶5∶1。MFC-电催化膜污水处理反应器中,进水从阳极室底部进入,随后经渗流进入阴极室,最后经过蠕动泵对电催化膜的减压抽滤得到出水,反应器采用连续进出水模式,运行一个周期为15 d。运行过程中阳极液稳定在(80±5) mL,阴极液为180 mL。
在电流输出回路中,阳极室放置碳棒导出电子,用铜丝与500 Ω的电阻连接,电阻另一端用铜丝与阴极电催化膜连接,构成完整的电子回路。
-
吡咯单体溶液的配制 250 mL水∶乙醇(V∶V)为9∶1的溶液中,加入1.68 g吡咯单体、1.86 g氯化钾及0.34 g磷酸二氢钾。配制的吡咯单体溶液含0.1 mol·L−1 吡咯、0.1 mol·L−1 KCl和0.34 g KH2PO4。
PVDF/碳纤维膜的制备 称取2 g聚偏氟乙烯(polyvinylidene fluoride,PVDF),0.2 g聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)加入到20 g N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)中,磁力搅拌3 h。随后,在上述溶液中加入0.2 g碳纳米纤维(150~200 nm,纯度>99.9%),继续磁力搅拌1 h。随后超声脱泡20 min,在碳纤维布表面浇铸刮膜,刮膜厚度为300 μm,后经相转化后,制备出PVDF/碳纤维膜。PVDF铸膜液中添加碳纳米纤维可提升PVDF/碳纤维膜的导电性。
电氧化聚合PPy在三电极体系(CHI660E,上海辰华仪器有限公司)中,饱和甘汞电极作为参比电极,铂片电极作为辅助电极,PVDF/碳纤维膜作为工作电极,吡咯单体溶液作为聚合液,在0.8 V的恒电位下,持续沉积5、10和15 min,得到PPy改性的PVDF/碳纤维膜(后面简称电催化膜),并对比不同的沉积时间(沉积量)对电催化膜活性的影响。
-
电催化膜的表征测试。本研究采用扫描电子显微镜(scanning electron microscopy,SEM)测试电催化膜的表面形貌;采用傅里叶变换红外光谱仪(fourier transform infrared spectroscopy,FT-IR)分析聚合形成的PPy。
电催化膜的活性测试。本研究对PPy聚合沉积前和沉积后的电催化膜在三电极体系中进行活性测试。配制5 mmol·L−1 K3Fe(CN)6 + 1 mol·L−1 KCl溶液作为电解液,饱和甘汞电极(saturated calomel electrode,SCE,0.241 2 V)作为参比电极,1 cm×1 cm Pt片电极作为辅助电极,电催化膜作为工作电极,采用循环伏安法[15],扫描电压设在0~0.8 V,扫速为10 mV·s−1,得到电催化膜的活性曲线。
电催化膜的抗污染性能测试。在清水通量的测试中,实验将PPy10-/PVDF/碳纤维膜用膜组件组装后,放置在超纯水中,在86 cm的水头压差(8.1 kPa)下测得40 min后的稳定通量为4 493.49 L·(m2·h)−1。在膜抗污染性能的测试中,本研究采用酵母菌(Zeta电位为−12.9 mV,平均粒径7 μm)模拟污水中活性污泥,配制的MLSS浓度为2 g·L−1。在处理污废水时,活性污泥的代谢产物在膜表面的黏附是导致过滤膜污染严重的主要因素之一[4]。酵母菌具有与活性污泥类似的特点如表面负电位性、粒径等,因而采用酵母菌替代活性污泥可以模拟膜在运行过程中的污染情况。实验将PPy10-PVDF/碳纤维膜用膜组件组装并作为阴极,膜的进出水的水头压差为66 cm(8.1 kPa)。将同面积的不锈钢网电极作为阳极,2个电极之间相对放置,且水平间距保持1 cm。阳极和阴极连接直流电源,输出电压控制在0.4 V。
MFC-电催化膜反应器的产能测试。在测试功率密度曲线和极化曲线时,先将阳极与阴极回路断开,保持开路2 h以上;随后将电阻箱连接到2侧电极上,并连接数字万用表(选择电压测量档位),通过变换不同的电阻值记录相应电压值,做出极化曲线和功率密度曲线。
MFC-电催化膜反应器的污染物降解测试。实验对反应器中COD(chemical oxygen demand,化学需氧量)的值进行了测定分析。每隔1 d取适量进水水样和出水水样,测定其相应的COD值并计算去除效率。此外,本研究还测量计算了MFC-电催化膜反应器在处理污水时的库仑效率,计算方法[10]如式(1)所示。
式中:ηCE代表库仑效率;Q输出代表反应器在运行时间t内产生的总电子数,C;Q消耗代表在运行时间t内降解去除的有机物中被完全氧化时产生的总电子数,C;I代表反应器中阴极和阳极短接时输出的电流,A;t代表运行时间,s;MCOD去除代表反应器在运行时间t内去除COD的摩尔数,mol。
-
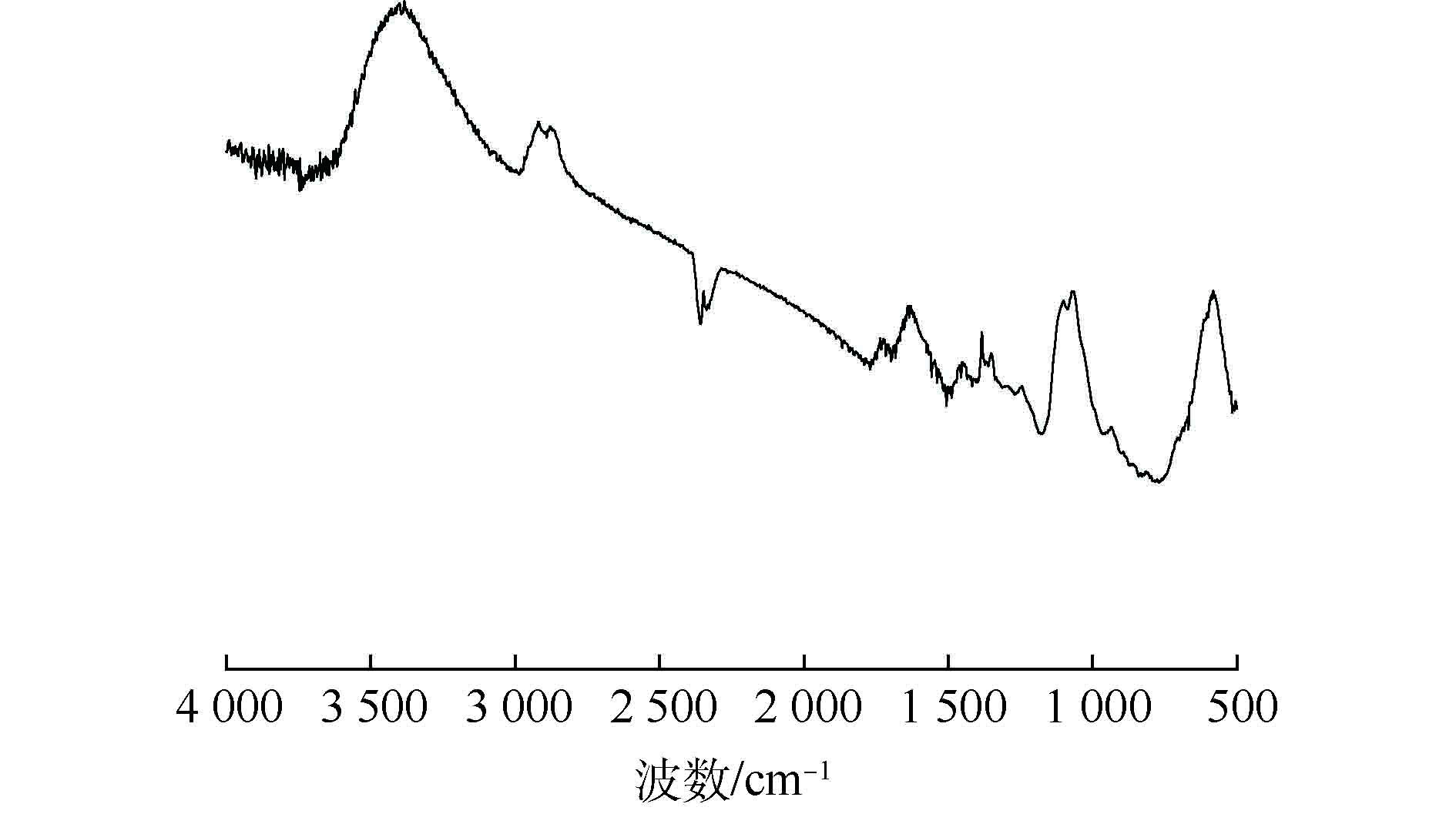
对沉积在PVDF/碳纤维膜表面的PPy进行了红外光谱测试,结果如图2所示。在1 538 cm−1和1 468 cm−1附近出现的峰分别为吡咯环中C—C双键伸缩振动和C—C骨架上的不对称伸缩振动;1 650 cm−1处为吡咯环内NH2弯曲振动峰;3 350 cm−1处为N—H伸缩振动峰;2 460 cm−1处为C—N—C的伸缩振动峰;1 280 cm−1和1 021 cm−1处为聚吡咯环上C—H面内弯曲振动峰。同时,本研究对制备的材料进行了扫描电镜测试,结果如图3所示。由红外光谱测试和扫描电镜观察可知,经过0.8 V的恒电位沉积后,PPy已成功地沉积在光滑的PVDF/碳纤维膜表面。
-
阴极电极的电化学活性对MFC-电催化膜反应器的产能具有重要影响。高活性的阴极电极可以加速电子传递,并加快氧气与质子、电子在阴极介孔内的反应,从而有效提高MFC-电催化膜反应器的产电性能。
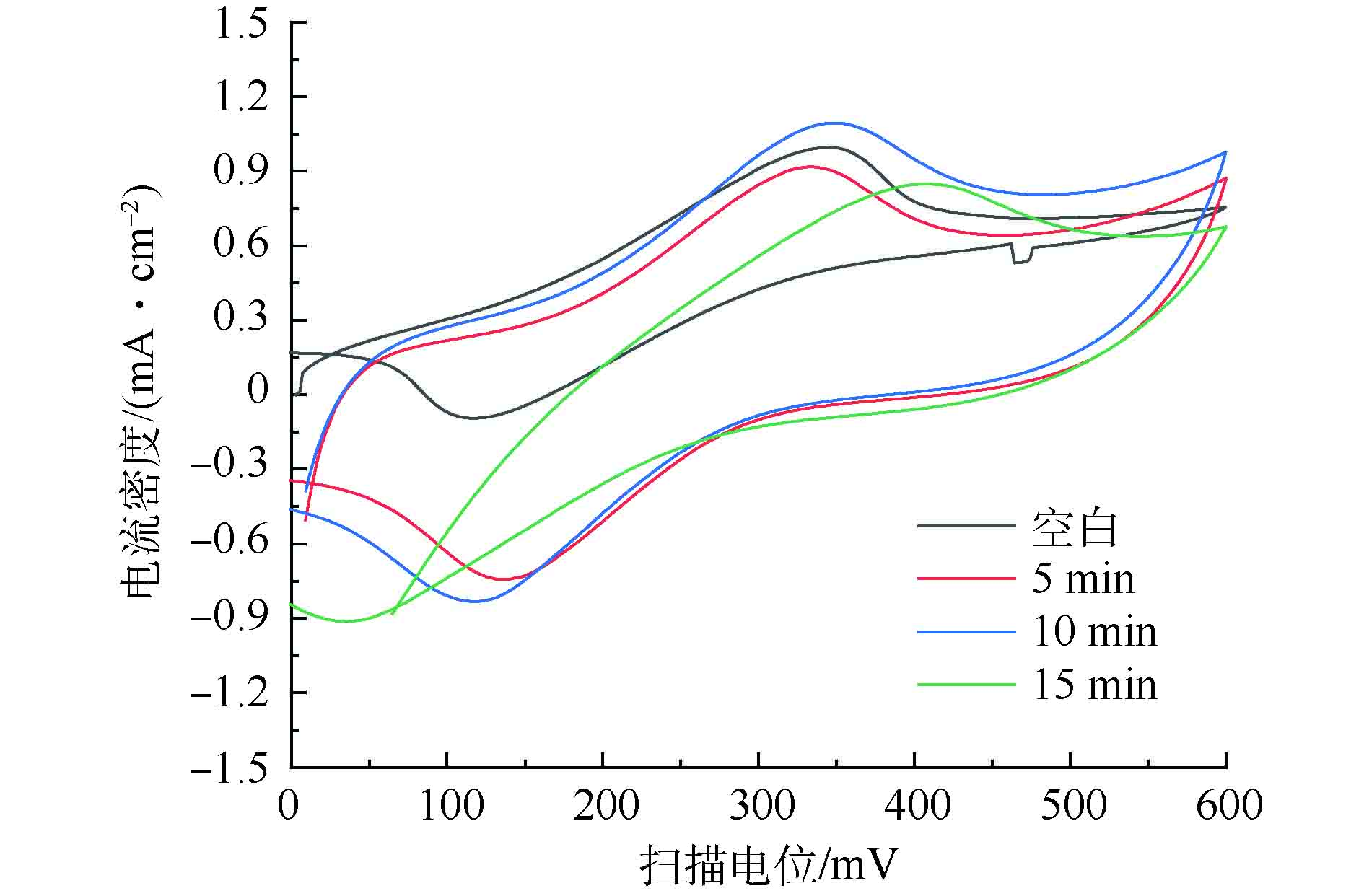
经过5、10和15 min的电氧化聚合制备的PPy沉积PVDF/碳纤维膜(分别用PPy5-PVDF/碳纤维膜,PPy10-PVDF/碳纤维膜和PPy15-PVDF/碳纤维膜表示),其氧化还原活性测试结果如图4所示。图4表明,PPy10-PVDF/碳纤维膜的氧化还原活性最佳。其氧化峰电位和还原峰电位分别出现在0.36 V和0.13 V附近。在PPy电氧化聚合过程中,电氧化聚合时间直接影响PPy在PVDF/碳纤维膜上的沉积量,最终影响PVDF/碳纤维膜的催化活性。在不同的聚合时间下,PPy在PVDF/碳纤维膜的沉积密度如表1所示。表1显示,在电氧化聚合初始阶段,随着PPy在PVDF/碳纤维膜表面的聚合沉积,PVDF/碳纤维膜的催化活性提高。但随着时间的延长,PPy在PVDF/碳纤维膜表面的沉积虽密度逐步变大,但PVDF/碳纤维膜的电化学活性并不是持续升高,在密度过高时其电催化活性反而下降,表明电氧化聚合时间过长导致PPy在PVDF/碳纤维膜表面密度过高,形成多层累积,反而导致PVDF/碳纤维膜活性降低。上述结果表明,PPy10-PVDF/碳纤维膜的电化学活性最高,其表面PPy的沉积密度为0.75 mg·cm−2。
此外,由图4可知,PPy10-PVDF/碳纤维膜的氧化电位出现在约0.34 V处,比PPy5-PVDF/碳纤维膜的氧化电位(约0.32 V)略高。但是,PPy10-PVDF/碳纤维膜的还原电位出现在约0.12 V,比PPy5-PVDF/碳纤维膜的还原电位(约0.16 V)低。这说明在MFC-电催化膜反应器中,在催化阴极还原反应后,在较低电位下即可实现PPy10-PVDF/碳纤维膜上催化活性的再生。
-
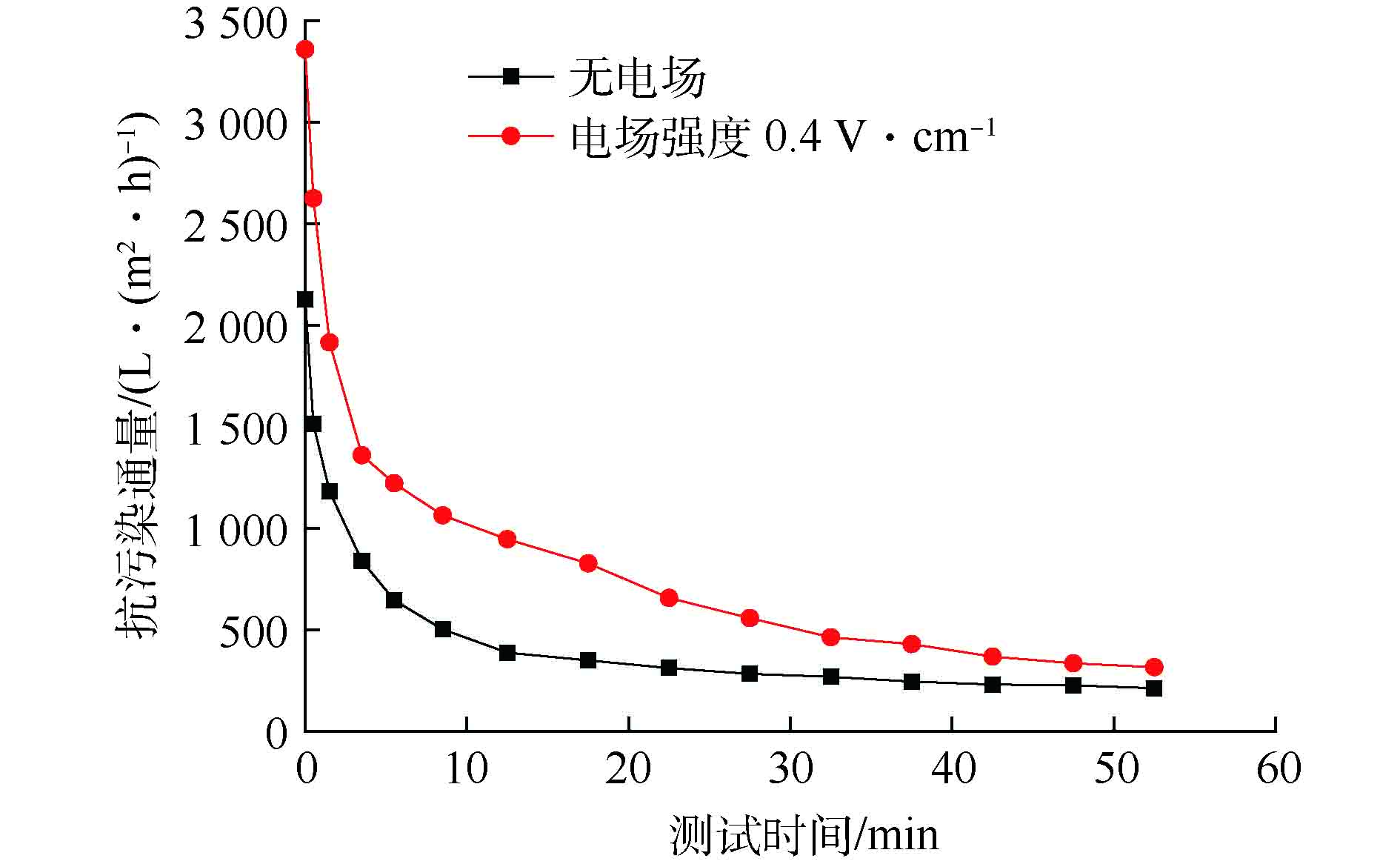
电催化膜抗污染通量的测试结果如图5所示。可以看出,在0.4 V·cm−1的电场环境下,PPy10-PVDF/碳纤维膜在运行55 min后,其通量为317 L·(m2·h)−1,比无电场下测试的通量值212 L·(m2·h)−1提高了约49.5%。实验结果表明,微电场环境可以有效减缓膜的污染程度,延长膜的使用周期。本研究通过组装MFC-电催化膜反应器,构建出过滤膜运行的微电场环境,利用微电场减缓PPy10-PVDF/碳纤维膜的污染程度,从而延长膜的使用周期。
在MFC-电催化膜反应器处理污水过程中,PPy10-PVDF/碳纤维膜的运行通量实测为18.7 L·(m2·h)−1,远低于其临界通量,说明PPy10-PVDF/碳纤维膜可以保持较长时间的稳定运行。
-
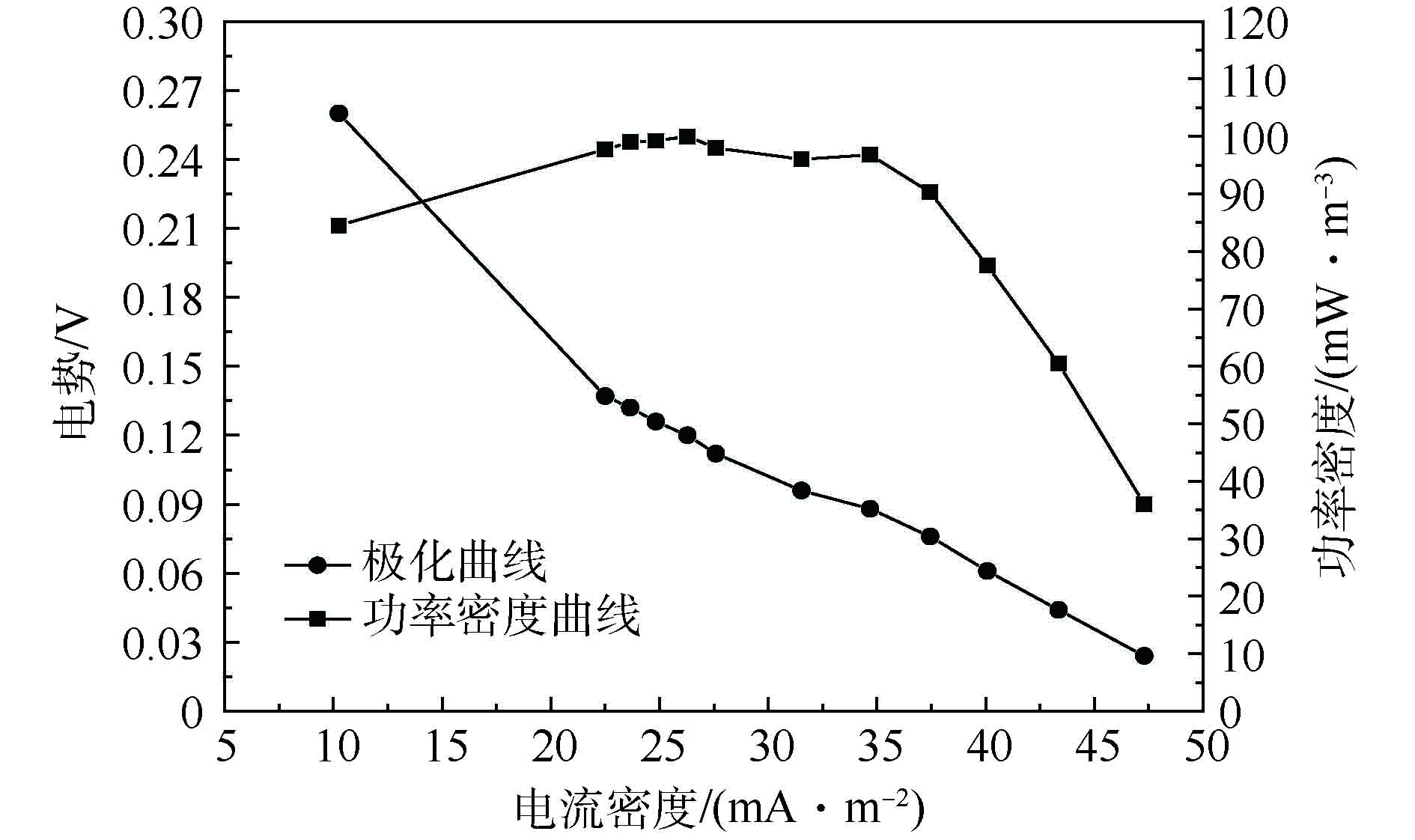
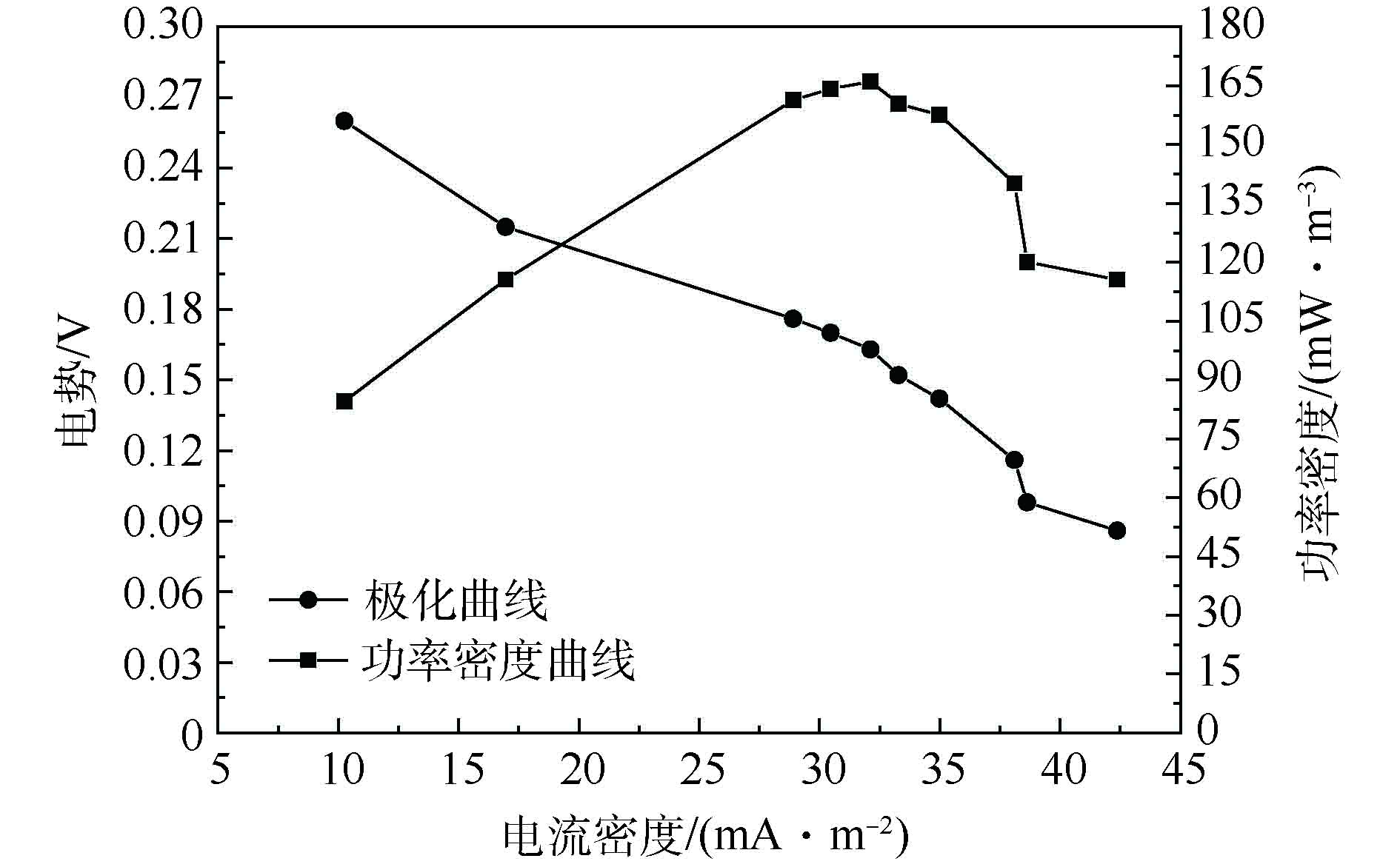
将PPy10-PVDF/碳纤维膜作为阴极膜在MFC-电催化膜反应器中进行污水处理。运行稳定后,反应器的产能效果(空白PVDF/碳纤维膜作为对照)如图6和图7所示。可以看出,采用空白PVDF/碳纤维膜作为MFC阴极兼催化膜构建MFC-电催化膜反应器,在处理污水过程中,该反应器产能最大功率密度约为99 mW·m−3;而采用PPy10-PVDF/碳纤维膜构建MFC-电催化膜反应器时,在处理污水时反应器产能最大功率密度达到约166 mW·m−3。
在阴极膜上沉积PPy后,MFC-电催化膜反应器在处理污水时其产能功率密度提高了约67%。经计算,采用PPy10-PVDF/碳纤维膜作阴极,MFC-电催化膜反应器的库仑效率为2.2%[10],与PVDF/碳纤维膜作阴极时的库伦效率1.5相比,提升了约50%。本实验结果与ZHANG等[10]的相比,产能效果略低。其原因在于:本研究是基于实际城镇污水水质进行的模拟产能测试,反应器中未添加任何离子盐类,电解质浓度较低,故污水的电导率低是限制本反应器产能的一个关键因素;另一方面,作为阴极的电催化膜表面有限的接触面积也是导致其与其他单独MFCs相比产能较低的原因之一。
-
在PPy10-PVDF/碳纤维膜作为阴极膜构建的MFC-电催化膜反应器中,反应器对污水中有机污染物的降解效果如图8所示。进水中的COD约在920~970 mg·L−1,经过MFC-电催化膜反应器处理(水力停留时间为6.7 h),在出水中检测到COD稳定在20~40 mg·L−1,反应器对污染物的去除率高达96%以上。这表明MFC-电催化膜反应器可将污水中有机污染物高效快速分解。
上述实验结果表明,在MFC-电催化膜反应器处理污水过程中,不仅处理效果高,膜污染程度大大减缓;而且在处理过程中还可以将污水中的能源转化回收,实现节能减排。因此,MFC-电催化膜反应器是一种高效环保的污水处理新技术。
-
1)聚吡咯(PPy)的沉积可有效提高PVDF/碳纤维膜的催化活性,在沉积密度为0.75 mg·cm−2时,PPy10-PVDF/碳纤维膜的催化活性最佳。
2)采用PPy10-PVDF/碳纤维膜构建的MFC-电催化膜反应器在污水处理过程中表现出高效的污染物去除效果和能源转化效率,并在降解过程中有效地减缓了膜污染,实现了水处理的节能减排。
MFC-电催化膜反应器中PPy-PVDF/碳纤维膜的污水处理性能
Performance of polypyrrole-PVDF/carbon fiber cloth composite membrane in a MFC-electrocatalytic membrane coupled reactor on wastewater treatment
-
摘要: 为解决膜分离技术在水处理中存在膜污染和高能耗的问题,通过电氧化聚合法将聚吡咯(polypyrrole,PPy)沉积在PVDF/碳纤维膜上,制备高活性的PPy-PVDF/碳纤维膜;研究不同沉积时间对电催化膜催化活性的影响及微电场环境对PPy-PVDF/碳纤维膜污染的影响;并构建MFC-电催化膜反应器,测试反应器在处理污水时的产能效果。结果表明,恒电位(0.8 V)聚合10 min时,PPy10-PVDF/碳纤维膜的催化活性最高,PPy的最佳沉积密度为0.75 mg·cm−2。抗污染通量测试结果表明,在0.4 V·cm−1的微电场下,PPy10-PVDF/碳纤维膜的稳定通量(317 L·(m2·h)−1)比无电场时(212 L·(m2·h)−1)提高了约49.5%,说明MFC-电催化膜反应器中的微电场可以有效减缓膜污染。在MFC-电催化膜处理污水的过程中,反应器对COD去除率高达96%以上;反应器产能最大功率密度为166 mW·m−3,与空白PVDF/碳纤维膜(产能密度为99 mW·m−3)相比提高了约67%。PPy10-PVDF/碳纤维膜在MFC-电催化膜反应器表现出较高的污染物去除率、能源回收效率及对膜污染的有效控制。Abstract: In order to solve the problems of membrane fouling and high energy consumption for membrane separation technology, through elctropolymerization of pyrrole monomer and deposition of polypyrrole (PPy) on polyvinylidene fluoride (PVDF)/carbon fiber cloth membrane, the high active PPy-PVDF/carbon fiber cloth composite membrane was prepared. The effect of deposition time on the catalytic activity of electrocatalytic membrane as well as the effect of micro-electric field on the fouling of PPy-PVDF/carbon fiber cloth composite membrane was studied. Then the as-prepared PPy-PVDF/carbon fiber cloth composite membrane was further used in microbial fuel cell (MFC)-electrocatalytic membrane coupled reactor to treat wastewater. The results showed the PPy10-PVDF/carbon fiber cloth composite membrane had the highest catalytic activity at the polymerization time of 10 min and the constant potential of 0.8 V, and the optimized deposition density of PPy was 0.75 mg·cm−2. The anti-fouling test of PPy10-PVDF/carbon cloth composite membrane indicated that the stable flux of the composite membrane was 317 L·(m2·h)−1 at a micro-electric field of −0.4 V·cm−1, which was 49.5% higher than that without electric field (212 L·(m2·h)−1). When MFC-electrocatalytic membrane coupled reactor was used to treat the wastewater, its chemical oxygen demand (COD) removal rate was above 96%, and its maximum power density was 166 mW·m−3, which was approximately 67% higher than that of blank PVDF/carbon cloth membrane (99 mW·m−3). The results indicated the PPy10-PVDF/carbon cloth composite membrane in MFC-electrocatalytic membrane coupled reactor showed an excellent performance in the aspects of contaminants removal, energy recovery and membrane fouling control.
-
Key words:
- polypyrrole /
- electrocatalytic membrane /
- microbial fuel cell /
- wastewater treatment
-
近十几年来,随着水产、养殖、医药等行业的迅速发展,我国的水体环境污染状况日趋严重。污染水体由最初的生活污水、工业废水衍变为地表水、地下水等在全国范围内的污染。在水污染治理技术中,膜技术由于其高效、环保的特点被广范应用。在膜技术处理废水的过程中,通过调节膜的孔径、表面结构等组装不同孔径的膜组件系列装置,可广泛用在炼油废水、印染废水及生活污水等的治理中[1-3]。但膜污染问题是限制膜技术广泛使用的瓶颈之一。膜污染导致膜的使用周期变短,清洗频率增高,大大提升了膜处理废水时的运行成本[4-6]。因此,在治理废水的过程中,如何有效减缓膜污染并节约能耗是当今膜技术研究的热点方向。
微生物燃料电池(microbial fuel cell,MFC)是一种新型的水处理技术[7-9]。该技术利用细菌的胞外电子传递机制,MFC的阳极厌氧细菌可将污水中氧化有机物时产生的电子释放出来,流经外接电路传递到阴极,在阴极与电子受体(多为O2)结合产生水,形成持续的电子回路,从而将污水中有机物的化学能转化为电能,进行能源回收。据研究报道,ZHANG等[10]将2个4 L的U型MFC用在城镇污水处理示范性工程中,结果表明,在水力停留时间为11 h时,MFC对COD的去除率达到0.2 kg·m−3,此时产生的电流密度为9 A·m−3。GE等[11]将200 L的MFC用在城镇污水处理过程中,最高产能达到0.009 kWh·m−3。但MFC单独处理污水时仅依靠细菌的降解作用,缺乏后续的深度处理技术,故其出水的水质通常较差,难以达到理想的处理效果。
将MFC与膜技术联用可以实现多重优势[12-14]。首先,膜过滤可以提升MFC处理污水后的出水水质,提升污水处理的整体效率;其次,MFC中电子和质子的定向移动会产生微电场,可以有效地减缓细菌代谢产物等向膜表面的附着,缓解膜污染。所以,将MFC与膜技术联用是一种集高效、节能为一体的污水处理技术。
电催化膜的研发是实现MFC与膜技术联用的关键技术之一[15]。在水处理过程中,电催化膜由于兼具导电和过滤作用,可同时充当MFC的阴极及过滤膜。污染物在经MFC分解后,再经过膜过滤,实现高效的污染物处理效率;并且,在此过程中可以将污水中的能源经MFC转化为电能,实现节能减排。在电催化膜上负载催化剂(如石墨烯、碳纳米管、过渡金属氧化物、聚苯胺等)可以有效提高MFC在污水处理中的产能效果[15-17]。
本研究将聚吡咯(polypyrrole,PPy)、碳纤维布和聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜复合,制备出PPy-PVDF/碳纤维催化膜(PPy-PVDF/碳纤维膜),研究了PPy对PVDF/碳纤维膜催化活性和抗污染性能的影响,并探究了PPy-PVDF/碳纤维膜在MFC-电催化膜反应器中的污染物去除效率和产能效果。
1. 材料与方法
1.1 实验原料
吡咯单体(C4H5N,化学纯),磷酸二氢钾(KH2PO4)、氯化钾(KCl)、聚乙烯吡咯烷酮((C6H9NO)n)、N,N-二甲基甲酰胺(C3H7NO)和乙醇(C2H6O)为分析纯。
1.2 实验装置
在MFC-电催化膜反应器污水处理过程中,阳极室与阴极室呈H型构型(如图1所示),体积均为200 mL。阳极室中填充产电微生物负载的石墨颗粒,接种的产电微生物为杂菌,其有效的菌种成分是具胞外电子传递特点的厌氧希瓦氏菌M2-1。阴极室放置制备的电催化膜,底部配置气石曝气。阳极室与阴极室之间采用多孔隔板隔开。反应器进水中各污染物的浓度约为COD∶N∶P=100∶5∶1。MFC-电催化膜污水处理反应器中,进水从阳极室底部进入,随后经渗流进入阴极室,最后经过蠕动泵对电催化膜的减压抽滤得到出水,反应器采用连续进出水模式,运行一个周期为15 d。运行过程中阳极液稳定在(80±5) mL,阴极液为180 mL。
在电流输出回路中,阳极室放置碳棒导出电子,用铜丝与500 Ω的电阻连接,电阻另一端用铜丝与阴极电催化膜连接,构成完整的电子回路。
1.3 实验方法
吡咯单体溶液的配制 250 mL水∶乙醇(V∶V)为9∶1的溶液中,加入1.68 g吡咯单体、1.86 g氯化钾及0.34 g磷酸二氢钾。配制的吡咯单体溶液含0.1 mol·L−1 吡咯、0.1 mol·L−1 KCl和0.34 g KH2PO4。
PVDF/碳纤维膜的制备 称取2 g聚偏氟乙烯(polyvinylidene fluoride,PVDF),0.2 g聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)加入到20 g N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)中,磁力搅拌3 h。随后,在上述溶液中加入0.2 g碳纳米纤维(150~200 nm,纯度>99.9%),继续磁力搅拌1 h。随后超声脱泡20 min,在碳纤维布表面浇铸刮膜,刮膜厚度为300 μm,后经相转化后,制备出PVDF/碳纤维膜。PVDF铸膜液中添加碳纳米纤维可提升PVDF/碳纤维膜的导电性。
电氧化聚合PPy在三电极体系(CHI660E,上海辰华仪器有限公司)中,饱和甘汞电极作为参比电极,铂片电极作为辅助电极,PVDF/碳纤维膜作为工作电极,吡咯单体溶液作为聚合液,在0.8 V的恒电位下,持续沉积5、10和15 min,得到PPy改性的PVDF/碳纤维膜(后面简称电催化膜),并对比不同的沉积时间(沉积量)对电催化膜活性的影响。
1.4 分析方法
电催化膜的表征测试。本研究采用扫描电子显微镜(scanning electron microscopy,SEM)测试电催化膜的表面形貌;采用傅里叶变换红外光谱仪(fourier transform infrared spectroscopy,FT-IR)分析聚合形成的PPy。
电催化膜的活性测试。本研究对PPy聚合沉积前和沉积后的电催化膜在三电极体系中进行活性测试。配制5 mmol·L−1 K3Fe(CN)6 + 1 mol·L−1 KCl溶液作为电解液,饱和甘汞电极(saturated calomel electrode,SCE,0.241 2 V)作为参比电极,1 cm×1 cm Pt片电极作为辅助电极,电催化膜作为工作电极,采用循环伏安法[15],扫描电压设在0~0.8 V,扫速为10 mV·s−1,得到电催化膜的活性曲线。
电催化膜的抗污染性能测试。在清水通量的测试中,实验将PPy10-/PVDF/碳纤维膜用膜组件组装后,放置在超纯水中,在86 cm的水头压差(8.1 kPa)下测得40 min后的稳定通量为4 493.49 L·(m2·h)−1。在膜抗污染性能的测试中,本研究采用酵母菌(Zeta电位为−12.9 mV,平均粒径7 μm)模拟污水中活性污泥,配制的MLSS浓度为2 g·L−1。在处理污废水时,活性污泥的代谢产物在膜表面的黏附是导致过滤膜污染严重的主要因素之一[4]。酵母菌具有与活性污泥类似的特点如表面负电位性、粒径等,因而采用酵母菌替代活性污泥可以模拟膜在运行过程中的污染情况。实验将PPy10-PVDF/碳纤维膜用膜组件组装并作为阴极,膜的进出水的水头压差为66 cm(8.1 kPa)。将同面积的不锈钢网电极作为阳极,2个电极之间相对放置,且水平间距保持1 cm。阳极和阴极连接直流电源,输出电压控制在0.4 V。
MFC-电催化膜反应器的产能测试。在测试功率密度曲线和极化曲线时,先将阳极与阴极回路断开,保持开路2 h以上;随后将电阻箱连接到2侧电极上,并连接数字万用表(选择电压测量档位),通过变换不同的电阻值记录相应电压值,做出极化曲线和功率密度曲线。
MFC-电催化膜反应器的污染物降解测试。实验对反应器中COD(chemical oxygen demand,化学需氧量)的值进行了测定分析。每隔1 d取适量进水水样和出水水样,测定其相应的COD值并计算去除效率。此外,本研究还测量计算了MFC-电催化膜反应器在处理污水时的库仑效率,计算方法[10]如式(1)所示。
ηCE=Q输出Q消耗=∑I⋅t96485×4MCOD去除 (1) 式中:ηCE代表库仑效率;Q输出代表反应器在运行时间t内产生的总电子数,C;Q消耗代表在运行时间t内降解去除的有机物中被完全氧化时产生的总电子数,C;I代表反应器中阴极和阳极短接时输出的电流,A;t代表运行时间,s;MCOD去除代表反应器在运行时间t内去除COD的摩尔数,mol。
2. 结果与讨论
2.1 材料表征分析
对沉积在PVDF/碳纤维膜表面的PPy进行了红外光谱测试,结果如图2所示。在1 538 cm−1和1 468 cm−1附近出现的峰分别为吡咯环中C—C双键伸缩振动和C—C骨架上的不对称伸缩振动;1 650 cm−1处为吡咯环内NH2弯曲振动峰;3 350 cm−1处为N—H伸缩振动峰;2 460 cm−1处为C—N—C的伸缩振动峰;1 280 cm−1和1 021 cm−1处为聚吡咯环上C—H面内弯曲振动峰。同时,本研究对制备的材料进行了扫描电镜测试,结果如图3所示。由红外光谱测试和扫描电镜观察可知,经过0.8 V的恒电位沉积后,PPy已成功地沉积在光滑的PVDF/碳纤维膜表面。
2.2 电催化膜的催化活性分析
阴极电极的电化学活性对MFC-电催化膜反应器的产能具有重要影响。高活性的阴极电极可以加速电子传递,并加快氧气与质子、电子在阴极介孔内的反应,从而有效提高MFC-电催化膜反应器的产电性能。
经过5、10和15 min的电氧化聚合制备的PPy沉积PVDF/碳纤维膜(分别用PPy5-PVDF/碳纤维膜,PPy10-PVDF/碳纤维膜和PPy15-PVDF/碳纤维膜表示),其氧化还原活性测试结果如图4所示。图4表明,PPy10-PVDF/碳纤维膜的氧化还原活性最佳。其氧化峰电位和还原峰电位分别出现在0.36 V和0.13 V附近。在PPy电氧化聚合过程中,电氧化聚合时间直接影响PPy在PVDF/碳纤维膜上的沉积量,最终影响PVDF/碳纤维膜的催化活性。在不同的聚合时间下,PPy在PVDF/碳纤维膜的沉积密度如表1所示。表1显示,在电氧化聚合初始阶段,随着PPy在PVDF/碳纤维膜表面的聚合沉积,PVDF/碳纤维膜的催化活性提高。但随着时间的延长,PPy在PVDF/碳纤维膜表面的沉积虽密度逐步变大,但PVDF/碳纤维膜的电化学活性并不是持续升高,在密度过高时其电催化活性反而下降,表明电氧化聚合时间过长导致PPy在PVDF/碳纤维膜表面密度过高,形成多层累积,反而导致PVDF/碳纤维膜活性降低。上述结果表明,PPy10-PVDF/碳纤维膜的电化学活性最高,其表面PPy的沉积密度为0.75 mg·cm−2。
表 1 不同电氧化聚合时间下PPy在PVDF/碳纤维膜的沉积密度Table 1. Deposition densities of PPy on PVDF/carbon fiber cloth membrane at different electro-oxidative polymerization time聚合时间/min 沉积密度/(mg·cm−2) 标准偏差 5 0.24 5.7 10 0.75 4.2 15 0.91 7.8 此外,由图4可知,PPy10-PVDF/碳纤维膜的氧化电位出现在约0.34 V处,比PPy5-PVDF/碳纤维膜的氧化电位(约0.32 V)略高。但是,PPy10-PVDF/碳纤维膜的还原电位出现在约0.12 V,比PPy5-PVDF/碳纤维膜的还原电位(约0.16 V)低。这说明在MFC-电催化膜反应器中,在催化阴极还原反应后,在较低电位下即可实现PPy10-PVDF/碳纤维膜上催化活性的再生。
2.3 膜通量及抗污染性能分析
电催化膜抗污染通量的测试结果如图5所示。可以看出,在0.4 V·cm−1的电场环境下,PPy10-PVDF/碳纤维膜在运行55 min后,其通量为317 L·(m2·h)−1,比无电场下测试的通量值212 L·(m2·h)−1提高了约49.5%。实验结果表明,微电场环境可以有效减缓膜的污染程度,延长膜的使用周期。本研究通过组装MFC-电催化膜反应器,构建出过滤膜运行的微电场环境,利用微电场减缓PPy10-PVDF/碳纤维膜的污染程度,从而延长膜的使用周期。
在MFC-电催化膜反应器处理污水过程中,PPy10-PVDF/碳纤维膜的运行通量实测为18.7 L·(m2·h)−1,远低于其临界通量,说明PPy10-PVDF/碳纤维膜可以保持较长时间的稳定运行。
2.4 MFC-电催化膜反应器的产能分析
将PPy10-PVDF/碳纤维膜作为阴极膜在MFC-电催化膜反应器中进行污水处理。运行稳定后,反应器的产能效果(空白PVDF/碳纤维膜作为对照)如图6和图7所示。可以看出,采用空白PVDF/碳纤维膜作为MFC阴极兼催化膜构建MFC-电催化膜反应器,在处理污水过程中,该反应器产能最大功率密度约为99 mW·m−3;而采用PPy10-PVDF/碳纤维膜构建MFC-电催化膜反应器时,在处理污水时反应器产能最大功率密度达到约166 mW·m−3。
在阴极膜上沉积PPy后,MFC-电催化膜反应器在处理污水时其产能功率密度提高了约67%。经计算,采用PPy10-PVDF/碳纤维膜作阴极,MFC-电催化膜反应器的库仑效率为2.2%[10],与PVDF/碳纤维膜作阴极时的库伦效率1.5相比,提升了约50%。本实验结果与ZHANG等[10]的相比,产能效果略低。其原因在于:本研究是基于实际城镇污水水质进行的模拟产能测试,反应器中未添加任何离子盐类,电解质浓度较低,故污水的电导率低是限制本反应器产能的一个关键因素;另一方面,作为阴极的电催化膜表面有限的接触面积也是导致其与其他单独MFCs相比产能较低的原因之一。
2.5 MFC-电催化膜反应器的污染物降解效果分析
在PPy10-PVDF/碳纤维膜作为阴极膜构建的MFC-电催化膜反应器中,反应器对污水中有机污染物的降解效果如图8所示。进水中的COD约在920~970 mg·L−1,经过MFC-电催化膜反应器处理(水力停留时间为6.7 h),在出水中检测到COD稳定在20~40 mg·L−1,反应器对污染物的去除率高达96%以上。这表明MFC-电催化膜反应器可将污水中有机污染物高效快速分解。
上述实验结果表明,在MFC-电催化膜反应器处理污水过程中,不仅处理效果高,膜污染程度大大减缓;而且在处理过程中还可以将污水中的能源转化回收,实现节能减排。因此,MFC-电催化膜反应器是一种高效环保的污水处理新技术。
3. 结论
1)聚吡咯(PPy)的沉积可有效提高PVDF/碳纤维膜的催化活性,在沉积密度为0.75 mg·cm−2时,PPy10-PVDF/碳纤维膜的催化活性最佳。
2)采用PPy10-PVDF/碳纤维膜构建的MFC-电催化膜反应器在污水处理过程中表现出高效的污染物去除效果和能源转化效率,并在降解过程中有效地减缓了膜污染,实现了水处理的节能减排。
-
表 1 不同电氧化聚合时间下PPy在PVDF/碳纤维膜的沉积密度
Table 1. Deposition densities of PPy on PVDF/carbon fiber cloth membrane at different electro-oxidative polymerization time
聚合时间/min 沉积密度/(mg·cm−2) 标准偏差 5 0.24 5.7 10 0.75 4.2 15 0.91 7.8 -
[1] 陈福泰, 范正虹, 黄霞. 膜生物反应器在全球的市场现状与工程应用[J]. 中国给水排水, 2008, 24(8): 14-18. doi: 10.3321/j.issn:1000-4602.2008.08.004 [2] 尹星, 吴志超, 王志伟, 等. MBR-纳滤组合工艺在生活污水和大型超市废水处理中的研究[J]. 环境工程学报, 2010, 4(1): 120-124. [3] LE-CLECH P. Membrane bioreactors and their uses in wastewater treatments[J]. Applied Microbiology and Biotechnology, 2010, 88(6): 1253-1260. doi: 10.1007/s00253-010-2885-8 [4] 孟凡刚. 膜生物反应器膜污染行为的识别与表征[D]. 大连: 大连理工大学, 2007. [5] MENG F, CHAE S, DREWS A, et al. Recent advances in membrane bioreactors (MBRs): Membrane fouling and membrane material[J]. Water Research, 2009, 43(6): 1489-1512. doi: 10.1016/j.watres.2008.12.044 [6] ZHANG J, WANG Z, WANG Q, et al. Comparison of antifouling behaviours of modified PVDF membranes by TiO2 sols with different nanoparticle size: Implications of casting solution stability[J]. Journal of Membrane Science, 2017, 525: 378-386. doi: 10.1016/j.memsci.2016.12.021 [7] ZENG L, LI X, SHI Y, et al. FePO4 based single chamber air-cathode microbial fuel cell for online monitoring levofloxacin[J]. Biosensors and Bioelectronics, 2017, 91(1): 367-373. [8] GE Z, LI J, XIAO L, et al. Recovery of electrical energy in microbial fuel cells: Brief review[J]. Environmental Science & Technology Letters, 2013, 1(2): 137-141. [9] OU S, KASHIMA H, AARON D, et al. Multi-variable mathematical models for the air-cathode microbial fuel cell system[J]. Journal of Power Sources, 2016, 314(1): 49-57. [10] ZHANG F, GE Z, GRIMAUD J, et al. Long-term performance of liter-scale microbial fuel cells treating primary effluent installed in a municipal wastewater treatment facility[J]. Environmental Science & Technology, 2013, 47(9): 4941-4948. [11] GE Z, HE Z. Long-term performance of a 200 L modularized microbial fuel cell system treating municipal wastewater: Treatment, energy, and cost[J]. Environmental Science: Water Research & Technology, 2016, 2(2): 274-281. [12] ZHANG F, BRASTAD K, HE Z. Integrating forward osmosis into microbial fuel cells for wastewater treatment, water extraction and bioelectricity generation[J]. Environmental Science & Technology, 2011, 45(15): 6690-6696. [13] SU X, TIAN Y, SUN Z, LU Y, et al. Performance of a combined system of microbial fuel cell and membrane bioreactor: Wastewater treatment, sludge reduction, energy recovery and membrane fouling[J]. Biosensors & Bioelectronics, 2013, 49(22): 92-98. [14] ZHANG G, ZHANG H, MA Y, et al. Membrane filtration biocathode microbial fuel cell for nitrogen removal and electricity generation[J]. Enzyme and Microbial Technology, 2014, 60(1): 56-65. [15] LI Y, LIU L, LIU J, et al. PPy/AQS (9, 10-anthraquinone-2-sulfonic acid) and PPy/ARS (alizarin red’s) modified stainless steel mesh as cathode membrane in an integrated MBR/MFC system[J]. Desalination, 2014, 349: 94-101. doi: 10.1016/j.desal.2014.06.027 [16] MAHMOUD M, GADALLAH T, ELKHATIB K, et al. Power generation using spinel manganese-cobalt oxide as a cathode catalyst for microbial fuel cell applications[J]. Bioresource Technology, 2011, 102(22): 10459-10464. doi: 10.1016/j.biortech.2011.08.123 [17] 杨改秀, 孔晓英, 孙永明, 等. 微生物燃料电池非生物阴极催化剂的研究进展[J]. 应用化学, 2012, 29(2): 123-128. -





 下载:
下载: