|
[1]
|
MEIJER S N, OCKENDEN W A, SWEETMAN A, et al.Global distribution and budget of PCBs and HCB in background surface soils:Implications for sources and environmental processes[J].Environmental Science and Technology,2003,7(4):667-672
|
|
[2]
|
林娜娜, 单振华, 朱崇岭,等.清远某电子垃圾拆解区河流底泥中重金属和多氯联苯的复合污染[J].环境化学, 2015,34(9):1685-1693
|
|
[3]
|
路风辉, 陈满英, 陈燕舞,等.电子垃圾拆解区氯化石蜡和多氯联苯的分布特征:以广东清远龙塘镇为例[J].环境化学,2015,4(7):1297-1303
|
|
[4]
|
SOWERS K R, MAY H D.In situ treatment of PCBs by anaerobic microbial dechlorination in aquatic sediment: Are we there yet?[J].Current Opinion in Biotechnology,2013,4(3):482-488
|
|
[5]
|
WU B Z, CHEN H Y, WANG S J, et al.Reductive dechlorination for remediation of polychlorinated biphenyls[J].Chemosphere,2012,8(7):757-768
|
|
[6]
|
GOMES H I, DIAS-FERREIRA C, RIBEIRO A B.Overview of in situ and ex situ remediation technologies for PCB-contaminated soils and sediments and obstacles for full-scale application[J].Science of the Total Environment,2013,5:237-260
|
|
[7]
|
MORRIS J M, JIN S, CRIMI B, et al.Microbial fuel cell in enhancing anaerobic biodegradation of diesel[J].Chemical Engineering Journal,2009,6(2):161-167
|
|
[8]
|
YAN Z, SONG N, CAI H, et al.Enhanced degradation of phenanthrene and pyrene in freshwater sediments by combined employment of sediment microbial fuel cell and amorphous ferric hydroxide[J].Journal of Hazardous Materials,2012,9:217-225
|
|
[9]
|
PHAM H, BOON N, MARZORTI M, et al.Enhanced removal of 1,2-dichloroethane by anodophilic microbial consortia[J].Water Research,2009,3(11):2936-2946
|
|
[10]
|
SUN M, YAN F, ZHANG R, et al.Redox control and hydrogen production in sediment caps using carbon cloth electrodes[J].Environmental Science and Technology,2010,4(21):8209-8215
|
|
[11]
|
CHUN C L, PAYNE R B, SOWERS K R, et al.Electrical stimulation of microbial PCB degradation in sediment[J].Water Research,2013,7(1):141-152
|
|
[12]
|
YU H, FENG C, LIU X, et al.Enhanced anaerobic dechlorination of polychlorinated biphenyl in sediments by bioanode stimulation[J].Environmental Pollution,2016,1:81-89
|
|
[13]
|
LIU X, WAN H, XUE Y, et al.Addition of iron oxides in sediments enhances 2,3, 4,5-tetrachlorobiphenyl (PCB 61) dechlorination by low-voltage electric fields[J].RSC Advances,2017,7(42):26019-26027
|
|
[14]
|
LOVLEY D R.Powering microbes with electricity:direct electron transfer from electrodes to microbes[J].Environmental Microbiology Reports,2011,3(1):27-35
|
|
[15]
|
LOVLEY D R, NEVIN K P.A shift in the current:New applications and concepts for microbe-electrode electron exchange[J].Current Opinion in Biotechnology,2011,2(3):441-448
|
|
[16]
|
YU H, WAN H, FENG C, et al.Microbial polychlorinated biphenyl dechlorination in sediments by electrical stimulation:The effect of adding acetate and nonionic surfactant[J].Science of the Total Environment,2017,0:1371-1380
|
|
[17]
|
TANG R, WU D, CHEN W, et al.Biocathode denitrification of coke wastewater effluent from an industrial aeration tank:Effect of long-term adaptation[J].Biochemical Engineering Journal,2017,5:151-160
|
|
[18]
|
FAIREY J L, WAHMAN D G, LOWRY G V.Effects of natural organic matter on PCB-activated carbon sorption kinetics:Implications for sediment capping applications[J].Journal of Environmental Quality,2010,9(4):1359-1368
|
|
[19]
|
QUENSEN J F, BOYD S A, TIEDJE J M.Dechlorination of four commercial polychlorinated biphenyl mixtures (aroclors) by anaerobic microorganisms from sediments[J].Applied and Environmental Microbiology,1990,6(8):2360-2369
|
|
[20]
|
BEDARD D L, VAN DORT H M, MAY R J, et al.Enrichment of microorganisms that sequentially meta, para-dechlorinate the residue of aroclor 1260 in Housatonic river sediment[J].Environmental Science and Technology,1997,1(11):3308-3313
|
|
[21]
|
GOMES H I, DIAS-FERREIRA C, OTTOSEN L M, et al.Electrodialytic remediation of polychlorinated biphenyls contaminated soil with iron nanoparticles and two different surfactants[J].Journal of Colloid and Interface Science,2014,3:189-195
|
|
[22]
|
MAY H D, MILLER G S, KJELLERUP B V, et al.Dehalorespiration with polychlorinated biphenyls by an anaerobic ultramicro bacterium[J].Applied and Environmental Microbiology,2008,4(7):2089-2094
|
|
[23]
|
PRAVECKOVA M, BRENNEROVA M V, HOLLIGER C, et al.Indirect evidence link PCB dehalogenation with Geobacteraceae in anaerobic sediment-free microcosms[J].Frontiers in Microbiology,2016,7:933
|
|
[24]
|
KITTELMANN S, FRIEDRICH M W.Novel uncultured Chloroflexi dechlorinate perchloroethene to trans-dichloroethene in tidal flat sediments[J].Environmental Microbiology,2008,0(6):1557-1570
|
|
[25]
|
HUG L A, MAPHOSA F, LEYS D, et al.Overview of organohalide-respiring bacteria and a proposal for a classification system for reductive dehalogenases[J].Philosophical Transactions of the Toyal Society B:Biological Sciences,2013,8(1616):20120322
|
|
[26]
|
LEE J, LEE T K.Development and characterization of PCE-to-ethene dechlorinating microcosms with contaminated river sediment[J].Journal of Microbiology and Biotechnology,2016,6(1):120-129
|
|
[27]
|
LIANG Y, MARTINEZ A, HORNBUCKLE K C, et al.Potential for polychlorinated biphenyl biodegradation in sediments from Indiana Harbor and Ship Canal[J].International Biodeterioration and Biodegradation,2014,9:50-57
|
|
[28]
|
GU Y, KORUS R A.Kinetics of pentachlorophenol degradation by a Flavobacterium species[J].Applied Microbiology and Biotechnology,1995,3(2):374-378
|
|
[29]
|
GOMES B C, ADORNO M A T, OKADA D Y, et al.Analysis of a microbial community associated with polychlorinated biphenyl degradation in anaerobic batch reactors[J].Biodegradation,2014,5(6):797-810
|
|
[30]
|
MATHTHIES C, EVERS S, LUDWIG W, et al.Anaerovorax odorimutans gen.nov., sp.nov., a putrescine-fermenting, strictly anaerobic bacterium[J].International Journal of Systematic and Evolutionary Microbiology,2000,0(4):1591-1594
|
|
[31]
|
FREEBORN R A, WESTK A, BHUPATHIRAJU V K, et al.Phylogenetic analysis of TCE-dechlorinating consortia enriched on a variety of electron donors[J].Environmental Science and Technology,2005,9(21):8358-8368
|
|
[32]
|
YE D, QUENSEN J I, TIEDJEJ M, et al.Evidence for para dechlorination of polychlorobiphenyls by methanogenic bacteria[J].Applied and Environmental Microbiology,1995,1(6):2166-2171
|
|
[33]
|
OH K H, OSTROFSKYE B, CHO Y C.Molecular characterization of polychlorinated biphenyl-dechlorinating populations in contaminated sediments[J].Journal of Microbiology,2008,6(2):165-173
|
|
[34]
|
HEAVNER G L W, ROWE A R, MANSFELDT C B, et al.Molecular biomarker-based biokinetic modeling of a PCE-dechlorinating and methanogenic mixed culture[J].Environmental Science and Technology,2013,7(8):3724-3733
|
|
[35]
|
HAN J I, LONTOH S, SEMRAU J D.Degradation of chlorinated and brominated hydrocarbons by Methylomicrobium album BG8[J].Archives of Microbiology,1999,2(6):393-400
|
|
[36]
|
ROTARU A E, SHRESTHA P M, LIU F, et al.A new model for electron flow during anaerobic digestion:Direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane[J].Energy and Environmental Science,2014,7(1):408-415
|
|
[37]
|
SU X L, TIAN Q, ZHANG J, et al.Acetobacteroides hydrogenigenes gen.nov., sp.nov., an anaerobic hydrogen-producing bacterium in the family Rikenellaceae isolated from a reed swamp[J].International Journal of Systematic and Evolutionary Microbiology,2014,4(9):2986-2991
|
|
[38]
|
JIANG X, SEHN J, HAN Y, et al.Efficient nitro reduction and dechlorination of 2,4-dinitrochlorobenzene through the integration of bioelectrochemical system into upflow anaerobic sludge blanket:A comprehensive study[J].Water Research,2016,8:257-265
|
|
[39]
|
UHLIK O, JECNA K, MACKOVA M, et al.Biphenyl-metabolizing bacteria in the rhizosphere of horseradish and bulk soil contaminated by polychlorinated biphenyls as revealed by stable isotope probing[J].Applied and Environmental Microbiology,2009,5(20):6471-6477
|
|
[40]
|
BUNGE M, KLEIKEMPERl J, MINIACI C, et al.Benzoate-driven dehalogenation of chlorinated ethenes in microbial cultures from a contaminated aquifer[J].Applied Microbiology and Biotechnology,2007,6(6):1447-1456
|
|
[41]
|
MAO X, STENUIT B, POLASKO A, et al.Efficient metabolic exchange and electron transfer within a syntrophic trichloroethene-degrading coculture of Dehalococcoides mccartyi 195 and Syntrophomonas wolfei [J].Applied and Environmental Microbiology,2015,1(6):2015-2024
|
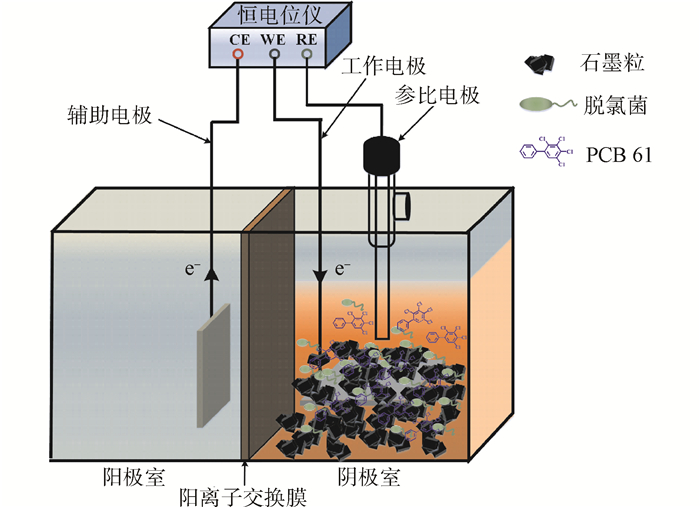
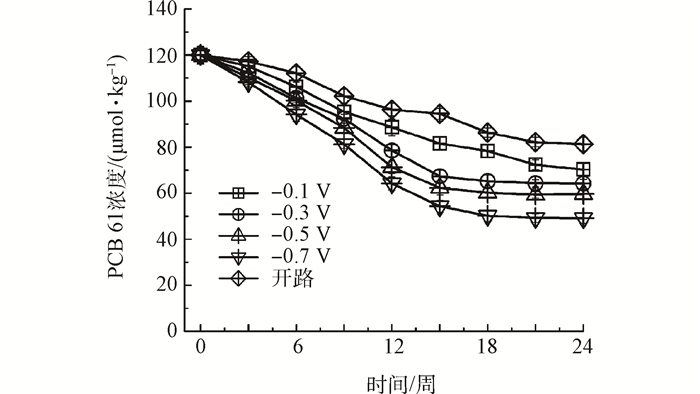
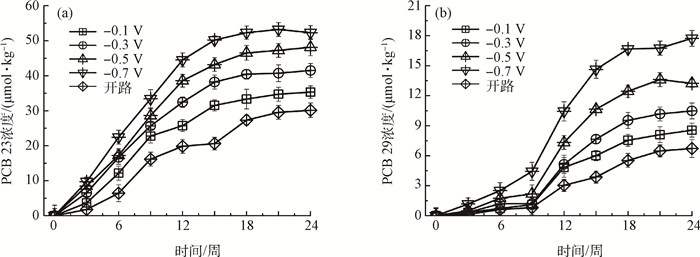
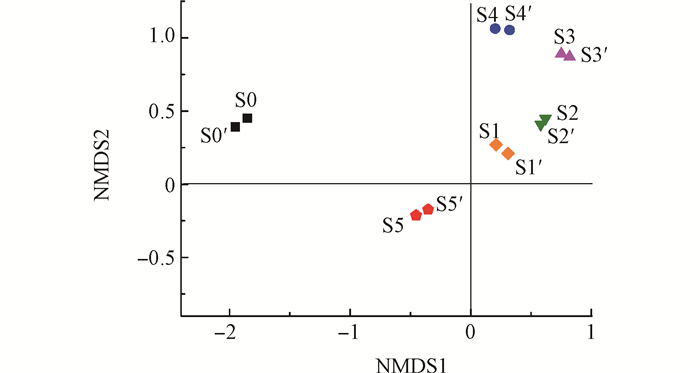





 百度学术
百度学术


 下载:
下载:
