新型正渗透汲取液的试制及其处理浓盐水的应用
Preparation of a new type of forword osmosis draw solution and its application in treatment of concentrated brine
-
摘要: 选取柠檬酸盐改良磁性纳米颗粒汲取液作为正渗透汲取液,研究其在浓盐水处理中的应用效果,采用热合成方法控制温度为30、60和90℃时制成了柠檬酸盐改良磁性纳米颗粒(MNP0、MNP1和MNP2)。对3种磁性纳米颗粒进行表征的结果显示,随反应温度的升高,分散性提高,同时温度升高,更有利于柠檬酸盐包覆到磁性纳米颗粒的表面。不同温度条件下合成的3种柠檬酸盐磁性纳米颗粒处理浓盐水测定水通量和反向盐通量研究表明,MNP2的水通量较MNP0和MNP1高,为23 L·(m2·h)-1,且水通量下降较稳定,反向盐通量较小。不同粒径的MNP2处理浓盐水研究结果表明,水通量随粒径的减小呈现增加趋势,粒径为3.5 nm时的渗透压和水通量最高且减压渗透(pressure relief osmosis,PRO)模式下水通量较正渗透(forward osmosis,FO)模式高。
-
关键词:
- 正渗透汲取液 /
- 浓盐水处理 /
- 柠檬酸改良磁性纳米颗粒
Abstract: This paper studied on a new type of forword osmosis draw solution comprised of citric acid magnetic nanoparticles and its application in the treatment of concentrated brine. Three kind of magnetic nanoparticles (MNP0, MNP1 and MNP2) were made with the method of hydrothermal synthesis by controlling the temperature in 30,60 and 90℃. The analysis of the three magnetic nanoparticles characterization showed that their dispersion in the solution increased with the reaction temperature increasing, because the citric acid can be coated onto the surface of the magnetic nanoparticles easily in high temperature. The highest water flux amount was 23 L·(m2·h)-1 in MNP2 draw solution. The decrease amount of water flux was more stable and the reverse salt flux was also smaller for MNP2 compared with the MNP0 and MNP1. The water flux increased with the decreasing of particle size for MNP2, and it is much higher in PRO mode than FO mode. -
印染废水成分复杂、排量大、色度高、碱度高、化学需氧量高、可生化性差,处理难度较大,常规生化处理很难实现稳定达标排放[1]。对印染废水生化出水采用吸附、催化臭氧氧化、芬顿/类芬顿氧化、光催化氧化、曝气生物滤池等方法进行深度处理,是印染废水处理的主要方法[2]。
芬顿/类芬顿氧化处理印染废水工艺在工业上应用较多。传统Fenton氧化在强酸条件下进行,存在Fe3+/Fe2+循环效率低、铁泥产生量大、H2O2利用率低等缺点[3-4]。用Fe3+代替Fe2+作为催化剂,则有机物降解速率降低。为减少反应过程中铁离子流失,异相光Fenton氧化技术备受关注,其采用固化铁离子催化剂,如天然含铁矿物、合成铁氧化物,或将铁离子负载于黏土、沸石、活性炭、Al2O3等载体表面[5-7]。
天然含铁矿物廉价易得,催化性能稳定,可以重复利用[8-9]。已报道作催化剂的含铁矿物主要有磁铁矿[10-12]、赤铁矿[13-14]、针铁矿[15-16]、黄铁矿[17-19]、磁黄铁矿[20]、钒钛磁铁矿[21]等。在光照条件下,通过光化学反应可以实现Fe3+/Fe2+循环和对部分有机物的光解,从而促进了H2O2分解产生·OH,提高了H2O2利用率,进而促使有机物快速、彻底被矿化[22]。
异相光Fenton体系分为异相UV-Fenton体系和异相可见光Fenton体系[23-25]。由于H2O2吸收波长小于320 nm才能产生·OH,故目前多采用中心波长为254 nm紫外灯光源。太阳光划分为紫外(100~400 nm)、可见(400~760 nm)和红外3个区段,其中,紫外光仅占3%~5%。在弱酸条件下,可见光照射铁离子的量子产率较低。因此,寻找太阳光利用率高的光催化材料,研究其在可见光下对异相Fenton体系的催化作用,可降低运行成本。
GUELOU等[26]采用FeOOH催化剂,比较了烷基苯硫酸基酸在不同氧化体系中的降解效果,其在均相Fenton体系中降解率为38%,在异相Fenton体系中几乎无法降解,在引入紫外光后,FeOOH表现出催化活性。张钰等[27]以天然赤铁矿为催化剂,在可见光照射、pH=3、H2O2浓度1.5 mmol·L−1的条件下,罗丹明B可在180 min内完全脱色,2,4-二氯苯酚在24 h后降解率可达56%,溶出铁对氧化作用贡献较小,赤铁矿可稳定循环使用6次。
陈芳艳等[28]的研究表明,在300 W高压汞灯照射和异相Fenton氧化的共同作用下,Fe/Al2O3/UV-Fenton体系在20 min时可使六氯苯的降解率达到94.5%。MUTHUVEL等[29]证实Fe(Ⅲ)-Al2O3催化剂在太阳光照射下,表面Fe3+会转变成Fe2+。MAZELLIER等[30]提出多相体系催化机理和铁循环机制,认为反应实质是均相Fenton氧化,但当溶出铁不足时,H2O2产·OH的过程以表面催化为主。刘婷[31]指出,催化剂表面Fe(III)光化学反应转变为Fe(II)是异相光Fenton反应的关键步骤之一,反应体系中·OH主要通过铁离子催化分解H2O2、H2O2直接光解及催化剂表面催化分解H2O2 3种途径生成。HE等[22]的研究表明,铁矿物催化剂具有多孔结构,除了吸收光子产生电子外,当H2O2被吸附到其表面时,会与催化剂表面上的电子空穴对结合反应产生·OH。
本研究以黄铜矿(CuFeS2)、磁铁矿(Fe3O4)、磁黄铁矿(Fe1-xS) 3种天然含铁矿物作为催化剂,分别选用300 W高压汞灯、400 W氙灯、400 W金卤灯作为光源,以无光条件下异相类Fenton体系作为对照,考察了不同类型的光源对异相光Fenton体系催化氧化效果的影响,并重点比较了不同氧化体系中Fe2+溶出量和COD去除率的变化。
1. 实验部分
1.1 废水性质
实验所用废水为通州某印染废水集中处理厂水解酸化-活性污泥好氧处理出水。在190~900 nm内进行光谱扫描,没有发现特征吸收峰。因此,根据现场经验,采用478 nm波长处的吸光度值对废水的色度进行表征,具体水质参数如下:pH为9.40、COD为81.32 mg·L−1、UV254=1.12、UV478=0.023、盐分为1.85 g·L−1、Cl−为227.80 mg·L−1、
SO2−4 1.2 天然矿物
实验所用天然矿物黄铜矿(CuFeS2)、磁铁矿(Fe3O4)、磁黄铁矿(Fe1-xS)均为工业品,所有矿物均过200目筛后备用,纯度在95%以上。X-射线衍射结果表明黄铜矿样品中含有少量黄铁矿杂质,Fe3O4样品中含有少量SiO2杂质,Fe1-xS样品中含有少量氟金云母杂质。
1.3 实验仪器和试剂
实验过程中用到的主要仪器有紫外可见分光光度计(T6新世纪,北京普析通用仪器有限责任公司),光化学反应仪(BL-GHX-V型,上海比朗仪器有限公司)和恒温水浴摇床(COS-110X50,上海比朗仪器有限公司)。所用试剂均为分析纯。
1.4 光Fenton降解实验
用氢氧化钠或硫酸调节废水pH,在250 mL石英试管中依次加入催化剂、废水和H2O2,放入光催化反应装置内,放有光源的石英冷阱置于中央。开启反应器,间隔一定时间用针筒取样,过滤测定铁离子浓度,用氢氧化钠将水样调至碱性,待H2O2没有残留后测定COD值,且计算COD的去除率。
光催化实验的光源有汞灯、氙灯、金卤灯,其中氙灯用于太阳光环境模拟,金卤灯分别用于太阳光、可见光环境模拟。实验分别采用18 W低压汞灯、300 W高压汞灯、400 W氙灯、400 W金卤灯作为光源,通过滤光片控制入射光波长。低压汞灯发热量小,实验时置于单层石英冷阱中;高压汞灯、氙灯、金卤灯功率大,发热量大,实验时置于双层石英冷阱中,冷阱接入20 ℃恒温水进行循环冷却。
1.5 分析测试方法
采用重铬酸钾-微波消解法测定COD。采用邻菲罗啉分光光度法测定铁离子浓度。通过测定Fe2+和1,10-邻菲罗啉的络合物在510 nm处的吸光度值以计算Fe2+的浓度。
2. 结果与讨论
2.1 低压汞灯照射下异相光Fenton体系处理效果
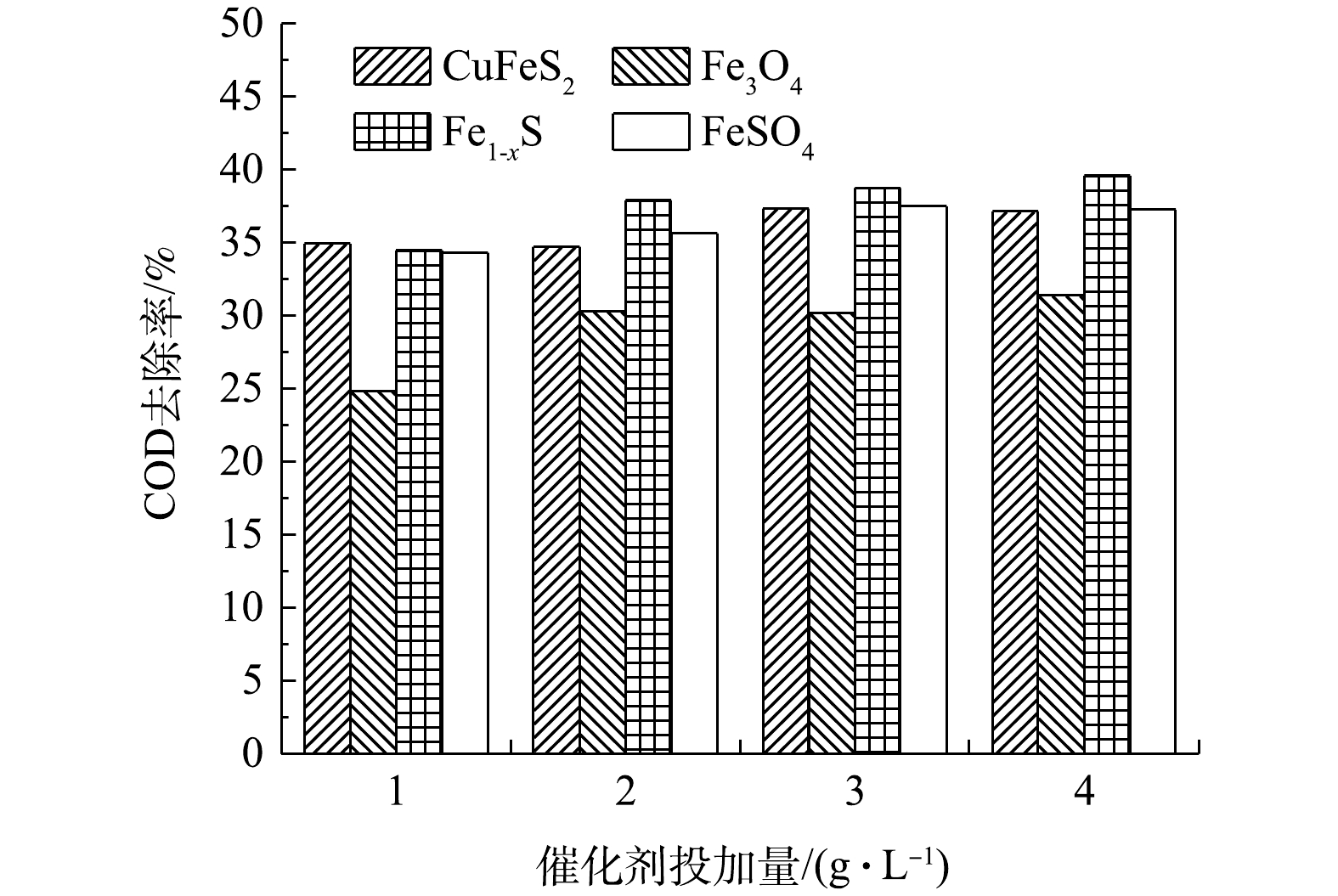
在pH为4时,以天然矿物为催化剂的异相UV-Fenton体系对废水有较好的处理效果[7, 10]。以主要发射波长为18 W低压汞灯作为辐照光源,在H2O2浓度为9.80 mmol·L−1的条件下反应2 h,催化剂投加量对COD去除效果的影响见图1。由图1可见,COD去除率随着催化剂投加量的增加而缓慢上升。因此,确定催化剂CuFeS2最佳用量为1 g·L−1、Fe3O4和Fe1-xS的最佳用量为2 g·L−1、FeSO4的最佳用量为1 g·L−1。
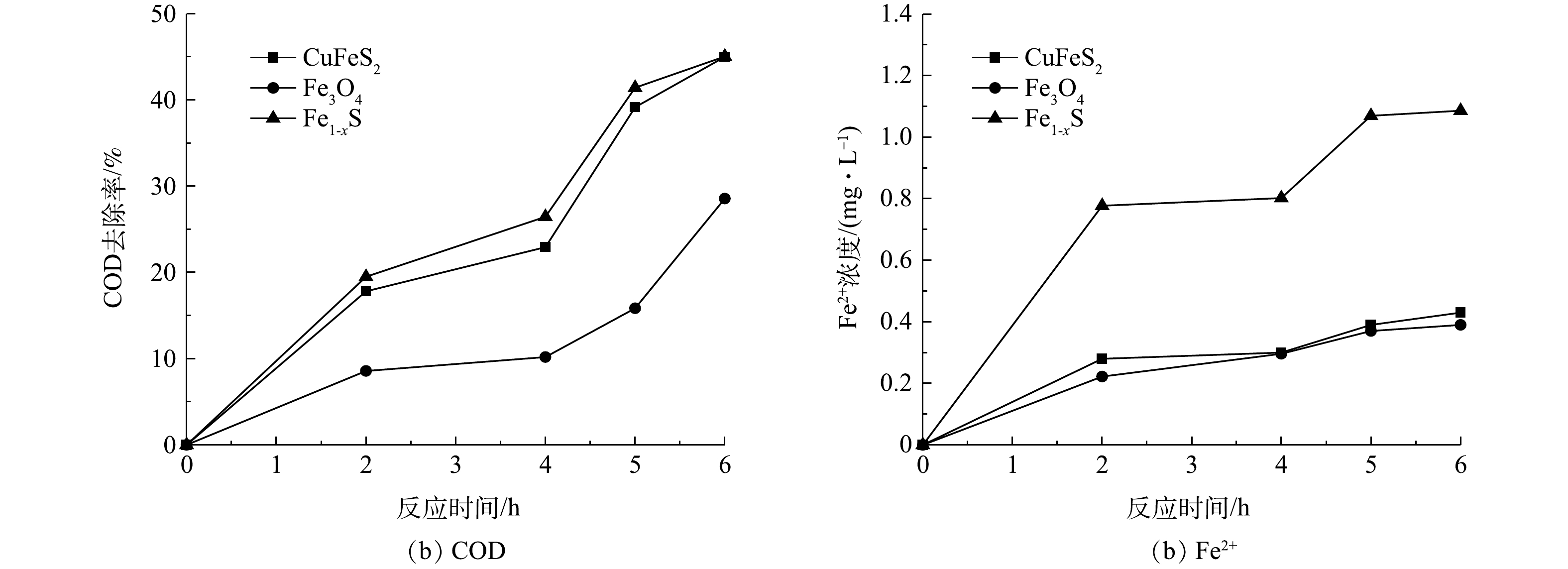
当pH为4时,首先考察在无光条件下,3种矿物异相类Fenton氧化体系对废水中COD的去除效果,其COD去除率、Fe2+浓度随反应时间的变化见图2。由图2(a)可见,Fe1-xS和CuFeS2催化体系中的COD去除率高于Fe3O4催化体系,在反应6 h后,Fe1-xS、CuFeS2、Fe3O4异相类Fenton体系对废水中COD的去除率分别达到45.91%、45.64%和28.57%。由图2(b)可见,3种矿物异相类Fenton体系中Fe2+浓度随着反应时间缓慢上升,CuFeS2、Fe3O4催化体系中Fe2+浓度始终保持在较低水平(0.40 mg·L−1左右),Fe1-xS催化体系中溶出Fe2+较多,在反应至2 h和6 h后,Fe2+浓度分别为0.78 mg·L−1和1.09 mg·L−1。综上结果可知,3种异相类Fenton体系在反应过程中溶出的Fe2+均较低[32]。
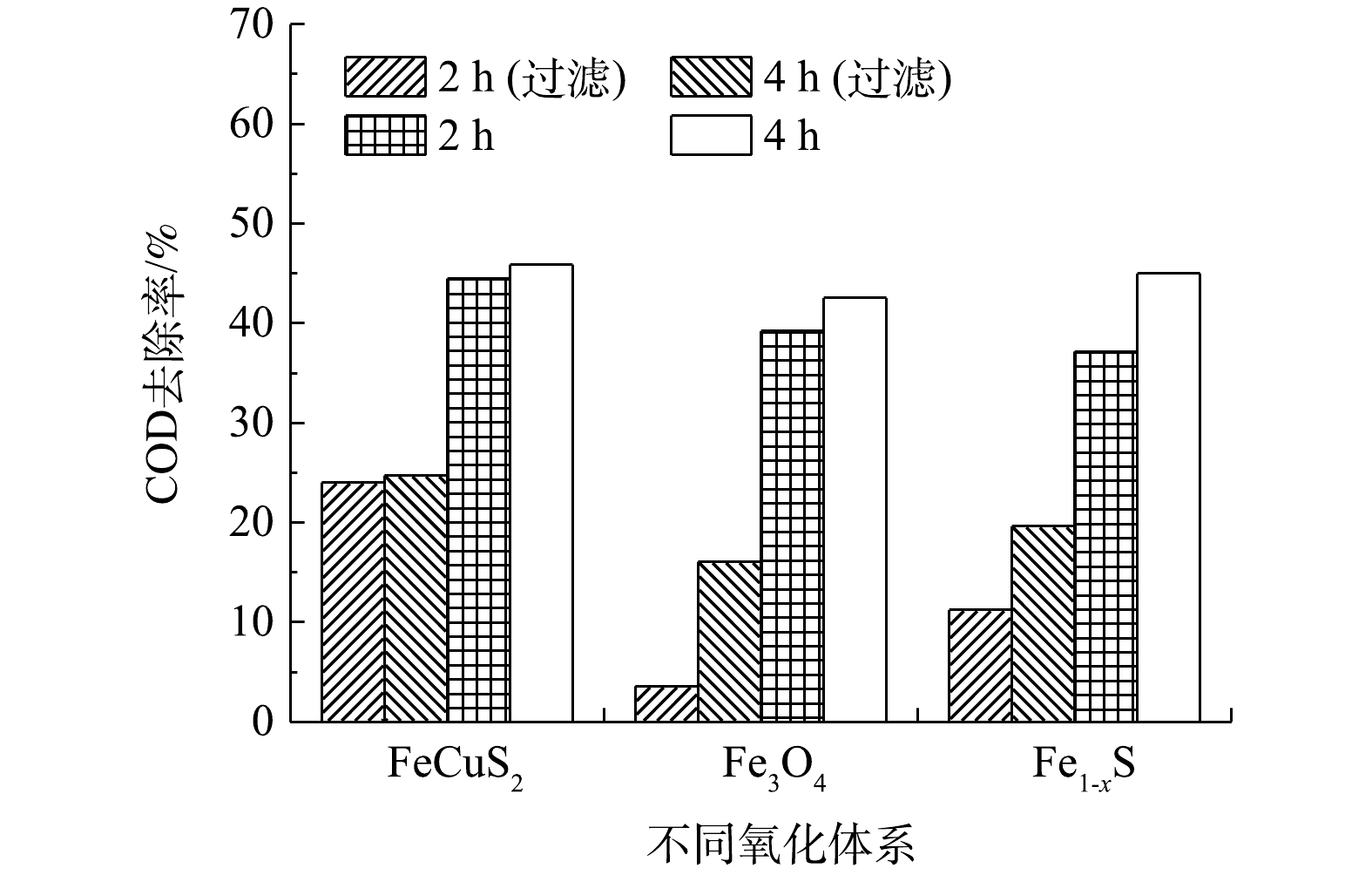
在pH为4、反应2 h时,有光和无光条件下,各催化氧化体系对COD的去除效果见图3。由图3可见,异相类Fenton体系的去除效果较差,各异相催化体系中COD的去除率均未达到20%,以Fe3O4作为催化剂时,COD去除率仅有8.58%。在低压汞灯光照后,UV-Fenton体系对COD的去除率比Fenton氧化体系去除率提高了8%;与无光异相Fenton反应相比,异相UV-Fenton体系对COD的去除率提高了40%左右。3种异相UV-Fenton体系均使COD降至30 mg·L−1左右,去除效果依次为CuFeS2(58.83%)>Fe1-xS(55.64%)>Fe3O4(54.07%)。在单独H2O2氧化的条件下,COD的去除率几乎为0,而UV-H2O2体系对COD的去除率为34.09%。这表明单独的H2O2几乎不能降解废水中的耗氧有机物(以COD计),但在紫外光作用下,H2O2通过光解产生·OH,以实现对部分耗氧有机物(以COD计)的降解。
2.2 高压汞灯照射下异相光Fenton体系处理效果
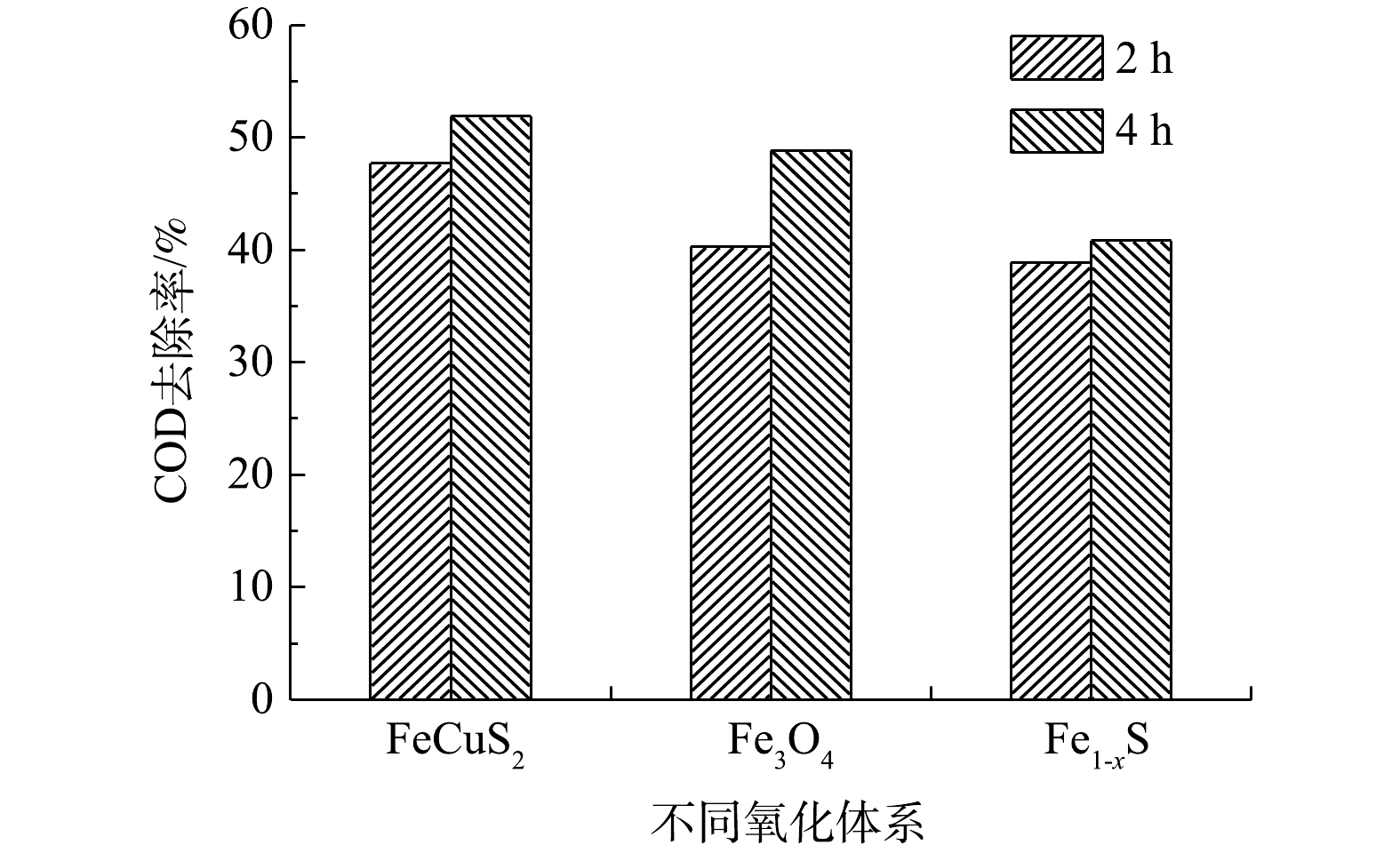
高压汞灯具有发射光谱波长范围宽、紫外辐射强度高等优点。以300 W高压汞灯为光源,考察了高压汞灯异相UV-Fenton体系对COD的去除效果。由图4可见,在反应2 h后,CuFeS2、Fe3O4、Fe1-xS催化体系对COD去除率分别为47.71%、40.31%和38.92%,COD去除率随着反应时间均有小幅上升。在3种催化剂中,CuFeS2催化氧化体系对COD的去除效果最佳,在反应4 h后,COD去除率可达51.95%。
在上述反应过程中Fe2+溶出量的变化见图5。由图5可见:在反应2 h后,各体系溶出的Fe2+很少;在反应4 h后,3种催化剂的Fe2+溶出量依次为Fe1-xS(3.00 mg·L−1)>CuFeS2(0.90 mg·L−1)>Fe3O4 (0.02 mg·L−1);溶出的Fe2+可与H2O2发生均相Fenton反应,但以矿物表面催化为主。
2.3 氙灯照射下异相光Fenton体系处理效果
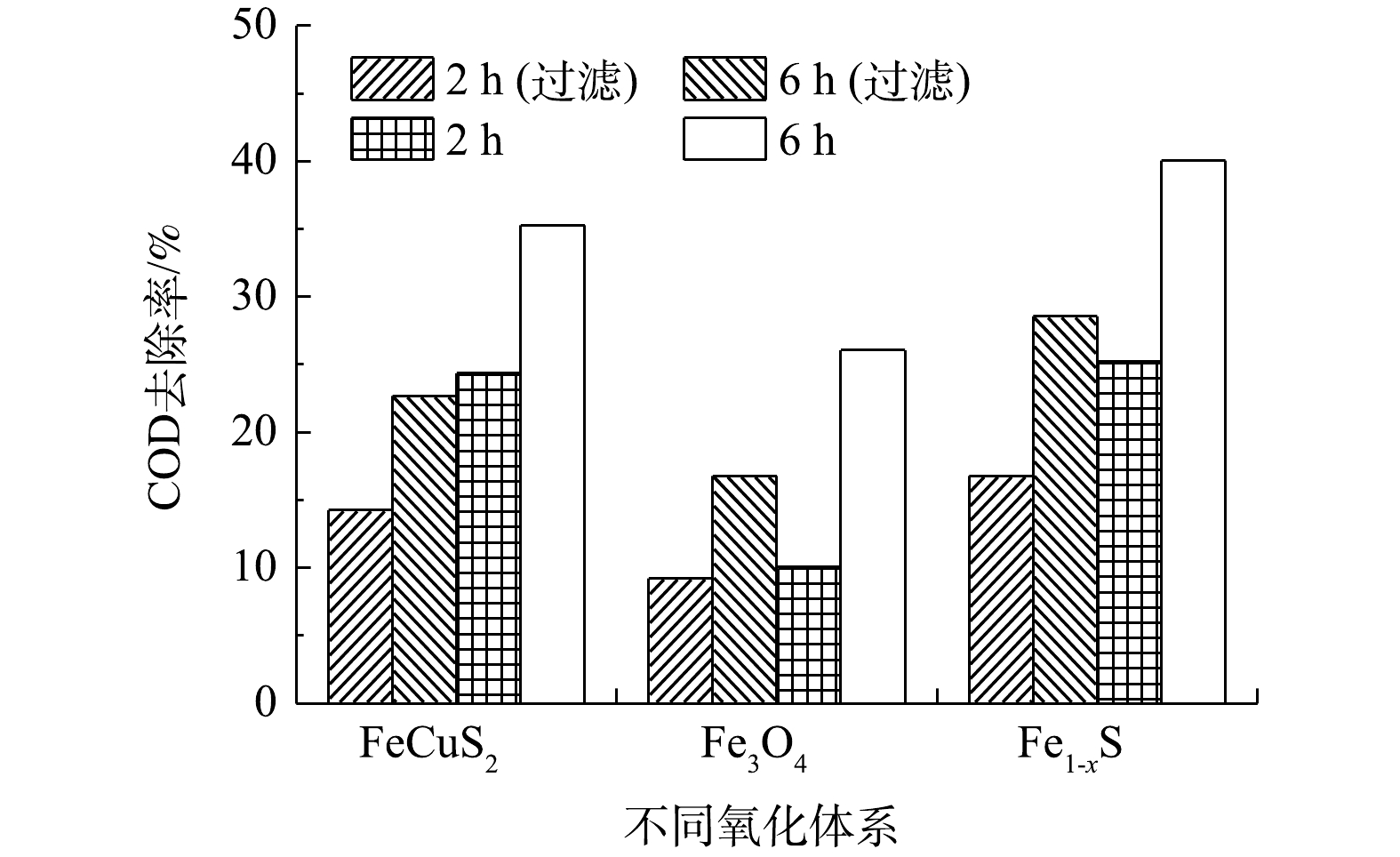
以400 W氙灯作为光源,用滤光片滤掉波长400 nm以下的光,考察了模拟异相太阳光Fenton体系对废水中COD的去除效果,结果见图6。由图6可见,尽管氙灯发射光谱中紫外光强度较低,但有无滤光片对COD去除率的影响较大。与有滤光片相比,在无滤光片时CuFeS2、Fe1-xS催化体系对COD的去除率有所增加,这表明紫外光可在一定程度上提高H2O2的利用率。随着反应时间延长至6 h时,CuFeS2、Fe3O4、Fe1-xS催化体系对COD去除率有所提高,分别为35.28%、26.04%、40.05%。
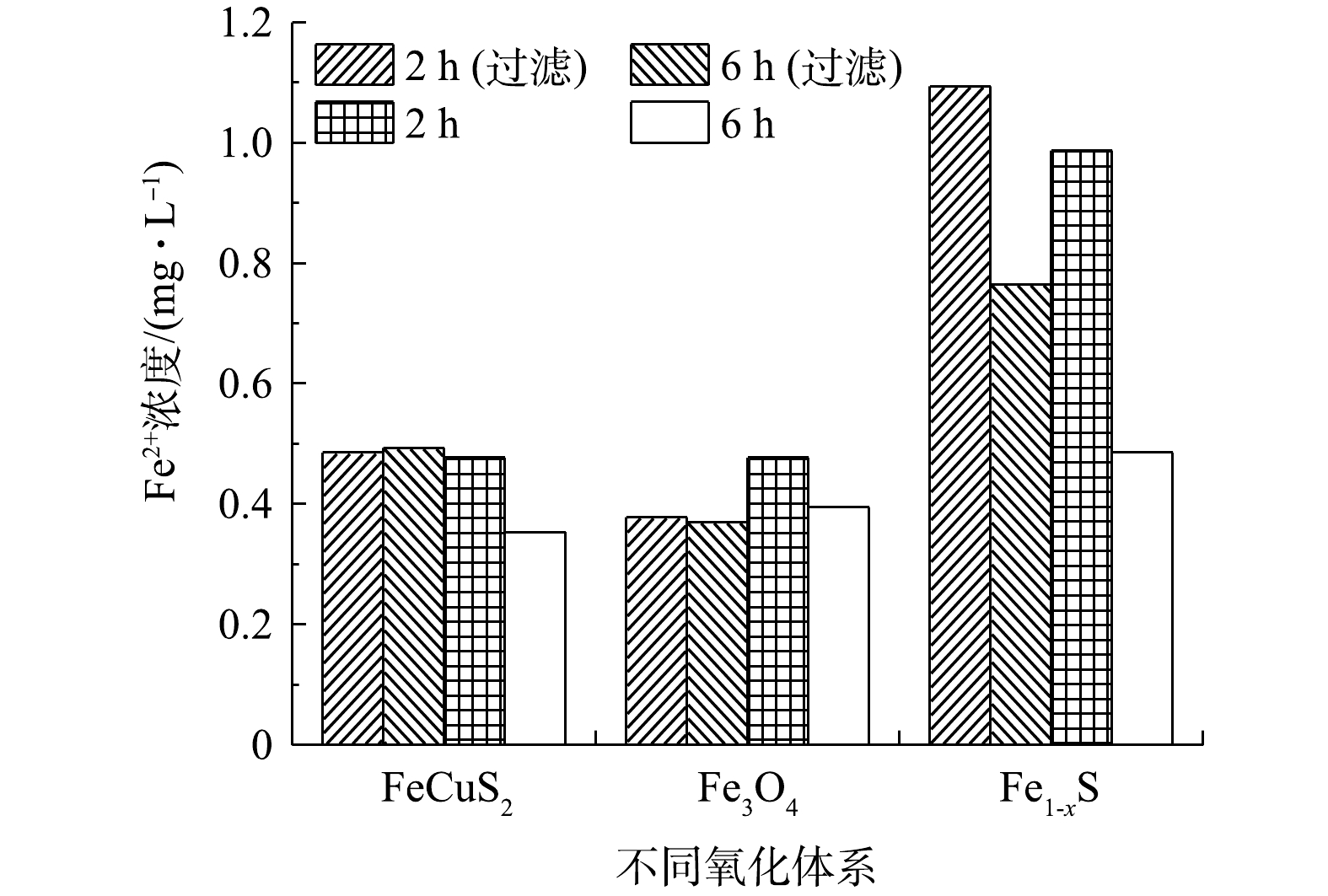
由图7可见,CuFeS2、Fe3O4催化体系中Fe2+浓度较小(<1.1 mg·L−1),有无滤光片对体系中Fe2+浓度的影响不大。Fe1-xS催化体系在反应6 h后,Fe2+浓度减少,这说明溶出Fe2+与H2O2发生均相Fenton反应。当以氙灯作为光源时,Fe1-xS体系中同时存在均相和异相催化作用。但由于体系中Fe2+浓度低于1.1 mg·L−1,均相催化作用的贡献十分有限。因此,Fe1-xS、CuFeS2、Fe3O4表面铁物种起主要催化作用,最终催化效果依次为Fe1-xS>CuFeS2>Fe3O4。
2.4 金卤灯照射下异相光Fenton体系处理效果
以400 W金卤灯作为光源,考察了在可见光下异相光Fenton体系对废水中COD的去除效果,结果见图8。设置一组对照实验,用滤光片过滤掉波长400 nm以下的紫外光。由图8可见,在无滤光片时,随着反应的进行,各氧化体系COD去除率有所增加,在4 h后的处理效果依次为CuFeS2(45.90%)≈Fe1-xS(45.13%)>Fe3O4(42.55%)。在加滤光片后,滤光片可滤去波长400 nm以下的紫外光,而波长大于320 nm的光不能使H2O2分解产生·OH。以CuFeS2为催化剂时,反应2 h后COD去除率为24%左右,Fe1-xS、Fe3O4催化效果更差,与无光条件下的异相类Fenton氧化结果相似,这说明3种异相催化体系对可见光的响应较弱。
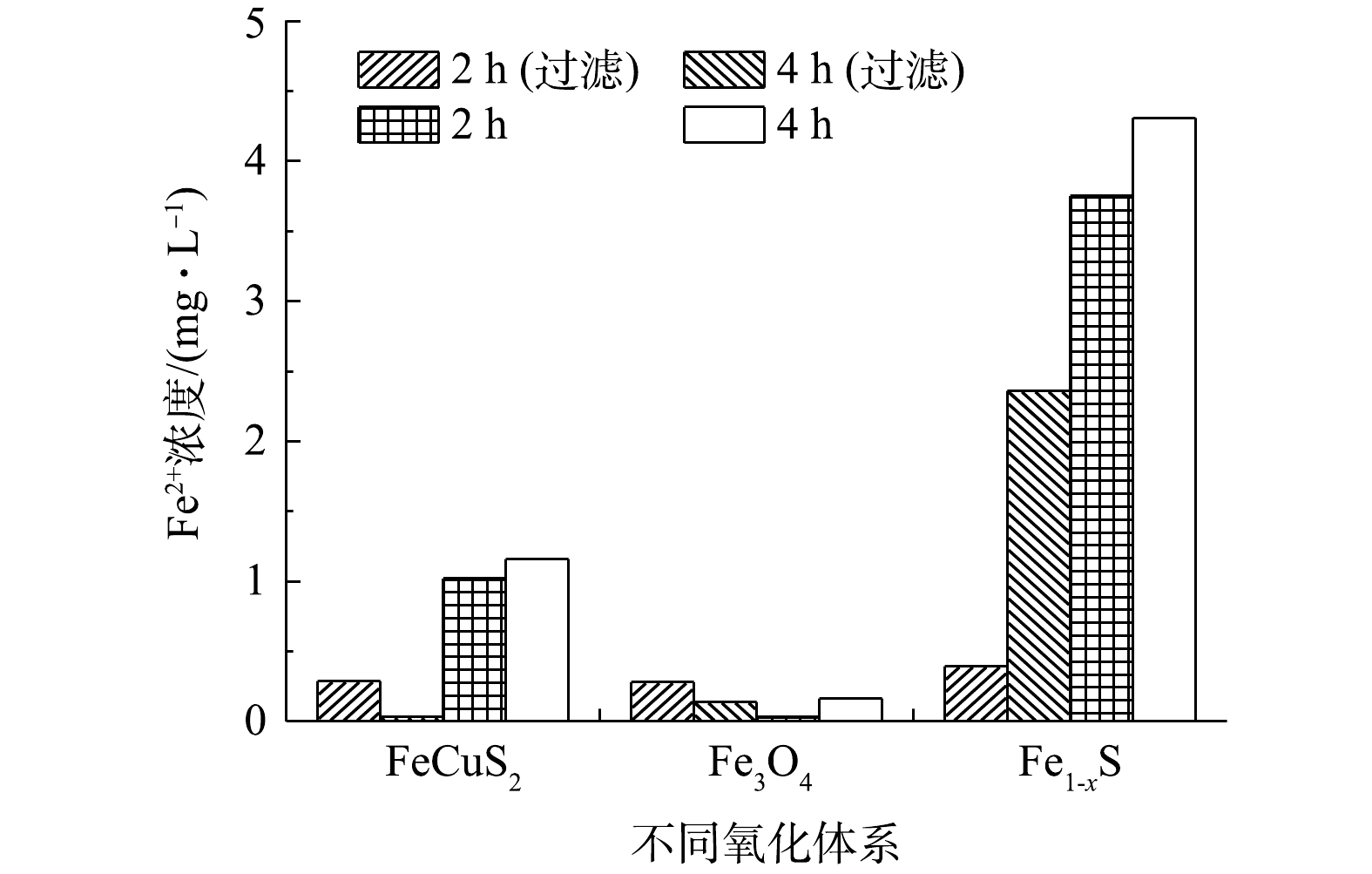
由图9可见,在有滤光片时,与CuFeS2、Fe3O4相比,Fe1-xS溶出Fe2+较多,反应4 h体系中Fe2+浓度为2.36 mg·L−1,COD去除率仅为19.63%;Fe3O4催化体系反应速率最慢,反应2 h后 COD去除率仅为3.58%。在不加滤光片反应4 h后,3种催化剂的Fe2+溶出量依次为Fe1-xS(3.75 mg·L−1)>CuFeS2(1.02 mg·L−1)>Fe3O4(0.03 mg·L−1),而COD的去除效果为CuFeS2≈Fe1-xS>Fe3O4,表明异相光Fenton体系以矿物表面催化为主。
2.5 催化剂稳定性
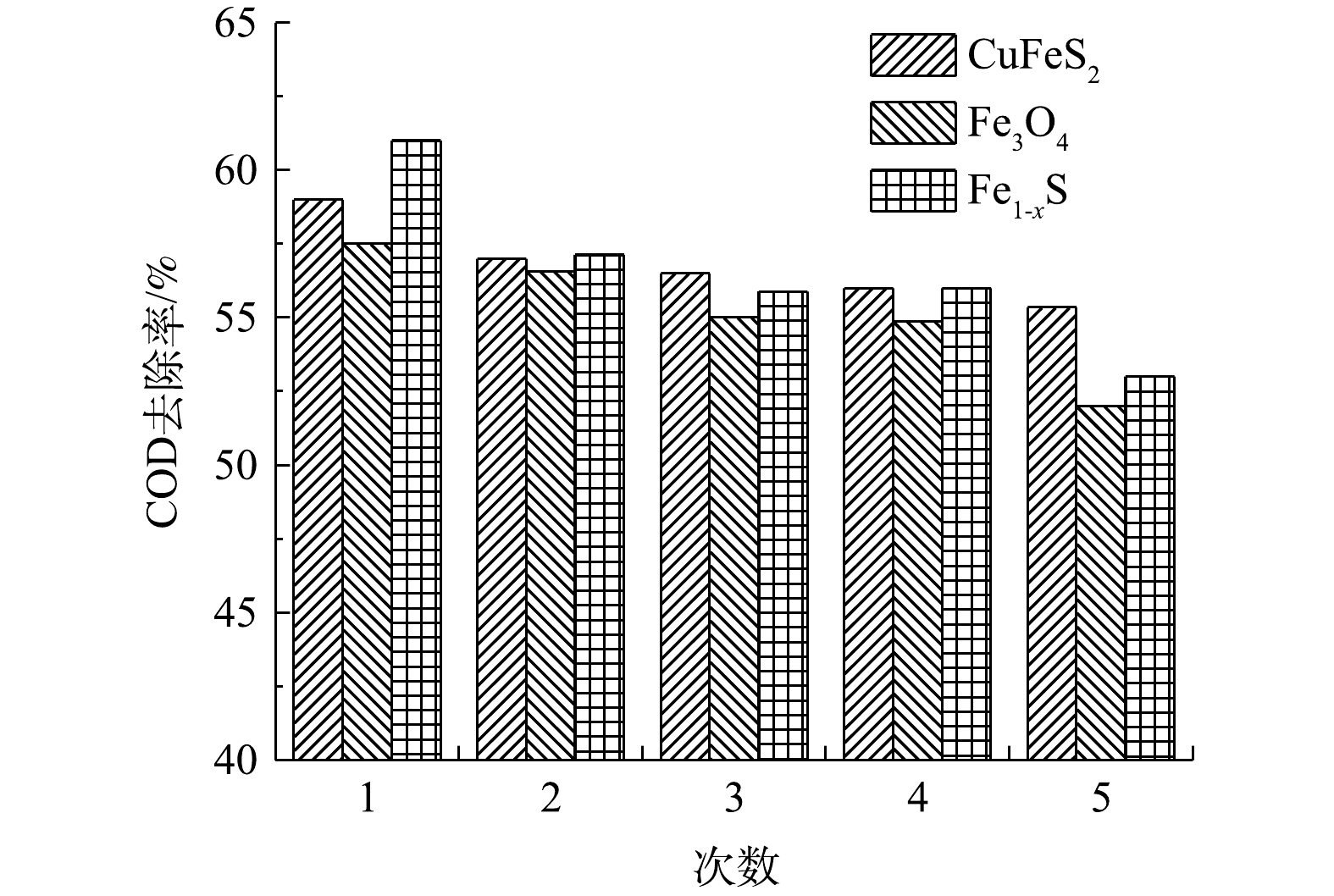
在低压汞灯照射下催化剂的循环使用对COD去除率的影响如图10所示。由图10可见,随着天然含铁矿物循环次数的增加,COD的去除率缓慢降低,但均保持在50%以上。这表明天然含铁矿物的光催化活性稳定,有效克服了均相UV-Fenton体系中催化剂无法重复利用的缺点,具有很好的应用价值。
2.6 催化机理
在pH为3~7时,CuFeS2、Fe3O4、Fe1-xS 3种矿物在光照6 h后,各体系中Fe2+溶出量均较小,H2O2浓度由9.8 mmol·L−1分别降低至3.22、3.76、2.38 mmol·L−1。这表明异相UV-Fenton体系中均相催化作用较弱,以矿物表面催化为主。在添加·OH的淬灭剂后,在低压汞灯照射下,在pH为4、CuFeS2、Fe3O4、Fe1-xS 3种矿物投加量分别为1、2、2 g·L−1、H2O2浓度为9.8 mmol·L−1的条件下,3种矿物对COD去除率分别由58.83%、55.64%和54.07%均降低到10%左右。这表明异相UV-Fenton体系·OH对有机物的氧化起主要作用。
·OH产生途径有H2O2光解、催化剂表面Fe(Ⅱ)催化H2O2分解、光致催化剂电荷分离和氧气二电子还原(式(1)~式(7)),其中
FeIIs FeIIIs H2O2+hv→2⋅OH (1) FeIIs+H2O2→FeIIIs+⋅OH+OH− (2) FeIIIs+H2O2→FeIIs+HOO⋅+H+ (3) 含铁矿物+hv→e−CB+h+VB (4) H2O+h+→⋅OH+H+ (5) O2+e−→O−2 (6) O−2+H2O2→⋅OH+OH−+O2 (7) 3. 结论
1)在无光条件下,COD的去除率较低,在反应6 h后,对废水中COD的去除效果为Fe1-xS≈CuFeS2>Fe3O4,在3种体系中COD去除率分别为45.91%、45.64%和28.57%,此时,Fe1-xS体系中的Fe2+溶出量最多(1.09 mg·L−1),其他2个体系中的Fe2+浓度均约为0.40 mg·L−1。
2) COD去除率对不同光源、不同催化剂的响应不同。以低压汞灯作为光源时,反应2 h后COD去除率为CuFeS2(58.83%)>Fe1-xS(55.64%)>Fe3O4(54.07%);以高压汞灯作为光源时,反应4 h后的COD去除率为CuFeS2(51.89%)>Fe3O4(48.86%)>Fe1-xS(40.83%);以氙灯为光源时(无滤光片),反应6 h后的COD去除率为Fe1-xS(40.05%)>CuFeS2(35.28%)>Fe3O4(26.04%);以金卤灯为光源时(无滤光片),反应4 h后的COD去除率为CuFeS2(45.90%)≈Fe1-xS(45.00%)>Fe3O4(42.55%)。
3)在3种天然矿物催化体系中,Fe1-xS、CuFeS2存在光腐蚀现象,在Fe1-xS体系中Fe2+溶出量最大;在以不同光源的异相光Fenton体系中,CuFeS2催化性能最为稳定,其次为Fe1-xS,均以表面催化作用为主。
4) 4种光源对异相类Fenton体系的强化作用依次为低压汞灯>高压汞灯>金卤灯>氙灯。在汞灯照射下,反应速率快,氧化效果好;以金卤灯作为光源时,加滤光片前后反应体系处理效果变化较大,这说明矿物异相类Fenton体系对可见光响应较弱;以氙灯作为光源时,各催化体系反应速率慢,对COD的去除效果与无光条件下的异相类Fenton体系相似。
-
[1] 蔡月圆,费学宁,苑宏英,等. 浓盐水处理技术研究进展[J]. 环境科学与管理,2013,38(4):93-98 [2] 宋英豪,陈瑞芳,熊娅,等. 基于零排放浓盐水处理技术的发展[J]. 环境工程,2013,31(增刊):263-265 [3] 王建龙,刘海洋. 放射性废水的膜处理技术研究进展[J]. 科学学报,2013,33(10):2639-2656 [4] 贾奇博,韩洪亮,刘必前,等. 基于海水淡化的正渗透膜分离技术的发展[J]. 化学通报,2012,75(9):771 [5] CHUNG T S, ZHANG S, WANG K Y, et al. Forward osmosis processes:Yesterday, today and tomorrow[J]. Desalination,2012,287:78-81 [6] FRANK B S. Desalination of sea water:3670897[P]. 1972-06-20 [7] STACHE K. Apparatus for transforming sea water, brackish water, polluted water or the like into a nutrious drink by means of osmosis:US4879030[P]. 1989-11-07 [8] YAELI J. Method and apparatus for processing liquid solutions of suspensions particularly useful in the desalination of saline water:5098575[P]. 1992-03-24 [9] BATCHELDER G W. Process for the demineralization of water:3171799[P]. 1965-03-02 [10] MCCUTCHEON J R, MCGINNIS R L, ELIMELECH M. Desalination by ammonia-carbon dioxide forward osmosis:Influence of draw and feed solution concentrations on process performance[J]. Journal of Membrane Science, 2006, 278(1):114-123 [11] NG H Y, TANG W, WONG W S. Performance of forward (direct) osmosis process:Membrane structure and transport phenomenon[J]. Environmental Science & Technology, 2006, 40(7):2408-2413 [12] SEMIAT R. Energy issues in desalination processes[J]. Environmental Science & Technology, 2008, 42(22):8193-8201 [13] HOUGH W T. Process for extracting solvent from a solution:3532621[P]. 1970-10-06 [14] LIU Z, BAI H, LEE J, et al. A low-energy forward osmosis process to produce drinking water[J]. Energy & Environmental Science, 2011, 4(7):2582-2585 [15] LOEB S, TITELMAN L, KORNGOLD E, et al. Effect of porous support fabric on osmosis through a Loeb-Sourirajan type asymmetric membrane[J]. Journal of Membrane Science, 1997, 129(2):243-249 [16] ACHILLI A, CATH T Y, CHILDRESS A E. Selection of inorganic-based draw solutions for forward osmosis applications[J]. Journal of Membrane Science, 2010, 364(1):233-241 [17] TAN C H, NG H Y. A novel hybrid forward osmosis-nanofiltration(FO-NF) process for seawater desalination:Draw solution selection and system configuration[J]. Desalination and Water Treatment, 2010, 13(1/2/3):356-361 [18] PHUNTSHO S, SHON H K, HONG S, et al. A novel low energy fertilizer driven forward osmosis desalination for direct fertigation:Evaluating the performance of fertilizer draw solutions[J]. Journal of Membrane Science, 2011, 375(1):172-181 [19] SCHRIER J. Ethanol concentration by forward osmosis with solar-regenerated draw solution[J]. Solar Energy, 2012, 86(5):1351-1358 [20] 王薇,孙静,王宝春.正渗透过程参数对渗透性能的影响[J]. 高分子材料科学与工程,2012,28(1):86-88 [21] 李刚,李雪梅,何涛,等.正渗透膜材料与驱动体系的研究[J]. 膜科学与技术,2012,32(2):104-106 [22] YEN S K, SU M, WANG K Y, et al. Study of draw solutes using 2-methylimidazole-based compounds in forward osmosis[J]. Journal of Membrane Science, 2010, 364(1):242-252 [23] GE Q, SU J, AMY G L, et al. Exploration of polyelectrolytes as draw solutes in forward osmosis processes[J]. Water Research, 2012, 46(4):1318-1326 [24] MIKHAYLOVA M, KIM D K, BERRY C C, et al. BSA immobilization on amine-functionalized superparamagnetic iron oxide nanoparticles[J]. Chemistry of Materials, 2004, 16(12):2344-2354 [25] LING M M, WANG K Y, CHUNG T S. Highly water-soluble magnetic nanoparticles as novel draw solutes in forward osmosis for water reuse[J]. Industrial & Engineering Chemistry Research, 2010, 49(12):5869-5876 [26] BAI H, LIU Z, SUN D D. Highly water soluble and recovered dextran coated Fe3O4 magnetic nanoparticles for brackish water desalination[J]. Separation and Purification Technology, 2011, 81(3):392-399 [27] ZHANG H, LI J, CUI H, et al. Forward osmosis using electric-responsive polymer hydrogels as draw agents:Influence of freezing-thawing cycles, voltage, feed solutions on process performance[J]. Chemical Engineering Journal, 2015, 259:814-819 [28] 李轻轻,马伟芳,聂超,等.正渗透汲取液类型及分离回收工艺进展研究[J]. 环境工程,2016,34(3):11-17 期刊类型引用(0)
其他类型引用(6)
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 2696
- HTML全文浏览数: 2241
- PDF下载数: 326
- 施引文献: 6





 下载:
下载: