一步还原焙烧法制备炭载零价铁及其对水中Cr(Ⅵ)的去除
One-step reductive roasting synthesis of activated carbon supported zero valent iron for the removal of Cr(Ⅵ) from aqueous solution
-
摘要: 以活性炭为还原剂和载体,通过一步还原焙烧法制备出炭载零价铁(AC-ZVI)材料。电镜扫描和X射线衍射分析结果表明,零价铁以平均粒径为2 μm的颗粒均匀分布在活性炭表面和孔道中。采用间歇实验考察了炭载零价铁去除水中Cr(Ⅵ)的效果,结果显示炭载零价铁对水中的Cr(Ⅵ)具有很好的去除效果,在初始pH值为5、Cr(Ⅵ)浓度为50 mg·L-1、AC-ZVI投加量(铁用量)为0.6 g·L-1和反应温度为25℃的条件下,反应5 h后Cr(Ⅵ)的去除率达到86.8%;降低溶液pH、增加炭载零价铁投加量和提高反应温度均有利于Cr(Ⅵ)的去除,反应过程符合准一级动力学,表观反应速率常数k为0.655 h-1(30℃),反应活化能为67.6 kJ·mol-1。研究结果表明,通过一步还原焙烧法制得的炭载零价铁可作为一种高效吸附还原材料用于Cr(Ⅵ)污染水体的治理。Abstract: An activated carbon-supported zero-valent iron (AC-ZVI) material was prepared through a one-step reductive roasting method with activated carbon (AC) as a reductant and supporting matrix.Scanning electron microscopy (SEM) and X-ray diffraction (XRD) analysis revealed that iron particles with an average diameter of 2 μm were dispersed uniformly on the surface and pores of the AC.Batch experiments were conducted to investigate the removal of Cr(Ⅵ) from aqueous solutions by the AC-ZVI.The AC-ZVI showed efficient Cr(Ⅵ) removal performance of 86.8% within 5 h at an initial pH of 5,Cr(Ⅵ) concentration of 50 mg·L-1,and AC-ZVI concentration of 0.6 g·L-1 at 25℃.The removal efficiency of Cr(Ⅵ) increased with AC-ZVI dosage,temperature,and lower pH values.The removal of Cr(Ⅵ) by the AC-ZVI followed pseudo-first-order kinetics,and the pseudo-first-order rate constant k was determined to be 0.655 h-1 (30℃).The activation energy was found to be 67.6 kJ·mol-1.This indicated that AC-ZVI prepared through the reductive roasting method can be used as an efficient adsorptive and reductive material for the removal of Cr(Ⅵ) from water.
-
Key words:
- reductive roasting /
- activated carbon /
- zero valent iron /
- hexavalent chromium
-
磷回收是未来城镇污水处理厂提升经济和环境双重效益的重要途径。目前,从污水中进行磷回收的方法主要有磷酸铵镁结晶法(MAP)、羟基磷酸钙结晶法(HAP)、铝盐和铁盐沉淀以及以离子交换法为代表的新方法[1]。其中,HAP结晶法具有易分离、生成物溶度积小、对进水氮磷比要求低等优点,因而对城镇污水的磷回收有更强的适用性,尤其适用于从污泥浓缩池上清液(磷酸盐浓度12.98~160 mg·L−1)、强化生物除磷系统的厌氧上清液(磷酸盐浓度17.5~28.2 mg·L−1)等富磷溶液中回收磷[2~3]。以往研究大量集中在HAP结晶过程中操作参数的影响,例如结晶体系的pH、钙磷摩尔比(n(Ca)/n(P))、晶种投加量、曝气强度等[4~6],而对城镇污水中不容忽视的重金属离子的影响则鲜有探讨。
城镇污水中的重金属杂质广泛来源于地表径流、工业废水和生活污水,包括Zn、Al、Cd、Cr、Cu、Fe、Mn、Ni、Pb等,其浓度在几微克每升到几千微克每升的范围内波动[7]。Cu、Cd、Zn是污水中常见的生态风险较大的重金属。杨妍妍等[8]研究发现,北京的8家污水厂在2011—2017年间的Cu、Cd、Zn含量均值(每千克脱水污泥)分别高达115、1.21和677 mg,属于重污染级别。这些重金属离子易被活性污泥富集,又会于厌氧释磷过程中再次被释放,难以避免地随富磷上清液进入结晶工艺[9]。众所周知,重金属对生物体具有持久危害性、毒性与累积放大性,即使是微量的重金属进入结晶产品也可能对环境造成二次污染。因此,重金属对HAP结晶过程和产品的影响是关乎生产效益与产品安全的现实问题。
根据现有研究结果[10-11],在磷酸铵镁和透钙磷石结晶体系中,重金属离子不能稳定存在于液相,极有可能参与晶核形成,进而会影响产品的纯度。但在HAP结晶体系中,围绕重金属展开的研究仍然较少。因此,本研究着重关注了在适宜的操作参数下,单独和联合投加Cu2+、Cd2+、Zn2+对HAP结晶法回收磷的影响特征,同时考察了重金属离子自身的浓度变化情况,并结合Visual MINTEQ模型验证相关规律。
1. 材料及方法
1.1 实验仪器及药品
实验仪器:紫外分光光度计(UV 9100 B)、pH测定仪(YSI pH 100,美国)、等离子体发射光谱仪(Optima 8000,美国)、场发射扫描电子显微镜(Quanta 2000 FEI,美国)等。
实验试剂:KH2PO4、CaCl2、Cd(NO3)2·4H2O、Cu(NO3)2·3H2O、ZnCl2、NaOH等,均为分析纯;所有溶液均使用去离子水配制。
1.2 实验方法
采用批量实验研究3种重金属离子在单独投加和联合投加2种形式下对磷去除效果的影响,重金属离子投加量分6个梯度(0、5、10、15、20、25 mg·L−1)。所有反应于500 mL锥形瓶中进行,设定初始pH=9.0、TP=20 mg·L−1、n(Ca)/n(P)=2.0、水温20 ℃、反应时间10 min,以恒温磁力搅拌器维持结晶体系内部流态化。分别在反应前和反应10 min时利用0.22 µm的针孔过滤器取10 mL溶液检测剩余磷浓度和重金属含量。结晶沉淀经抽滤、烘干处理后进行电镜扫描。
1.3 抑制模型
采用抑制模型(式(2))[13]分析重金属离子在单独投加时对结晶体系磷去除率的影响。
Y=E0−EiE0×100% (2) 式中:Y代表重金属离子对除磷的抑制率,%;E0为空白组的磷去除率,%;E为投加重金属离子时的磷去除率,%。重金属离子初始浓度与磷去除率的关系采用修正的Monod方程(式(3))进行拟合。
1E=1E0+CiKiE0 (3) 式中:Ci为重金属离子的初始浓度,mg·L−1;Ki对应重金属离子的抑制常数,mg·L−1。
1.4 Visual MINTEQ模型的建立
利用Visual MINTEQ模型进行结晶体系的化学平衡计算,以验证和解释重金属对HAP结晶的影响。构建模型所需的反应条件和物料浓度与批量实验保持一致;所有未设定输入数据均采用缺省值;同时考虑“允许”和“不允许”过饱和物质析出的情形,以关注饱和指数(Is)和析出产物的变化。Is用来描述HAP反应体系的饱和状态[12],可根据式(4)进行计算。
Is=lgKiap−lgKsp (4) 式中:Is、
Kiap 、Ksp 分别指某化合物的饱和指数、离子活度积和溶度积常数。Is>0时,溶液过饱和;Is =0时,沉淀溶解平衡;Is<0时,溶液不饱和。2. 结果与讨论
2.1 重金属离子对磷去除率的影响
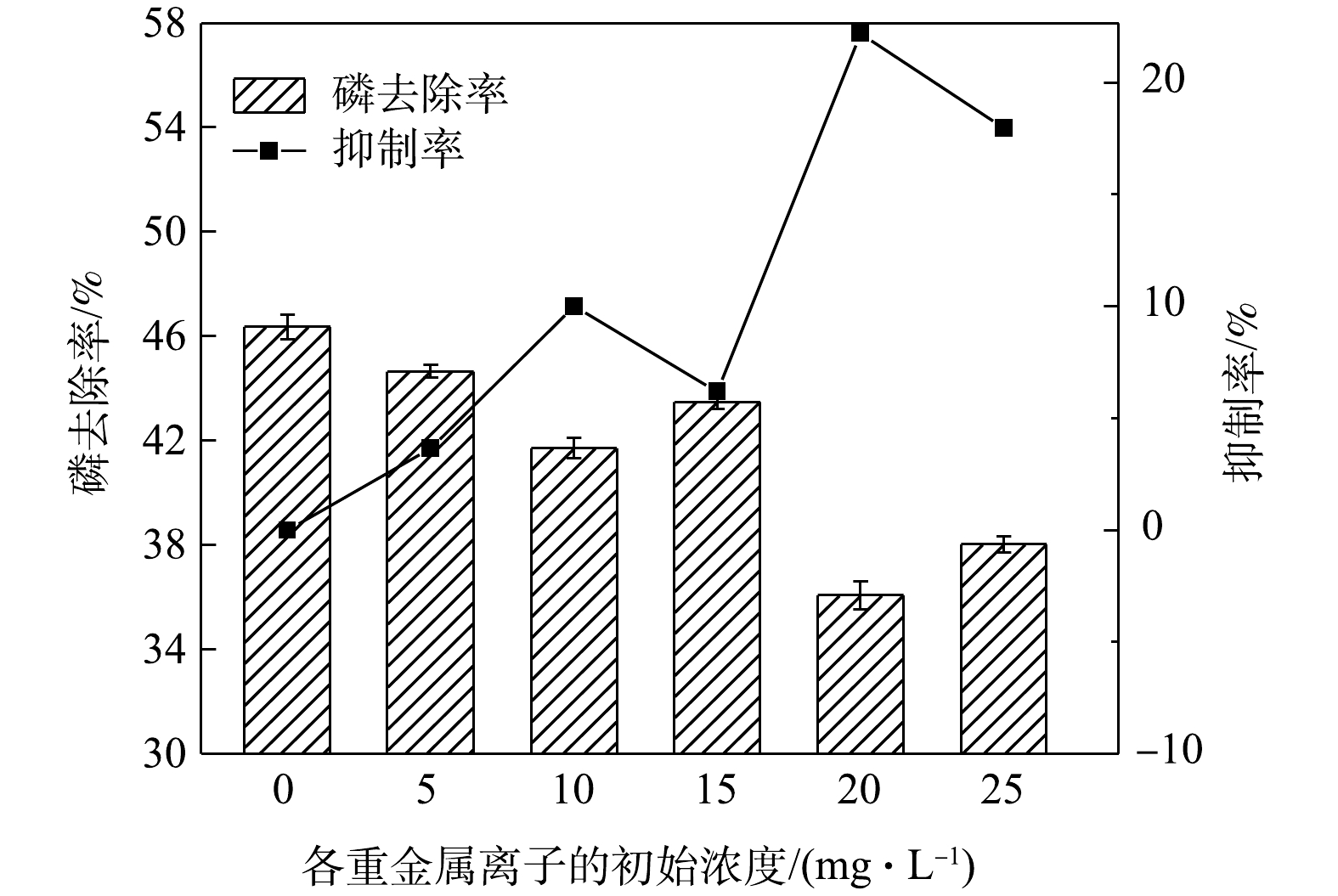
1)单一重金属离子的影响。由图1可知,向HAP结晶体系单独投加Cu2+/Cd2+/Zn2+时,随着重金属投加量的增加,3组反应的磷去除率均发生显著改变。为了进一步分析该影响的特征,利用式(2)计算每种重金属对除磷的抑制率,结果如图1所示。由图1可知,随着重金属浓度的增加,Cu2+和Cd2+对除磷的抑制率呈现波动变化,而Zn2+对除磷的抑制率稳步上升。这说明Zn2+对HAP结晶法除磷的抑制作用比Cu2+和Cd2+的抑制作用更稳定,这一结果与MURYANTO等[15]在研究Zn2+、Cu2+对磷酸铵镁结晶生长的影响时得出的结论相似。此外,Cu2+和Cd2+对除磷的影响以抑制作用为主,仅当Cu2+和Cd2+的浓度分别为15 mg·L−1和10 mg·L−1时,抑制率为负值,呈现反向促进作用。导致这种现象的主要原因是:当Cu2+和Cd2+的浓度分别达到15 mg·L−1和10 mg·L−1附近时,Cu2+、Cd2+开始与
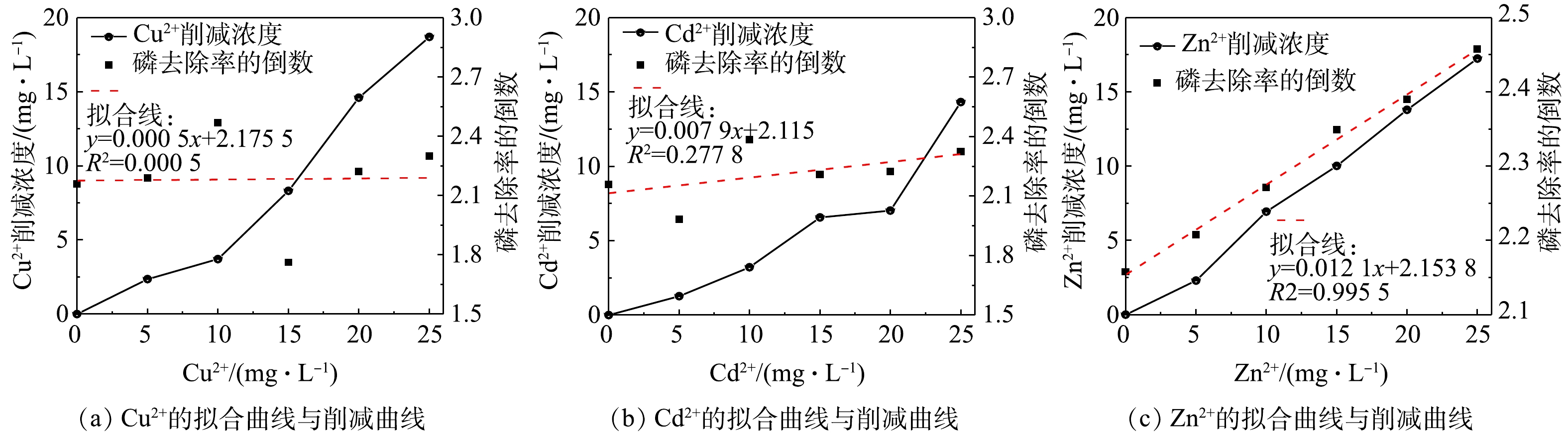
PO3−4 结合生成沉淀,反而促进了液相中磷的去除;而随着Cu2+和Cd2+的浓度进一步加大,Cu2+、Cd2+共沉淀消耗大量OH−,导致HAP结晶量大大下降,随之而来的除磷量的下降无法由铜或镉的磷酸盐沉淀完全弥补。DAI等[14]在研究Fe3+、Cu2+对HAP结晶的影响时也有类似发现。3种重金属离子的抑制模型拟合结果如图2(a)~(c)所示,Zn2+的投加浓度与磷去除率的倒数(E−1)存在显著的线性关系 (R2=0.995 5),符合修正的Monod方程。根据式(3)求得 Zn2+的抑制常数为178.0 mg·L−1,即Zn2+对磷去除率的半最大抑制浓度。Cu2+和Cd2+的抑制模型拟合效果不佳(R2远远小于0.9)。此外,图2(a)~(c)也表明3种重金属离子的浓度在反应过程中会不断削减,削减量随初始浓度的增加而增加。其中,仅Zn2+的削减浓度与E−1存在较显著的正相关关系,R2为0.996 5(P<0.05),Cu2+和Cd2+不存在类似规律。
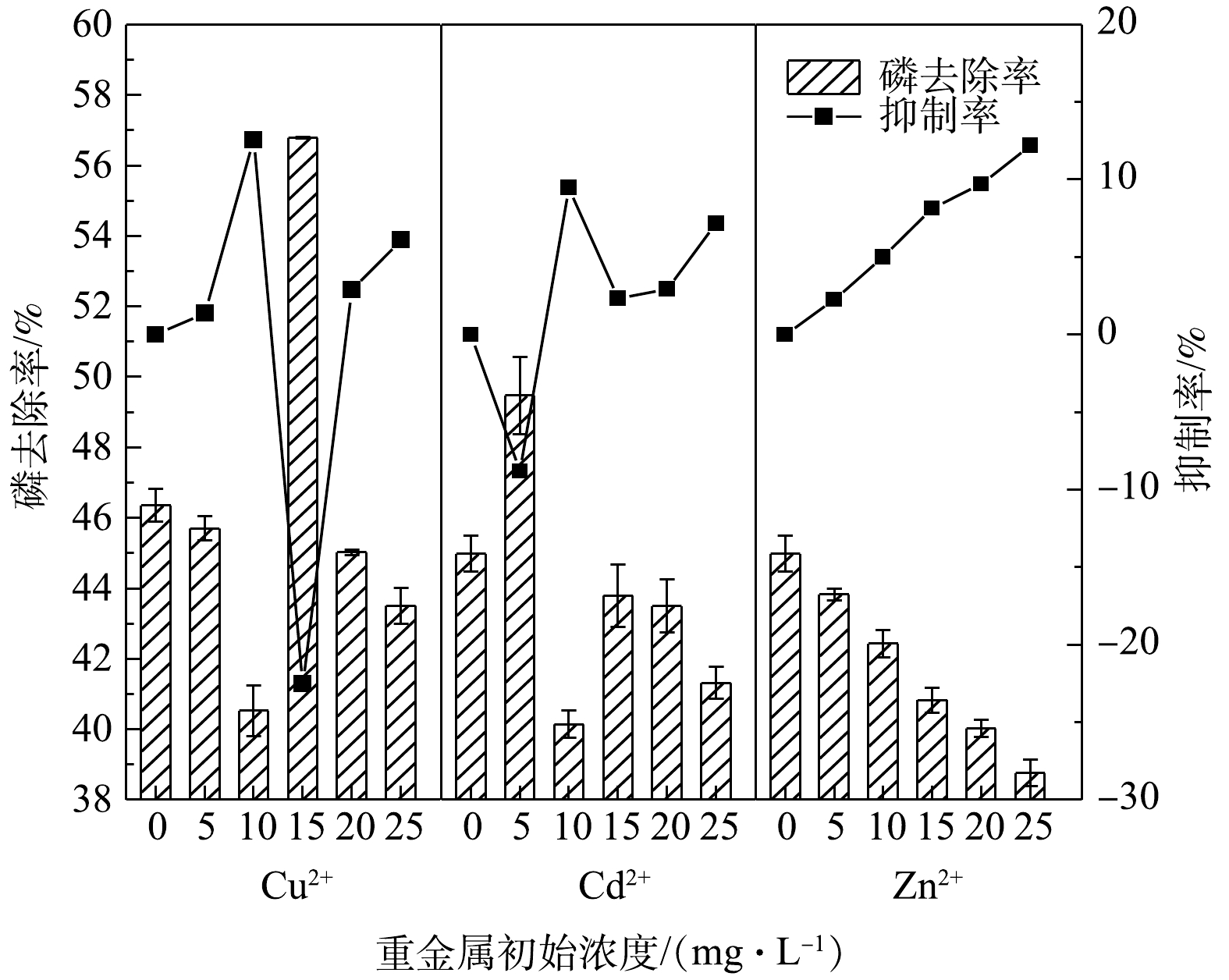
2)重金属离子的联合影响。由图3可见,联合投加Cu2+、Cd2+、Zn2+时,随着重金属浓度的增加,结晶体系中磷的去除率呈现不同程度的下降。当3种重金属的浓度均达到20 mg·L−1时,他们对磷去除率的联合抑制率达到最大,为22.19%,远远超过Cu2+、Cd2+、Zn2+各自在单独投加时的最大抑制率12.57%、9.49%和12.20%,同时也超过单独投加Cu2+、Cd2+、Zn2+各20 mg·L−1时的抑制率总和(15.51%)。由此可见,相比于单独投加,联合投加Cu2+、Cd2+、Zn2+对结晶体系磷去除率的抑制作用更强。
2.2 重金属离子的浓度削减规律
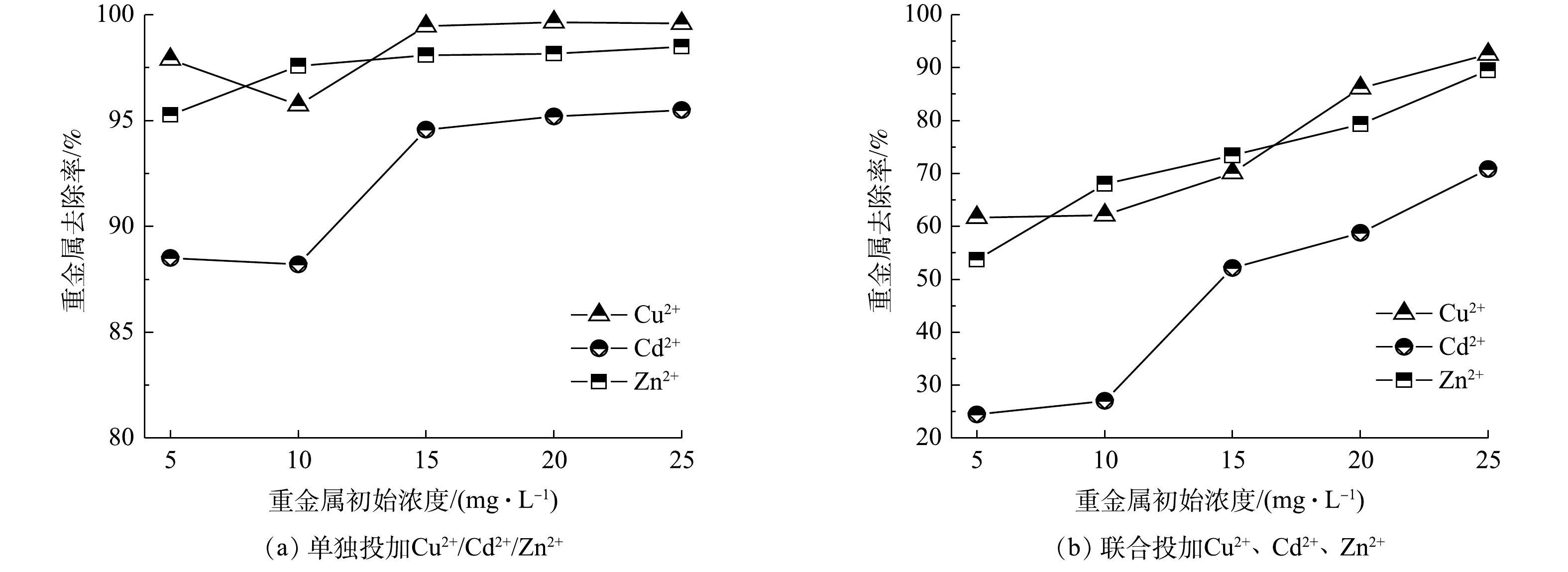
本研究发现,HAP结晶体系可以协同去除磷和重金属。如图4(a)所示,在单独投加重金属离子的形式下,随着重金属初始浓度的增加,Cu2+、Cd2+、Zn2+的去除率均呈上升趋势,Cu2+的去除率最大,Zn2+次之,Cd2+最小。对比图4(a)和图4(b)可以发现,3种重金属在联合投加时的去除率均比单独投加时对应的去除率要低。这说明当Cu2+、Cd2+、Zn2+共存于结晶体系时,单个重金属的去除会受到另两者的拮抗。产生以上现象的主要原因是:Cu2+、Cd2+、Zn2+会在碱性条件下竞争OH−,发生如式(5)~(7)所示的化学反应。
Cu2++2OH−↔Cu(OH)2↓Ksp=5.0×10−20 (5) Cd2++2OH−↔Cd(OH)2↓Ksp=2.2×10−14 (6) Zn2++2OH−↔Zn(OH)2↓Ksp=3.1×10−17 (7) 由于Ksp[Cu(OH)2]<Ksp[Zn(OH)2]<Ksp[Cd(OH)2],故Cu2+比 Zn2+、Cd2+更易形成共沉淀,使得液相中Cu2+的去除率最高,Cd2+的去除率最低。此外,重金属离子会取代部分Ca2+[16],或与HAP的表面基团络合,从而发生单分子层化学吸附[17],因此,3种重金属离子也可能竞争结晶体系中HAP前驱物表面的可吸附点位,从而强化相互拮抗作用。
2.3 重金属对结晶产物表面形貌的影响
图5为Cu-HAP、Cd-HAP、Zn-HAP和纯HAP晶体的SEM图像。Cu-HAP、Cd-HAP、Zn-HAP分别表示Cu2+、Cd2+、Zn2+的初始浓度为25 mg·L−1时的HAP结晶体系产物。由图5可知,Cu-HAP、Cd-HAP、Zn-HAP和纯HAP晶体均具有疏松多孔的表面特征,但Cu-HAP、Cd-HAP、Zn-HAP的晶体表面比纯HAP晶体更为松散,这一改变可能是金属离子进入晶格和/或这些离子吸附在晶体表面所引起的应力造成的。同时,Cu-HAP、Cd-HAP和Zn-HAP三者的表面形貌无显著差异,这说明3种重金属对晶体表面形貌的影响程度相当。
2.4 Visual MINTEQ模拟分析
1)模拟单一投加Cu2+/Cd2+/Zn2+。结晶体系中主要的过饱和物质及其Is值如表1、表2、表3所示。可以看出,3种重金属在HAP结晶体系中均可能与OH−和
PO3−4 生成多种过饱和物质。随着重金属初始浓度的增加,HAP的Is值减小,结晶速率降低,表明HAP的Kiap值下降,构成化合物的离子有效浓度降低;而含铜/镉/锌化合物的Is值增大,结晶动力增强,说明含铜/镉/锌化合物的Kiap值上升,构成化合物的离子有效浓度升高。这证实了3种重金属离子进入结晶体系后会通过争夺HAP的构晶离子(OH−和PO3−4 )的方式来抑制HAP结晶。表 1 结晶体系含Cu2+时主要的过饱和物质及相应的Is值Table 1. Major supersaturated substances and their saturation indexes in the crystal system containing Cu2+过饱和物质 不同Cu2+初始浓度下的Is值 0 5 mg·L−1 10 mg·L−1 15 mg·L−1 20 mg·L−1 25 mg·L−1 HAP 16.874 16.868 16.859 16.849 16.839 16.829 Ca3(PO4)2(beta)* 5.769 5.764 5.758 5.752 5.746 5.739 Ca4H(PO4)3·3H2O 5.158 5.149 5.141 5.132 5.123 5.114 Cu(OH)2 2.025 2.141 2.205 2.250 2.284 Cu2(OH)3NO3 0.562 1.093 1.397 1.611 1.775 Cu3(PO4)2 2.889 3.230 3.421 3.552 3.653 Cu2(OH)3Cl 3.575 3.805 3.934 4.022 4.090 CuO (c) 3.640 3.756 3.820 3.865 3.899 注:*表示该物质为同质多晶体,括号内的内容代表同质多晶体的晶型。表1~4同。 表 2 结晶体系含Cd2+时主要的过饱和物质及相应的Is值Table 2. Major supersaturated substances and their saturation indexes in the crystal system containing Cd2+过饱和物质 不同Cd2+初始浓度下的Is值 0 5 mg·L−1 10 mg·L−1 15 mg·L−1 20 mg·L−1 25 mg·L−1 HAP 16.874 16.844 16.814 16.784 16.511 16.726 Ca3(PO4)2(beta)* 5.769 5.748 5.728 5.707 5.573 5.667 Ca4H(PO4)3·3H2O 5.158 5.126 5.094 5.063 4.934 5.000 Cd3(PO4)2 4.294 5.184 5.699 6.208 6.339 Cd(OH)2 0.153 表 3 结晶体系含Zn2+时主要的过饱和物质及相应的Is值Table 3. Major supersaturated substances and their saturation indexes in the crystal system containing Zn2+过饱和物质 不同Zn2+初始浓度下的Is值 0 5 mg·L−1 10 mg·L−1 15 mg·L−1 20 mg·L−1 25 mg·L−1 HAP 16.874 16.814 16.771 16.722 16.703 16.676 Ca3(PO4)2 (beta) * 5.769 5.741 5.720 5.697 5.686 5.672 Ca4H(PO4)3·3H2O 5.158 5.134 5.114 5.093 5.080 5.064 ZnO 1.215 1.513 1.685 1.809 1.905 Zn(OH)2 (epsilon) * 0.943 1.242 1.414 1.538 1.634 Zn3(PO4)2·4H2O 5.267 6.211 6.785 7.166 7.473 Zn5(OH)8Cl2 1.749 3.309 4.243 4.910 5.438 2)模拟联合投加Cu2+、Cd2+、Zn2+各25 mg·L−1。可能形成的沉淀种类复杂:除HAP、Ca3(PO4)2、CaHPO4外,Cu2+主要形成Cu(OH)2及相关的盐、Cu3(PO4)2和CuO,其中的CuO极易由亚稳态的Cu(OH)2脱水转化而来[18];Cd2+主要形成Cd3(PO4)2;Zn2+主要形成Zn(OH)2及相关的盐、Zn3(PO4)2·4H2O和ZnO,其中的ZnO在碱性环境下可由Zn(OH)2转化而来[19]。比较不同化合物的Is值可以看出,与OH−结合的重金属化合物中,Cu(OH)2的Is值最大,Zn(OH)2的Is值次之,Cd(OH)2的Is值接近于0,说明OH−更易与Cu2+结合,其次是Zn2+,与Cd2+几乎不会结合产生沉淀;与
PO3−4 结合的重金属化合物中,Zn3(PO4)2·4H2O的Is值最大,Cd3(PO4)2次之,Cu3(PO4)2最小,说明PO3−4 更易与Zn2+结合,其次是Cd2+和Cu2+。因此,Cd2+主要通过结合PO3−4 来抑制HAP的结晶,而Cu2+和Zn2+通过与PO3−4 或OH−结合来抑制HAP的结晶。表 4 联合投加Cu2+、Cd2+、Zn2+各25 mg·L−1时所有的过饱和物质及相应的Is值Table 4. All supersaturated substances and their saturation indexes with joint addition of 25 mg·L−1 Cu2+, Cd2+ and Zn2+过饱和物质 Is值 过饱和物质 Is值 Cu2(OH)3Cl 4.168 HAP 16.478 Ca3(PO4)2 (am1) * 1.678 CuO(am) * 3.007 Ca3(PO4)2 (am2) * 4.449 CuO(c) * 3.857 Ca3(PO4)2 (beta) * 5.540 ZnO 1.905 Ca4H(PO4)3·3H2O 4.868 Zn(OH)2 (am) * 0.673 CaHPO4 0.140 Zn(OH)2 (beta) * 1.400 Cd3(PO4)2 6.177 Zn(OH)2 (delta) * 1.559 Cd(OH)2 0.026 Zn(OH)2 (epsilon) * 1.634 Cu(OH)2 2.242 Zn(OH)2 (gamma) * 1.424 Cu2(OH)3NO3 1.939 Zn2(OH)3Cl 0.071 Cu3(PO4)2 3.640 Zn3(PO4)2·4H2O 7.346 Cu3(PO4)2·3H2O 1.910 Zn5(OH)8Cl2 5.427 由表5可知,模拟联合投加时,
PO3−4 -P的去除率高达89.361%,而固相中的n(Ca)/n(P)为1.08,低于纯HAP的n(Ca)/n(P)(1.67)。这说明PO3−4 -P并未完全以HAP的形式进入固相,重金属的引入降低了结晶体系的产物纯度。模拟反应体系中Cu2+、Cd2+、Zn2+的沉淀率分别为93.300%、0.000和79.123%,这表明液相中重金属去除率的排序为Cu2+>Zn2+>Cd2+,这与3.3节的实验结果是一致的。在本研究中,Visual MINTEQ模拟计算仅考虑化学反应,关于重金属与HAP前驱物的吸附特性有待进一步研究。表 5 联合投加Cu2+、Cd2+、Zn2+各25 mg·L−1时主要元素在液相和固相中的分布Table 5. Distribution of main elements in liquid and solid phases with joint addition of 25 mg·L−1 Cu2+, Cd2+ and Zn2+组分 液相浓度/(10-4 mol·L-1) 溶解态/% 固相浓度/(10-4 mol·L-1) 沉淀/% Ca2+ 6.659 7 51.560 6.256 7 48.440 
0.686 94 10.639 5.770 1 89.361 Cu2+ 0.263 60 6.700 3.670 6 93.300 Cd2+ 2.224 2 100.000 0 0.000 Zn2+ 0.797 92 20.877 3.024 2 79.123 3. 结论
1) 3种重金属(Cu2+、Cd2+、Zn2+)对HAP结晶法除磷均会产生抑制,其中Zn2+的抑制作用最稳定且符合抑制模型,抑制常数为178.0 mg·L−1,Zn2+的削减浓度与E−1正相关。联合投加3种重金属会增强对磷去除率的抑制。
2) HAP结晶法可协同去除重金属,去除率的顺序为Cu2+>Zn2+>Cd2+。重金属的初始浓度越大,去除率越大。联合投加时,Cu2+、Cd2+、Zn2+三者相互拮抗,去除率均有所降低,降幅排序为Cd2+>Zn2+>Cu2+。
3) Cu2+、Cd2+、Zn2+的引入使得结晶产物变得更为松散,但3种重金属对晶体表面形貌的影响程度相当。
4) Visual MINTEQ的模拟计算结果证实,Cu2+、Cd2+、Zn2+主要通过争夺HAP的构晶离子来抑制磷去除率,并通过共沉淀降低产物纯度。HAP的构晶离子中,OH−易与Cu2+结合,
PO3−4 易与Zn2+结合。3种重金属进入结晶产物的含量大小为Cu2+>Zn2+>Cd2+。 -
[1] DHAL B.,THATOI H.N.,DAS N.N.,et al.Chemical and microbial remediation of hexavalent chromium from contaminated soil and mining/metallurgical solid waste:A review.Journal of Hazardous Materials,2013,250-251:272-291 [2] DI PALMA L.,GUEYE M.T.,PETRUCCI E.Hexavalent chromium reduction in contaminated soil:A comparison between ferrous sulphate and nanoscale zero-valent iron.Journal of Hazardous Materials,2015,281:70-76 [3] 武甲,田秀君,王锦,等.应用纳米零价铁处理模拟含Cr(Ⅵ)无氧地下水.环境科学,2010,31(3):645-652 WU Jia,TIAN Xiujun,WANG Jin,et al.Treatment of Cr(Ⅵ) in Deoxygenated simulated groundwater using nanoscale zero-valent iron.Environmental Science,2010,31(3):645-652(in Chinese) [4] FU Fenglian,DIONYSIOU D.D.,LIU Hong.The use of zero-valent iron for groundwater remediation and wastewater treatment:A review.Journal of Hazardous Materials,2014,267:194-205 [5] LO I.M.C.,LAM C.S.C.,LAI K.C.K.Hardness and carbonate effects on the reactivity of zero-valent iron for Cr(Ⅵ) removal.Water Research,2006,40(3):595-605 [6] MITRA P.,SARKAR D.,CHAKRABARTI S.,et al.Reduction of hexa-valent chromium with zero-valent iron:Batch kinetic studies and rate model.Chemical Engineering Journal,2011,171(1):54-60 [7] 王德帅,杨开,王弘宇.无机矿物黏土负载纳米零价铁技术研究进展.无机盐工业,2015,47(1):5-8WANG Deshuai,YANG Kai,WANG Hongyu.Research progress of inorganic mineral clay supported nanoscale zero-valent iron.Inorganic Chemicals Industry,2015,47(1):5-8(in Chinese) [8] BABEL S.,KURNIAWAN T.A.Cr(Ⅵ) removal from synthetic wastewater using coconut shell charcoal and commercial activated carbon modified with oxidizing agents and/or chitosan.Chemosphere,2004,54(7):951-967 [9] LAI K.C.K.,LO I.M.C.Removal of chromium (Ⅵ) by acid-washed zero-valent iron under various groundwater geochemistry conditions.Environmental Science & Technology,2008,42(4):1238-1244 [10] 张环,金朝晖,韩璐,等.负载型纳米铁化学反硝化法去除硝酸盐氮的研究.中国给水排水,2006,22(15):83-87 ZHANG Huan,JIN Zhaohui,HAN Lu,et al.Study on nitrate nitrogen removal in chemical denitrification by supported nano zero-valent iron.China Water & Wastewater,2006,22(15):83-87(in Chinese) [11] YUAN Peng,FAN Mingde,YANG Dan,et al.Montmorillonite-supported magnetite nanoparticles for the removal of hexavalent chromium from aqueous solutions.Journal of Hazardous Materials,2009,166(2/3):821-829 [12] SUN Yuanpang,LI Xiaoqin,CAO Jiasheng,et al.Characterization of zero-valent iron nanoparticles.Advances in Colloid and Interface Science,2006,120(1/2/3):47-56 [13] LYU Xiaoshu,XU Jiang,JIANG Guangming,et al.Removal of chromium (Ⅵ) from wastewater by nanoscale zero-valent iron particles supported on multiwalled carbon nanotubes.Chemosphere,2011,85(7):1204-1209 [14] CHEN S.S.,CHENG C.Y.,LI Chiwang,et al.Reduction of chromate from electroplating wastewater from pH 1 to 2 using fluidized zero valent iron process.Journal of Hazardous Materials,2007,142(1/2):362-367 [15] SHI Li'na,ZHANG Xin,CHEN Zuliang.Removal of Chromium (Ⅵ) from wastewater using bentonite-supported nanoscale zero-valent iron.Water Research,2011,45(2):886-892 [16] 曾淦宁,武晓,郑林,等.负载纳米零价铁铜藻基活性炭的制备及其去除水中Cr(Ⅵ)的研究.环境科学,2015,36(2):530-536 ZENG Ganning,WU Xiao,ZHENG Lin,et al.Preparation of nano zero-valent iron/Sargassum horneri based activated carbon for removal of Cr(Ⅵ) from aqueous solution.Environmental Science,2015,36(2):530-536(in Chinese) [17] YIN Weizhao,WU Jinhua,LI Ping,et al.Experimental study of zero-valent iron induced nitrobenzene reduction in groundwater:The effects of pH,iron dosage,oxygen and common dissolved anions.Chemical Engineering Journal,2012,184:198-204 [18] YANG J.E.,KIM J.S.,OK Y.S.,et al.Capacity of Cr(Ⅵ) reduction in an aqueous solution using different sources of zerovalent irons.Korean Journal of Chemical Engineering,2006,23(6):935-939 [19] GENG Bing,JIN Zhaohui,LI Tielong,et al.Kinetics of hexavalent chromium removal from water by chitosan-Fe0 nanoparticles.Chemosphere,2009,75(6):825-830 期刊类型引用(0)
其他类型引用(2)
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 2412
- HTML全文浏览数: 1908
- PDF下载数: 654
- 施引文献: 2





 下载:
下载: