负载型TiO2纳米管对水体中萘普生光催化作用
Photocatalysis of naproxen in water over TiO2 nanotube supported on polyurethane membrane
-
摘要: 为了解决水体中光催化剂的分离和回收问题,对纳米TiO2的固载化及其应用进行了研究。首先以纳米TiO2为原料,采用水热合成法制备TiO2纳米管;再以聚氨酯膜片为载体制备负载型TiO2纳米管(PU/TiO2)。对负载材料进行FT-IR和SEM表征,表征结果表明:TiO2纳米管能很好地接枝在PU薄膜表面;然后在空气曝气、pH=5、T=26 ℃的条件下,进行光催化降解萘普生的实验。实验结果表明:制备的负载材料对水体中的萘普生有较强的吸附作用,在300 W紫外光的照射下,5 min内能使10.00 mg/L的萘普生降解完全;紫外光照与光催化剂对萘普生的降解具有协同效应;光催化反应近似符合一级模型。综合表明,负载型TiO2纳米管是一种具有潜在应用前景的光催化剂。Abstract: The immobilization of TiO2 and application as a photocatalyst were studied to solve the problem of photocatalyst separation and recovery in water. First, a TiO2 nanotube was successfully synthesized using a hydrothermal method, and then a polyurethane membrane was used as the carrier to prepare a supported TiO2 nanotube. The materials were characterized using Fourier transform infrared (FT-IR) spectroscopy and scanning electron microscopy (SEM). The results showed that the TiO2 nanotube could graft well on the surface of the polyurethane film. Photocatalytic degradation of naproxen was conducted under the conditions of aeration, pH=3.0, and T=26 ℃. The results indicated that the prepared catalytic materials strongly adsorbed naproxen in water, and naproxen (10.00 mg/L) was degraded completely in 5 min under 300 W ultraviolet (UV) irradiation. UV irradiation and the photocatalyst have a significant synergistic effect on naproxen degradation. Furthermore, the photocatalytic reaction rate obeys a pseudo-first-order kinetics equation. It could be concluded that the supported TiO2 nanotube is a promising photocatalyst.
-
Key words:
- TiO2 nanotube /
- photocatalysis /
- naproxen
-
苯并噻唑及其类似物(benzothiazoles, BTs)是一类非常重要的杂环化合物,广泛应用于医药[1]、农业[2]及工业[3]等领域。近年来,BTs引起的环境问题与健康问题日益受到关注。由于汽车轮胎中BTs与橡胶基质结合不牢固,因此,会随着轮胎的磨损进入道路雨水径流,继而渗入土壤,很容易造成地下水的污染[4]。目前,在国内外多处地表水体、废水及地下水中均检测到了BTs的存在,质量浓度可达μg·L−1甚至mg·L−1水平[5-9]。在我国,许多以地下水为饮用水源的城市自来水中也频繁检出BTs类物质[10-12]。有研究表明,BTs能够进入地下环境,并吸附于含水层介质上,还会随着地下水的流动而发生迁移[13],每年随着各类工业废水被大量排放进入环境当中[14]。作为一类新污染物,BTs的污染特征和降解行为尚未被充分了解,而现有场地修复技术对BTs污染物的有效性仍有待研究。
原位化学氧化法(in-situ chemical oxidation, ISCO)是目前最具应用前景的有机污染场地修复技术之一。该技术可以通过直接向污染含水层注入氧化剂,使目标污染物分解为无毒或毒性较小的物质,操作简便,适应性强[15]。目前应用较广的氧化剂包括高锰酸盐、过硫酸盐、Fenton试剂和过氧化钙/镁等。其中,过氧化钙(CaO2)是一种绿色安全的固体氧化剂[16],在水中能缓慢释放O2和H2O2(式(1)~(2))。H2O2经过Fe2+活化可以生成强氧化性的·OH,即发生Fenton反应(式(3)),能够有效降解大多数有机污染物[17-20]。常规CaO2的粒径为1~20 μm,若直接注入地下则容易在注入点周围发生团聚,分散性和传输性能欠佳,导致氧化剂影响半径小、分布不对称等问题[21-22]。而纳米过氧化钙(nCaO2)具有更好的扩散性能和更高的比表面积,可在一定程度上提高污染物的降解速率,并且在无催化剂条件下可以长期稳定保存。
2CaO2+2H2O=2Ca(OH)2+O2(g) (1) CaO2+2H2O=Ca(OH)2+H2O2 (2) H2O2+Fe2+→∙OH+OH-+Fe3+ (3) 因此,本研究选择3种典型BTs化合物作为目标污染物,利用基于nCaO2的类Fenton体系对受污染地下水开展氧化修复实验。采用多孔介质悬浮液批实验研究氧化剂与活化剂投加量、地下水pH、背景离子对BTs去除效率的影响;采用砂柱实验研究nCaO2在含水层中的迁移分布规律并考察nCaO2/Fe2+对BTs污染含水层的连续动态修复性能;探讨利用nCaO2原位反应去除地下水中BTs的可行性,为ISCO技术在实际污染场地修复中的应用提供一定的理论指导。
1. 材料与方法
1.1 材料
苯并噻唑(benzothiazole, BTH)、2-羟基苯并噻唑(2-hydroxy-benzothiazol, OBT)、2-巯基苯并噻唑(2-mercapto-benzothiazole, MBT)、氯化钙、氨水、过氧化氢(30%)、七水合硫酸亚铁(FeSO4·7H2O)、0.1 mol·L−1氢氧化钠、0.1 mol·L−1硫酸、氯化钠、碳酸氢钠均为分析纯,均购自上海国药集团化学试剂有限公司;十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide, CTMAB)为分析纯,购自上海麦克林生化科技有限公司;甲醇为色谱纯,购自上海国药集团化学试剂有限公司。所有的溶液均由去离子水制成。静态实验和动态实验中所用模拟含水层多孔固体介质均为过筛、洗涤并烘干后的市售天然河砂,粒径为0.5~1.0 mm,孔隙度为0.42。
1.2 nCaO2的制备
采用钙盐法制备nCaO2:首先向120 mL去离子水中加入12 g CaCl2,搅拌均匀,然后取1.2 g CTMAB溶于480 mL去离子水中,将两者混合均匀后放置在磁力搅拌器上进行恒速搅拌。测试pH,滴加氨水调节pH到10左右,形成母液。在不断搅拌的条件下,在母液中以1 mL·min−1的速率加入60 mL的30%H2O2。全部混合后,滴加NaOH溶液将pH调节到11左右。溶液中逐渐产生沉淀,静置一段时间。将溶液进行离心,取下方沉淀用无水乙醇冲洗后,将混合液进行抽滤,将抽滤后的滤饼在真空干燥箱中40 °C下完全干燥,将干燥过的nCaO2粉末进行研磨后收集保存。取0.5 g nCaO2固体,加入250 mL去离子水中搅拌均匀制成浆液,用于砂柱实验原位注入模拟含水层。
1.3 静态批实验
本研究采用批实验考察了nCaO2对含水层中BTs的降解及其影响因素。模拟BTs污染含水层的构建方法为:取BTH、MBT和OBT各100 mg加入去离子水定容至500 mL,采用超声助溶,配制成200 mg·L−1的BTs母液,使用时取母液稀释成20 mg·L−1的BTs水溶液。向250 mL顶空培养瓶中加入固体介质50 g和100 mL BTs水溶液(20 mg·L−1)构成模拟污染含水层[15]。实验前使用0.1 mol·L−1的H2SO4和0.1 mol·L−1的NaOH对其初始pH(3~11)进行调节,随后加入不同剂量的氧化剂nCaO2和活化剂FeSO4·7H2O启动反应。加盖密封后,在室温、150 r·min−1条件下持续振荡。此基础上,通过向模拟含水层中添加1~100 mmol·L−1 NaHCO3或NaCl,考察地下水中2种常见无机离子的影响。振荡1 h后取出水样,使用0.22 μm微孔滤膜过滤并收集滤液,立即对BTs污染物浓度进行测定。
1.4 动态砂柱实验
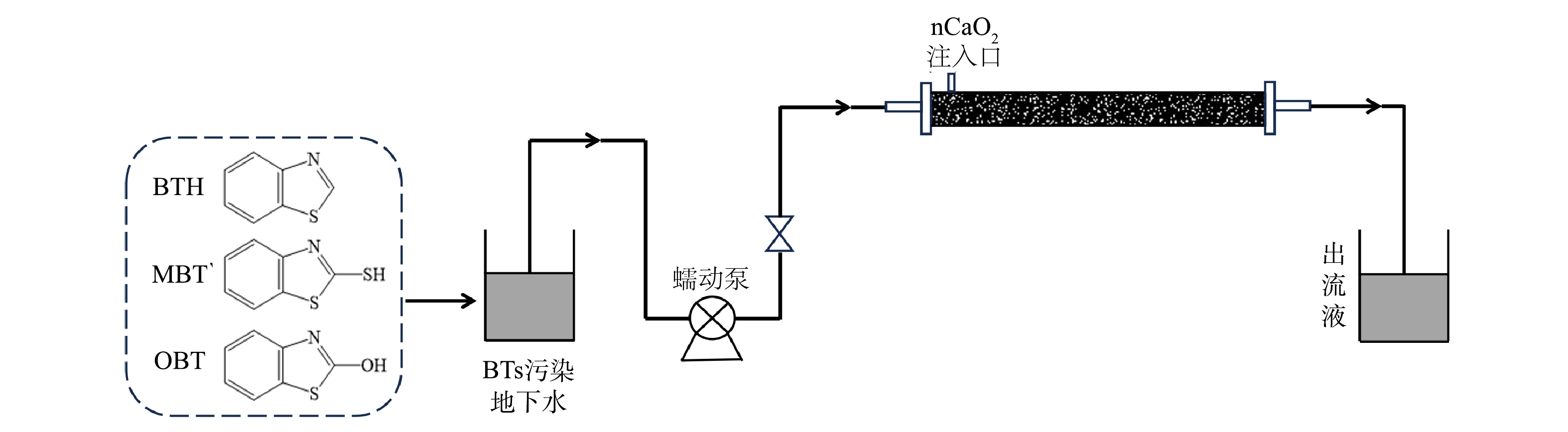
本研究采用砂柱实验考察nCaO2在模拟地下含水层内的迁移分布特性以及BTs的连续动态修复效果。砂柱为有机玻璃制成(图1),长30 cm,内径3 cm,水平放置,填充有多孔固体介质。在模拟柱的两端铺设衬有滤布的布水板达到均匀布水的目的;实验中从柱左端进水、右端出水,在距离左端布水板3 cm的位置设有一外径为6.4 mm的氧化剂注入口。砂柱进水口与蠕动泵间用一根软管相连,通过蠕动泵来调节模拟地下水的流速。
1)氧化剂的迁移分布特性实验。实验开始前将去离子水缓慢注入到砂柱当中进行冲洗,直至出水澄清,并确认砂柱处于饱和状态。先从氧化剂注入口注入1 PV(孔隙体积,pore volume) 2 g·L−1的nCaO2,再从进水口以2 m·d−1的流速注入4 PV去离子水,当注入nCaO2后开始定时在出水口取水样。实验结束后,从进水口沿水流方向每3 cm一段取出柱内固体介质。测定水样和砂样中的Ca2+浓度,用于分析nCaO2在水和介质中的含量。
2) BTs污染含水层连续动态修复实验。 从进水口泵入含有20 mg·L−1 BTs的模拟污染地下水,控制流速在0.1 m·d−1,直至出水中BTs浓度稳定,使BTs在含水层中达到饱和。从注入口一次性注入250 mL 2 g·L−1的nCaO2,同时从进水口持续通入模拟BTs污染地下水(含有1 mmol·L−1 Fe2+),并对砂柱出水进行监测分析。测定出水中BTs浓度变化及含水层地球化学参数变化(pH、氧化还原电位(oxidation-reduction potential,ORP)、溶解氧(dissolved oxygen,DO)和Fe2+浓度),综合评估连续动态氧化修复效能。
1.5 分析方法
nCaO2的主要成分采用X射线衍射仪(x-ray diffraction,XRD)和傅里叶变换红外光谱(fourier transform infrared spectroscopy,FT-IR)进行定性分析。利用扫描电子显微镜(scanning electron microscope,SEM)观察nCaO2的形貌及大小等。通过高效液相色谱(high performance liquid chromatography,HPLC)对地下水中BTs的浓度进行测定,检测器为紫外吸收检测器(Shimadzu SPD-16)。采用反相色谱柱(Agilent TC-C18,250 mm×4.6 mm,5 μm)进行分离。具体分离条件为:以甲醇-水(体积比为70:30)体系为流动相,柱温始终保持为40 °C,流速为0.8 mL·min−1,进样体积为20 μL,其中BTH、MBT及OBT的检测波长分别为225、320及250 nm。利用分光光度法测定溶液和介质中的Ca2+浓度;DO采用便携式溶解氧测定仪测定;pH及ORP值采用便携式水质分析仪测定;Fe2+采用邻菲罗啉分光光度法进行测定。
2. 结果与讨论
2.1 nCaO2的主要成分及形貌结构
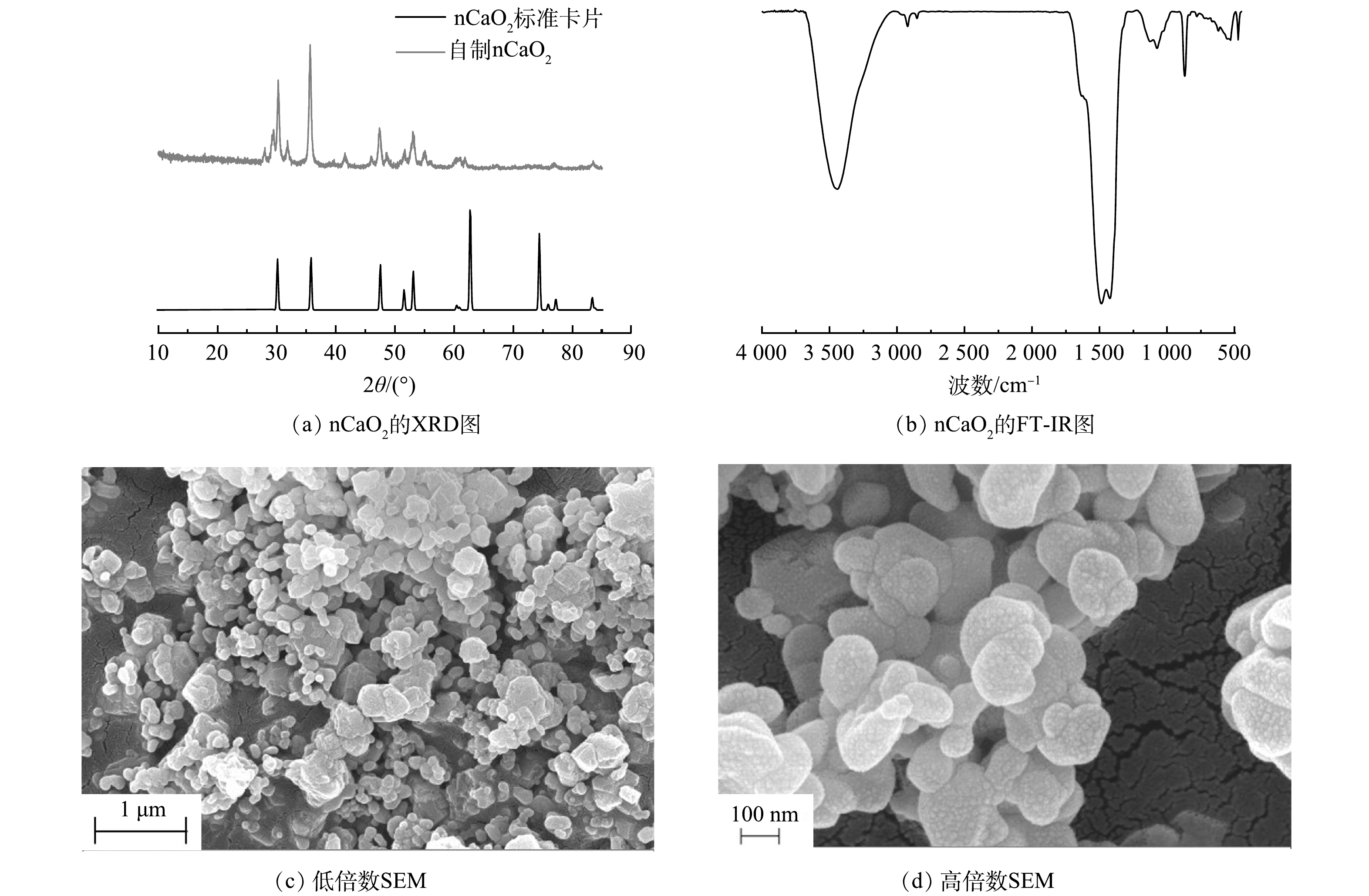
由图2(a)可以看出,在20~90°的衍射角度内,样品在30.3°、35.7°、47.4°、53°、55°和60.3°处出现明显的衍射峰。通过与CaO2的标准卡片JCPDS03-0865进行比对可以判断CaO2成功制备。此外,由图2(b)可见,位于1 074 cm−1和867 cm−1处的吸收峰对应于CaO2的O—O键振动;位于1 423 cm−1附近的吸收峰则可归因于碳酸根的振动,这可能是由于制备过程中空气中CO2参与反应从而生成了少量CaCO3;位于1 488 cm−1处的吸收峰是O—Ca—O的弯曲振动吸收峰;位于3 440 cm−1的2个吸收峰则归因于样品表面吸附水的羟基振动,FT-IR也表明CaO2成功制备。由nCaO2的SEM图(图2(c)~(d))可以看出,实验制备的CaO2颗粒呈现出椭球状,粒径大小约为200 nm,表现出相对均匀的粒径,且颗粒较为分散。
2.2 nCaO2降解地下水中BTs的影响因素
以往研究表明,氧化剂与活化剂投加量、环境pH以及地下水中的背景离子等都可能对含水层中BTs原位氧化降解产生影响。因此,本研究首先对不同条件下的BTs去除率进行了比较,结果如图3~5所示。
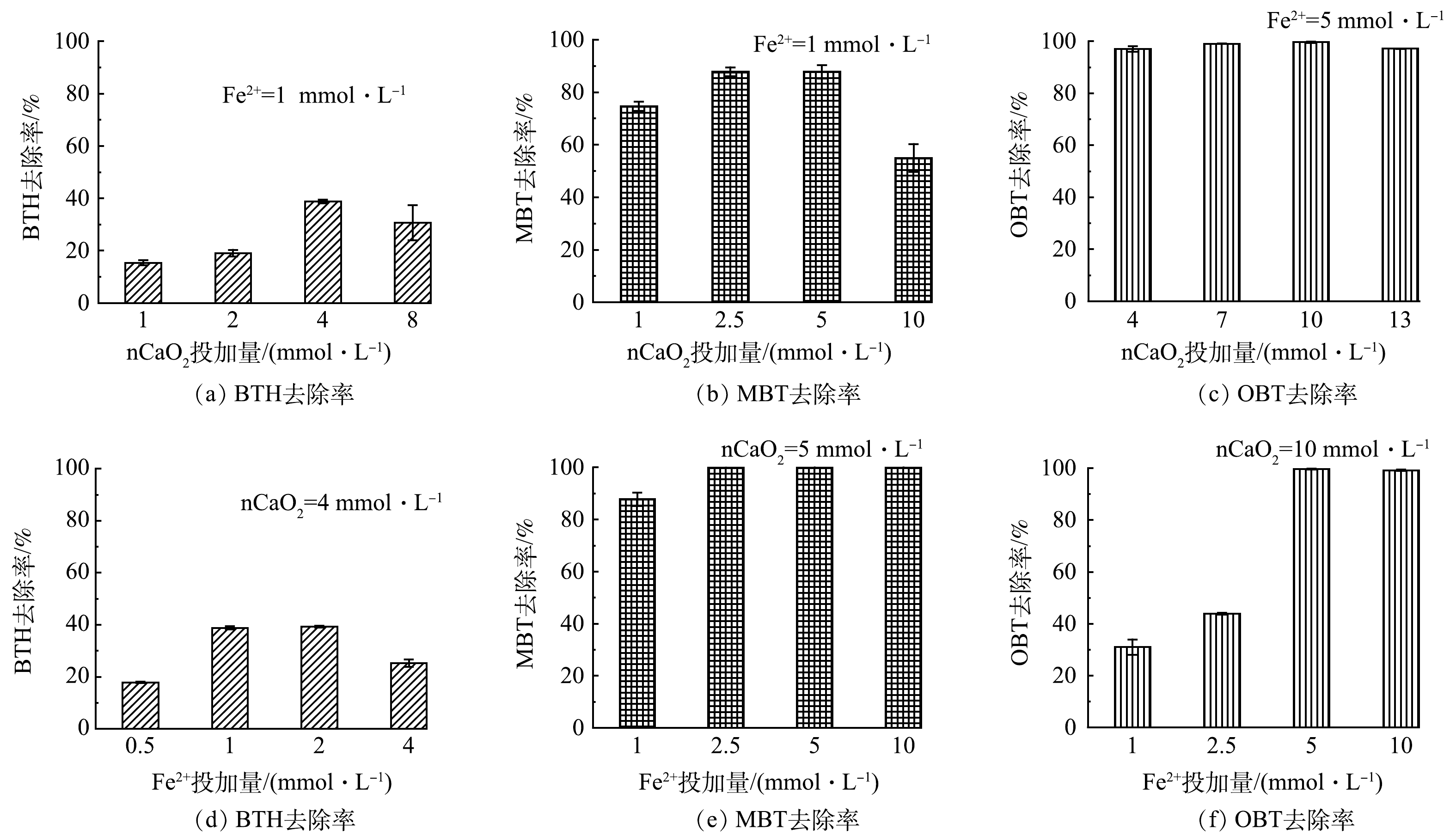
1)氧化剂nCaO2与活化剂Fe2+投加量的影响。nCaO2投加量对BTs去除效果的影响如图3(a)~(c)所示。可以看出,随nCaO2的投加量的增加,3种BTs化合物的去除率均呈现先升高后降低的趋势。在本实验条件下,对于BTH、MBT和OBT而言,去除效果最佳的nCaO2投加量分别为4、5和10 mmol·L−1。经过1 h后,BTH、MBT和OBT的去除率达到38.8%、87.8%和99.6%。这表明提高nCaO2的投加量仅在一定范围内有助于BTs的降解,过量的nCaO2会对BTs的降解产生抑制作用。这可能是由于:一方面,过量nCaO2的加入使得体系内产生较多的Ca(OH)2(式(1)),导致溶液pH上升,从而抑制了芬顿反应;另一方面,反应中释放出的过量的H2O2可与·OH自由基发生反应(式(4)~(5))[23],从而消耗一部分·OH,降低·OH与BTs的氧化反应效率。
H2O2+⋅OH→H2O+HO2− (4) ⋅OH+⋅OH→H2O2 (5) 在此基础上,在上述最佳nCaO2投加量条件下,研究了Fe2+投加量对3种BTs降解的影响。对于BTH而言,随着Fe2+浓度增加,BTH去除率呈现先增后减的趋势(图3(d))。当Fe2+浓度为2 mmol·L−1时,BTH去除率最高(39.3%),继续增加Fe2+浓度至4 mmol·L−1,则去除率下降至25.3%。如图3(e)~(f)所示,随着Fe2+浓度从1 mmol·L−1增加到5 mmol·L−1,MBT和OBT的去除率分别从87.8%和31.0%升高到100%和99.6%。当Fe2+浓度进一步增加到10 mmol·L−1时,MBT和OBT的去除率基本维持不变。以上结果表明,氧化体系内适量的Fe2+能够有效地活化nCaO2产生大量自由基,有利于BTs的降解。但过量的Fe2+会与目标污染物争夺·OH自由基[24](式(6)),使目标污染物的降解受到抑制。
Fe2++⋅OH→Fe3++HO− (6) 根据上述结果,可知对于MBT、BTH和OBT的降解而言,最佳nCaO2 ∶Fe2+的浓度比分别为5∶1、4∶1和2∶1。后续实验均在此条件下进行。
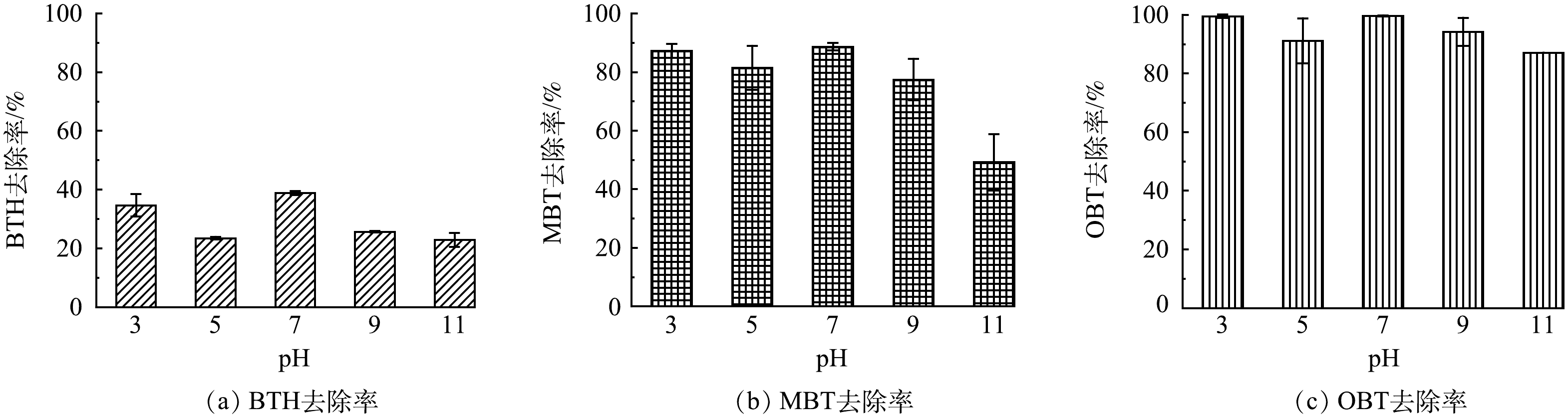
2)地下水环境pH的影响。已有多项研究表明·OH的作用与pH有着密切的联系[25-27]。如图4((a)~(c))所示,本研究评估了pH=3~11内BTs的降解效果。对于Fenton反应而言,pH=3时Fe2+更容易被氧化,从而促进·OH的生成,有利于提高污染物的降解速率[28]。另一方面,对于本实验中的Fe2+/nCaO2体系而言,较低的pH条件下,水中大量的H+可能直接与nCaO2发生反应,使H2O2的释放变少[29],不利于BTs降解。因此pH对BTs的实际影响可能是复杂的。实验结果显示,pH=3和7时,BTs具有较好的去除效果,去除率高于初始pH=5时的情况。同时,实验还发现,氧化降解过程可在碱性条件下发生。但在碱性溶液中,BTs降解受到了明显抑制。相比pH=7条件下,BTH、MBT和OBT在pH=11时的去除率分别降低了16.0%、39.5%和12.6%。原因可能涉及2个方面:一方面,随着地下水pH的升高,nCaO2释放H2O2的量会降低[30],同时,活化剂Fe2+也更容易发生沉淀;另一方面,碱性条件下体系内会优先形成O2−,导致对BTs的降解能力有所下降[31]。
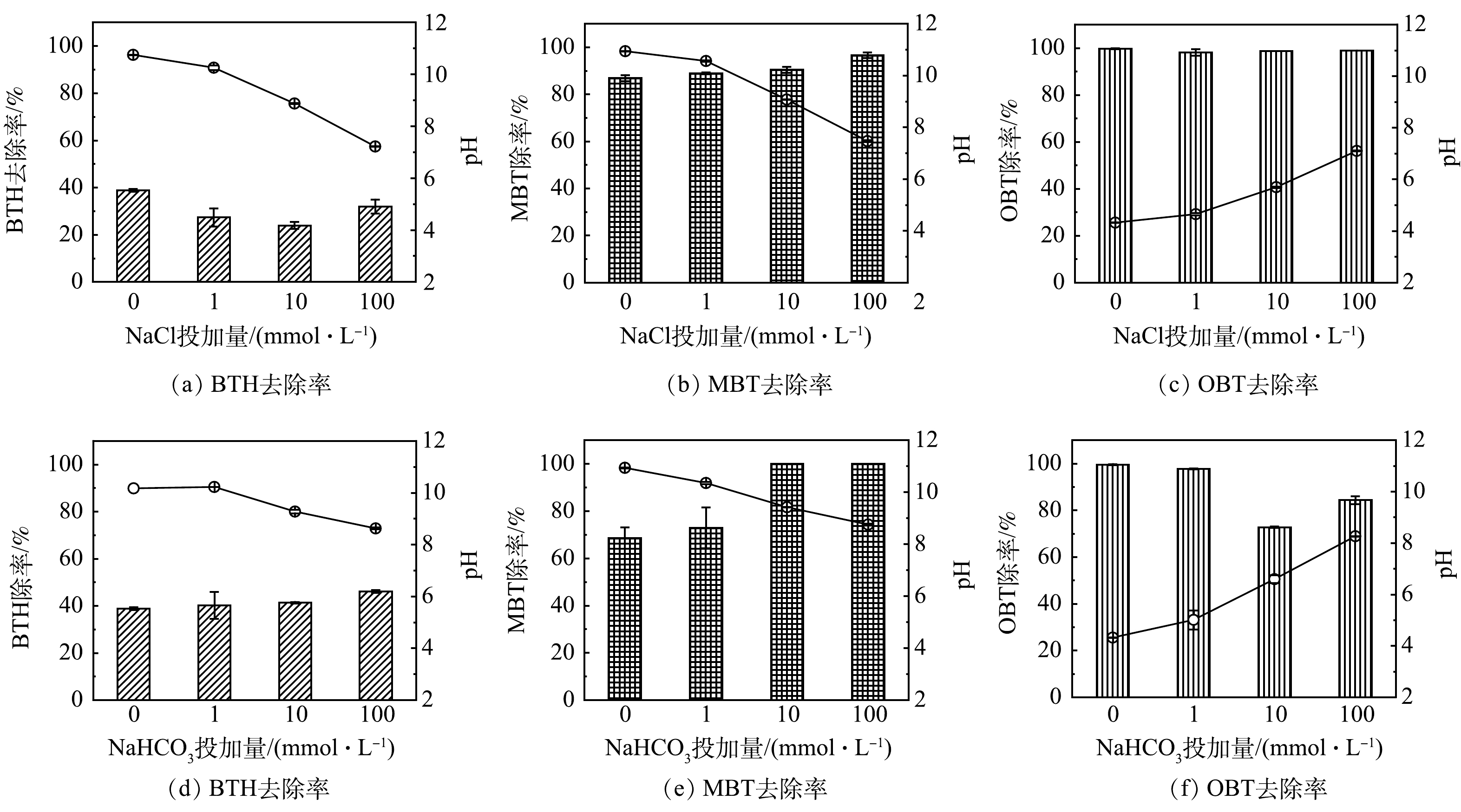
3)地下水中背景离子的影响。类Fenton体系在真实地下环境中的反应性能往往受到某些地下水背景组分(如阴离子)的影响。已有研究[32-36]表明,在不同的类Fenton体系中,阴离子的影响可能是积极的或是消极的,个别情况下也可以忽略不计。本实验分别研究了地下水中Cl−和HCO3−对BTs降解的影响(如图5所示,图中柱形表示BTs去除率,折线表示溶液初始pH)。
有研究[32]表明,在类芬顿体系中,Cl−的具体影响与其浓度、溶液pH和目标污染物类型有关。在Cl−存在的条件下,Cl−和·OH反应会生成含氯自由基(例如,Cl·和Cl2·−)(式(7)~(9))。一方面,当污染物与含氯自由基的反应速率低于其与·OH的反应速率时,Cl−的增加会抑制这些污染物的降解。另一方面,这些含氯自由基对含有给电子官能团(如羟基和巯基等)的化合物具有很高的反应活性[37]。某些富电子污染物与含氯自由基的反应速率常数甚至与这些污染物与·OH的反应速率常数相当,因此含氯自由基的产生可以部分抵消·OH的损失[32]。在本研究中,由于BTH分子不含给电子官能团,因此,Cl−的存在可对BTH的降解产生一定的抑制作用(图5(a)),然而抑制的强弱并非与Cl−浓度呈正相关。当Cl−浓度增加到100 mmol·L−1时,BTH的去除率出现回升的趋势。这可能是因为Cl−浓度增加的同时伴随着溶液pH的改变(图5(a))。根据2.2中pH的影响研究结果,当溶液pH从碱性降低至中性时可以促进BTH的降解。MBT和OBT均是富电子污染物,因此,Cl−浓度对其降解效果影响并不显著(图5(b)~(c))。
Cl−+⋅OH↔ClOH⋅− (7) ClOH⋅−+H+→Cl⋅+H2O (8) Cl⋅+Cl−→Cl2⋅− (9) 一般认为,地下水中的HCO3−是一种天然自由基清除剂,与·OH反应会生成氧化能力较低的CO3·−自由基(式(10)),对污染物的降解通常会产生负面影响。然而,一些研究发现,在基于·OH的非均相H2O2氧化体系中,HCO3−并不总是抑制污染物的降解[34, 38-39]。主要原因是CO3·−的长寿命及高稳态浓度(10−13~10−15 mol·L−1)可以弥补其在降解富电子化合物时的低反应活性和·OH的消耗[40-42]。如图5(d)~(f)所示,当地下水中存在1、10和100 mmol·L−1 HCO3−时,MBT在1 h内的去除率由68.6%分别上升到72.9%、100%和100%,OBT去除率由99.6%分别下降到97.7%、72.8%和84.4%。这表明HCO3−对MBT的降解产生了促进作用,而对OBT的降解产生了抑制作用。虽然OBT也是富电子化合物,但HCO3−浓度的增加导致溶液pH从酸性(pH=4.3)转变为碱性(pH=8.3),从而造成了OBT降解效率的降低。
HCO3−+⋅OH→CO3⋅−+H2O (10) 2.3 nCaO2在砂柱中的迁移分布特性
为了考察nCaO2对地下环境中BTs的氧化效果,本研究设计了模拟砂柱实验。首先对nCaO2在多孔介质中的迁移特性进行评估,然后考察了nCaO2 连续动态修复过程中BTs浓度随时间变化情况,最后对修复过程中地球化学参数的变化进行了分析。
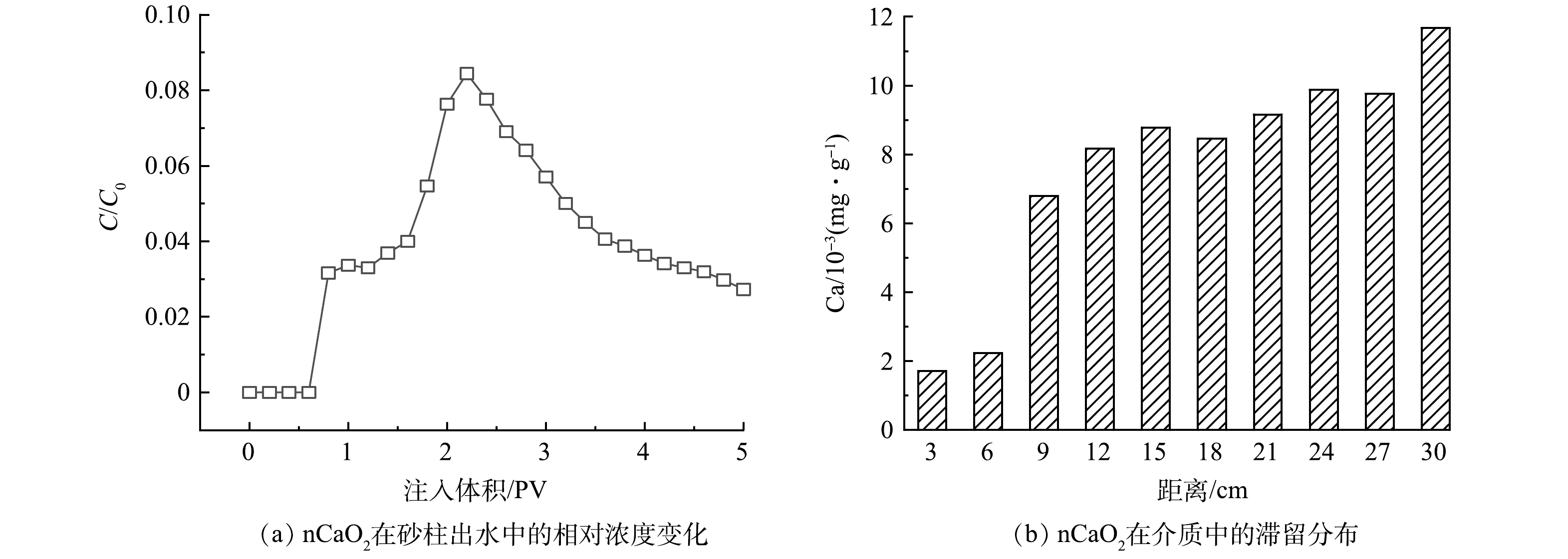
出水中nCaO2浓度随PV变化情况见图6(a)。nCaO2能够穿透整个砂柱,表明其在含水层中具有一定的迁移能力。出水中的nCaO2的浓度远小于注入浓度(C/C0<0.09),且随着时间的延长,出水中nCaO2的浓度呈现先升后降的趋势,在2.2 PV时达到最大值(0.17 g·L−1)。当地下水流速为2 m·d−1,nCaO2注入浓度为2 g·L−1时,nCaO2在0.5~1.0 mm粒径介质中的累计迁出量为20.0 mg,占注入总量的11.2%。这表明绝大部分nCaO2滞留在砂柱中,形成了原位反应带。多孔介质具有较大的比表面积,与修复试剂接触时可产生黏附、沉积作用,导致试剂发生滞留。对不同位置的砂样进行分析得到了nCaO2在模拟柱中的滞留分布情况见图6(b)。nCaO2沿整个柱长均有分布,其滞留量随迁移距离的增加呈现上升的趋势,出口处达到了12.2×10−3 mg·g−1。颗粒在含水层介质中存在着迁移-滞留-脱附-再迁移的动态变化,介质孔隙中的nCaO2在后续通入去离子水时被驱替而流出,因此,在5 PV之后的出水中仍能检测到nCaO2的存在[43]。
2.4 nCaO2对地下水中BTs的连续动态去除效果
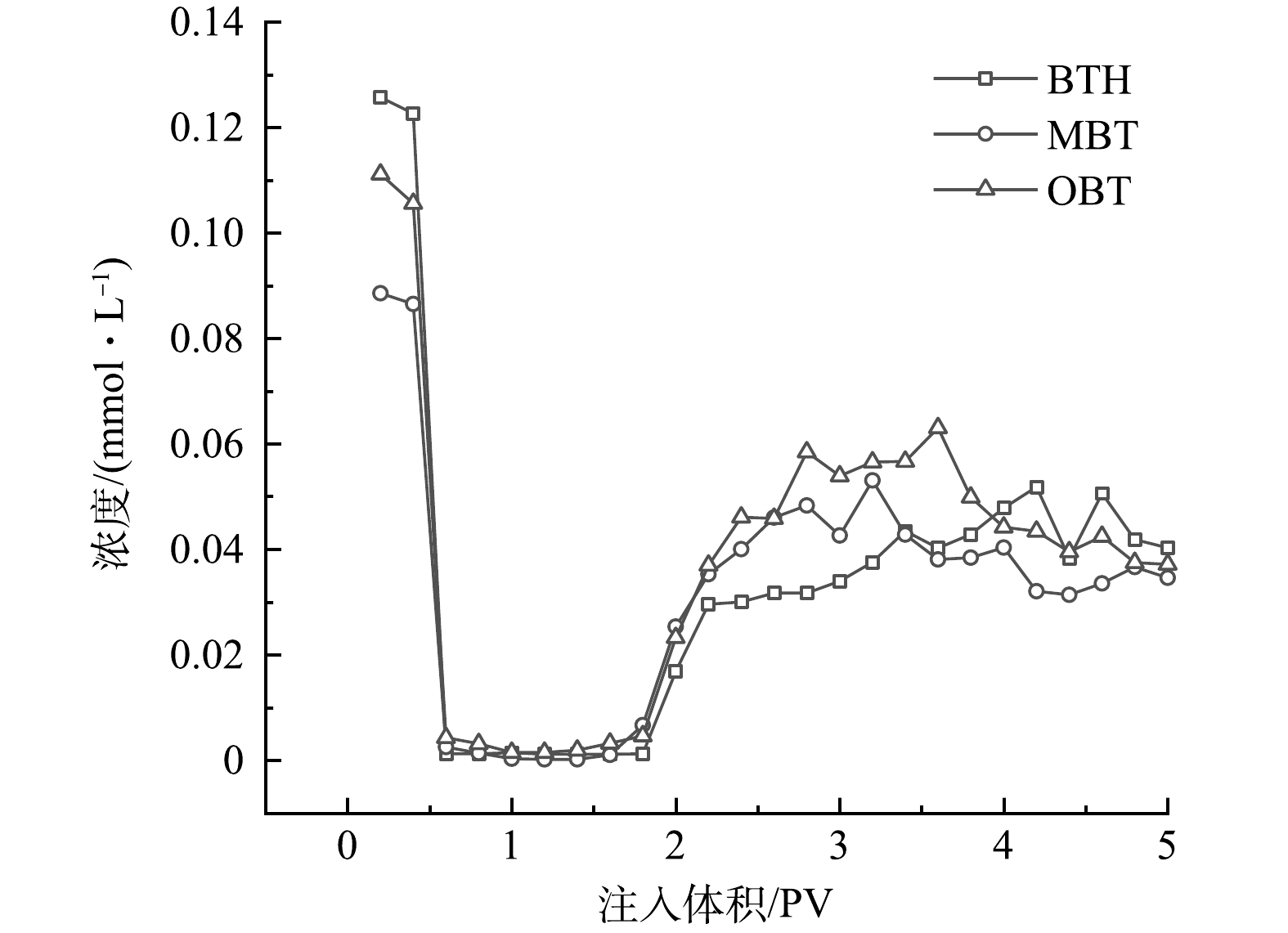
连续氧化修复过程中模拟柱出水BTs的浓度变化规律如图7所示。注入氧化剂前,BTs污染物在含水层中达到饱和,出水C/C0稳定在84.0%左右。在起初注入nCaO2后,出水中BTs浓度迅速降低,当出流体积为0.6~1.8 PV时,模拟柱内BTs去除率均达到97%以上。这是由于当含有Fe2+的模拟地下水进入nCaO2分布区域后,Fe2+活化nCaO2释放·OH(式(2)~(3))与BTs发生反应,导致其降解。随着BTs溶液的持续注入,模拟柱内氧化剂逐渐耗尽,降解作用逐渐减弱,出水中BTs浓度也随之逐渐升高。3种污染物均在注入1.8 PV后才重新穿透模拟柱。出水中BTH、MBT和OBT的浓度分别在大约3.4、3.2和3.6 PV时达到最大值,最大浓度分别为0.043、0.053和0.063 mmol·L−1,仅为修复前出水浓度的34.2%、59.9%和56.8%,以上结果表明nCaO2能够连续有效地降解BTs。由于后期(2.8 PV)模拟柱内pH有所下降(图7),又一次促进了·OH的生成,因此,2种富电子化合物MBT和OBT 的浓度再次出现下降。当出流体积为5.0 PV时,模拟柱出水中BTs浓度为注入浓度的72%左右。计算可得,实验过程中通入的BTs总量均为8.9 mg,实验结束时,砂柱出水中收集到的BTH、MBT和OBT的质量分别为1.9、2.2和2.4 mg,即迁出率分别为21%、25%和27%。以上实验结果表明,nCaO2能持续发挥氧化作用,有效地实现BTs污染物的削减。
2.5 连续修复过程中含水层地球化学参数变化
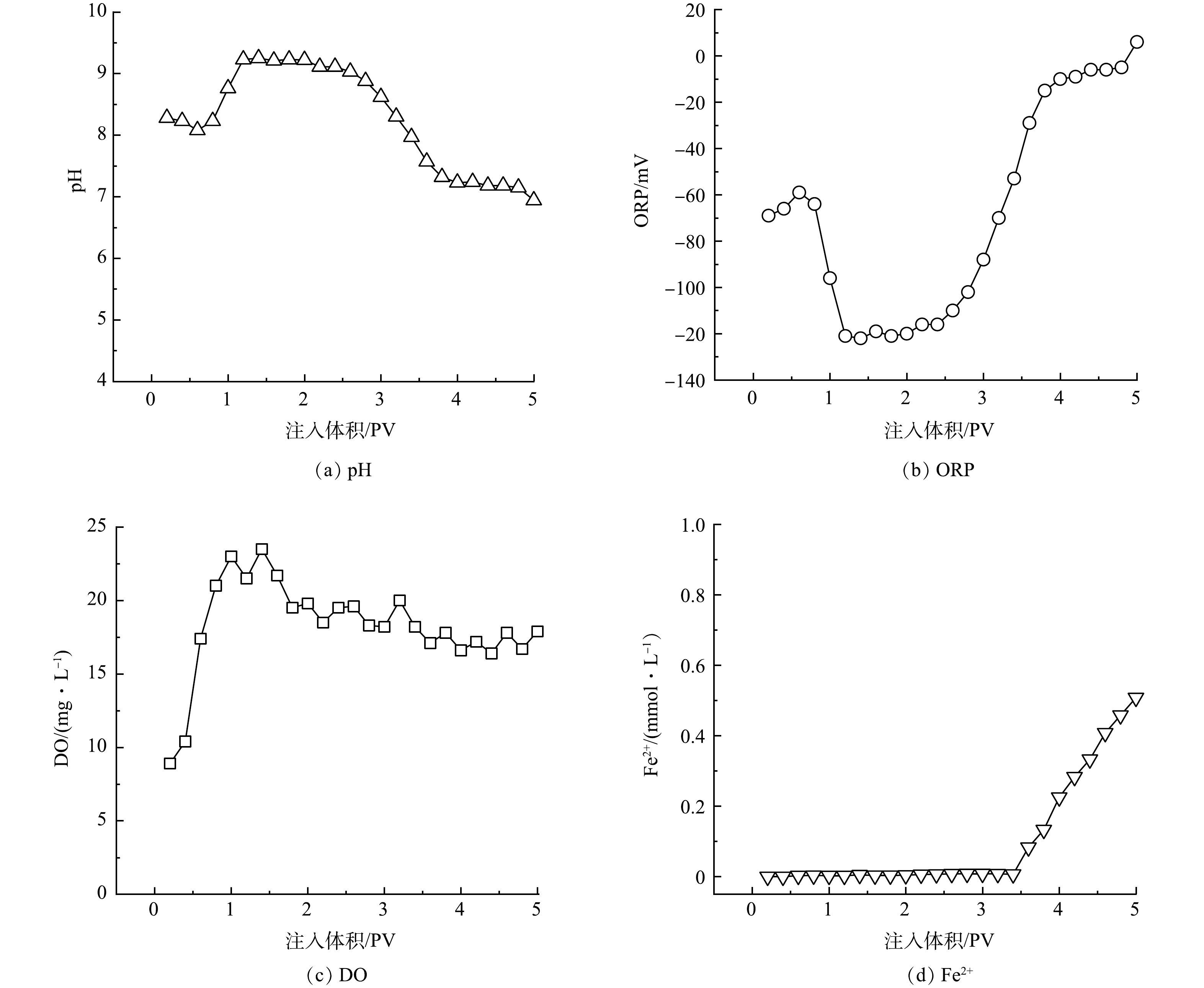
地下水原位修复过程往往会对含水层地球化学参数(pH、ORP、DO和Fe2+等)产生影响,而这些参数的变化也能够间接反映修复试剂的活性与氧化效果。本实验在模拟修复过程中pH、ORP、DO和Fe2+浓度变化情况如图8所示。如图8(a)所示,氧化修复实验过程中模拟柱内pH发生了明显变化。注入nCaO2前,BTs污染含水层pH约为8.3,注入nCaO2后,随着nCaO2遇水分解生成Ca(OH)2(式(1)~(2)),出水中pH有所升高。当出流体积为1.2 PV时,模拟柱出水pH达到9.2左右并趋于稳定。然而,随着污染地下水的不断注入,水中的Fe2+被迅速氧化为Fe3+并水解产生H+,导致水的酸性持续增加。同时,由于BTs的不断降解,生成的小分子有机酸逐渐增多[44],也会造成H+浓度的上升。当出流体积达到2.8 PV以后,模拟柱内pH开始快速下降,最终稳定在7.2左右。水溶液中pH的变化通常会引起ORP的变化,且pH与ORP值负相关。随着氧化剂的注入,模拟柱内的ORP出现了显著的变化(图8(b))。在注入nCaO2后,随着pH的升高,在1.2 PV时出水中ORР逐渐下降到−121 mV并在一段时间内保持稳定。当含水层pH开始下降时,ORP也快速升高,最终稳定在−10 mV左右(3.8 PV)。整体上,ORP的变化规律与BTs浓度变化规律一致。
氧化修复过程中DO浓度变化情况如图8(c)所示。由于nCaO2与水反应生成O2(式(1)),因此,模拟柱内DO浓度主要受nCaO2分布的影响。在反应初期,nCaO2的浓度相对较高,能够快速释放O2,使水中的DO快速升高。在出流体积为1.4 PV时,柱内DO最高可达到23.5 mg·L−1。之后,随着nCaO2分布区域的缩小以及pH的不断下降[45],O2释放量逐渐减少,DO有所下降,最终维持在18 mg·L−1。在本实验中,含水层内O2的消耗主要包括两部分:一为出水口的溢散;二是与Fe2+发生反应。从实验结果来看,出水DO在整个反应过程的5 PV内均高于背景值,也即含水层内O2的消耗低于O2的生成。这表明nCaO2能够持续有效地释放O2。在反应的前中期(<3.4 PV),出水中Fe2+的浓度极低(C/C0≈0)(图8(d))。这是由于Fe2+作为活化剂始终处于被消耗的状态,而较高的DO也加快了Fe2+的氧化[46]。随着含有Fe2+的地下水不断注入以及氧化剂nCaO2的消耗,在反应的后期,Fe2+的浓度呈现逐渐上升的趋势。
3. 结论
1)制备出了粒径较为均匀的nCaO2颗粒,经Fe2+活化后能够有效去除模拟含水层中的难降解BTs污染物;在适当范围内提高nCaO2的投加量可以促进BTs的降解;对MBT、BTH和OBT而言,在上述所选实验条件下最佳nCaO2∶Fe2+浓度比分别为5∶1、4∶1和2∶1。
2)地下水环境pH对Fe2+/nCaO2氧化体系存在着复杂的影响,在强酸性(pH=3)和中性(pH=7)条件下对BTs具有较好的去除效果;水中Cl−和HCO3−对BTs降解的影响因pH和BTs自身性质而异。
3) nCaO2在含水层中具有一定的迁移能力,但在多孔介质中迁移时受到的阻滞作用较强;约89% nCaO2滞留在砂柱中,沿整个柱长分布。砂柱中的nCaO2能够有效拦截地下水中的BTs,模拟修复实验中BTH、MBT和OBT的累计去除率均在70%~80%。
4)注入nCaO2后,地下水 pH在一段时间内呈现碱性,随后逐渐下降并最终稳定在中性;ORP与pH负相关,最终稳定在−10 mV左右;nCaO2能够持续有效地释放O2,使地下水的DO维持在18 mg·L−1左右;反应的前中期Fe2+的浓度极低,后期逐渐上升。
-
[1] Verenitch S. S., Lowe C. J., Mazumder A. Determination of acidic drugs and caffeine in municipal wastewaters and receiving waters by gas chromatography-ion trap tandem mass spectrometry. Journal of Chromatography A, 2006, 1116(1-2): 193-203 [2] Bendz D., Paxéus N. A., Ginn T. R., et al. Occurrence and fate of pharmaceutically active compounds in the environment, a case study: Höje River in Sweden. Journal of Hazardous Materials, 2005, 122(3): 195-204 [3] Hernando M. D., Heath E., Petrovic M., et al. Trace-level determination of pharmaceutical residues by LC-MS/MS in natural and treated waters. A pilot-survey study. Analytical and Bioanalytical Chemistry, 2006, 385(6): 985-991 [4] Benotti M. J., Trenholm R. A., Vanderford B. J., et al. Pharmaceuticals and endocrine disrupting compounds in U.S. drinking water. Environmental Science & Technology, 2009, 43(3): 597-603 [5] 陈依玲, 刘国光, 姚琨, 等. 紫外光照处理低浓度萘普生废水. 环境工程学报, 2013, 7(2): 473-476 Chen Yiling, Liu Guoguang, Yao Kun, et al. Treatment of naproxen-containing water in low concentration by ultraviolet irradiation. Chinese Journal of Environmental Engineering, 2013, 7(2): 473-476(in Chinese) [6] Richardson B. J., Lam P. K. S., Martin M. Emerging chemicals of concern: Pharmaceuticals and personal care products (PPCPs) in Asia, with particular reference to Southern China. Marine Pollution Bulletin, 2005, 50(9): 913-920 [7] Kormann C., Bahnemann D. W., Hoffmann M. R. Environmental photochemistry: Is iron oxide (hematite) an active photocatalyst? A comparative study: α-Fe2O3, ZnO, TiO2. Journal of Photochemistry and Photobiology A: Chemistry, 1989, 48(1): 161-169 [8] Beydoun D., Tse H., Amal R., et al. Effect of copper(II) on the photocatalytic degradation of sucrose. Journal of Molecular Catalysis A: Chemical, 2002, 177(2): 265-272 [9] Wang Nan, Xu Yaozhuo, Zhu Lihua, et al. Reconsideration to the deactivation of TiO2 catalyst during simultaneous photocatalytic reduction of Cr (VI) and oxidation of salicylic acid. Journal of Photochemistry and Photobiology A: Chemistry, 2009, 201(2-3): 121-127 [10] Han Wenya, Zhu Wanpeng, Zhang Pengyi, et al. Photocatalytic degradation of phenols in aqueous solution under irradiation of 254 and 185 nm UV light. Catalysis Today, 2004, 90(3-4): 319-324 [11] Lin Longli, Liu Guoguang, Lü Wenying, et al. Removal of chelated copper by TiO2 photocatalysis: Synergetic mechanism between Cu (II) and organic ligands. Iranian Journal of Chemistry & Chemical Engineering-International English Edition, 2013, 32(1): 103-112 [12] Hu C., Yu J. C., Hao Z., et al. Effects of acidity and inorganic ions on the photocatalytic degradation of different azo dyes. Applied Catalysis B: Environmental, 2003, 46(1): 35-47 [13] Twigg M. V., Richardson J. T. Structured ceramic foams as catalyst supports for highly exothermic processes. Studies in Surface Science and Catalysis, 2006, 162(23): 135-142 [14] Ding Z., Hu Xijun, Yue P. L., et al. Synthesis of anatase TiO2 supported on porous solids by chemical vapor deposition. Catalysis Today, 2001, 68(1-3): 173-182 [15] Anandan S., Yoon M. Photocatalytic activities of the nano-sized TiO2-supported Y-zeolites. Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2003, 4(1): 5-18 [16] Hsien Y. H., Chang Chifu, Chen Yuhuang, et al. Photodegradation of aromatic pollutants in water over TiO2 supported on molecular sieves. Applied Catalysis B: Environmental, 2001, 31(4): 241-249 [17] Kim S. H., Ngo H. H., Shon H. K., et al. Adsorption and photocatalysis kinetics of herbicide onto titanium oxide and powdered activated carbon. Separation and Purification Technology, 2008, 58(3): 335-342 [18] Deng Fengjie, Li Weifan, Xu Shaohua, et al. Surface modification of polyurethane by grafting methyl acrylate via ATRP. New Chemical Materials, 2008, 36(3): 68-70 [19] 林龙利, 刘国光, 吕文英, 等. TiO2纳米管对Cu(II)和Ag(Ⅰ)的吸附和光催化还原作用研究. 河南师范大学学报(自然科学版), 2013, 41(1): 78-82 Lin Longli, Liu Guoguang, Lü Wenying, et al. Adsorption and photocatalytic reduction of Cu (II) and Ag (I) on the surface of TiO2 nanotube. Journal of Henan Normal university (Natural Science Edition), 2013, 41(1): 78-82(in Chinese) [20] Ma Pengcheng, Kim J. K., Tang Benzhong. Functionalization of carbon nanotubes using a silane coupling agent. Carbon, 2006, 44(15): 3232-3238 [21] 宁永成. 有机化合物结构鉴定与有机波谱学(第2版). 北京: 科学出版社, 2000 [22] 林龙利, 刘国光, 吕文英. TiO2光催化同步去除水体中重金属和有机物研究进展. 科技导报, 2011, 29(23): 74-79 Lin Longli, Liu Guoguang, Lü Wenying. Treatment of heavy metals and organic contaminants by titanium dioxide photocatalysis. Science & Technology Review, 2011, 29(23): 74-79(in Chinese) -

 点击查看大图
点击查看大图
计量
- 文章访问数: 2336
- HTML全文浏览数: 1925
- PDF下载数: 287
- 施引文献: 0




 下载:
下载: