浸没式超滤膜处理再生水过程中的膜污染与化学清洗
Membrane fouling and chemical cleaning for wastewater reclamation using submerged ultrafiltration membrane
-
摘要: 以超滤膜处理再生水过程为对象,对膜污染的主要有机物、污染膜的清洗效果以及清洗前后表观形态的变化进行了分析,了解膜污染物的主要有机物。结果表明,污染物会在PVDF超滤膜表面不断累积,形成滤饼层。同时污染物能够进入膜孔内部,在外截面层造成严重的堵塞,导致通量下降,污染严重。随着运行时间的增加,膜表面污染程度越来越严重,化学清洗对污染物的去除效果有限。利用体积排阻色谱、三维荧光光谱和红外光谱等手段对洗脱液进行分析发现,蛋白类有机物是造成超滤膜污染的主要有机物。Abstract: A reclaimed water treatment process was investigated by using an ultrafiltration membrane. In order to understand the main membrane organic foulants, the fouled and clean membrane, cleaning effect and changes of membrane morphology were analyzed. The results indicated that membrane foulants can accumulate on the PVDF ultrafiltration membrane surface and then form a cake layer. In the same time, foulants can entrance into membrane pores and blocked pores in the outer of membrane cross-section, causing flux decline. Therefore, membrane fouling became more and more serious with operation time. Furthermore, chemical cleaning had a little effect on removal of fouling. High pressure size exclusion chromatography (HPSEC), fluorescence excitation-emission matrix, attenuated total reflectance-fourier transform infrared spectroscopy (ATR-FTIR) and other analysis methods were used to examine the desorbed organic matters from fouled membranes. It displayed that protein/protein-like substances were the dominant organic foulants.
-
Key words:
- ultrafiltration membrane /
- membrane fouling /
- organic matter /
- chemical cleaning
-
近百年来,工业水平高速发展,水源污染形势日益严峻,人类社会对饮用水质量的要求日趋严格。在饮用水净化处理过程中,以增加铝盐混凝剂投加量为主要手段的强化混凝技术已成为高效去除水体污染物的主要方式,但与之带来的出厂水中铝残余量显著增加的现象难以避免。此外,近年来大量开展的黑臭水体治理等水环境修复工作,也涉及铝盐混凝剂净化天然水体、处理剩余污泥等方面的应用,增加了水环境中铝残留的环境健康风险[1-2]。
残余铝作为此过程中不可避免的次生污染物,具有强烈的化学活泼性和生物有效性[3]。在人体中积累可导致语言表达能力丧失、记忆能力退化、骨质疏松软化、肝肾功能失调,诱发血液疾病、心血管疾病、阿尔茨海默病、肾衰竭及尿毒症等[4]。研究表明,铝的生物毒性不仅取决于铝的残留浓度,更与其赋存形态密切相关[5]。相关研究大多从剂量-效应角度评价残留铝的毒性特征,鲜有研究探讨不同形态羟基铝团簇的毒性效应。近二十年来,随着低浓度羟基铝团簇形态识别技术的日益成熟[6],铝离子向纳米聚合形态转化的过程逐渐清晰[7]。然而,受低浓度铝形态鉴定、解析技术瓶颈限制,以及受纳米铝团簇赋存形态和转化机制复杂性的影响,纳米羟基铝团簇的致毒过程和机理是否类似于传统单体铝(如Alm)、低聚体铝絮凝剂,纳米残余铝团簇毒性效应特征与其团簇形态的响应关系等依然不清[8]。
本文以残余铝团簇为主要对象,在归纳铝残留途径的基础上,对目前关于铝无机单体态(Alm)和纳米多核形态(Al13)的毒性效应研究进行综述,分析不同残余形态铝的毒性效应特征和影响因素,以期为优化控制混凝工艺中铝的投加和残留控制,确保水生态环境安全提供参考。
1. 残余铝来源及特征(Sources and characteristics of residual aluminum)
1.1 铝的残余控制标准
正常人体含铝量是50—100 mg。每天摄入铝量平均为35 mg,大部分随粪便排出体外,但仍有1%—2%的铝经肠道吸收进入人体并难再从体内排出,被吸收蓄积于肺、骨骼、肝、脑、睾丸等内脏中[9-11]。许多国家、地区和卫生组织都对饮用水中残留铝的含量制定了限制标准[12-14](表1)。2006年我国颁布实施了新的《生活饮用水卫生标准》(GB 5749-2006),要求饮用水中的残留铝含量不大于0.20 mg·L−1[15],然而大量调查表明,我国部分地区生活饮用水铝含量依然超标严重[16-19]。
表 1 国内外生活饮用水铝残留标准 (单位: mg·L−1)Table 1. Standard for residual aluminum concentration in drinking water (Unit: mg·L−1)世界卫生组织World Health Organization 欧共体European Community 日本Japan 美国America 前苏联Former Soviet Union 中国China 残留铝浓度标准Standard of residual aluminum concentration 0.20 0.20 0.20 0.05 0.50 0.20 1.2 残余铝的来源与残留途径
人体内的铝主要来源于饮用水和食物。早在1989年,世界卫生组织便已将铝确定为“食品污染源之一”而加以控制。探明残余铝的来源是控制残余铝、明确其毒性的重要前提。长期以来,人体中过量的铝来源归因于炊具、食物及药品,而对于饮用水这一重要的铝来源缺乏关注。
水源水中铝的来源主要集中在以下3个方面:
(1)酸性降水溶出。在天然水体条件下,水中溶解态铝浓度通常少于0.1 mg·L−1。受全球气候变化影响,部分地区酸性降水增多,土壤、矿物、岩石中的铝不断释放[20]。
(2)人类活动排放。受人类活动影响,采矿、冶炼、化工、制药等行业含铝废水大量排放,致使水环境中的铝残余量明显增加。
(3)天然水环境修复及应急事件中的铝残留。我国80%以上的城市河道受污染,其中大部分已演变为黑臭河道,成为我国当下亟待解决的水环境问题[21]。采用强化混凝方法处理水环境突发事件及城市河道黑臭水体问题,所投加混凝剂的剂量大、浓度高(500−800 mg·L−1),致使大量铝盐残留在水体中[22].
在水处理环节,残余铝主要来源于铝盐絮凝剂的投加尤其是粗放投加。全球范围内约80%的水处理工艺使用聚合氯化铝(PACl)和硫酸铝 [Al2(SO4)3] 等铝盐混凝剂[4,23],其中聚合氯化铝因其优良的絮凝性能作为主流药剂被国内外广泛使用[24-25]。受水源水质不稳定、环境因素季节性波动等影响,混凝剂的非精准投加或过量投加直接导致出厂水中铝浓度超标。研究表明,水源水中的铝和投加混凝剂引入的铝在经混凝、沉淀、过滤、消毒等工艺后仍有约11%残留于出厂水中[16]。已有研究表明,全国40座城市中有5%的城市自来水中铝浓度超标,东北地区超标城市高达76.9%[17]。此外,大量富含铝的水处理污泥直接排入地表水体,也将加大地表水铝残余浓度。地表水的年均铝浓度及羟基铝、单体铝的浓度显著高于地下水[26]。
在输配水环节,给水管网中铝的转化溶出也是残余铝的重要来源[27]。给水和排水管道的主要材料(水泥、混凝土和陶土)中含有一定量的铝,在低pH、低碱度、低钙含量时溶出严重[28-29]。此外,管网中长期沉积铝在水动力、离子强度、水源切换引发pH变化等影响下,也会发生铝形态转化释放。
2. 单体及多聚态残余铝毒性效应(Toxic effects of monomeric and polymeric aluminum)
2.1 残余铝毒性表现形式
2014年,英国水文与生态中心评估了金属对水生生物的潜在危害程度,提出铝位居第二,仅次于铜[30],且鱼类比水生无脊椎动物对铝的毒性更为敏感[31]。当铝浓度达到3.7 μmol·L−1(100 μg·L−1)以上时,水生生态系统的生物多样性出现下降,并导致生物的活体神经组织发生病变[23]。然而,以往研究主要侧重于土壤中铝对植物的毒害作用。目前认为,铝离子的有害作用主要来自其对植物根生长细胞分裂的抑制作用。铝胁迫下的植物根毛、次生根减少,影响根系对水分和营养物质的吸收,同时降低光合作用。除此之外,植物细胞内离子态的铝可以鳌合有机酸、脱氧核糖核酸、三磷酸腺普等重要生物分子,干扰植物正常代谢活动[32]。
(1)铝的神经毒性
对于许多参与糖酵解和基础代谢的酶,铝通过抑制其活性进而引发神经系统疾病[33]。在活体组织中,铝通过对磷酸肌醇和胞内钙离子的干涉而影响细胞的基础功能,对次级信使系统发生抑制作用进而干扰神经系统,可使因年龄增长而导致的新陈代谢变化提前发生[34]。脑组织中铝含量虽相对较低,但可影响大脑中基础三羧酸循环代谢中相关酶的活性,引起透析性脑病或透析性痴呆,现称阿尔茨海默征[35]。临床实验证明,铝可明显降低脑组织中神经原纤维缠结附近乙酰胆碱脂酶的活性[36-37]。挪威、瑞典、英国、加拿大、瑞士和法国的13个关于阿尔茨海默症研究结果发现,饮水中铝含量与阿尔茨海默症的发病存在显著相关性[38]。患者大脑内有30%新皮层区的铝浓度大于4 μg·g−1(干重),脑部神经元细胞核内的铝比正常人高4−30倍[39]。X射线光谱分析发现,阿尔茨海默病患者脑内海马神经纤维的变性病灶中有铝的沉淀。长期口服氢氧化铝凝胶等铝制剂的病人,可引起血铝浓度增高,进而引起智力障碍。大鼠中枢神经病理形态学研究发现,铝可引起大脑顶叶、小脑及与学习记忆密切相关的海马神经元细胞数目减少[39]。除此之外,铝也可以直接或与运铁蛋白及其受体结合使血脑屏障通透性增加[40]。
(2)铝性骨病。
铝与骨骼疾病尤其是骨质疏松间的关系不可低估。生物体内富集的铝会竞争性地抑制钙的吸收并导致相关功能酶失活[41]。与部分重金属一样,过量摄入铝会造成铝在骨骼类骨质中大量沉积并置换出钙,引发铝骨病,临床表现为广泛的骨及关节疼痛、骨质疏松软化、骨骼系统发育不良。研究证明,小肠可吸收病人含铝磷盐结合剂药物中的铝,服用该药的患者滑膜腔内铝含量较不服用的患者高2−10倍,并可引发肋骨、股骨颈、脊椎和股骨干附近的近端肌无力和复发性骨折,还可诱发骨骼变形[32, 42]。进入骨中的铝可降低甲状旁腺激素浓度,并结合胶原蛋白沉积于骨基质中,抑制成骨细胞和破骨细胞的增殖和功能,形成骨内结晶[37, 43]。
(3)血液和心血管疾病
铝含量增加将影响生成红细胞,并干扰血红素合成相关的酶,导致可逆性巨幼红细胞性贫血。研究表明,铝可抑制大鼠的骨髓造血功能,致大鼠贫血,使红细胞膜的流动性下降并影响红细胞膜蛋白百分含量和分子量[44]。临床实验证实,透析脑病综合征患者的透析水及血浆中铝含量显著高于无透析性脑病综合征患者,有全身不适、呕吐、体重减轻、肌肉疼痛等迹象[45]。
(4)肝脏疾病、肾功能失调、肾衰竭及尿毒症
具有骨重塑低下、甲状旁腺素低下的病人,包括甲状旁腺切除患者、肾移植排异使用皮质激素治疗患者、糖尿病患者、二羟胆骨化醇治疗患者和双侧肾切除的患者,对铝毒性作用的更加敏感[46]。终末期肾病患者铝的排泄受阻,铝在体内的蓄积作用增强,使其体内铝含量较正常人高20倍[46]。
(5)生殖毒害
铝对生殖系统和胚胎发育也有一定毒害作用[47-48]。当铝含量与体重之比大于1.5 mg·kg−1时,磷化合物的代谢将被破坏,可能导致体内硫酸盐过量流失。连续摄入剂量达17—50 mg·kg−1体重时,铝对性腺有毒害作用[32,49-50]。铝盐溶液对大鼠胚胎生长发育和器官形态存在影响,导致胚胎畸形[11]。
铝的致毒机理大多与置换反应有关,即通过置换作用取代生物体内原有必需金属或酶活性中心如Fe3+、Ca2+、Mg2+、-SH的位置,这与铝金属元素的性质密切相关[8, 51]。如在类骨质中置换出钙而导致骨生成抑制,在卵母细胞中置换镁离子从而使小鼠生殖细胞及骨髓细胞染色体畸变率提高等。
整体而言,铝属于非急毒、非极毒物质,但其危害是潜在的、长期的、不可逆转的,是不可忽视的。
2.2 铝团簇与单体铝毒性差异
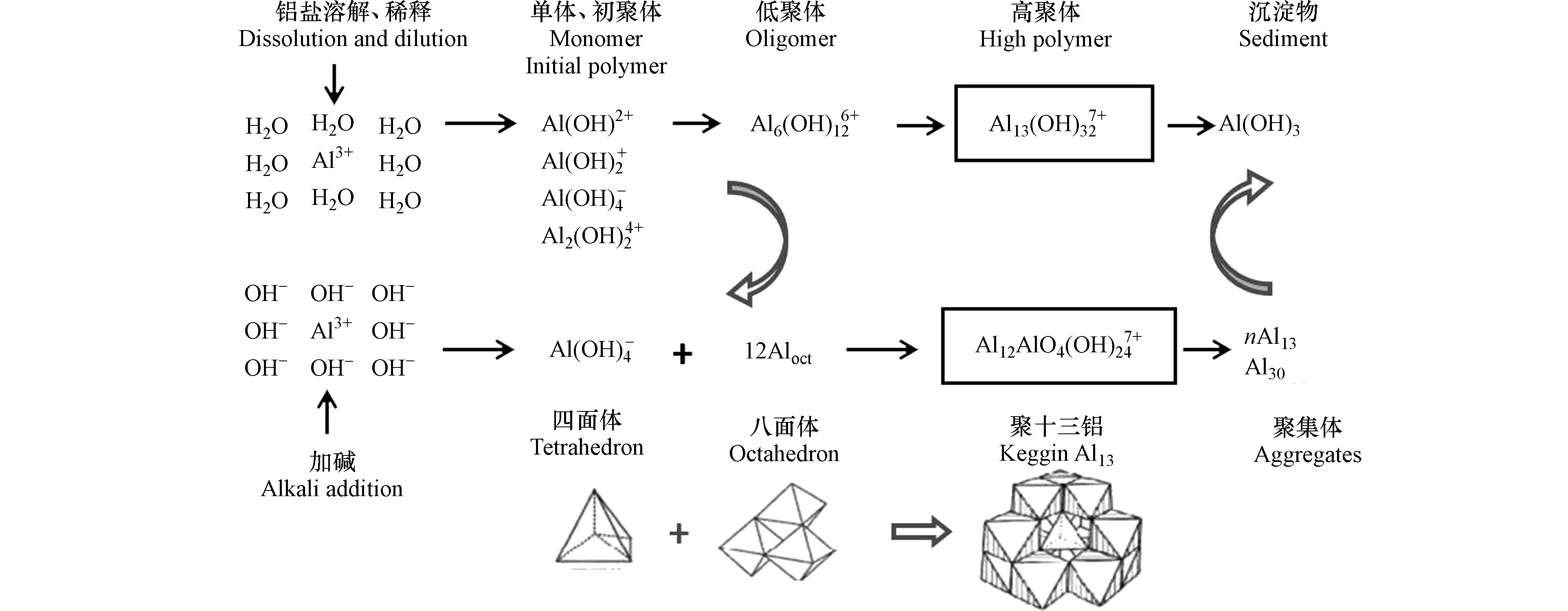
大量研究表明,残余铝毒性特征与其残留形态密不可分。国内外很多学者如汤鸿霄、毕树平、Bertsch、孙忠、Casey、Johansson 等开展了大量研究,提出和验证了铝团簇形态、结构特征及转化模式[52]。整体而言,水中残余铝形态复杂多样,以双水解模式(图1)相互转化,并以单体Alm及多聚体态Al13等主要形态存在。
(1)无机单体铝形态 (Alm)。
铝在水溶液中很活泼,以Al3+、A1(OH)2+、A1(OH)2+等多种离子态存在,水解过程十分复杂。以往研究普遍认为,游离态的铝离子Al3+是人体、动物或植物体中毒性最高的形态[54]。表2给出了无机单体铝离子生物毒性研究现状。单体态残余铝对人脑中脂质过氧化反应的促进作用是铝作为慢性蓄积性神经毒素发挥毒性作用的重要机制[18]。AlCl3染毒大鼠12周后发现随染铝剂量的增加,大鼠学习记忆能力下降,脑组织中丙二醛(MDA)含量显著升高,超氧化物歧化酶(SOD)活力下降,谷胱甘肽(GSH)含量和谷胱甘肽过氧化物酶(GPX)活力先上升后降低[55]。水中离子态铝含量高于0.2—0.5 mg·L−1可使鲑鱼致死。将三氯化铝溶液注入猫的脑海马或脑室内,一周之后,出现明显的脑功能障碍,即记忆力减退、行为障碍,并且海马及脑皮质出现神经原缠结[44, 54]。暴露于亚急性(每日摄入三氯化铝1 g,10 d)和慢性(每日摄入三氯化铝0.03 g,4个月)饮食摄入强度下,老鼠神经突触中铝富集率分别为45%和59%。此外,亲水区域的流动和突触前膜的CH/PL(胆固醇/磷脂)摩尔比的下降伴随着无机铝离子的积累而出现[39]。
表 2 无机单体铝离子生物毒性研究现状Table 2. Research status of biological toxicity effects of inorganic mononuclear Al赋存形态Speciation 浓度Concentration 受试生物Organisms 测试指标Indexs 暴露时间Exposure time 结果Results 文献References AlCl3 2 mg·kg−1 大鼠 记忆能力脂质过氧化反应 84 d 记忆力下降MDA↑ SOD↓ [55] AlCl3 430 mg·L−1 大鼠 血浆Al、转铁蛋白(TF)、可溶性转铁蛋白受体(sTfR)含量及总铁结合力(TIBC) 120 d 体重抑制干扰体内铁代谢 [44] AlCl3 1 g 大鼠 富集率 120 d 45% [39] 0.03 g 大鼠 富集率 120 d 59% AlCl3 6.53 mg·L−1 鳟鱼 鳃组织损伤 96 h 渗透调节紊乱酶活↓ [32] AlCl3(矿山废水) 0.2 mg·L−1 枝角类植物 急性毒性(致死率) 24 h 与离子交换位点结合 [56] AlCl3 3 g·L−1 蛋白核小球藻 生物累积生长抑制 24 h 低pH下毒性↓ [57] (2)多聚体铝团簇形态。
聚合氯化铝(PACl)是在传统硫酸铝盐混凝剂基础上发展起来的新型高效絮凝剂。PACl中最佳凝聚絮凝形态—纳米Keggin Al137+(即Al12AlO4(OH)247+)较单体铝Alm具有更好的除浊、除腐殖酸、脱色效果和更强的电中和能力而被广泛使用。Al13及聚集体投入水中后,可在一定时间内具有稳定性而保持其原有形态[58]。此外,其他各形态残余铝可随水体pH、微界面共存等理化条件变化尤其是在黏土微界面促发下发生形态转变,转化为较为稳定的Al13[7,59-60](图1,双水解模式)。有研究报道,具有适度酸性的河流和湖泊以及某些酸性物质流过的地下水域可形成All3[61],且已被证明在人的脑突触中存在[62]。
迄今为止,基于Alm和Al13毒性效应之争尚无定论。传统观念中流行的、垄断性观点是单体铝毒性高于多聚体态铝,铝的有机配合物低毒或基本无毒[63],也有研究认为有机配体会促进铝在血液中的吸收[39]。近年来,越来越多研究表明多聚体态Al13对生物和人体毒性风险远高于Alm。非单体铝的生物毒性研究现状如表3所示。与Alm单体相比,Al13对海藻类植物的毒性更大[57]。Al13对大豆根尖的毒性比Alm高10倍[64]。有研究者探讨了nano−Al13及Alm对于苹果酸脱氢酶活性、谷氨酸脱氢酶活性、谷胱甘肽还原酶活性、还原型谷胱甘肽和血红蛋白的影响。结果表明,纳米Al13较低电荷单体铝表现出更强的毒性效应,并提出这可能与团簇铝比表面积较大有关[51,65-67]。
表 3 非单体铝的生物毒性研究现状Table 3. Biological toxicity effects of no-nmonomeric Al species赋存形态Speciation 浓度Concentration 受试生物Organisms 测试指标Indexs 暴露时间Exposure time 结果Results 文献References Al13、Al3+ 0.01 m mol·L−1 体外 苹果酸脱氢酶MDAH 50 s 毒性作用Al13>Al3+ [65] 0.1 mol·L−1 体外 还原型谷胱甘肽GSH 50 s [66] 0.25 mol·L−1 烟酰胺腺嘌呤二核苷酸构象 谷氨酸脱氢酶谷胱甘肽还原酶GR 50 s [51,67] Al13、Al3+ 0—100 μmol·L−1 大豆 根尖红细胞 12 h 毒性作用Al13>Al3+ [64] Al2O3 50—200 μm3000 mg·kg−1 蚯蚓 繁殖和行为 28 d 回避行为繁殖未减少 [68] 11 nm3000 mg·kg−1 蚯蚓 繁殖和行为 28 d 回避行为繁殖减少 [68] Al(OH)3 50 mg·L−1 鲑鱼 慢性毒性 28 d 慢性中毒 [69] 此外,多聚体铝团簇同时具备纳米颗粒效应。目前,针对纳米级铝化合物的研究主要关注纳米氧化铝(Al2O3)。纳米氧化铝对各生物主要脏器均有损害作用,肝、肾、脾为主要损伤器官,炎性细胞的浸润可能是其损伤机制之一[68]。作为高效混凝形态,溶解态纳米铝团簇尤其是Keggin结构的Al13成为关注焦点和研究热点。Al13粒度被鉴定为约2 nm,相互之间会结合成线性及枝状的Al13聚集体,其大小为几十或几百纳米[70]。Al13具有纳米尺度、高电荷(+7)、表面多羟基多活性位点、结构稳定等特征,在工业、生物医药制品方面均有应用,也可用作分子筛、电子元件、离子交换剂等。nano−Al13在水中具有较强的吸附、絮凝、络合、沉淀等物理化学性能,其结构和功能区更为规范和集中,微界面特性也更加突出,其生物可利用性及生物毒性机制极大可能不同于常规纳米颗粒物和单体铝离子,从总量角度衡量nano−Al13的毒性效应可能会掩盖其实际的毒性风险。
单体铝和纳米铝团簇毒性的相关争议依然存在,难于达成统一认识。尽管铝的化学行为和生物毒性直接取决于其存在形态已经被广泛认可,但受其形态转化机制复杂且缺少团簇形态分析技术瓶颈的限制,铝团簇生物毒性效应机制研究一直处于严重滞后阶段。从铝团簇形态学角度对其生物毒性效应的研究依然较少,具体毒性机制仍不清晰[1,71]。此外,有研究发现在纳米颗粒物共存且无“微区强碱”前提下也可生成nano−Al13[7]。因此,不仅单体铝而且其微界面促发新生成的nano-Al13以及其它聚合铝都可能是传统单体铝毒性效应的主要贡献组分。
3. 残余铝毒性影响因素(Influencing factors of residual aluminum toxicity)
羟基铝团簇可以和多种无机离子(OH−、F−、SO42-、PO33-、HCO3−等)或有机配体结合,其存在形态复杂多样,主要取决于溶液pH值、复合配体浓度、温度等典型环境理化因素。羟基铝团簇还易与大分子化合物,如蛋白质、DNA、磷脂等形成较为复杂的化合物[64]。共存的有机、无机离子与羟基铝团簇形态结合,势必也将影响铝团簇毒性效应。鉴于目前铝团簇毒性的影响因素研究相对较少,本文仅基于现有研究进展,从水源水质组分、pH值和有机酸角度,结合铝团簇形态的转化阐述不同因素对残余铝毒性的影响。
(1)水源水质对残余铝毒性的影响
水源水的温度、浊度、色度、硬度、有机质含量、无机离子差异和河流水文状况将直接影响铝的含量与形态分布,进而对其毒性大小产生影响[72]。水中铝浓度的增加,会导致水体中有机物的凝聚作用增加,使有机物减少,致水生动物因营养匮乏而死亡;同时,还将导致水体中的可溶性磷沉淀,降低磷的再矿化率,对水生动物的生命带来极大的威胁[73]。原水浊度和TOC、DOC浓度增加可提高残留铝中胶体态铝和溶解态羟基铝含量[74-75]。水体悬浮颗粒物含量与颗粒结合态铝含量存在明显的相关关系。水体氟化物含量对弱酸性水源水的残余铝有显著影响,其对羟基铝团簇的形态分布影响占据主导地位。酸性、弱酸性条件下铝氟化物成为主导形态,但该条件对溶解态铝向颗粒态铝的转化并无显著抑制作用[76]。
(2)pH对残余铝毒性的影响
羟基铝团簇毒性效应除与浓度有关外,还和团簇形态密切相关,而形态赋存和转化受水体pH值影响较大。pH对于水中残余铝含量的影响主要体现在絮凝形态和絮凝机制两方面[15, 77],不同pH下铝团簇形态分布不同[78-79]。在[Al3+] <10−4 mol·L−1水相溶液中,铝的水解优势形态为单体羟基络合离子[80]。当pH值从3−6向7−8以及大于8演变时,铝水解优势形态也从Al3+、Al(OH)2+、Al(OH)2+向Al(OH)3凝胶态、铝酸阴离子Al(OH)4−转化[81-82]。在单体铝的浓度较高([Al3+]>10−3 mol·L−1)或在向含铝溶液中加碱时,溶液中水解生成的单体羟基态铝络合离子会发生聚合反应,生成二聚体、低聚体及高聚体等羟基聚合形态。其中,纳米Al13形态更加稳定,电荷稳定性更好,受pH影响较小。
不同pH条件下水溶液中主导的铝团聚形态不同,其毒性效应亦不同。当pH值约为5.0时,铝以氢氧化铝Al(OH)3的形态沉积在鱼鳃内,阻止氧气进入血液中,并使鱼体内的含盐浓度失调,导致鱼类死亡[73]。在pH=8−9的弱碱性条件下,水中的铝酸根离子浓度高于0.5 mg·L−1时也可使鲑鱼致死;沉淀的氢氧化铝Al(OH)3不会使鲑鱼急性中毒而死,但能引起鲑鱼的慢性中毒,且在未污染的水体中其解毒的过程比较缓慢[11,69]。该观点主要从单体铝形态转化过程角度,从Al(OH)3生成及对鳃的毒性影响角度论述铝的毒性,长期以来一直主导铝毒性效应的认知,同时也并未考虑铝团簇形态尤其是纳米铝团簇毒性机制的差异性。已有研究表明,不同pH及不同浓度的Al3+及nano-Al13对脱氢酶活性的影响存在较大差异[67]。在磷酸盐存在的情况下,pH值在7−10范围内时,无定形态氢氧化铝颗粒可通过共沉淀的方式将磷原子包裹在自身结构之中或吸附磷酸盐基团在表面[83-84];随pH下降,铝和磷酸盐作用生成晶体态铝磷酸盐,并在输水过程中造成残余铝的二次释放,进而引发残余铝毒性。
(3)有机酸对残余铝毒性的影响
有机酸(如柠檬酸、草酸、甲酸等)能与金属形成稳定的复合体,将离子态的金属转变成低毒或无毒的螯合态形式,从而减轻过量金属的毒害效应[85]。有机酸与铝离子形成稳定的化合物,降低铝离子生理活性,从而降低细胞内铝离子的毒害效应。如铝可与柠檬酸形成1∶1的复合体, 与草酸形成1∶3的复合体[86]。几种常见低分子有机酸离子削弱铝毒的能力大小顺序为:草酸>乙酸>柠檬酸/硅酸>酒石酸>水杨酸>邻苯二甲酸[85]。有机酸的化学结构也会影响其对铝的络合能力。水杨酸(邻羟基苯甲酸)能与铝形成稳定的六元环鳌合物,而邻苯二甲酸与铝形成不稳定的七元鳌合物,水杨酸对铝的络合能力比邻苯二甲酸大。柠檬酸与铝也能形成稳定的五元环和六元环鳌合物,因此柠檬酸与铝有很强的络合能力[86]。一些多齿或多配位点的有机配体如EDTA、柠檬酸、聚合酚类与铝形成稳定的鳌合物,能抵抗Al3+水解作用的影响[87]。铝和磷酸盐共同作用可生成铝磷酸盐沉淀,直接影响饮用水的剩余浊度和残余铝含量。
然而,上述研究大多基于传统重金属观念,探讨单体铝与有机酸的络合过程。对于纳米铝团簇而言,其比表面积大、表面能高,位于表面的原子占相当大比例,能有效吸附和配位溶液中重要的生物有机分子。有机酸离子可以与高活性的羟基铝络合成为低活性的有机络合态铝,进而降低铝毒性。同时,有机酸离子在与羟基铝络合过程中还可以释放出OH−,使得pH值升高,进一步降低离子态铝的活性,削弱铝毒。研究发现Alm和nano−Al13对谷胱甘肽还原酶(GR)活性有较强抑制作用,加入柠檬酸、草酸以后,抑制作用均显著减轻,其与铝和配体的配位、酶构象的改变有关[51]。有机酸作为残余铝解毒剂应用具有较高的潜在价值。
4. 展望(Prospect)
现有研究主要从残余铝总量角度探讨单体铝或纳米铝团簇的毒性机制,而从高荷电、纳米粒度、铝团簇结构等角度解析单体铝和纳米多聚体铝团簇形态毒性机制差异性的研究尚少。在溶解性铝团簇生物毒性效应过程与机制研究上有待深入系统揭示内在机理和突破方向,主要可以归纳为以下4点:
(1)高正电荷(+7)、高活性位点、纳米Al13团簇在生物体内组织、内脏等负电性器官中迁移途径与机理是否类似于常规负电性纳米污染物以及溶解性单体铝。
(2)单体铝水解形态在黏土等微界面促发下可转化生成nano-Al13这一新认知,是否能解释以往研究中单体铝与多聚体铝毒性效应认知的矛盾。传统观念中单体铝的毒性效应是否也取决于nano-Al13。
(3)铝团簇不同于其他纳米颗粒物,除具有纳米粒度特征外,还具有极强的凝聚絮凝效能,成为水体有机有毒污染物的重要载体和聚集体,其复合毒性研究依然较少。在毒性机制上,铝团簇纳米聚合体是否存在协同效应还是拮抗效应依然需要深入探讨。
(4)对于已进入水环境中的铝,如何实现高毒性铝团簇形态向毒害作用更低的形态转化,实现解毒效果,也是今后铝毒性效应研究方向之一。
-
[1] 刘鹤, 李永峰, 程国玲. 膜分离技术及其在饮用水处理中的应用. 上海工程技术大学学报, 2008, 22(1): 48-53 Liu He, Li Yongfeng, Cheng Guoling. Membrane separation technology and its application in drinking water treatment. Journal of Shanghai University of Engineering Science, 2008, 22(1): 48-53(in Chinese) [2] 孙丽华, 李星, 杨艳玲, 等. 浸没式超滤膜处理地表水除污染效能实验研究. 膜科学与技术, 2010, 30(1): 69-72 Sun Lihua, Li Xing, Yang Yanling, et al. Study on the removal efficiency with surface water pollutant by immersed ultrafitration membrane. Membrane Science and Technology, 2010, 30(1): 69-72(in Chinese) [3] Kim H. C., Dempsey B. A. Effects of wastewater effluent organic materials on fouling in ultrafiltration. Water Research, 2008, 42(13): 3379-3384 [4] Kerry J. H., Clark M. M. Fouling of microfiltration and ultrafiltration membranes by natural waters. Environmental Science & Technology, 2002, 36(16): 3571-3576 [5] Fu L. F., Dempsey B. A. Modeling the effect of particle size and charge on the structure of the filter cake in ultrafiltration. Journal of Membrane Science, 1998, 149(2): 221-240 [6] Cho J., Amy G., Pellegrino J., et al., Characterization of clean and natural organic matter (NOM) fouled NF and UF membranes, and foulants characterization. Desalination, 1998, 118(1-3): 101-108 [7] Noble R. D., Stern S. A. Membrane Separations Technology: Principles and Applications. Amsterdam: Elsevier, 1999 [8] 刘忠洲, 续曙光, 李锁定. 微滤、超滤过程中的膜污染与清洗. 水处理技术, 1997, 23(4): 187-193 Liu Zhongzhou, Xu Shuguang, Li Suoding. Membrane fouling and cleaning in UF and MF. Technology of Water Treatment, 1997, 23(4): 187-193(in Chinese) [9] 许振良. 膜法水处理技术. 北京: 化学工业出版社, 2001: 148-149 [10] Nikolova J. D., Islam M. A. Contribution of adsorbed layer resistance to the flux-decline in an ultrafiltration process. Journal of Membrane Science, 1998, 146(7): 105-111 [11] Hilal N., Ogunbiyi O. O., Miles N. J., et al. Methods employed for control of fouling in MF and UF membranes: A comprehensive review. Separation Science and Technology, 2005, 40(10): 1957-2005 [12] Xiao P., Xiao F., Wang D. S., et al. Investigation of organic foulants behavior on hollow-fiber UF membranes in a drinking water treatment plant. Separation and Purification Technology, 2012, 95(5): 109-117 [13] Mietton-peuchot M., Ranisio O. Study of behavior of membranes on the presence of anionic or nonionic surfactants, a presentation at the 7th World Filtration Congress in Budapest. Budapest, 1996 [14] Nystrom M., Zhu H. H. Characterization of cleaning results using combined flux and streaming potential methods. Journal of Membrane Science, 1997, 131(1-2): 195-205 [15] Howe K. J., Ishida K. P., Clark M. M. Use of ATR/FTIR spectrometry to study fouling of microfiltration membranes by natural waters. Desalination, 2002, 147(1-3): 251-255 [16] Jarusutthirak C., Amy G. Role of soluble microbial products (SMP) in membrane fouling and flux decline. Environmental Science & Technology, 2006, 40(3): 969-974 [17] Lee N., Amy G., Croué J. P., et al. Identification and understanding of fouling in low-pressure membrane (MF/UF) filtration by natural organic matter (NOM). Water Research, 2004, 38(20): 4511-4523 [18] Chen W., Weaterhoff P., Leenheer J. A., et al. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter. Environmental Science & Technology, 2003, 37(24): 5701-5710 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 1969
- HTML全文浏览数: 1631
- PDF下载数: 372
- 施引文献: 0



 DownLoad:
DownLoad: